2. 复旦大学放射医学研究所,上海 200032
2. Institute of Radiation Medicine, Fudan University, Shanghai 200032, China
氡是天然存在的放射性气体,生活环境中的氡主要来自于岩石、土壤、建筑材料、地下水和天然气的使用。根据联合国原子辐射效应科学委员会(UNSCEAR)报告,在全球成年人接受天然辐射照射中,氡照射所致年有效剂量约占总剂量一半左右[1]。人类接受氡(222Rn)暴露的主要途径是吸入氡的短寿命子体(218Po和214Po),这些子体衰变时产生的α射线可损伤肺和支气管上皮细胞,产生随机性效应,最终导致肺癌[2]。
氡诱发肺癌首先是在对暴露于高浓度氡的井下矿工的流行病学研究中得到证实[3]。早在1988年,国际癌症研究机构(IARC)就将氡列为Ⅰ类致癌物[4-5]。随后多项针对矿工或一般居民的流行病学调查研究结果也表明[6-9],长期暴露于低浓度氡环境的人们也会增加发生肺癌风险[10-11],甚至有研究还发现存在有暴露的逆剂量率效应[12-13]。根据世界卫生组织2009年的报告,氡是紧随吸烟之后的第二大致肺癌环境因素,全球范围内有3%~14%的肺癌是由氡暴露引起的[14]。2018年的一项最新研究表明,全球66个国家中可归因于氡的肺癌死亡中位数约为13.6%~16.5%,这些国家2012年由氡暴露所致肺癌死亡的总人数可超过20万人[15]。总而言之,环境氡致肺癌已成为一重大的公共卫生问题。开展氡致肺癌的危险度评价并研究其相应的防控措施,也已成为当前国内外放射卫生学领域的热点课题[16]。
氡致肺癌的危险度评价通常被分为剂量学方法[17-19]和流行病学方法[20-22],但剂量学评价方法实际上也用到了流行病学研究得到的相对危险度模型[23]。为此,本文主要对迄今为止多个氡致肺癌研究机构或团队所建立的风险评价模型进行了综述,并结合我国不同年代的室内氡浓度水平进行了氡致肺癌危险度的试算,希望能为更加准确开展我国室内氡致肺癌评估研究提供参考与借鉴。
一、美国电离辐射生物效应委员会的主要模型1. BEIR Ⅳ的ERR模型:美国科学院电离辐射生物效应(biological effects of ionizing radiation, BEIR) 委员会主要致力于低剂量照射对人类辐射效应研究,1988年基于4项氡暴露矿工的流行病调查资料(包括459名肺癌死亡矿工,调查样本涉及50万人年,未持续追踪到矿工的终生),建立了受照后经过时间修正的氡致肺癌超额相对危险度(ERR)评价模型[24]:
| $ \operatorname{ERR}(a)=0.025 \beta(a)\left(W_{1}+0.5 W_{2}\right) $ | (1) |
式中,β(a)为对到达年龄(a)的相对危险度调整因子(≤55岁取1.2,55~65岁取1.0,>65岁取0.4);W1为到达年龄前5~15年的氡累积暴露量,W2为到达年龄减去15年的氡累积暴露量,单位均为工作水平月(working level month, WLM)。
在从矿工资料向普通居民的外推中,BEIR Ⅳ引入了一个比例系数K来调整矿山和居室不同环境中如人的呼吸(频)率、氡子体浓度及其粒径大小和分布等差异引起的不同肺内靶细胞反应。在BEIR Ⅳ中,建议K值取0.7,说明普通居民的氡暴露危险系数比矿工低30%。
2. BEIR Ⅵ的ERR模型:1999年基于中国、加拿大、欧洲、美国和澳大利亚矿工的11项流行病调查资料(包括2 620名肺癌死亡矿工,调查样本涉及120万人年)[25],BEIR委员会建立了新的氡致肺癌相对危险评价模型。考虑到氡暴露可能存在的“逆剂量率效应”,BEIR Ⅵ报告引入了两个独立参数——氡子体浓度水平和暴露间期,由此建立的两个模型分别被命名为“暴露-年龄-浓度模型”(EAC模型)和“暴露-年龄-间期模型”(EAD模型),同时BEIR Ⅵ报告还对BEIR Ⅳ中的比例系数K进行了调整,建议K值取为1(意味着不需要再分矿工和或居民)。与BEIR Ⅵ模型不同的是,新的模型能够计算在氡暴露量率降低或暴露持续时间延长的情况下单位危险度的增加。BEIR Ⅵ的EAC模型和EAD模型的数学表达式相同,只是各项参数的设置有所不同,其共通表达式为[25]:
| $ \operatorname{ERR}(a)=\beta\left(W_{5 \sim 14}+\theta_{15 \sim 24} W_{15 \sim 24}+\theta_{25+} W_{25+}\right) \phi_{\text {age }} \gamma_{\rm{z}} $ | (2) |
式中,β为到达年龄(a)的危险度系数,对应于EAC和EAD模型其归一化值分别取0.076 8和0.005 5;暴露窗口W5~14、W15~24和W25+分别为到达年龄前5~14年、15~24年和25年以上的累积氡暴露量,WLM;θ15~24和θ25+分别为到达年龄前15~24年和25年以上的氡累积暴露对总危险度的相对贡献;ϕage为不同年龄组的危险度调整系数;γz为不同暴露量率或不同暴露间期的危险度调整系数,相关参数的取值见表 1。
|
|
表 1 BEIR Ⅵ两种模型中相关参数的取值 Table 1 Parameters set in different models in the BEIR Ⅵ Report |
二、美国环境保护署模型
EPA/BEIRⅥ的ERR模型:美国环境保护署(US Environmental Protection Agency, EPA)为开展美国室内氡致肺癌风险的评估,于2003年对BEIR Ⅵ模型进行了改进。不管是在BEIR Ⅳ还是在BEIR Ⅵ报告中,EAC模型均假定单位暴露的危险度随氡子体浓度(暴露量率)的减少而增加,而EAD模型假定暴露的危险度随着暴露持续时间的延长而增加。这可以解释为对于一个固定的总暴露而言,暴露时间延长就意味着暴露量率减低。体外细胞学实验也曾发现过α粒子的致突变和恶性转化作用具有逆剂量率效应[26]。也就是说,α粒子致癌的关键因素之一是氡的浓度水平,其次是氡的暴露时间。另一方面,促癌作用的强度也与暴露时间和浓度直接相关。但由于BEIR Ⅵ报告依据的是高度平均化的资料,不能反映每天或每年的暴露浓度变化。
因此,用两种模型计算的最终结果会有所不同。例如,在预测居室氡暴露的个体危险度时,EAC模型的估计值比EAD模型要高40%左右,且在55、65和75岁年龄点还会出现ERR(a)的间断性下降[27]。为了解决这个问题,考虑到β(a)实际上是暴露-危险关系的斜率,EPA新模型中的β(a)采用了EAC和EAD两种模型相应值的几何均数[27],并采用了一个连续函数ϕage(a)对间断性下降的断点进行平滑处理;同时,为了能更准确地评估室内氡致肺癌的危险度,EPA还对吸烟与不吸烟对肺癌的影响进行了调整,改进后的EPA模型的数学表达式如下[27]:
| $ \operatorname{ERR}(a)=\delta \beta\left(W_{5 \sim 14}+\theta_{15 \sim 24} W_{15 \sim 24}+\theta_{25+} W_{25+}\right) \phi_{\text {age}}\gamma_{z} $ | (3) |
式中,δ为吸烟或非吸烟者的修正因子,对非吸烟者和吸烟者分别取值为2和0.9;β归一化值取0.063 4;总暴露为3个暴露时段的权重之和(W5~14+θ15~24W15~24+θ25+W25+)构成,θ15~24和θ25+为各段暴露后经过时间的效应修正因子。
三、欧洲模型1. Kreuzer等[28]的ERR模型:2009年欧盟的Alpha-Risk项目综合分析了捷克、法国和德国铀矿工人的3个队列研究结果[28-31]。这3个队列随访了在1946—1999年期间接触低浓度氡暴露的铀矿工人73 969名,其中1 720人死于肺癌,调查样本近130万人年,但整个研究中没有考虑吸烟的影响。Kreuzer等[28]在欧盟Alpha-Risk项目的调研基础上建立的ERR模型的数学表达式如下:
| $ \operatorname{ERR}(a)=\beta W_{5 \sim 19}+0.42 W_{20 \sim 34}+0.14 W_{35+} \varphi_{{age }} $ | (4) |
式中,β归一化取值为0.052;W5~19、W20~34、和W35+分别为达到年龄前5~19年、20~34年和35年及以上的累积氡暴露量,WLM;ϕage为5个年龄组的危险度调整系数,对于 < 45岁、45~54岁、55~64岁、65~74岁和75岁及以上分别取1.0、0.66、0.39、0.33和0.49。
比较式(4)和式(2)可以看出,Kreuzer等[28]的ERR模型与BEIR Ⅵ的EAC模型十分类似,有所不同的是年龄组的分组做了调整、相应的ϕage值也发生的变化。值得注意的是,Kreuzer等[28]的模型中75岁及以上组的ϕage值还高于55~74岁之间2个年龄组的相应值。
2. Hunter等[32]的ERR模型:为了研究氡和吸烟的联合作用,2011年,Leuraud等[33]和Hunter等[32]在欧洲矿工中还进一步开展了巢式病例对照研究,该研究中包括1 476例肺癌病例和3 389例有吸烟信息的对照。Hunter等[32]在欧洲矿工巢式病例对照研究的基础上共建立了两个ERR模型,具体数学表达式分别如下:
| $ \operatorname{ERR}(a)=\delta \beta_{1} W_{5 \sim 24}+0.12 W_{25+} \varphi_{{age }} $ | (5) |
| $ \operatorname{ERR}(a)=\delta \beta_{2} W_{5 \sim 24}+0.12 W_{25+}[\exp \alpha(t-30)] $ | (6) |
式中,δ为吸烟或非吸烟者的修正因子,对非吸烟者和吸烟者分别取值为1.5和0.75;β1和β2分别取0.041和0.013;W5~24和W25+分别为达到年龄前5~24年和25年及以上的累积氡暴露量,WLM;ϕage为4个年龄组的危险度调整系数,对于 < 55岁、55~64岁、65~74岁和75岁及以上分别取1.0、0.93、0.32和0.66;α为用于调整与首次暴露后年数(t)相关的参数,其值取-0.078。
比较式(5)或(6)和式(4)可以看出,巢式病例对照模型增加了对吸烟与非吸烟影响因素的调整,总暴露只考虑两个时段的权重之和(W5~24+0.12W25+)。另外,Hunter等[32]的巢式病例对照模型中75岁及以上组的ϕage值也高于65~74岁年龄组的相应值。
3. Darby等[34]的ERR模型:Darby等[34]对欧洲9个国13项关于室内氡和肺癌的病例-对照研究进行了联合分析,其中病例组和对照组分别为7 148人和14 208人,所有人群均有详细的吸烟史。该联合分析并未发现氡致肺癌的相对危险度在年龄、性别以及吸烟等方面的差异有统计学意义,得到的居室氡致肺癌的超额相对危险度可用以下简单的线性模型来估算:
| $ \mathrm{ERR}=\beta \times W_{5 \sim 34} $ | (7) |
式中,β取0.012,W5~34为过去5~34年累积氡暴露量,WLM。
四、不同模型对我国室内氡致肺癌危险度预测的结果比较我国20世纪80和90年代曾开展过较系统的全国范围内的环境氡调查,当时的室内平均氡浓度约为24 Bq/m3[1]。从我国近40年来开展的地区居室氡浓度调查结果来看,我国城市室内氡浓度呈明显的上升趋势[35-39]。最近的多项汇总分析研究表明,我国的室内平均氡浓度已上升至约54 Bq/m3[40-41]。结合近年我国公民的人均期望寿命(76.34岁)[42],取当前我国公民接受室内氡暴露的平均浓度为40 Bq/m3,居民每年在室内的滞留时间均为7 000 h、室内氡的平衡因子为0.4[43-44],图 1给出了用不同模型估算我国室内氡致公民肺癌的超额相对危险度的估算结果。需要说明的是,在利用EPA/BEIR-Ⅵ的模型计算时,假定我国公众的吸烟率及吸烟致肺癌的危险度与美国的相同;在利用Hunter模型计算时,不考虑是否吸烟的修正,δ值取为1。从图 1可看出,不同模型的估算结果在65岁前有明显的差异,在65~75岁之间基本一致,但在75岁之后又发生了偏离,这提示了上述模型的适用性仍需全面深入加以研究。值得提及的是,利用欧洲矿工模型(Kreuzer等[28]或Hunter等[32]的模型)预测出75岁以上居民的相对危险度比65~75岁、甚至55~75岁年龄组的居民还要高,这主要是因为他们对75岁以上人群设置的年龄调整系数大于65~75岁的年龄组。这个预测结果似乎与人们对电离辐射致癌风险是随年龄增大而降低的普遍认识不一致,提示了我们要慎用欧洲矿工模型来开展室内氡致肺癌风险的预测。
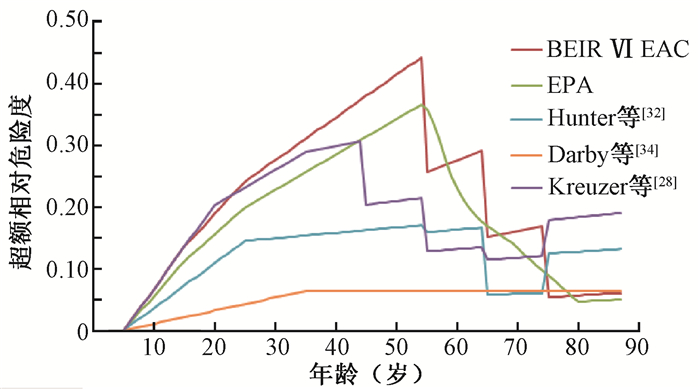
|
注:EAC.暴露—年龄—浓度模型;EPA.美国环境保护署 图 1 不同模型估算我国室内氡致肺癌超额相对危险度结果 Figure 1 Results of excess relative risks of radon-induced lung cancer in China by using different models |
为了更加直观了解室内氡诱发我国公民肺癌死亡的大致比例,假设我国20世纪90年代和当前的人均寿命分别为70和80岁,全部人群均接受氡暴露,在不考虑性别和吸烟情况分布等因素调整前提下,表 2给出了我国这两个时间段氡致肺癌的人群归因危险度百分比(PAR%)的粗略估算结果。从表 2可看出,不论用哪一种模型估算,随着室内氡浓度的升高,我国公民因接受室内氡暴露而诱发肺癌的PAR%已成倍增长,当前室内氡致肺癌的PAR%值至少可达6.39%。如考虑我国人口的性别比例、肺癌死亡数据和吸烟情况分布,苗晓翔等[45]已估算出在氡浓度为40 Bq/m3情况下,2015年我国公民因室内氡暴露而诱发肺癌的终生风险约为8.82%。
|
|
表 2 利用不同ERR模型估算我国氡致肺癌人群归因危险度(%) Table 2 Estimated population attributable risks of indoor radon-induced lung cancer in China by using different excess relative risk models |
从表 2还可以看出,利用Darby等[34]的ERR模型的估算明显偏低。其可能原因是仅考虑30年的氡暴露,而非终生;且Darby等[34]也自己指出其超额相对危险度的估算在低浓度暴露情况下很可能会被低估;另外,Darby等[34]研究中未发现年龄和吸烟情况分布情况对肺癌危险度的影响仍很值得考证。而利用基于矿工的流行病学研究得到不同超额相对危险度模型的估算结果基本相近。相对而言,利用没有考虑吸烟因素调整模型(BEIR Ⅵ模型、Kreuzer等[28]的模型)的估算结果更大,经吸烟因素调整后的模型(EPA/BEIR Ⅵ模型、Hunter等[32]的模型)估算结果较小;但欧洲矿工模型(Kreuzer等[28]和Hunter等[32]的模型)存在有75岁以上年龄组的调整系数似乎不合理的问题。为此,对于室内氡肺癌超额相对危险度评估,建议采用EPA/BEIR Ⅵ模型。
五、小结与展望近40年来,美国和欧洲的学术组织和学者先后建立了多个氡致肺癌的超额相对危险度评价模型,包括考虑了氡的暴露量率和暴露间期不同影响的模型。总的说来,利用已有模型开展室内氡致肺癌的归因风险评估时,基于矿工研究但不考虑吸烟情况分布调整的模型的估算结果较高,利用针对一般居民模型的估算结果最低。模型不同和使用不同模型得到不同估算结果的可能原因主要有如下几点:
(1) 矿工和居民在氡的暴露间期和暴露环境因素有很大差异。矿工一般是成年后开始工作,其暴露间期为数年至数十年不等,而居民的室内氡伴随其一生;矿山环境的氡浓度水平较高,矿山环境中的氡子体性状(粒径大小及其分布)与通常居室有很大不同,矿山环境中还存在有更多的其他健康危害因素(如粉尘、重金属等);因此,矿工和居民的氡致肺癌危险度很可能不同。
(2)“逆剂量率效应”有待于进一步验证并准确定量。矿工模型都是基于暴露于相对较高氡浓度的人群流行病学调查研究而得到的,且均接受了α粒子照射的“逆剂量率效应”观点;该“逆剂量率效应”观点虽然在体外细胞实验研究中得到了验证,但还有待于在更多的人群流行病学研究中得到验证,尤其是在低浓度暴露情况下的剂量率效应仍需要更加准确定量。
(3) 已建立的大部分模型没有充分考量吸烟与氡的联合暴露作用。EPA的模型也仅考虑了美国男女吸烟率的比例,未对吸烟史和吸烟量做进一步研究;而不同国家、不同人群的吸烟率、吸烟史和吸烟量不尽相同,为此,今后不同国家仍有必要进一步开展更详细的吸烟与氡的联合暴露作用对肺癌发病率的贡献。
(4) 室内氡致肺癌危险模型仍存在有一定不确定度。Darby等[34]建立的氡致肺癌相对危险度模型虽然针对室内氡暴露人群,但其研究资料中的室内平均氡浓度水平相对全球平均值而言偏高,且其只考虑了30年的氡暴露情况;另外,没有发现年龄和吸烟情况分布对氡致肺癌风险的影响也令人存疑。2009年世界卫生组织(WHO)基于Darby等[34]的模型估算出全球室内氡致肺癌归因风险度在3%至14%之间,而Gaskin等[15]的最新研究表明,不少国家的室内氡致肺癌归因风险度可高达16.5%以上。因此,仍十分有必要针对室内氡与吸烟的联合作用进一步开展更深入的研究。
本研究的初步试算结果表明,当前我国室内氡致肺癌的人群归因危险度可达6.39%以上。若以我国2020年的肺癌新发病例数(82万)[46]估算,我国目前每年可能约有5万人因接受室内氡暴露而诱发肺癌。为此,亟需重视我国室内氡致肺癌的问题,并研究制定相应的防控措施。为更加准确评估我国室内氡致肺癌的危险度,建议在我国:①开展更加高效且全面的室内氡浓度水平调查。②开展更加系统的氡与吸烟致肺癌的流行病学调查研究。③加强多部门间协作与基础数据(包括室内氡浓度、吸烟情况、人口年龄分布与寿命表、肺癌发病率/死亡率等)共享等,尽快建立适合于本国的室内氡致肺癌危险度评价模型,为准确评估我国室内氡致居民的肺癌风险提供科学依据。
利益冲突 无
作者贡献声明 强紫琪负责文献调研、数据计算与分析、撰写论文;陈波负责计算结果核对、数据分析;卓维海负责设计论文框架、指导修改论文
| [1] |
United Nations Scientific Committee on the Effects of Atomic Radiation. UNSCEAR 2000 report. Sources and effects of ionizing radiation[R]. Vienna: United Nations, 2000.
|
| [2] |
Auvinen A, Pershagen G. Indoor radon and deaths from lung cancer[J]. BMJ, 2009, 338: a3128. DOI:10.1136/bmj.a3128 |
| [3] |
International Commission on Radiological Protection. ICRP publication 65. Protection against radon-222 at home and at work[R]. Oxford: Pergamon Press, 1993.
|
| [4] |
IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Man-made mineral fibres and radon[R]. Lyon: International Agency for Research on Cancer, 1988.
|
| [5] |
National Research Council. Health risks of radon and other internally deposited alpha-emitters: BEIR Ⅳ[R]. Washington: National Academies Press, 1988.
|
| [6] |
Türkan Özbay, Özlem Karadeniz. Indoor radon measurement in Izmir province, Turkey[J]. Int J Environ Anal Chem, 2016, 96(8): 752-762. DOI:10.1080/03067319.2016.1196684 |
| [7] |
Eheman CR, Ford E, Garbe P, et al. Knowledge about indoor radon in the United States: 1990 National health interview survey[J]. Arch Environ Health, 1996, 51(3): 245-247. DOI:10.1080/00039896.1996.9936023 |
| [8] |
Torres-Durán M, Casal-Mouriño A, Ruano-Ravina A, et al. Residential radon and lung cancer characteristics at diagnosis[J]. Int J Radiat Biol, 2021, 97(7): 997-1002. DOI:10.1080/09553002.2021.1913527 |
| [9] |
Calvente I, Núñez MI, Chahboun Karimi R, et al. Survey of radon concentrations in the University of Granada in Southern Spain[J]. Int J Environ Res Public Health, 2021, 18(6): 2885. DOI:10.3390/ijerph18062885 |
| [10] |
Lubin JH, Tomásek L, Edling C, et al. Estimating lung cancer mortality from residential radon using data for low exposures of miners[J]. Radiat Res, 1997, 147(2): 126-134. DOI:10.2307/3579412 |
| [11] |
Tomasek L, Rogel A, Tirmarche M, et al. Lung cancer in French and Czech uranium miners: radon-associated risk at low exposure rates and modifying effects of time since exposure and age at exposure[J]. Radiat Res, 2008, 169(2): 125-137. DOI:10.1667/rr0848.1 |
| [12] |
Lubin JH. Radon and lung cancer risk: a joint analysis of 11 underground miners studies[M]. Maryland: U.S. Dept. of Health and Human Services, Public Health Service, National Institutes of Health, 1994.
|
| [13] |
Lubin JH, Boice JD Jr, Edling C, et al. Radon-exposed underground miners and inverse dose-rate (protraction enhancement) effects[J]. Health Phys, 1995, 69(4): 494-500. DOI:10.1097/00004032-199510000-00007 |
| [14] |
World Health Organization. WHO handbook on indoor radon: a public health perspective[R]. Geneva: World Health Organization, 2009.
|
| [15] |
Gaskin J, Coyle D, Whyte J, et al. Global estimate of lung cancer mortality attributable to residential radon[J]. Environ Health Perspect, 2018, 126(5): 057009. DOI:10.1289/EHP2503 |
| [16] |
International Commission on Radiological Protection. ICRP publication 126. Radiological protection against radon exposure[R]. Oxford: Pergamon Press, 2014.
|
| [17] |
International Commission on Radiation Units and Measurements. ICRU report 88. Measurement and reporting of radon exposures[R]. New York: Oxford University Press, 2012.
|
| [18] |
Hofmann W, Winkler-Heil R. Radon lung dosimetry models[J]. Radiat Prot Dosim, 2011, 145(2-3): 206-212. DOI:10.1093/rpd/ncr059 |
| [19] |
United Nations Scientific Committee on the Effects of Atomic Radiation. Effects of ionizing radiation Annex E: Sources-to-effects assessment for radon in homes and workplaces[R]. Vienna: United Nations, 2006.
|
| [20] |
童建. 氡致肺癌的危险度评价模型[J]. 中华劳动卫生职业病杂志, 2007, 25(6): 372-374. Tong J. Risk evaluation models of radon-induced lung cancer[J]. Chin J Ind Hyg Occup Dis, 2007, 25(6): 372-374. DOI:10.3760/cma.j.issn.1001-9391.2007.06.017 |
| [21] |
United Nations Scientific Committee on the Effects of Atomic Radiation. Sources, effects and risks of ionizing radiation. Annex B: Lung cancer from exposure to radon[R]. Vienna: United Nations, 2019.
|
| [22] |
International Commission on Radiological Protection. ICRP Publication 115. Lung cancer risk from radon and progeny and statement on radon[R]. Oxford: Pergamon Press, 2010.
|
| [23] |
International Commission on Radiological Protection. ICRP Publication 103. The 2007 recommendations of the international commission on radiological protection[R]. Oxford: Pergamon Press, 2007.
|
| [24] |
National Research Council. Health risks of radon and other internally deposited alpha-emitters: BEIR Ⅳ[R]. Washington: National Academies Press, 1988.
|
| [25] |
National Research Council. Health effects of exposure to radon: BEIR Ⅵ[R]. Washington: National Academies Press, 1999.
|
| [26] |
陈志海, 童建. 氡致肺癌研究进展[J]. 癌变·畸变·突变, 2011, 23(6): 482-484. Chen ZH, Tong J. Research progress of radon induced lung cancer[J]. Cancerat Distort Mutat, 2011, 23(6): 482-784. DOI:10.3969/j.issn.1004616x.2011.06.020 |
| [27] |
United States Environmental Protection Agency. EPA Assessment of risks from radon in homes[R]. Washington: EPA 402-R-03-003, 2003.
|
| [28] |
Kreuzer M, Grosche B, Schnelzer M, et al. Radon and risk of death from cancer and cardiovascular diseases in the German uranium miners cohort study: follow-up 1946-2003[J]. Radiat Environ Biophys, 2010, 49(2): 177-185. DOI:10.1007/s00411-009-0249-5 |
| [29] |
Tirmarche M. Quantification of cancer and noncancer risks associated with multiple chronic radiation exposures: epidemiologic studies, organ dose calculation, and risk assessment (Alpha-Risk)[J]. Epidemiology, 2006, 17(6): S68. DOI:10.1097/00001648-200611001-00151 |
| [30] |
Tomásek L. Czech mine studies of lung cancer risk from radon[J]. J Radiol Prot, 2002, 22(3A): A107-112. DOI:10.1088/0952-4746/22/3A/319 |
| [31] |
Amabile JC, Leuraud K, Vacquier B, et al. Multifactorial study of the risk of lung cancer among French uranium miners: radon, smoking and silicosis[J]. Health Phys, 2009, 97(6): 613-621. DOI:10.1097/01.HP.0000363842.62922.58 |
| [32] |
Hunter N, Muirhead CR, Tomasek L, et al. Joint analysis of three European nested case-control studies of lung cancer among radon exposed miners: exposure restricted to below 300 WLM[J]. Health Phys, 2013, 104(3): 282-292. DOI:10.1097/HP.0b013e3182765857 |
| [33] |
Leuraud K, Schnelzer M, Tomasek L, et al. Radon, smoking and lung cancer risk: results of a joint analysis of three European case-control studies among uranium miners[J]. Radiat Res, 2011, 176(3): 375-387. DOI:10.1667/rr2377.1 |
| [34] |
Darby S, Hill D, Deo H, et al. Residential radon and lung cancer detailed results of a collaborative analysis of individual data on 7 148 persons with lung cancer and 14 208 persons without lung cancer from 13 epidemiologic studies in Europe[J]. Scand J Work Environ Health, 2006, 32(1): 1-83. DOI:10.1590/S1807-59322010000900013 |
| [35] |
Wang Z, Lubin JH, Wang L, et al. Residential radon and lung cancer risk in a high exposure area of Gansu province, China[J]. Am J Epidemiol, 2002, 155(6): 554-564. DOI:10.1093/aje/155.6.554 |
| [36] |
王春红, 潘自强, 刘森林, 等. 我国部分地区居室氡浓度水平调查研究[J]. 辐射防护, 2014, 34(2): 65-73. Wang CH, Pan ZQ, Liu SL, et al. Investigation on indoor radon levels in some parts of China[J]. Radiat Prot, 2014, 34(2): 65-73. DOI:10.3969/j.issn.1000-8187.2014.02.001 |
| [37] |
尚兵, 贺青华, 王作元, 等. 中国室内氡行动水平的研究[J]. 中华放射医学与防护杂志, 2003, 23(6): 462-465. Shang B, He QH, Wang ZY, et al. Studies of indoor action level of radon in China[J]. Chin J Radiol Med Prot, 2003, 23(6): 462-465. DOI:10.3760/cma.j.issn.0254-5098.2003.06.032 |
| [38] |
王喜元, 金元, 卓维海, 等. 中国室内氡研究[M]. 北京: 科学出版社, 2003. Wang XY, Jin Y, Zhuo WH, et al. Research of indoor radon concentration in China[M]. Beijing: Science Press, 2003. |
| [39] |
卢志娟, 涂彧, 俞荣生. 三十年来我国室内外氡浓度的变化[J]. 中国辐射卫生, 2010, 19(1): 118-121. Lu ZJ, Tu Y, Yu RS. Changes of radon concentration in China in the past 30 years[J]. Chin J Radiol Health, 2010, 19(1): 118-121. DOI:10.13491/j.cnki.issn.1004-714x.2010.01.009 |
| [40] |
Yao Y, Chen B, Zhuo W. Reanalysis of residential radon surveys in China from 1980 to 2019[J]. Sci Total Environ, 2021, 757: 143767. DOI:10.1016/j.scitotenv.2020.143767 |
| [41] |
Su C, Pan M, Zhang Y, et al. Indoor exposure levels of radon in dwellings, schools, and offices in China from 2000 to 2020: A systematic review[J]. Indoor Air, 2022, 32(1): e12920. DOI:10.1111/ina.12920 |
| [42] |
王薇, 殷鹏, 王黎君, 等. 2005-2018年中国分省死亡率及期望寿命分析[J]. 中华流行病学杂志, 2021, 42(8): 1420-1428. Wang W, Yin P, Wang LJ, et al. Analysis on all-cause mortality rate and life expectancy in China, 2005-2018[J]. Chin J Epidemiol, 2021, 42(8): 1420-1428. DOI:10.3760/cma.j.cn112338-20200825-01095 |
| [43] |
Chen J. Lifetime lung cancer risks associated with indoor radon exposure based on various radon risk models for canadian population[J]. Radiat Prot Dosim, 2017, 173(1-3): 252-258. DOI:10.1093/rpd/ncw297 |
| [44] |
Cheng J, Guo Q, Ren T. Radon levels in China[J]. J Nucl Sci Technol, 2002, 39(6): 695-699. DOI:10.1080/18811248.2002.9715251 |
| [45] |
苗晓翔, 苏垠平, 卓维海, 等. 基于EPA/BEIR-Ⅳ模型的我国居室内氡致肺癌风险估计[J]. 中华放射医学与防护杂志, 2022, 42(1): 45-49. Miao XX, Su YP, Zhuo WH, et al. Risk estimation for lung cancer caused by indoor radon exposure in China based on EPA/BEIR-Ⅳ model[J]. Chin J Radiol Med Prot, 2022, 42(1): 45-49. DOI:10.3760/cma.j.cn112271-20210822-00338 |
| [46] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
 2022, Vol. 42
2022, Vol. 42


