2. 南华大学衡阳医学院生理教研室 421001;
3. 南华大学衡阳医学院病理教研室 421001;
4. 南华大学公共卫生学院, 衡阳 421001;
5. 南华大学附属第一医院肿瘤放疗科, 衡阳 421001
2. Department of Physiology, Medical College, University of South China, Hengyang 421001, China;
3. Department of Pathology, Medical College, University of South China, Hengyang 421001, China;
4. School of Public Health, University of South China, Hengyang 421001, China;
5. Department of Radiation Oncology, The First Affiliated Hospital of University of South China, Hengyang 421001, China
动物模型研究发现,辐射所致神经炎症与认知障碍关系密切[1-3]。炎症小体是一种重要的细胞内多蛋白复合物,能引导先天免疫对致病性刺激的反应,调节Caspase-1的激活、白介素1β(IL-1β)和IL-18的产生以及诱导细胞死亡[3]。在已知的炎症小体中,NOD样受体(NLR)家族成员NLRP3在脑内小胶质细胞中高度表达[4], 能够激活Caspase-1、IL-1β和IL-18[5]。到目前为止,还没有直接证据表明NLRP3炎症小体参与了辐射诱导的海马神经炎症。
越来越多的证据表明,NLRP3炎症细胞活化可能与神经炎症、神经退行性疾病[6]和神经精神障碍[7]等有关,小分子化合物MCC950是最近开发的选择性NLRP3炎症抑制剂,能在体内外有效地减轻炎性反应[8],在阿尔茨海默病等中枢神经系统疾病模型中也具有保护作用[9],对引起病理性炎症的全身性疾病有一定的疗效[10]。然而,MCC950对照射后小胶质细胞激活和认知行为的影响尚不清楚。
在本研究中,使用MCC950干预辐射诱导脑损伤模型,并进行临床相关的药理学分析。探讨能否通过给予MCC950抑制NLRP3炎症小体,减轻炎症性脑损伤,阻止促凋亡信号,从而改善照射后的认知行为,为NLRP3炎症小体作为放射性脑损伤的潜在治疗靶点提供研究基础。
材料与方法1.实验动物及材料:成年雌性昆明小鼠,购自湖南斯莱克景达实验动物中心[合格证号:SYXK(湘)2015-0001],体重25~30 g。动物适应性喂养1周(4~6只/笼),然后将其置于室温恒定(22±2)℃,光照可控(12 h昼/夜循环)的环境下饲养,自由饮水进食。实验流程符合南华大学动物护理与使用委员会规定。一抗:山羊抗兔NeuN (1:500, 美国Proteintech公司);二抗:生物素化兔抗羊IgG(武汉三鹰公司)、羊抗兔或羊抗小鼠(-HRP) (1:1 000, 北京康为世纪公司);137Cs HXFS-IA型生物辐照仪(中国核动力原设备制造厂)。一抗信息及稀释比见表 1。
|
|
表 1 一抗信息及稀释比 Table 1 Information and dilution of the primary antibodies |
2.动物分组及实验模型制备:小鼠采用随机数表法分为健康对照(NS)组、全身照射(IR)组和照射后MCC950干预(IR+MCC950)组,每组15只。IR组和IR+MCC950组小鼠经腹腔注射10%水合氯醛(40 mg/kg)麻醉,然后置于辐射仪中予137Cs单次辐照,总剂量4.0 Gy,剂量率为1.118 Gy/min。每天监测小鼠状态和死亡率。NS组小鼠只接受麻醉,不接受辐照。
3.药物处理:IR+MCC950组小鼠从照射后3周开始腹腔注射MCC950,每日1次,每次10 mg/kg,持续至行为学测试期,剂量参考文献[11]。NS组和IR组小鼠在相同时间段注射等量的生理盐水。
4.新旧事物识别测试:方法参照文献[12]。在训练阶段,每只小鼠在包含两个相同物体的旷场(40 cm×40 cm×40 cm)中自由探索5 min,然后返回饲养笼1 h,将旷场中的物体去掉1个,更换为一个形状质地不同的其他物体,再将小鼠放回旷场自由探索5 min。记录5 min内探索新事物的时间(T新)和探索旧事物的时间(T旧),计算新事物识别率(%)=(T新-T旧)/(T新+T旧) × 100%。该值越高,表明小鼠对新事物偏好越强。实验进行前及结束后,用70%乙醇擦拭旷场及物体,减少气味对实验的影响。
5.新旧位置识别实验:方法参照文献[13]。小鼠置于旷场(40 cm×40 cm×40 cm)中训练和测试,其上方装有记录小鼠活动的摄像机。训练阶段,两个相同的物体被放置在旷场对角的角落,距离侧壁8~9 cm。小鼠放在两个物体的中点,在两个相同的物体面前探索5 min后,放回笼子里。1 h后进行新旧位置识别检测,此时,一个物体被移到另一个角落的新位置,而另一个物体则保持在原来的位置;将小鼠放回起点,记录小鼠5 min内对两物体的探索次数。每个实验结束后用75%的乙醇去除旷场及其内物体小鼠残留气味。识别指数(discrimination ratio,DR)计算公式:DR=(新位置探索时间-旧位置探索时间)/(新位置探索时间+旧位置探索时间)×100 %。
6.社会认知检测:方法参照文献[14]。设备包括一个有黑色墙壁和底板的无顶木框(40 cm×40 cm×40 cm)。两个干净的圆形笼子(直径8.5 cm,高11 cm),分别置于框内左右两侧。训练阶段,一个笼子内放入1只雌性小鼠,另外一笼子空着,待测小鼠置于框内中央位置,任其自由探索5 min。社会认知检测阶段,空笼内放入新的雌性小鼠,待测小鼠再次置于框内中央位置,任其自由探索5 min,记录小鼠在两个笼子附近探索的时间。DR′=(新小鼠接触时间-旧小鼠接触时间)/(新小鼠接触时间+旧小鼠接触时间)×100%。
7.免疫组织化学检测:方法参照文献[14]。选择照射后6周,行为学检测结束后,每组4只小鼠,腹腔注射10%水合氯醛(40 mg/kg),先后用生理盐水和4%甲醛溶液灌注固定,取脑置于4%甲醛溶液中后固定过夜,4℃下梯度蔗糖(15%、30%)浸泡脱水,冰冻切片,厚度30 μm,切片用0.01 mol/L磷酸盐缓冲液(PBS)漂洗3次,每次5 min,3%双氧水浸泡25 min去过氧化物酶,5%羊血清(ZSGB-BIO)封闭2 h后,一抗4℃孵育过夜:兔抗-NeuN (1:500)。次日,漂洗3次后,室温下切片用羊抗兔IgG孵育2 h。亲和素-生物素复合物(ABC)法将链霉亲和素-生物素过氧化物酶复合物与二级抗体结合(孵育2 h),DAB试剂盒(ZSGB-BIO)显色。用Image-Pro Plus 6.0检测小鼠海马CA3区NeuN蛋白表达的平均吸光度(A)值。
8.Western blot检测:小鼠用10%水合氯醛(45 mg/kg)腹腔注射麻醉小鼠实施安乐死,快速取出完整海马,加入含蛋白酶抑制剂的裂解液(北京CWBIO公司)匀浆,提蛋白。总蛋白(25~40 μg)经10%或15% SDS-聚丙烯酰氨凝胶电泳分离后,转移至醋酸纤维素(NC)膜上。NC膜用5%脱脂奶粉封闭2 h,一抗(表 1)孵育,4℃过夜。次日复温,0.05%磷酸盐缓冲液(PBS)洗涤3次,用羊抗兔或羊抗小鼠(-HRP) (1:1 000)孵育2 h,加入电化学发光ECL液显影。β-tubulin作为内参照。吸光度值用ImageJ(美国国立卫生研究院)分析。
9.Real-time-PCR检测:按说明书用TRIzol®试剂(北京CWBIO公司)提取小鼠海马组织的RNA,用Revert AidTM First Strand cDNA合成试剂盒(北京Fermentas公司)将1 μg总RNA进行cDNA合成。然后将cDNA储存在-20℃下。基因表达水平由采用SYBR©绿色PCR主混合物(日本TaKaRa公司)的ABI-7500 Real-time PCR系统测定。以GAPDH基因表达作为内参照。用Primer 3软件设计引物,引物序列见表 2。采用两步PCR方法。PCR循环条件为:95℃ 30 s;95℃ 40 s;60℃ 30 s。样品采用技术复制品进行处理,PCR结束时对每个样品进行熔融分析。使用2-ΔΔCt法确定相关基因的表达[14]。
10.统计学处理:采用Prism 6.0软件(Graphpad Software)进行分析。数据经K-S检验呈正态分布,用x±s表示。组间比较用Student′s t检验,Hartley检验显示数据方差齐。多组比较采用One-way ANOVA及Bonferroni posttest法检验。P < 0.05为差异有统计学意义。
|
|
表 2 Real-time PCR引物序列 Table 2 The sequence of primers used in Real-time PCR |
结果
1.照射诱导小鼠认知损伤:短时新旧事物识别实验及长期新旧事物识别实验中,与NS组相比,IR组小鼠识别指数显著降低(t=4.321、5.473, P < 0.05);此外,IR组小鼠新旧位置识别指数也显著低于NS组(t=3.188, P < 0.01)。社会认知检测结果表明,与NS组相比,IR组小鼠识别指数显著降低(t=2.097, P < 0.05)。表明辐射可诱导小鼠认知障碍,见表 3。
|
|
表 3 辐射对小鼠认知功能的影响(%,x±s) Table 3 Effect of radiation on cognitive function in mice(%, x±s) |
2.照射后海马NLRP3炎性小体表达上调:结果见图 1。与NS组相比,照射后海马NLRP3炎症小体相关蛋白(NLRP3和Caspase-1)表达增强(t=2.699、8.515, P < 0.01),但对ASC的表达没有显著影响(P>0.05)。与NLRP3表达增强一致,IR组IL-1β及IL-18蛋白表达也明显增强(t=3.340、3.950, P < 0.05)。PCR结果也显示,照射后小鼠海马NLRP3、Caspase-1、IL-1β和IL-18的mRNA表达明显高于对照组(t=2.956、3.254、2.956, P < 0.05)。但对ASC的表达无影响(P> 0.05)。
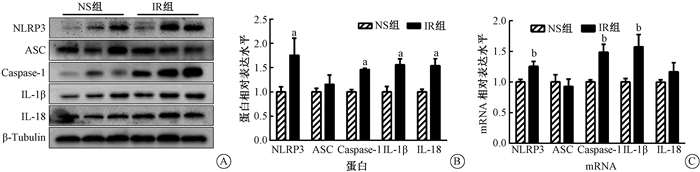
|
注:a与同一指标NS组比较,t=2.699、8.515、3.340、3.950,P < 0.05;b与同一指标NS组比较,t=2.956、3.254、2.956,P < 0.05 图 1 照射对海马NLRP3炎症小体(NLRP3、ASC、Caspase-1、IL-1β和IL-18)的影响 A. Western blot实验的蛋白条带;B.蛋白的相对表达量;C. PCR检测mRNA的表达水平 Figure 1 Effect of radiation on NLRP3 inflammasomes (NLRP3, ASC, Caspase-1, IL-1β and IL-18) in the hippocampus A. Representative protein bands of Western blot assay; B. Relative expression level of each protein; C. mRNA expression levels measured with PCR assay |
3.MCC950对照射后海马NLRP3炎症反应和认知功能的影响:在短时和长期新旧事物识别、新旧位置识别、社会认知测试中,不同组间的辨别率均存在显著差异(F=20.64、27.14、9.24、8.87, P < 0.01,表 4)。与NS组相比,IR组小鼠在此4项测试中的辨别率显著降低(t=5.014、7.318、3.987、3.152,P < 0.05),经MCC950治疗可以逆转以上改变(t=5.860、4.598、3.040、4.021,P < 0.05)。表明MCC950可以改善辐射引起的小鼠认知损伤。
|
|
表 4 MCC950对照射后小鼠认知功能的影响(%,x±s) Table 4 Effect of MCC950 on cognitive function of mice after irradiation(%, x±s) |
3组间NLRP3和Caspase-1的表达存在差异(F=35.23、7.599,P < 0.05,图 2)。与NS组小鼠相比,IR组小鼠中NLRP3和Caspase-1的表达显著增加(t=7.656、3.548,P < 0.05),而IR+MCC950组水平与NS小鼠相似(t=7.000、3.172,P < 0.05)。各组间IL-1β和IL-18的表达差异有统计学意义(F=10.46、15.88,P < 0.05)。与NS组相比,IR组小鼠IL-1β和IL-18蛋白表达水平升高(t=4.021、5.290,P < 0.05),而MCC950显著降低了其表达(t=3.897、4.169,P < 0.01)。
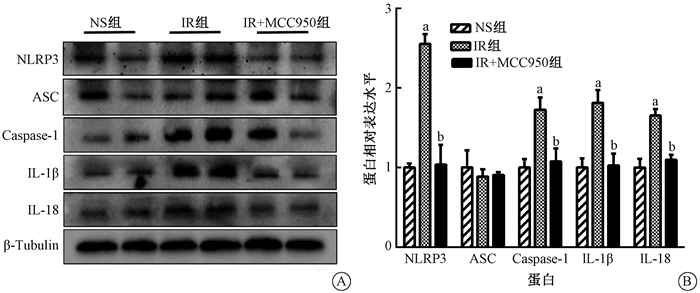
|
注:a与NS组比较,t=7.656、3.548、4.021、5.290,P < 0.05;b与IR组比较,t=7.000、3.172、3.897、4.169,P < 0.05 图 2 MCC950对受照射小鼠海马NLRP3炎症小体(NLRP3、ASC、Caspase-1、IL-1β和IL-18)的影响 A. Western blot实验的蛋白条带;B.蛋白的相对表达量 Figure 2 Effect of MCC950 on radiation-induced NLRP3 inflammasomes (NLRP3, ASC, Caspase-1, IL-1β and IL-18) in the hippocampus A. Representative protein bands of Western blot assay; B. Relative expression level of each protein |
4.MCC950通过抑制照射后促凋亡信号抑制神经元凋亡:海马中凋亡相关蛋白的表达见图 3。各组间凋亡相关蛋白BAX、Caspase-3、PARP1的表达差异有统计学意义(F=7.887、8.771、48.620, P < 0.05)。与NS组相比,辐射显著上调了海马BAX、Caspase-3和PARP1的表达(t=3.887、2.742、3.287, P < 0.05),而MCC950显著降低其表达(t=2.852、4.090、9.614,P < 0.05)。免疫组织化学法测定各组海马CA3区NeuN(成熟神经元的标志物)(图 4),其平均A值差异有统计学意义(NS组:0.097 72±0.006,IR组:0.067 35±0.002,IR+MCC950组:0.087 23±0.002;F=10.43,P < 0.01)。与NS组相比,照射明显降低了海马CA3区NeuN的表达(t=4.545, P < 0.001),而MCC950显著增加了其表达(t=2.613, P < 0.05)。
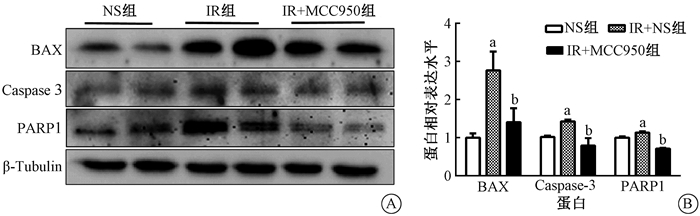
|
注:a与NS组比较,t=3.887、2.742、3.287, P < 0.05;b与IR组比较,t=2.852、4.090、9.614,P < 0.05 图 3 MCC950对受照射小鼠海马细胞凋亡标志物和神经元标志物(BAX、Caspase-3和PARP1)的影响 A. Western blot实验的蛋白条带;B.蛋白的相对表达量 Figure 3 Effect of MCC950 on radiation-induced expressions of apoptosis markers (Bax, Caspase-3) and neuronal marker (PARP1) in the hippocampus A. Representative protein bands of Western blot assay; B. Relative expression level of each protein |
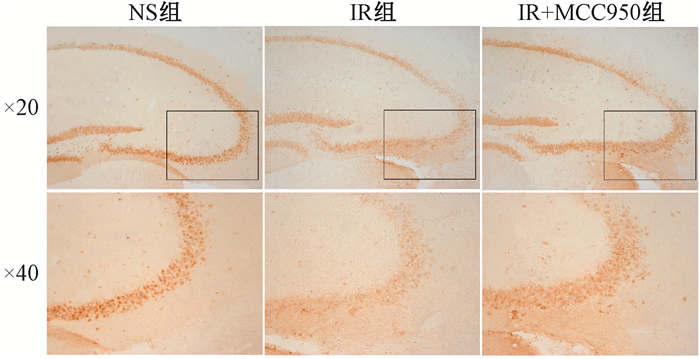
|
注:方框示局部放大位置 图 4 受照射小鼠海马CA3区神经元NeuN免疫组织化学图 Figure 4 Images of immunohistochemical staining of NeuN in the hippocampal CA3 area of mice |
讨论
慢性炎症被认为是放射性脑损伤的标志之一,它与认知障碍有关[15]。研究表明,辐照降低了照射后1个月新旧事物识别实验和新旧位置识别实验中的辨别力[16-17]。
NLRP3炎症小体是研究最广泛的炎症小体,它可能激活Caspase-1,导致促炎性IL-1β和IL-18的加工和分泌[18-19]。据报道,典型的NLRP3炎症激活与炎症引起的认知功能衰退[20]和阿尔茨海默病[4]有关。本研究的新发现是,NLRP3炎症小体在受照小鼠海马中被激活,表现为NLRP3的增加和Caspase-1、IL-1β和IL-18的裂解。提示NLRP3可能在辐射损伤小鼠学习记忆功能中起一定作用。在啮齿动物脑损伤模型中,阻断或抑制NLRP3炎症激活可减轻神经炎症,改善组织病理学和功能结果[20]。MCC950是一种新型、有效、选择性的小分子NLRP3炎性小体抑制剂,已有报道显示它能抑制NLRP3炎性小体的形成,减少IL-1β和IL-18的产生[21]。对于转化途径,评估了小分子MCC950对受照小鼠的治疗优势。数据表明,用MCC950抑制NLRP3可以防止全身照射后认知能力下降。MCC950处理的受照小鼠与NS组小鼠没有明显区别,NS小鼠和MCC950注射动物都对探索新的地点或对象有显著的偏好。
前期研究证实,腹腔注射MCC950能显著抑制照射后小鼠海马NLRP3炎症小体的激活以及随后IL-1β和IL-18的产生[22]。最近,Ismael等[23]报道,MCC950可减轻脑损伤及相应的促凋亡信号,也支持这一观点。为了进一步探讨MCC950对照射后认知行为的保护作用机制,本研究还测定了照射后海马神经元凋亡和促凋亡信号的表达。海马细胞凋亡标志物如BAX、PARP1和Caspase-3减少的结果表明MCC950可以抑制促凋亡信号。
总之,本研究表明,用MCC950阻断NLRP3炎症通路可减轻小鼠的炎症性脑损伤和认知功能障碍。提示MCC950可能是一种有潜力的治疗放射性脑损伤药物。
志谢 感谢湖南省教育厅科学研究项目(2019C1566)对本研究的资助
利益冲突 所有研究者未因该研究接受不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 刘政海、罗诗诗负责研究方案的设计、动物饲养、行为学拍摄、数据处理、论文撰写;王贞、徐杨、何洁负责免疫组织化学及Western blot操作;王五洲、何淑雅提供辐射仪及技术指导;艾小红、李彩负责实验设计指导和论文修改;曹文宇负责总体实验设计、论文撰写指导
| [1] |
乃爱桃, 王贞, 曹文宇, 等. 丰富环境对辐射诱导小鼠认知障碍的保护作用及可能机制[J]. 中华放射医学与防护杂志, 2018, 38(6): 401-406. Nai AT, Wang Z, Cao WY, et al. The protective effect of environmental enrichment on radiation induced cognitive dysfunction and underlying mechanism[J]. Chin J Radiol Med Prot, 2018, 38(6): 401-406. DOI:10.3760/cma.j.issn.0254-5098.2018.06.001 |
| [2] |
Heneka MT, Mcmanus RM, Latz E. Inflammasome signalling in brain function and neurodegenerative disease[J]. Nat Rev Neurosci, 2018, 19(10): 610-621. DOI:10.1038/s41583-018-0055-7 |
| [3] |
Singhal G, Jaehne EJ, Corrigan F, et al. Inflammasomes in neuroinflammation and changes in brain function:a focused review[J]. Front Neurosci, 2014, 8: 315. DOI:10.3389/fnins.2014.00315 |
| [4] |
Jang J, Park S, Jin HH, et al. 25-hydroxycholesterol contributes to cerebral inflammation of X-linked adrenoleukodystrophy through activation of the NLRP3 inflammasome[J]. Nat Commun, 2016, 7: 13129. DOI:10.1038/ncomms13129 |
| [5] |
Alcocer-Gomez E, de Miguel M, Casas-Barquero N, et al. NLRP3 inflammasome is activated in mononuclear blood cells from patients with major depressive disorder[J]. Brain Behav Immun, 2014, 36: 111-117. DOI:10.1016/j.bbi.2013.10.017 |
| [6] |
Coll RC, Robertson AA, Chae JJ, et al. A small-molecule inhibitor of the NLRP3 inflammasome for the treatment of inflammatory diseases[J]. Nat Med, 2015, 21(3): 248-255. DOI:10.1038/nm.3806 |
| [7] |
Dempsey C, Rubio AA, Bryson KJ, et al. Inhibiting the NLRP3 inflammasome with MCC950 promotes non-phlogistic clearance of amyloid-beta and cognitive function in APP/PS1 mice[J]. Brain Behav Immun, 2017, 61: 306-316. DOI:10.1016/j.bbi.2016.12.014 |
| [8] |
Ismael S, Zhao L, Nasoohi S, et al. Inhibition of the NLRP3-inflammasome as a potential approach for neuroprotection after stroke[J]. Sci Rep, 2018, 8(1): 5971. DOI:10.1038/s41598-018-24350-x |
| [9] |
Bevins RA, Besheer J. Object recognition in rats and mice:a one-trial non-matching-to-sample learning task to study 'recognition memory'[J]. Nat Protoc, 2006, 1(3): 1306-1311. DOI:10.1038/nprot.2006.205 |
| [10] |
Liu ZW, Yu Y, Lu C, et al. Postweaning isolation rearing alters the adult social, sexual preference and mating behaviors of male CD-1 mice[J]. Front Behav Neurosci, 2019, 13: 21. DOI:10.3389/fnbeh.2019.00021 |
| [11] |
Xu X, Yin D, Ren H, et al. Selective NLRP3 inflammasome inhibitor reduces neuroinflammation and improves long-term neurological outcomes in a murine model of traumatic brain injury[J]. Neurobiol Dis, 2018, 117(1): 15-27. DOI:10.1016/j.nbd.2018.05.016 |
| [12] |
Xu Y, Cao W, Zhou M, et al. Inactivation of BRD7 results in impaired cognitive behavior and reduced synaptic plasticity of the medial prefrontal cortex[J]. Behav Brain Res, 2015, 286(1): 1-10. DOI:10.1016/j.bbr.2015.02.031 |
| [13] |
Kentrop J, Smid CR, Achterberg E, et al. Effects of maternal deprivation and complex housing on rat social behavior in adolescence and adulthood[J]. Front Behav Neurosci, 2018, 12: 193. DOI:10.3389/fnbeh.2018.00193 |
| [14] |
Cao WY, Hu ZL, Xu Y, et al. Role of early environmental enrichment on the social dominance tube test at adulthood in the rat[J]. Psychopharmacology (Berl), 2017, 234(22): 3321-3334. DOI:10.1007/s00213-017-4717-3 |
| [15] |
Moravan MJ, Olschowka JA, Williams JP, et al. Cranial irradiation leads to acute and persistent neuroinflammation with delayed increases in T-cell infiltration and CD11c expression in C57BL/6 mouse brain[J]. Radiat Res, 2011, 176(4): 459-473. DOI:10.1667/rr2587.1 |
| [16] |
Jiang D, Chen S, Sun R, et al. The NLRP3 inflammasome:Role in metabolic disorders and regulation by metabolic pathways[J]. Cancer Lett, 2018, 419: 8-19. DOI:10.1016/j.canlet.2018.01.034 |
| [17] |
Mangan M, Olhava EJ, Roush WR, et al. Targeting the NLRP3 inflammasome in inflammatory diseases[J]. Nat Rev Drug Discov, 2018, 17(8): 588-606. DOI:10.1038/nrd.2018.97 |
| [18] |
Youm YH, Grant RW, Mccabe LR, et al. Canonical Nlrp3 inflammasome links systemic low-grade inflammation to functional decline in aging[J]. Cell Metab, 2013, 18(4): 519-532. DOI:10.1016/j.cmet.2013.09.010 |
| [19] |
Mortezaee K, Khanlarkhani N, Beyer C, et al. Inflammasome:Its role in traumatic brain and spinal cord injury[J]. J Cell Physiol, 2018, 233(7): 5160-5169. DOI:10.1002/jcp.26287 |
| [20] |
Ren H, Kong Y, Liu Z, et al. Selective NLRP3(pyrin domain-containing protein 3) inflammasome inhibitor reduces brain injury after intracerebral hemorrhage[J]. Stroke, 2018, 49(1): 184-192. DOI:10.1161/STROKEAHA.117.018904 |
| [21] |
Ma Q, Chen S, Hu Q, et al. NLRP3 inflammasome contributes to inflammation after intracerebral hemorrhage[J]. Ann Neurol, 2014, 75(2): 209-219. DOI:10.1002/ana.24070 |
| [22] |
Yuan B, Shen H, Lin L, et al. Recombinant adenovirus encoding NLRP3 RNAi attenuate inflammation and brain injury after intracerebral hemorrhage[J]. J Neuroimmunol, 2015, 287: 71-75. DOI:10.1016/j.jneuroim.2015.08.002 |
| [23] |
Ismael S, Nasoohi S, Ishrat T. MCC950, the selective inhibitor of nucleotide oligomerization domain-like receptor protein-3 inflammasome, protects mice against traumatic brain injury[J]. J Neurotrauma, 2018, 35(11): 1294-1303. DOI:10.1089/neu.2017.5344 |
 2020, Vol. 40
2020, Vol. 40


