2. 济南市第四人民医院肿瘤放疗科 250031;
3. 山东省肿瘤防治研究院 山东省肿瘤医院肿瘤放疗科, 济南 250117
2. Department of Radiation Oncology, Jinan Fourth People's Hospital, Jinan 250031, China;
3. Department of Radiation Oncology, Shandong Cancer Hospital and Institute, Jinan 250117, China
目前,放射治疗的不良反应仍然不可避免,不仅影响患者的生活质量,甚至会中断放疗,降低疗效[1]。表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是绿茶的主要成分,对正常组织放射损伤具有防治作用,但具体机制仍不清楚[2]。为此,本研究探讨EGCG对放射性食管炎动物模型新西兰兔的影响,分析其与相对分子质量67×103层粘连蛋白受体(67LR)的相关性。
材料与方法1.实验动物:普通级健康雄性新西兰兔,体重(2.14±0.07)kg,8~10周龄,购自扬州仪征安立卯生物科技有限公司。动物许可证号:SCXK(苏)2016-0013。饲养环境为温度22~25℃, 湿度55%~65%。
2.药品与试剂:EGCG,纯度:95%,购自宁波禾普生物技术有限公司(配置成浓度为440 μmol/L的EGCG盐溶液)、兔白细胞介素1β(IL-1β)、兔白细胞介素6(IL-6);兔转移趋化生长因子β1(TGF-β1)和兔肿瘤坏死因子α(TNF-α)ELISA试剂盒均购自武汉Cusabio公司;磷酸盐缓冲液(PBS,南京生兴生物公司);免疫组织化学试剂盒购自丹麦Dako公司。
3.主要仪器:SDS-PAGE电泳仪及湿法转膜仪(美国Bio-Rad公司);Tanon5200化学发光检测系统(上海Tanon科技有限公司);放疗加速器(美国瓦里安公司)。
4.模型分组和处置:雄性新西兰兔30只,用随机数表法分为3组,每组10只,分别为空白组、生理盐水组与EGCG组。生理盐水组与EGCG组新西兰兔用4%的戊巴比妥钠(1.5 ml/kg)耳缘静脉麻醉后,仰卧位固定治疗床上。采用瓦里安直线加速器6 MV X射线,对新西兰兔颈部食管进行单次照射。照射野为颈部1/2处往膈肌食管裂口6 cm,颈部正中4 cm,深度为皮下1.5 cm,照射剂量率为2 Gy/min,源皮距100 cm,单次照射30 Gy[3]。空白组不进行照射。
照射后第2天分别对EGCG组、生理盐水组进行EGCG和生理盐水给药。EGCG的给药浓度为440 μmol/L,每天3次,间隔6 h,每次10 ml,给药后禁食水30 min,连续5 d。生理盐水给药剂量、次数、时间间隔同上。给药方法为大鼠灌胃针给药。
5.标本采集与处理:分别于照射前及照射后每日取血清,分别取空白组、生理盐水组与EGCG组新西兰兔血液各2 ml。采血管置于冷冻离心机12 000 r/min,离心半径8 cm,4℃离心10 min,取上清做(ELISA)检测。采血时间点为造模前1 d,给药当天开始每天各取1次,给药5 d后麻醉处死新西兰兔,完整剥取食管,一半固定于4%多聚甲醛24 h以上,脱水,包埋,修整后4 μm切片,剩余样本放在液氮罐暂存后保存至-80℃。
6.食管组织病理观察:取食管组织石蜡切片,脱蜡,苏木素-伊红染色。脱水封片后,显微镜镜检,图像采集分析。染色结果为细胞核蓝色,细胞质红色。评分标准参考文献[4]。食管组织损伤程度分为0分:无损伤;1分:轻度坏死脱落;2分:中度坏死脱落;3分:重度坏死脱落。炎症细胞浸润深度分为0分:无炎症细胞浸润;1分:仅固有层和黏膜下层有少量炎症细胞浸润;2分:固有层和黏膜下层有中量炎症细胞浸润;3分:固有层和黏膜下层有大量炎症细胞浸润,肌层和外膜层均有炎症细胞浸润。
7.食管组织免疫组织化学分析:取食管组织石蜡切片,烘片2 h,脱蜡水化,微波修复,过氧化氢溶液孵育,封闭。加入50 μl稀释的一抗覆盖组织,4℃过夜。冲洗除液后加入二抗,4℃孵育50 min。二氨基联苯胺(DAB,丹麦Dako公司)底物显色。苏木素复染,乙醇脱水干燥,二甲苯透明,中性树胶封固。67LR免疫组织化学染色的阳性信号呈棕黄色颗粒,显色强时为棕褐色颗粒。每张组织切片摄取3个视野(×100),运用Image-Pro Plus 6.0图像分析软件对图片进行分析计算吸光度(A)值。
8. Western blot检测:按试剂盒说明书提取蛋白,Bradford蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)进行蛋白定量。聚丙烯酰胺凝胶电泳分离,转膜、封闭,一抗(按1:1 000稀释比例)4℃孵育过夜,和相应二抗(1:5 000稀释)室温孵育2 h,之后使用增强型化学发光系统(ECL)进行化学发光,按照试剂盒说明书操作。于Tanon凝胶成像仪下拍照,计算蛋白量。重复3次,取均数。
9.用ELISA法测定新西兰兔血清IL-1β、IL-6、TGF-β及TNF-α水平:取出保存的兔血清,按照ELISA试剂盒说明书进行操作,酶标仪450 nm波长检测吸光度,计算新西兰兔血清IL-1β、IL-6、TGF-β及TNF-α水平。
10.统计学处理:用SPSS 17.0软件包对数据进行分析,分析前对数据进行正态性及方差齐性检验,符合的计量资料以x±s表示,非正态分布资料进行对数转换。各组间比较用单因素方差分析,其后两两比较应用LSD检验。P < 0.05为差异有统计学意义。
结果1.一般情况及体重变化:各组新西兰兔进食及活动情况正常,照射前、照射后、用药结束后空白组、生理盐水组、EGCG组同一时间点体重差异均无统计学意义(P>0.05)。
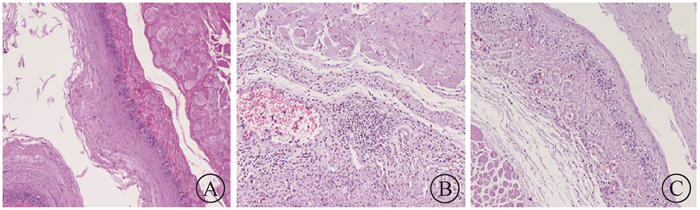
2.食管组织病理变化评分比较:图 1为各组的典型表现。在镜下可见空白组食管组织形态结构完好,无水肿、出血和炎性细胞浸润等情况;生理盐水组食管黏膜鳞状上皮层坏死脱落,黏膜充血、糜烂,产生脓肿,固有层、黏膜下层甚至肌层可见大量炎性细胞浸润;EGCG组炎细胞浸润较少,出血也较生理盐水组有一定程度的减少。空白组、生理盐水组、EGCG组食管组织损伤评分分别为0、2.10±0.74、1.60±0.70;炎症细胞浸润分别为0、1.90±0.57、1.20±0.42;最终食管组织病理变化程度评分分别为0、3.90±1.10、2.80±0.92。各组间两两比较差异均有统计学意义(t=10.54、7.56、2.97,P < 0.05)。
|
图 1 各组新西兰兔食管组织的病理观察HE染色×100 A.空白组;B.生理盐水组;C. EGCG组 Figure 1 The pathological changes in esophagus tissue of rabbit with HE staining ×100 A. blank group; B. saline group; C. EGCG group |
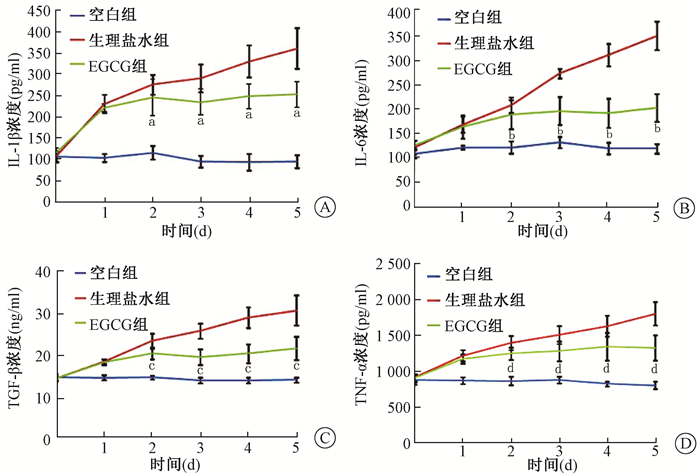
3.血清IL-1β、IL-6、TGF-β及TNF-α水平比较:如图 2所示,相对于空白组,照射后随时间延长生理盐水组IL-1β、IL-6、TGF-β及TNF-α表达明显升高,而EGCG组对各炎症因子的表达均有抑制作用。以IL-1β为例,照射后各观测时间3组差异均存在统计学意义(F=82.35~236.32,P < 0.05),从给药第2天起,EGCG组与生理盐水组比较,差异有统计学意义(t=2.25~7.13,P < 0.05)。
|
注:给药后1~5 d,同一时间点3组间比较,FIL-1β=82.35~236.32,P < 0.05;FIL-6=23.66~236.04,P < 0.05;FTGF-β=97.11~149.61,P < 0.05;FTNF-α=68.24~127.98,P < 0.05;与生理盐水组比较,at=2.25、4.45、6.18、7.13,P < 0.05;bt=2.10、8.27、11.69、13.67,P < 0.05;ct=4.90、8.91、9.89、7.59,P < 0.05;dt=4.17、4.50、4.56、7.62,P < 0.05 图 2 各组动物血清炎症因子的表达随时间的变化A. IL-1β;B.IL-6;C.TGF-β;D.TNF-α Figure 2 Time responses of serum inflammatory factors in each group after irradiation A. IL-1β; B.IL-6; C.TGF-β; D.TNF-α |
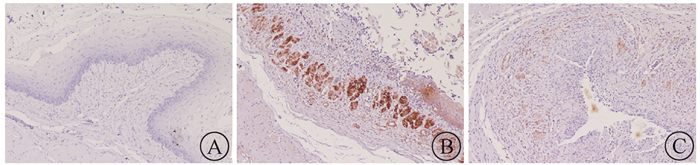
4.食管组织67LR蛋白表达水平的比较:空白组、生理盐水组及EGCG组的食管组织67LR表达吸光度(A)值分别为178.40±20.58,7 072.90±870.34,1 551.30±308.11,3组间差异有统计学意义(F=468.48,P < 0.05),EGCG组与生理盐水组差异有统计学意义(t=23.16,P < 0.05)。图 3示各组67LR蛋白的阳性表达情况。空白组食管组织67LR蛋白无明显表达,而生理盐水组高表达,EGCG组阳性表达介于两组之间。
|
图 3 各组新西兰兔67LR蛋白的表达免疫组织化学染色×100 A.空白组;B.生理盐水组;C. EGCG组 Figure 3 Expression of 67LR protein in esophagus tissue of each group with immunohistochemistry assay ×100 A. blank group; B. saline group; C. EGCG group |
空白组、生理盐水组及EGCG组应用Western blot进行67LR表达量分析,结果分别为0.34±0.04、1.26±0.07、0.69±0.07,差异有统计学意义(F=585.38,P < 0.05);两组间比较差异有统计学意义(t=13.17、33.94、20.77,P < 0.05,图 4)。

|
注:1.空白组;2.生理盐水组;3.EGCG组 图 4 Western blot检测3组67LR蛋白表达水平 Figure 4 Western blot assay of the 67LR protein level in the three groups |
讨论
放射性食管炎的生物学机制十分复杂,包括炎症、凋亡、免疫等多项进程。辐射的生物效应主要引起细胞双螺旋结构复制紊乱,导致细胞信息传递障碍而丧失正常功能。主要病理变化是上皮细胞和血管损伤变化及炎症细胞浸润等,晚期可出现纤维化[5]。临床上表现为患者放疗后开始出现的吞咽困难、吞咽疼痛及胸骨下疼痛,是肺癌放疗时重要的剂量限制性因素之一[6],但目前在国际上没有公认的防治放射性食管炎的有效药物。
EGCG具有抗炎、抗氧化、抗突变、抗病毒等多种功能[2, 7-8]。细胞实验发现EGCG可与细胞表面受体67 LR结合,诱导Toll样蛋白相互作用蛋白(TLLIP)表达,从而负性调节脂多糖诱导的Toll样受体(TLR)信号通路,该通路在固有免疫及受体相关激酶介导的炎症反应中发挥重要作用,通过抑制下游多种炎症及凋亡通路,进一步抑制前炎症因子释放,减轻放射导致的正常细胞损伤的发生及发展[9-10]。
本研究通过动物实验探讨了在急性放射性食管损伤中EGCG能否通过67LR的表达,减轻放射性食管炎的损伤程度,起到防护放射性食管炎的作用。结果显示,30 Gy X射线单次照射新西兰兔食管部位,导致食管组织放射性损伤明显,多种检测手段发现损伤部位食管壁67LR表达明显升高,而且伴随着血液中的炎症因子IL-1β、IL-6、TGF-β及TNF-α随着时间的延长明显增加。当给予EGCG治疗后,新西兰兔食管的炎症损伤明显减轻,而且67LR及各炎症因子表达也明显降低。这表明EGCG对新西兰兔放射性食管炎损伤有一定的治疗作用。其作用机制可能是通过与67LR的结合,负性调节放射性食管炎症通路,抑制炎症因子的产生,阻断放射导致的炎症级联反应。从炎症因子的变化来看,EGCG给药当天的检测结果表明,相对于生理盐水组,EGCG组炎症因子相对降低,且随着时间的延长,炎症因子差异性显著增加,这提示EGCG的起效迅速,且持续应用减轻炎症的功效愈加明显。在前期开展EGCG治疗放射性损伤的临床研究中,该结果也得到佐证[11-12]。目前的研究多关注EGCG抗氧化作用,其降低放疗产生的大量活性氧[13-15],从而减轻细胞损伤,但具体机制尚不清楚。不同于以往研究,本研究从EGCG作用的靶点出发,初步发现了照射后新西兰兔正常食管组织损伤时也同样高表达67LR,而EGCG可能是其发挥抗放射性损伤的一个作用靶点。另外,发现了EGCG对TGF-β表达的抑制,此标志物是食管发生纤维化的预测因子,提示EGCG也可能被用于防治放射导致的食管纤维化,延缓病情发展,需进一步研究证实。另外,与既往研究不同的是,既往研究EGCG放射防护作用的给药方式往往是腹腔注射,但在临床应用时,此给药方法实施困难,本研究尝试了局部给药的方法,增加其临床应用的可行性。
综上所述,EGCG可以有效减轻食管病理放射性损伤,降低炎性因子水平,可能与EGCG与67LR作用有关。本研究旨在为临床应用EGCG防治放射性食管损伤提供理论基础,同时初步探索其治疗的机制。不足之处是缺乏EGCG对67LR下游通路的验证,对放射损伤的观测时间较短,对晚期损伤没有进行评估,这些将在下一步研究中进行。
利益冲突 所有研究者未接受其他机构提供的不当利益,在此对研究的独立性和科学性予以保证
作者贡献声明 朱婉琦分析数据撰写论文;贾丽负责论文修改;陈冠璇、李晓琳协助部分实验的完成;邢力刚协助部分实验的完成、论文修改;赵汉玺设计研究方案、开展实验;于金明设计研究方案,指导实验
| [1] |
Ma L, Qiu B, Li Q, et al. An esophagus-sparing technique to limit radiation esophagitis in locally advanced non-small cell lung cancer treated by simultaneous integrated boost intensity-modulated radiotherapy and concurrent chemotherapy[J]. Radiat Oncol, 2018, 13(1): 130. DOI:10.1186/s13014-018-1073-3 |
| [2] |
牛雪娜, 赵汉玺, 朱婉琦, 等. 表没食子儿茶酸没食子酸酯用于放射损伤防治的研究进展[J]. 中华放射医学与防护杂志, 2018, 38(1): 69-72. Niu XN, Zhao HX, Zhu WQ, et al. Research progresses of green tea extract epigallocatechin-3-gallate on preventing and treating radiation injury[J]. Chin J Radiol Med Prot, 2018, 38(1): 69-72. DOI:10.3760/cma.j.issn.0254-5098.2018.01.015 |
| [3] |
王丽娟, 路军章, 李明伟, 等. 复方竹叶石膏颗粒对家兔急性放射性食管炎COX-2与MMP-2 mRNA及蛋白表达的影响[J]. 解放军医药杂志, 2017, 29(5): 5-8. Wang LJ, Lu JZ, Li MW, et al. Effects of compound Zhuye Shigao granule on mRNA and protein expressions of COX-2 and MMP-2 in treatment of rabbits with radiation esophagitis[J]. Med Pharm J Chin PLA, 2017, 29(5): 5-8. DOI:10.3969/j.issn.2095.140X.2017.05.002 |
| [4] |
汪治宇, 郭盛虎, 李幸, 等. 芍药总苷对6 MV-X射线放射性食管炎模型大鼠的作用研究[J]. 中国临床药理学杂志, 2018, 34(7): 827-830. Wang ZY, Guo SH, Li X, et al. Effect of total glucosides of peony on esophagitis model of rats by 6 MV-X ray radiation[J]. Chin J Clin Pharmacol, 2018, 34(7): 827-830. DOI:10.13699/j.cnki.1001-6821.2018.07.028 |
| [5] |
Kim KS, Jeon SU, Lee CJ, et al. Radiation-induced esophagitis in vivo and in vitro reveals that epidermal growth factor is a potential candidate for therapeutic intervention strategy[J]. Int J Radiat Oncol Biol Phys, 2016, 95(3): 1032-1041. DOI:10.1016/j.ijrobp.2016.02.051 |
| [6] |
Giuliani ME, Lindsay PE, Kwan JY, et al. Correlation of dosimetric and clinical factors with the development of esophagitis and radiation pneumonitis in patients with limited-stage small-cell lung carcinoma[J]. Clin Lung Cancer, 2015, 16(3): 216-220. DOI:10.1016/j.cllc.2014.11.008 |
| [7] |
田丹丹, 王玉祥, 邱嵘, 等. 局部晚期非小细胞肺癌三维适形放疗所致放射性食管炎的相关因素[J]. 中华放射医学与防护杂志, 2014, 34(9): 678-682. Tian DD, Wang YX, Qiu R, et al. Radiation-induced esophagitis in local advanced non-small cell lung cancer after three-dimensional conformal radiotherapy[J]. Chin J Radiol Med Prot, 2014, 34(9): 678-682. DOI:10.3760/cma.j.issn.0254-5098.2014.09.009 |
| [8] |
王岳飞, 唐德松, 朴宰日, 等. 茶多酚对荷瘤小鼠辐射损伤的影响[J]. 中华放射医学与防护杂志, 2004, 24(3): 263-264. Wang YF, Tang DS, Piao ZR, et al. The effects of tea polyphenol on radiation injury in the mice with tumors[J]. Chin J Radiol Med Prot, 2004, 24(3): 263-264. DOI:10.3760/cma.j.issn.0254-5098.2004.03.028 |
| [9] |
Mitrica R, Dumitru I, Ruta LL, et al. The dual action of epigallocatechin gallate (EGCG), the main constituent of green tea, against the deleterious effects of visible light and singlet oxygen-generating conditions as seen in yeast cells[J]. Molecules, 2012, 17(9): 10355-10369. DOI:10.3390/molecules170910355 |
| [10] |
Byun EB, Mi-SoYang, Kim JH, et al. Epigallocatechin-3-gallate-mediated Tollip induction through the 67-kDa laminin receptor negatively regulating TLR4 signaling in endothelial cells[J]. Immunobiology, 2014, 219(11): 866-872. DOI:10.1016/j.imbio.2014.07.010 |
| [11] |
Zhao H, Zhu W, Xie P, et al. A phase I study of concurrent chemotherapy and thoracic radiotherapy with oral epigallocatechin-3-gallate protection in patients with locally advanced stage Ⅲ non-small-cell lung cancer[J]. Radiother Oncol, 2014, 110(1): 132-136. DOI:10.1016/j.radonc.2013.10.014 |
| [12] |
Zhao H, Xie P, Li X, et al. A prospective phase Ⅱ trial of EGCG in treatment of acute radiation-induced esophagitis for stage Ⅲ lung cancer[J]. Radiother Oncol, 2015, 114(3): 351-356. DOI:10.1016/j.radonc.2015.02.014 |
| [13] |
You H, Wei L, Sun WL, et al. The green tea extract epigallocatechin-3-gallate inhibits irradiation-induced pulmonary fibrosis in adult rats[J]. Int J Mol Med, 2014, 34(1): 92-102. DOI:10.3892/ijmm.2014.1745 |
| [14] |
Tiwari M, Dixit B, Parvez S, et al. EGCG, a tea polyphenol, as a potential mitigator of hematopoietic radiation injury in mice[J]. Biomed Pharmacother, 2017, 88: 203-209. DOI:10.1016/j.biopha.2016.12.129 |
| [15] |
Lee HJ, Kim JS, Moon C, et al. Modification of gamma-radiation response in mice by green tea polyphenols[J]. Phytother Res, 2008, 22(10): 1380-1383. DOI:10.1002/ptr.2507 |
 2019, Vol. 39
2019, Vol. 39


