胸段食管癌治疗的首选策略是以手术为主的综合治疗[1]。约有60%的患者初诊时即为晚期,失去手术机会[2]。局部晚期食管癌患者同步放化疗的生存率与手术治疗相近[3]。目前,同步放化疗已被美国国立综合癌症网络(NCCN)指南及日本食管癌治疗指南认定为局部晚期食管癌患者的标准治疗手段。评价食管癌的放化疗疗效具有重要临床意义。Ou等[4]报道,局部晚期食管癌新辅助放疗后病理缓解与患者的总生存期(OS)有关,即病理完全缓解的患者生存率最高。文献报道,病理中血管内皮生长因子(vascular endothelial growth factor, VEGF)表达是食管癌的独立预后因素[5]。本课题组前期研究也显示,血清中VEGF水平动态变化与食管癌非手术治疗预后密切相关[2]。本研究对接受放疗或同步放化疗的初治食管癌患者治疗过程中肿瘤组织病理缓解程度及血清VEGF动态变化进行分析,研究其与患者预后的关系。
资料与方法1.临床资料:收集2008年1月至2014年12月于常州市第二人民医院放疗科接受放疗或同步放化疗的食管癌患者89例,其中,男性62例,女性27例,其他资料见表 1。纳入标准:ECOG评分为0~1分; 初治患者; 年龄≤80岁; 拒绝手术治疗或有手术禁忌无法进行手术者。排除食管穿孔; 无合并严重的肝、肾、心肺严重疾病; 预期生存期大于3个月。怀孕、哺乳、合并有其他肿瘤或随访数据不足的患者被排除在外。本研究获得常州市第二人民医院伦理委员会批准(审批号:2008科研006-01)。
|
|
表 1 89例食管癌患者一般资料 Table 1 Characteristics of 89 esophageal carcinoma patients |
2.治疗方案
(1) 放疗:所有患者均采取三维技术放疗,其中三维适形放疗(3D-CRT)26例,调强放疗(IMRT)63例。三维计划系统(ADAC-Pinnacle 9.3)制定放疗计划,均采用德国西门子公司Primus plus H型直线加速器6 MV X射线放疗。GTV为CT或食管钡透中所见的原发肿瘤(GTVt)及转移淋巴结(GTVn),其中,转移淋巴结的评判标准为胸腔或腹腔中短径>1 cm或喉返神经旁短径>0.5 cm的淋巴结。CTV为GTVt基础上侧向外扩0.5 cm、长轴方向外扩3~5 cm和需要预防照射的淋巴结引流区。PTV为CTV基础上外扩0.5 cm。计划大体肿瘤区(PGTV)为GTVt基础上侧向外扩0.5~1 cm、长轴方向外扩3 cm以及在GTVn基础上外扩0.5~1 cm。PGTV剂量:60~66 Gy/30~33次/6~6.6周,PTV剂量:50 Gy/25次,共5周;均为2 Gy/次,1次/d,5 d/周,常规分割。
(2) 化疗:紫杉醇脂质体135 mg/m2 d1、顺铂20 mg/m2 d2~d5。同步化疗者年龄不超过75岁,共65例患者接受2程同步化疗和2程巩固性化疗。
3.病理学检查:放疗第4周行胃镜下肿瘤组织病理活检,根据Tahara等[7]报道的病理学诊断标准,将放射治疗后病理缓解分为完全缓解(CR)组及非CR组,CR标准为肿瘤完全消失;溃疡坏死组织完全消失;活检未发现肿瘤。
4.血清VEGF测定:分别于放疗前、放疗第4周以及放疗后1周内采集患者外周血,采用双抗体夹心亲和素-生物素酶联免疫吸附法检测血清中VEGF水平。另检测30名健康者血清VEGF作为对照。
5.随访:治疗结束2年内每3个月随访1次,2年后每6个月随访1次。研究终点为总生存(OS)、无进展生存(PFS)。随访至2017年12月31日。
6.统计学处理:采用SPSS 21.0软件进行数据分析。计量资料均数用x±s表示,多组间计量资料经方差齐性检验,均数的比较采用方差分析,多组间计数资料比较和分类资料的关联性分析采用χ2检验或Fisher精确概率法,生存分析采用Kaplan-Meier法和Logrank检验,多因素分析采用Cox比例风险模型。P < 0.05为差异有统计学意义。
结果1.疗效:随访截止时间为2017年12月31日,随访时间3~116月,67例在随访期间发生死亡,其中,8例患者死因与肿瘤复发、转移或治疗并发症无关。全组患者1年、3年和5年生存率分别为70.8%、34.8%和26.5%,中位生存期21个月(95%CI 15.3~21.7个月);1年、3年和5年无进展生存率分别为61.4%、30.7%和25.7%,中位无进展生存期15.5个月(95%CI 11.1~20.0个月)。
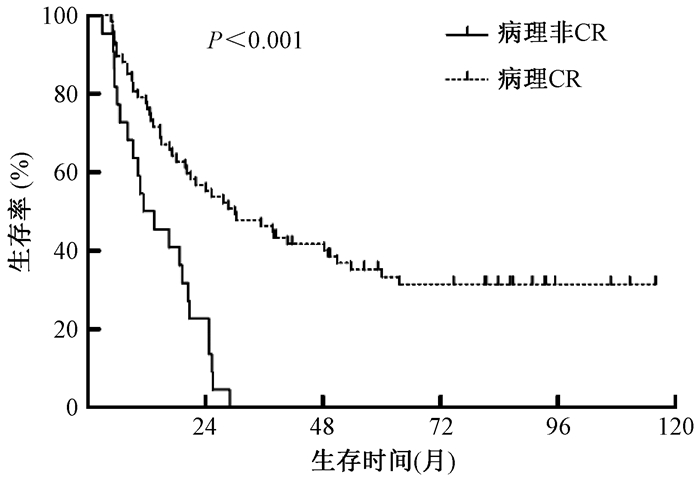
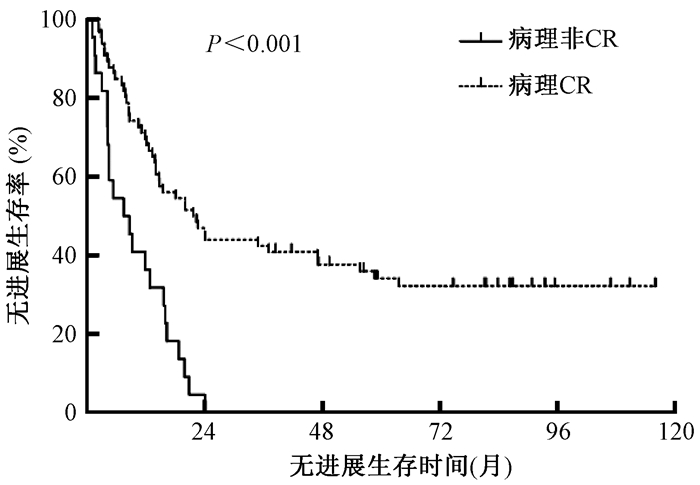
2.肿瘤组织病理缓解程度与预后的关系:肿瘤组织病理完全缓解(CR)67例、未完全缓解(非CR)22例。CR组1年、3年和5年OS率分别为77.6%、46.3%和35.2%,中位OS为30.0个月(95%CI 14.3~45.6个月);非CR组1年、3年和5年OS率分别50%、0和0,中位OS为11.4个月(95%CI 4.2~18.6个月),CR组OS显著好于非CR组(P<0.001),见图 1。CR组1年、3年和5年PFS率分别为69.7%、40.9%和34.3%,中位PFS为21.7月(95%CI 13.1~30.3个月);非CR组1年、3年和5年PFS率分别为36.4%、0和0,中位PFS为7.4月(95%CI 2.1~12.4个月)。CR组PFS明显好于非CR组(P<0.001),见图 2。
|
图 1 89例食管癌患者不同病理缓解程度的生存曲线比较 注:CR.完全缓解 Figure 1 Comparison of OS curve among 89 esophageal carcinoma patients with different pathological responses |
|
图 2 89例食管癌患者不同病理缓解程度的无进展生存曲线比较 注:CR.完全缓解 Figure 2 Comparison of PFS curve among 89 esophageal carcinoma patients with different pathological responses |
3.血清VEGF动态变化与预后的关系:血清VEGF检测标准差为8.1 ng/L,以放疗前VEGF血清水平为基线、以2倍标准差为判断标准,根据放疗中或放疗后样本中VEGF水平的变化情况,将患者分为VEGF增高组、稳定组和降低组。本研究VEGF增高组、稳定组和降低组分别为16例、43例和30例。增高组1年、3年和5年OS率分别为50%、18.8%和12.5%,中位OS为9.2个月(95%CI 2.2~17.9个月);稳定组1年、3年和5年OS率分别为67.4%、30.2%和19.9%,中位OS为19.9个月(95%CI 14.9~24.9个月);降低组1年、3年和5年OS率分别为86.7%、50%和42.9%,中位OS为28.7个月(95%CI 5.4~51.2个月),血清VEGF降低组OS显著好于增高组(P < 0.05),见图 3。

|
图 3 89例食管癌患者不同VEGF变化的生存曲线比较 注:VEGF.血管内皮生长因子 Figure 3 Comparison of OS curve among 89 esophageal carcinoma patients with different VEGF changes |
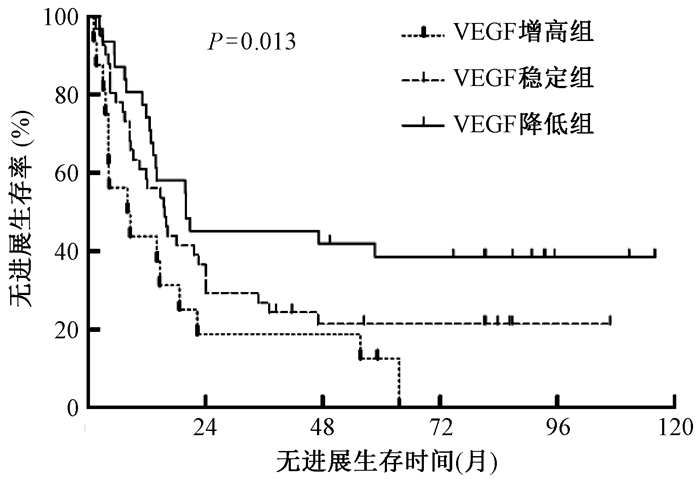
增高组1年、3年和5年PFS率分别为43.8%、12.5%和0%,中位PFS为8.0个月(95%CI 2.5~15.9个月);稳定组1年、3年和5年PFS率分别为57.1%、26.2%和20.8%,中位PFS为15.5个月(95%CI 10.7~20.4个月);降低组1年、3年和5年PFS率分别为76.7%、46.7%和39.7%,中位PFS为20.1个月(95%CI 2.4~40.1个月);血清VEGF降低组PFS显著好于增高组(P=0.013),见图 4。
|
图 4 89例食管癌患者不同VEGF变化的无进展生存曲线比较 注:VEGF.血管内皮生长因子 Figure 4 Comparison of PFS curve among 89 esophageal carcinoma patients with different VEGF changes |
4.预后因素分析:单因素分析显示,患者的年龄、性别、病理类型、肿瘤部位和治疗方法(放疗或同步放化疗)对患者的OS及PFS无影响(P>0.05),患者的T分期、N分期、TNM分期、病理缓解程度及放疗中血清VEGF动态变化趋势与患者的OS及PFS有关(χ2=4.805~33.630, P < 0.05),见表 2、3。Cox多因素分析显示,在调整了年龄、性别、肿瘤部位和是否化疗等因素后,TNM分期、病理缓解程度(RR=0.463, 95%CI=0.224~0.958, P < 0.05;RR=0.463, 95%CI=0.224~0.958, P < 0.05)及放疗中血清VEGF动态变化趋势(RR=2.722, 95%CI=1.293~5.731, P < 0.05;RR=2.408, 95%CI=1.129~5.137, P < 0.05)是影响OS和PFS的独立危险因素,见表 4。
|
|
表 2 89例食管癌患者生存率Logrank法单因素预后分析 Table 2 Univariate analysis of OS in 89 esophageal cancer patients using Logrank estimates |
|
|
表 3 89例食管癌患者无进展生存率Logrank法单因素预后分析 Table 3 Univariate analysis of PFS in 89 esophageal cancer patients using Logrank estimates |
|
|
表 4 89例食管癌患者总生存率和无进展生存率Cox法多因素预后分析 Table 4 Multivariate analysis of OS and PFS in 89 esophageal cancer patients using Cox estimates |
讨论
在食管癌的治疗中放疗或同步放化疗已成为主要治疗手段[9],因此,对非手术食管癌患者同步放化疗的疗效评价具有重要的临床意义。
大量研究发现,新辅助治疗加手术可以延长局部晚期患者的OS[4, 10-11]。Ou等[4]将新辅助放疗后肿瘤组织对放疗的反应情况分为轻、中、重度,结果显示轻、中和重度5年OS率分别为21.1%、46.4%和60.7%,病理完全缓解的患者生存率最高。Tahara等[7]选择在放疗结束后1月行胃镜下活检,根据病理缓解情况分为CR组和非CR组,两组的3年、5年生存率分别为55%、46%和11%、6%,CR组明显高于非CR组。本研究前期报道[12]参照Ou等[4]报道将放疗中肿瘤组织病理反应分为轻、中、重度,结果显示,轻度反应组患者1年、3年生存率低于中、重度反应组,而中重度反应组之间生存率相似。因此,研究结果显示,CR组OS和PFS均显著好于非CR组(P<0.001)。本研究采取放疗第4周行胃镜病理活检分析病理缓解与预后的关系,下一步拟对病理非CR患者进行进一步研究,如这部分患者放疗后加1~2次后装观察能否改善预后。
VEGF是一种主要由血管内皮细胞分泌的促细胞分裂因子,除能够特异性的促进血管内皮细胞的分裂外,还可以增强毛细血管通透性。此外,VEGF作为一种重要的促进血管生成因子,能够促进血管生成、增加微血管密度[13]。正常组织中VEGF含量较低,肿瘤组织中VEGF明显高于正常组织,肿瘤细胞及肿瘤内血管内皮细胞均可分泌VEGF以促进肿瘤内血管生长并供应肿瘤生长所需的营养成分[14]。VEGF的表达程度被认为与食管癌患者的肿瘤血管生成、淋巴结转移有关,是食管癌的是独立预后因素[5]。对于血清VEGF水平与食管癌预后的关系,文献报道不一。本文主要研究食管癌放疗过程中血清VEGF动态变化与预后的关系,结果显示,随着放疗进行,血清VEGF降低的患者1年、3年、5年OS率和PFS率均高于血清VEGF增高者。
本研究也有一定局限性,主要是胃镜病理活检只能取到食管癌的局部组织,其结果不能反应整个食管癌组织对射线的反应程度。
总之,放疗中癌组织病理缓解情况和血清VEGF变化趋势与食管癌预后密切相关,是预测患者放射敏感性和判断预后的重要指标,对及时调整食管癌患者的治疗计划、指导不同患者个体化治疗具有重要意义。
利益冲突 本研究接受常州市卫生计生委重大科技项目(ZD201710)、南京医科大学科技发展基金面上项目(2015NJMU172)、常州市应用基础研究指导性项目(2017301)的资助。作者与作者家属未因进行该研究而接受任何不正当的职务或财务利益、在此对研究的独立性和科学性予以保证作者贡献声明 孙威负责数据整理分析和论文撰写;孙志强、汪建林、于静萍、倪新初、聂斌、李毅负责病例入组、治疗和随访;孙苏平提供研究思路和研究方案;王坚负责审校
| [1] |
Vellayappan BA, Soon YY, Ku GY, et al. Chemoradiotherapy versus chemoradiotherapy plus surgery for esophageal cancer[J]. Cochrane Database Syst Rev, 2017, 8: CD010511. DOI:10.1002/14651858.CD010511.pub2 |
| [2] |
于静萍, 孙志强, 倪新初, 等. 食管癌患者放疗前后血清血管内皮生长因子变化的临床意义[J]. 中华放射医学与防护杂志, 2011, 31(6): 671-674. Yu JP, Sun ZQ, Ni XC, et al. Clinical significance of changes of serum vascular endothelial growth factor level before and after radiotherapy in patients with esophageal carcinoma[J]. Chin J Radiol Med Prot, 2011, 31(6): 671-674. DOI:10.3760/cma.j.issn.0254-5098.2011.06.013 |
| [3] |
Crehange G, Maingon P, Peignaux K, et al. Phase Ⅲ trial of protracted compared with split-course chemoradiation for esophageal carcinoma:Federation Francophone de Cancerologie Digestive 9102[J]. J Clin Oncol, 2007, 25(31): 4895-4901. DOI:10.1200/JCO.2007.12.3471 |
| [4] |
欧广飞, 汪楣, 王绿化, 等. 食管癌术前放疗后病理反应与预后的关系[J]. 中华肿瘤杂志, 2003, 25(3): 278-281. Ou GF, Wang M, Wang LH, et al. Relation between pathologic tumor response to preoperative radiotherapy and the prognosis in patients with esophageal carcinoma[J]. Clin J Oncol, 2003, 25(3): 278-281. DOI:10.3760/j.issn.0253-3766.2003.03.021 |
| [5] |
Cellini F, Valentini V. Targeted therapies in combination with radiotherapy in oesophageal and gastroesophageal carcinoma[J]. Curr Med Chem, 2014, 21(8): 990-1004. DOI:10.2174/09298673113209990236 |
| [6] |
中国非手术治疗食管癌临床分期专家小组. 非手术治疗食管癌的临床分期标准(草案)[J]. 中华放射肿瘤学杂志, 2010, 19(3): 179-180. Expert Group for the Non-surgical Treatment of the Esophageal Cancer Staging. Non-surgical treatment of esophageal cancer clinical staging standard(draft)[J]. Chin J Radiat Oncol, 2010, 19(3): 179-180. DOI:10.3760/cma.j.issn.1004-4221.2010.03.001 |
| [7] |
Tahara M, Ohtsu A, Hironaka S, et al. Clinical impact of criteria for complete response (CR) of primary site to treatment of esophageal cancer[J]. Jpn J Clin Oncol, 2005, 35(6): 316-323. DOI:10.1093/jjco/hyi095 |
| [8] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [9] |
Xi M, Xu C, Liao Z, et al. The impact of histology on recurrence patterns in esophageal cancer treated with definitive chemoradiotherapy[J]. Radiother Oncol, 2017, 124(2): 318-324. DOI:10.1016/j.radonc.2017.06.019 |
| [10] |
Cheng JC, Graber MS, Hsu FM, et al. High serum levels of vascular endothelial growth factor-A and transforming growth factor-beta1 before neoadjuvant chemoradiotherapy predict poor outcomes in patients with esophageal squamous cell carcinoma receiving combined modality therapy[J]. Ann Surg Oncol, 2014, 21(7): 2361-2368. DOI:10.1245/s10434-014-3611-z |
| [11] |
Kurokawa Y, Shibata T, Ando N, et al. Which is the optimal response criteria for evaluating preoperative treatment in esophageal cancer:RECIST or histology?[J]. Ann Surg Oncol, 2013, 20(9): 3009-3014. DOI:10.1245/s10434-013-2946-1 |
| [12] |
王坚, 于静萍, 汪建林, 等. 非手术食管癌患者放化疗中肿瘤组织病理反应和血清血管内皮生长因子的变化及其对预后的影响[J]. 中华肿瘤杂志, 2016, 38(8): 589-595. Wang J, Yu JP, Wang JL, et al. Pathologic response and changes of serum VEGF during chemoradiotherapy may predict prognosis in non-surgical patients with esophageal carcinoma[J]. Chin J Oncol, 2016, 38(8): 589-595. DOI:10.3760/cma.j.issn.0253-3766.2016.08.005 |
| [13] |
Yoon MS, Nam TK, Lee JS, et al. VEGF as a predictor for response to definitive chemoradiotherapy and COX-2 as a prognosticator for survival in esophageal squamous cell carcinoma[J]. J Korean Med Sci, 2011, 26(4): 513-520. DOI:10.3346/jkms.2011.26.4.513 |
| [14] |
鲁建军, 马俊, 缪蓉, 等. 血管内皮生长因子D在食管鳞癌组织中的表达及其临床意义[J]. 中华胃肠外科杂志, 2013, 16(12): 1191-1194. Lu JJ, Ma J, Miao R, et al. Expression of vascular endothelial growth factor D in human esophageal squamous cell carcinoma tissue and its significance[J]. Chin J Gastrointest Surg, 2013, 16(12): 1191-1194. DOI:10.3760/cma.j.issn.1671-0274.2013.12.017 |
 2018, Vol. 38
2018, Vol. 38


