2. 100850 北京, 军事医学研究院辐射医学研究所 北京市放射生物学重点实验室
2. Beijing Key Laboratory for Radiobiology, Institute of Radiation Medicine, AMMS, Beijing 100850, China
外泌体作为细胞间信号传递的载体,在促进癌细胞增殖、肿瘤生长、侵袭等中发挥重要作用[1-5],而发挥这些功能的物质基础主要是外泌体中所包含的非编码RNA、蛋白等。miRNA是17~21个核苷酸长度小分子非编码RNA,其与靶基因的3′端非翻译区靶序列结合,直接降解靶mRNA或抑制靶mRNA的翻译,从而影响细胞的功能[6-7]。近年来,系列研究报道显示,miRNA分子对受照射细胞的DNA损伤修复、周期改变、凋亡、上皮间质转化等细胞放射损伤反应有重要调控作用[6, 8-11]。miRNA分子除直接对受照射细胞产生影响外,还可能会被包裹进外泌体中,随外泌体排泌到培养液中或整体水平的组织液、血液循环中,再进入其他细胞引发生物学效应,由此可能参与介导放射旁效应的发生。因此,有关辐射诱导的外泌体miRNAs的识别鉴定及功能的研究,将有助于揭示放射旁效应发生机制,以及进一步了解放射治疗中正常组织损伤机制,对辐射危害评估也具有一定的意义。
材料与方法1.细胞培养、照射及样品收集:正常的人支气管上皮细胞BEP2D由本实验室保存,培养在无血清LHC-8培养基(美国GIBCO公司)中,培养条件为饱和湿度、37℃、5%CO2的培养箱中。待细胞生长到80%接触密度,设立未照射组和照射组,室温下给予2 Gy 60Co γ射线照射,照射前30 min换新鲜培养基。照射后放于培养箱继续培养,4 h后收集细胞培养液保存于4℃冰箱。同时,收集细胞,细胞用预冷的1×磷酸盐缓冲液(PBS)洗2遍,加TRIzol(美国Sigma-Aldrich公司)裂解,置于-80℃冰箱保存。
2.外泌体的收集与鉴定:收集的细胞培养液用0.22 μm的过滤器过滤,在300×g、4℃下离心10 min,保留上清;随后,2 000×g、4℃下离心10 min,保留上清液;在10 000×g、4℃下离心30 min,保留上清液;最后采用低温超速离心机(美国Beckman公司)在100 000×g、4℃下离心70 min,弃上清,用1×PBS垂悬沉淀物,即为外泌体。吸取10~20 μl外泌体液滴于铜网上,1 min后吸去多余液体,滴加10~20 μl的3%磷钨酸染1 min,吸走多余的液体,把铜网放于白炽灯下干燥8~10 min,在透视电镜(日本日立公司,H-7650)下观察外泌体。
3.总RNA提取:细胞或者收集的外泌体加TRIzol裂解(美国Sigma-Aldrich公司),加入适量氯仿,剧烈摇晃15 s,静置2~3 min后,4℃,9 660×g,离心15 min;吸取上层到新的EP管中,加入异丙醇,4℃,9 660×g,离心10 min,留白色RNA沉淀,加入适量的75%乙醇,4 300×g,离心5 min;留下底部沉淀,风干20 min左右,加入20~30 μl的焦碳酸二乙酯(DEPC)水,在37℃条件下孵育15 min,用NanoDrop2000/2000c软件测试RNA浓度,进行下一步实验,或放于-80℃冰箱保存备用。
4. miRNAs芯片分析:采用LC Sciences microRNA Microarray-Single(miRbase 21.0)表达谱芯片(北京联川生物公司)进行芯片分析。miRNA芯片具体实验过程:样品总RNA通过质检后,即进入芯片分析阶段依次进行polyA加尾、样品标记、芯片杂交、杂交信号放大、扫描图像等过程。再对芯片扫描图像进行数字信号提取,分析。数据分析先减去背景值,再使用局部加权回归过滤进行信号归一化。变化倍数大于1.5倍认为是差异表达基因。
5.实时定量RT-PCR:实时定量PCR的主要试剂为铂系SYBR Green qPCR SuperMix-UDG(美国Invitrogen公司, 11733-038), dNTP(日本TaKaRa公司, D4030RA), RNase Inhibitor (日本TaKaRa公司, D2 313 A),M-MLV(日本TaKaRa公司, D2 639 A)。PCR仪器为ABI PRISM 7900HT型荧光定量PCR仪。将提取的RNA,采用Invitrogen GoldScript试剂盒(美国Invitrogen公司,c81401190)反转录合成cDNA模板。20 μl定量PCR反应体系,包含荧光定量探针反应预混液、探针和扩增引物预混液、cDNA模板等。每个样品的每一种miRNA样本做3组平行试验。PCR反应条件是50℃ 2 min,95℃ 2 min,95℃ 15 s,60℃ 60 s,后面两步39个循环以上。实时定量PCR反应完成后,保存实验数据进行分析,根据以前报道的基因表达定量计算方法[12],以2-ΔΔCt法计算出目的miRNA表达水平的相对变化。所检测的miRNA序列及PCR引物如表 1, 2所示。
|
|
表 1 miRNA分子cDNA合成的反转录引物 Table 1 The reverse transcription primers for cDNA synthesis of the indicated miRNAs |
|
|
表 2 miRNA分子实时定量PCR引物 Table 2 The primers for the quantitative real-time PCR analysis of the indicated miRNAs |
6.靶基因功能的生物信息学分析:采用基因本体论(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析外泌体中差异表达(P < 0.05)miRNA分子的靶基因的生物学功能。本研究中GO分析所给出结果是靶基因功能的生物过程(biological processes)通路的归类,KEGG分析给出的是靶基因功能的信号通路归类。
7.统计学处理:采用SPSS 17.0软件进行统计分析,实验均重复3次,数据以x±s表示。在数据正态分布和方差齐性的条件下,多组之间的数据比较使用方差分析,各组间的差异比较使用t检验,方差不齐采用秩和检验。P < 0.05为差异具有统计学意义。
结果1.外泌体的鉴定:外泌体是直径约30~150 nm的一种微粒小囊泡,呈典型的“杯状”或者“碟状”膜结构。2 Gy γ射线照射后4 h收集的培养液,经超速离心后获得的外泌体在透射电镜下观察到的形态结构,有的呈现典型的“碟状”结构。
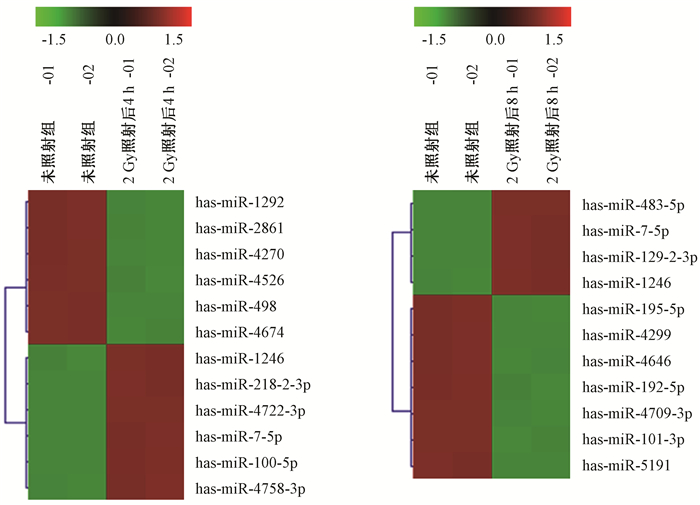
2.外泌体中miRNA表达谱的变化:通过芯片筛查由辐射诱导表达的外泌体中miRNA,发现细胞受照射后的外泌体中miRNA表达有升高的,也有降低的,图 1所示外泌体中miRNA表达谱聚类分析的一部分miRNA分子变化结果,其中miRNA-7-5p和miRNA-1246在照射后4和8 h的外泌体中的表达均增加。表 3列出了照射后4 h表达水平增加1.5倍以上、差异具有统计学意义(P < 0.05)的16个外泌体miRNA分子,且受照细胞外泌体的检测信号值大于500。
|
图 1 芯片分析外泌体miRNAs的表达变化(部分) Figure 1 Changes miRNA expressions in the exosomes identified by microarray analysis |
|
|
表 3 芯片分析鉴定的BEP2D细胞2 Gy照射后4 h外泌体中表达增加的miRNA分子 Table 3 Upregulated miRNAs in the exosomes released from BEP2D cells at 4 h post-2 Gy irradiation identified by microarray analysis |
3.表达上调miRNAs的qRT-PCR验证:选择照射细胞外泌体中4个表达上调的miRNA分子(miR-100-5p、miR-1246、miR-29b-3p、miR-7-5p)进行qRT-PCR验证。2 Gy γ射线照射BEP2D细胞后4 h,收集细胞分泌到培养液中的外泌体,同时收集未照射细胞的外泌体,提取外泌体RNA,qRT-PCR验证。结果显示,这4个miRNA分子的表达均上调(表 4)。
|
|
表 4 qRT-PCR验证细胞受2 Gy照射后4 h的外泌体中表达上调miRNA分子 Table 4 qRT-PCR confirmation of the increased expression of miRNAs in the exosomes released from BEP2D cells at 4h post-2 Gy irradiation |
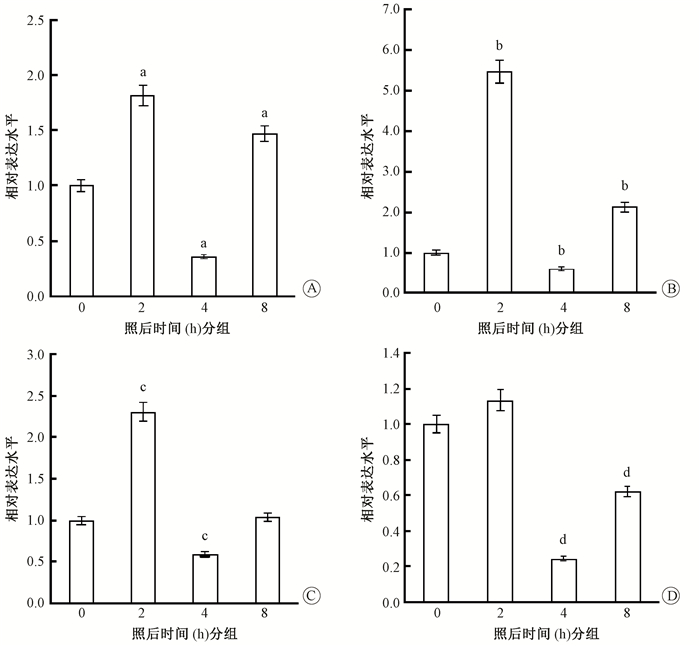
4. BEP2D细胞内相应miRNA分子的表达变化:在确认外泌体中上述4个miRNA分子的放射诱导表达增加后,继续检测了细胞内这些miRNA分子在相应时间段的表达变化,结果见图 2。照射后2 h,其中3种miRNA(miR-100-5p、miR-1246、miR-29b-3p)在细胞内的表达水平显著上调;而照射后4 h,细胞内的这4种miRNA的表达水平全部降低,与外泌体中的变化趋势恰恰相反。照射后8 h,表达水平又逐渐恢复或升高。提示射线照射先诱导细胞内miRNA的产生,再通过外泌体释放到细胞外,从而导致细胞内相应miRNA含量水平降低。
|
图 2 qRT-PCR检测2 Gy照射后细胞内miRNA分子的表达变化 A. miR-1246;B. miR-100-5p;C. miR-29b-3p; D. miR-7-5p 注:与照后0 h比较,at=10.6、17.1、7.2,P < 0.01;bt=13.30、2.27、1.89,P < 0.05;ct=20.70、6.76,P < 0.05;dt=6.74、2.94,P < 0.05 Figure 2 qRT-PCR detection of the expressions of cellular miRNAs in BEP2D cells at given times post-2 Gy irradiation. A. miR-1246;B. miR-100-5p;C. miR-29b-3p;D. miR-7-5p |
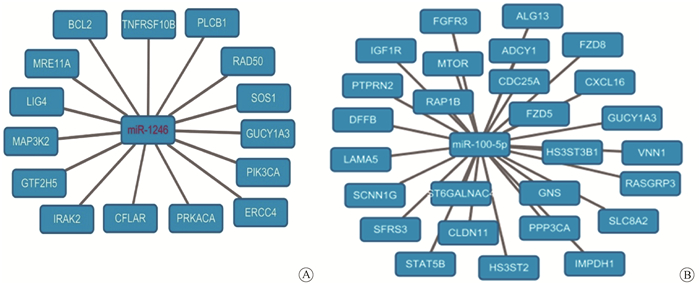
5. miRNAs的预测靶基因的生物学功能和通路的分析:通过Targetscan和miranda在线对显著性差异表达的miRNA进行靶基因的预测,图 3显示了miRNA-1246和miRNA-100-5p的部分靶基因。miRNA-1246的靶基因中就包含了一组DNA修复基因,如MRE11 A、LIG4、ERCC4、RAD50等。
|
图 3 miR-1246 (A)和miR-100-5p (B)的预测靶基因(部分) Figure 3 Predicted targeting genes of miR-1246 (A) and miR-100-5p (B) |
表 5和表 6分别给出了差异miRNA分子靶基因的GO生物过程通路和KEGG功能通路的生物信息学分析结果。GO生物过程通路按照统计学显著性排前5位的依次是:磷脂酰肌醇磷酸化、γ-氨基丁酸信号通路、染色质修饰和DNA修复通路、正调控脂肪酸β氧化通路、蛋白磷酸化,聚集靶基因最多的是细胞粘附和蛋白磷酸化过程(表 5)。按照统计学显著性排前5位的KEGG功能通路依次是:聚焦粘附、癌症通路、ErbB信号通路、ECM受体相互作用、内吞作用(表 6)。其他还有mTOR信号通路、MAPK信号通路、p53信号通路、泛素介导的蛋白水解作用通路等。
|
|
表 5 GO分析差异表达miRNA分子的靶基因的生物过程通路 Table 5 GO analysis of the biological processes of the targeting genes of differentially expressed miRNAs |
|
|
表 6 KEGG分析差异表达miRNA分子的靶基因的功能信号通路 Table 6 KEGG analysis of the functional pathways of the targeting genes of differentially expressed miRNAs. |
讨论
传统的辐射健康风险的考虑主要是基于将细胞核作为辐射“靶”的靶效应理论,然而,近年来的研究报道,除了那些直接的DNA损伤引起的效应外,线粒体、高尔基体等细胞器,可能作为细胞核外的辐射靶,而引起辐射的非靶效应,进一步扩大辐射损伤效应[14-15]。此外,直接照射细胞可以影响其周围那些没有受到辐射的细胞,使其也能出现明显的辐射损伤效应,这种现象称为辐射诱导的旁效应,也被称为非靶效应[14, 16]。揭开辐射旁效应之谜,就必须识别鉴定引发旁效应的信号分子或诱导子及其在细胞间的传递方式和载体。
外泌体因其包含有丰富的生物功能调控分子特别是miRNA,以及穿梭于细胞-微环境-细胞之间的信号传递功能,成为辐射旁效应机制研究中关注的新对象[17-20]。miRNA作为基因表达的表观遗传调控分子,近年来对其在受照细胞中的表达改变和辐射响应中的作用有比较多的研究和证实[21-23]。而外泌体作为一个细胞间的信号传递者,可以将包裹的受照细胞的miRNA从一个细胞转移到另一个细胞,所以在辐射诱导的旁效应中可能扮演重要的角色。本实验室前期报道了BEP2D细胞受照后,外泌体中has-miR-7-5p显著增加,并能诱导细胞自噬旁效应[19]。在后续的研究中,进一步在小鼠局部受照的动物整体水平上明确了外泌体miR-7-5p诱导的自噬旁效应[18]。本研究报道了2 Gy 60Co γ射线照射后4 h,人支气管上皮细胞(BEP2D)分泌的外泌体中表达增加差异有统计学意义的全部miRNAs分子,并对其中的miR-100-5p、miR-1246、miR-29b-3p、miR-7-5p放射诱导表达增加,通过qRT-PCR得到进一步验证。
本研究关注的另一个问题是细胞内这些miRNA分子的相应变化情况。结果显示,其中检测验证的3个miRNA分子(miR-100-5p、miR-1246、miR-29b-3p)在照射后2 h均显著增加。但在照射后4 h,所检测的4个miRNA在细胞内的含量无一例外地显著降低,8 h后又开始恢复或再次增加。此结果提示,辐射诱导miRNAs的产生,一定时间后通过外泌体包裹释放到细胞外,降低了受照细胞中这些miRNA含量水平。如果这些miRNA对细胞修复和存活是负面调控作用,这种通过外泌体外排作用有可能是受照细胞对抗放射损伤的一种新的防御机制。而这些外泌体miRNAs可能会被旁细胞吸收,从而参与辐射旁效应的一些进程。
本研究对差异表达显著的外泌体miRNA的靶基因进行了GO和KEGG生物信息学功能分析,得出预测的差异靶基因主要富集在粘附斑、癌症通路、mTOR信号通路、蛋白磷酸化、染色质修饰和DNA修复、MAPK信号通路、p53信号通路、泛素介导的蛋白水解等。
综上所述,本研究报道了2 Gy γ射线照射BEP2D细胞的外泌体差异表达miRNA分子,对表达差异显著miRNA的靶基因的生物学功能进行了预测分析,为进一步研究阐明辐射诱导旁效应的机制提供了有价值的信息。
利益冲突 无作者贡献声明 莫丽君负责实验操作和论文撰写;宋曼参与课题设计和参与外泌分离鉴定工作;刘晓丹参与实验操作;关华参与课题设计和实验指导;周平坤负责提出研究思路、结果分析讨论、指导论文写作和修改论文
| [1] |
Tkach M, Théry C. Communication by extracellular vesicles:where we are and where we need to go[J]. Cell, 2016, 164(6): 1226-1232. DOI:10.1016/j.cell.2016.01.043 |
| [2] |
Kourembanas S. Exosomes:vehicles of intercellular signaling, biomarkers, and vectors of cell therapy[J]. Annu Rev Physiol, 2015, 77: 13-27. DOI:10.1146/annurev-physiol-021014-071641 |
| [3] |
Colombo M, Raposo G, Théry C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles[J]. Annu Rev Cell Dev Biol, 2014, 30: 255-289. DOI:10.1146/annurev-cellbio-101512-122326 |
| [4] |
Kowal J, Tkach M, Théry C. Biogenesis and secretion of exosomes[J]. Curr Opin Cell Biol, 2014, 29: 116-125. DOI:10.1016/j.ceb.2014.05.004 |
| [5] |
Raposo G, Stoorvogel W. Extracellular vesicles:exosomes, microvesicles, and friends[J]. J Cell Biol, 2013, 200(4): 373-383. DOI:10.1083/jcb.201211138 |
| [6] |
Hu B, Wang X, Hu S, et al. miR-21-mediated radioresistance occurs via promoting repair of DNA double strand breaks[J]. J Biol Chem, 2017, 292(8): 3531-3540. DOI:10.1074/jbc.M116.772392 |
| [7] |
Liu ZL, Wang H, Liu J, et al. MicroRNA-21(miR-21) expression promotes growth, metastasis, and chemo-or radioresistance in non-small cell lung cancer cells by targeting PTEN[J]. Mol Cell Biochem, 2013, 372(1-2): 35-45. DOI:10.1007/s11010-012-1443-3 |
| [8] |
Zheng R, Liu Y, Zhang X, et al. miRNA-200c enhances radiosensitivity of esophageal cancer by cell cycle arrest and targeting P21[J]. Biomed Pharmacother, 2017, 90: 517-523. DOI:10.1016/j.biopha.2017.04.006 |
| [9] |
Hou W, Song L, Zhao Y, et al. Inhibition of Beclin-1-mediated autophagy by microrna-17-5p enhanced the radiosensitivity of glioma cells[J]. Oncol Res, 2017, 25(1): 43-53. DOI:10.3727/096504016X14719078133285 |
| [10] |
Zheng L, Chen J, Zhou Z, et al. miR-195 enhances the radiosensitivity of colorectal cancer cells by suppressing CARM1[J]. Onco Targets Ther, 2017, 10: 1027-1038. DOI:10.2147/OTT.S125067 |
| [11] |
Guo Y, Sun W, Gong T, et al. miR-30a radiosensitizes non-small cell lung cancer by targeting ATF1 that is involved in the phosphorylation of ATM[J]. Oncol Rep, 2017, 37(4): 1980-1988. DOI:10.3892/or.2017.5448 |
| [12] |
刘晓丹, 张士猛, 李兵, 等. 60Co γ射线诱导正常人淋巴母细胞PIG3基因mRNA表达的剂量相关性研究[J]. 中华放射医学与防护杂志, 2011, 31(6): 623-626. Liu XD, Zhang SM, Li B, et al. Dose-dependent pattern of inducible mRNA expression of PIG3 gene in normal human lymphoblastoid cells by 60Co γ-rays[J]. Chin J Radiol Med Prot, 2011, 31(6): 623-626. DOI:10.3760/cms.j.issn.0254-5098.2011.06.001 |
| [13] |
Ge Q, Zhou Y, Lu J, et al. miRNA in plasma exosome is stable under different storage conditions[J]. Molecules, 2014, 19: 1568-1575. DOI:10.3390/molecules19021568 |
| [14] |
付佳美, 袁德晓, 邵春林. 线粒体在电离辐射旁效应中的变化和作用[J]. 中华放射医学与防护杂志, 2013, 33(5): 559-562. Fu JM, Yuan DX, Shao CL. Changes and roles of mitochondria in bystander effect of ionizing radiation[J]. Chin J Radiol Med Prot, 2013, 33(5): 559-562. DOI:10.3760/cma,j.issn.0254-5098.2013.05.029 |
| [15] |
闫述东, 关华, 王豫, 等. 放射损伤细胞中高尔基体弥散现象及香兰素衍生物的防护作用[J]. 军事医学, 2016, 40(10): 809-813. Yan SD, Guan H, Wang Y, et al. Golgi dispersal in irradiated cells and the protective effect of vanillin derivatives[J]. Mil Med Sci, 2016, 40(10): 809-813. DOI:10.7644/j.issn.1674-9960.2016.10.008 |
| [16] |
樊婵, 王豫, 刘晓丹, 等. 细胞共培养旁效应实验模型的建立及其在低剂量α粒子诱发旁效应DNA损伤的应用[J]. 中华放射医学与防护杂志, 2013, 33(3): 248-251. Fan C, Wang Y, Liu XD, et al. A cell co-culture model for studying bystander effect and its application on bystander DNA double-strand breaks induced by α-particles irradiation[J]. Chin J Radiol Med Prot, 2013, 33(3): 248-251. DOI:10.3760/cma.j.issn.0254-5098.2013.03.008 |
| [17] |
Jella KK, Rani S, O'Driscoll L, et al. Exosomes are involved in mediating radiation induced bystander signaling in human keratinocyte cells[J]. Radiat Res, 2014, 181(2): 138-145. DOI:10.1667/RR13337.1 |
| [18] |
Cai S, Shi GS, Cheng HY, et al. Exosomal miR-7 mediates bystander autophagy in lung after focal brain irradiation in mice[J]. Int J Biol Sci, 2017, 13(10): 1287-1296. DOI:10.7150/ijbs.18890 |
| [19] |
Song M, Wang Y, Shang ZF, et al. Bystander autophagy mediated by radiation-induced exosomal miR-7-5p in non-targeted human bronchial epithelial cells[J]. Sci Rep, 2016, 6: 30165. DOI:10.1038/srep30165 |
| [20] |
Xu S, Wang J, Ding N, et al. Exosome-mediated microRNA transfer plays a role in radiation-induced bystander effect[J]. RNA Biol, 2015, 12(12): 1355-1363. DOI:10.1080/15476286.2015.1100795 |
| [21] |
Cellini F, Morganti AG, Genovesi D, et al. Role of microRNA in response to ionizing radiations:evidences and potential impact on clinical practice for radiotherapy[J]. Molecules, 2014, 19(4): 5379-5401. DOI:10.3390/molecules19045379 |
| [22] |
Chaudhry MA. Radiation-induced microRNA:discovery, functional analysis, and cancer radiotherapy[J]. J Cell Biochem, 2014, 115(3): 436-449. DOI:10.1002/jcb.24694 |
| [23] |
孙秀锦, 崔凤梅, 黄铖铖, 等. 60Co γ射线照射致小鼠肝脏的miRNAs表达改变[J]. 中华放射医学与防护杂志, 2011, 31(1): 13-16. Sun XJ, Cui FM, Huang CC, et al. Differential expression profiles of microRNAs in liver of 60Co γ-ray irradiated mice[J]. Chin J Radiol Med Prot, 2011, 31(1): 13-16. DOI:10.3760/cma.j.issn.0254-5098.2011.01.004 |
 2018, Vol. 38
2018, Vol. 38


