放疗是中晚期食管癌治疗的主要手段,目前5年生存率仍仅有10%~39%[1]。这与晚期食管癌的放疗抵抗有关。有文献报道,食管癌肿瘤干细胞的存在是晚期食管癌放疗抵抗的原因之一[2]。肿瘤干细胞是肿瘤组织中存在的一种极少数量具有无限增殖能力、分化潜能、自我更新能力以及具有特异表面分子的肿瘤细胞[3]。有学者从神经胶质瘤、乳腺癌、卵巢癌、结肠癌、肺癌、食管癌等中都找到了肿瘤干细胞存在的证据[4-9]。目前临床研究认为,食管癌患者血清血管内皮生长因子(VEGF)的表达与放疗敏感性密切相关[10],采用放疗联合抑制VEGF表达的药物在食管癌临床放射治疗中已有研究报道[11-13]。
甲磺酸阿帕替尼(YN968D1)是我国自主研发的多靶点小分子酪氨酸激酶抑制剂,阿帕替尼可抑制VEGFR-2的活性,阻断其与VEGF结合后的信号转导,抑制其下游相关功能蛋白的表达,具有潜在的放疗增敏作用[14]。本研究旨在探究阿帕替尼对食管癌ECA-109细胞辐射敏感性的影响及相关机制。
材料与方法1.主要试剂与仪器:RPMI 1640培养基、含0.25%EDTA的胰酶、青霉素链霉素双抗(美国GIBCO公司),胎牛血清(杭州四季青产品),表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(美国PeproTech公司),B27(美国Invitrogen公司);阿帕替尼溶剂(美国MEC公司),规格为10 mmol/L× 1 ml,实验前以RPMI 1640培养基稀释。CCK-8试剂盒(日本同仁研究所),酶联免疫吸附法(ELISA)试剂盒(深圳欣博盛公司),X射线辐照装置(德国西门子Primus-H型医用直线加速器),剂量率1 Gy/min,源靶距100 cm。流式细胞仪(美国BD公司)。CHK2、P-STAT3、GAPDH抗体均购于美国CST公司。
2.细胞培养:人食管鳞癌细胞系ECA-109购自中科院细胞库,用含10%胎牛血清、1%青霉素链霉素双抗的RPMI 1640培养基配成培养液,在37℃、5% CO2的培养箱中培养。细胞单层贴壁,每2~3天传代1次,选取指数生长期细胞用于实验。
3.细胞成球培养:用含10%胎牛血清的RPMI 1640培养基,无血清培养基由RPMI 1640(1 :1)、B27(1 :50)、EGF(20 ng/ml)、bFGF(20 ng/ml)、胰岛素5 μg/ml、转铁蛋白10 μg/ml、0.5%牛血清白蛋白(BSA)组成。食管癌细胞系的培养和传代按常规方法,用含10%胎牛血清,100 U/ml青霉素及100 mg/L链霉素的RPMI 1640培养基,在37℃、5%CO2及100%湿度的培养箱中培养,每2天传代1次,取处于对数生长期的细胞进行实验。用无血清培养基重悬以1×105细胞/孔接种于低黏附6孔培养板,在培养箱中培养,每隔1 d加1 ml新鲜无血清培养基。ECA-109肿瘤干细胞在前期实验中已经通过细胞增殖、肿瘤干细胞相关蛋白表达及表面分子测定等方法得以鉴定[2]。
4.阿帕替尼浓度筛选:实验分空白对照组(仅含培养基)、细胞对照组(仅含细胞及培养基)、单纯药物组(亲本细胞:5、10、20、30和40 μmol/L,干性细胞:20、30、40、50、60和80 μmol/L)。取指数生长期细胞,胰酶消化后制成单细胞悬液,实验组以每孔5 000个细胞/100 μl接种于96孔细胞培养板中,空白对照组仅加入100 μl培养基。待细胞贴壁后,单纯药物组更换阿帕替尼终浓度为对应的培养液100 μl,细胞对照组仅加入不含阿帕替尼的完全培养液。各组设6个平行孔,每板分别于37℃、5%CO2的培养箱中孵育24、48和72 h后,每孔加入10 μl CCK-8溶液,继续培养2 h,用酶标仪测定450 nm处的吸光度(A)值。细胞增殖抑制率(%)= 1-(实验组A值-空白对照组A值)/(细胞对照组A值-空白对照组A值)×100%。求出50%细胞生长抑制浓度(IC50),独立实验重复3次。
5.CCK-8法检测细胞增殖能力:实验分为空白对照组、细胞对照组,单纯照射组(6和8 Gy), 单纯药物组(亲本:0、10和20 μmol/L,干性细胞:0、30和40 μmol/L),药物+照射组(阿帕替尼浓度同单纯药组,照射剂量同单纯照射组)。取指数生长期细胞,胰酶消化后制成单细胞悬液,实验组以每孔5 000个细胞/100 μl接种于96孔细胞培养板中,空白对照组仅加入100 μl培养基。待细胞贴壁后,单纯药物组及药物+照射组更换阿帕替尼终浓度为10和20 μmol/L的培养液100 μl,细胞对照组及单纯照射组仅加入不含阿帕替尼的完全培养液。各组设6个平行孔,每板分别于37℃、5%CO2的培养箱中孵育48 h后,更换每孔培养液为不含阿帕替尼的完全培养液,按各组要求进行X射线照射。照射后每板分别于37℃、5%CO2的培养箱中继续孵育24 h后,每孔加入10 μl CCK-8溶液,继续培养2 h,用酶标仪测定450 nm处的吸光度(A)值,计算细胞增殖抑制率(%)。
6.酶联免疫吸附法检测不同条件下食管癌ECA-109细胞及其干性细胞VEGF的分泌:收集处理后的各组细胞,更换培养基继续于瓶中培养24 h后,收集各组细胞的上清液。加入已包被人VEGF单克隆抗体的酶标板上,检测方法按试剂盒说明书操作,根据标本的吸光度(A)值,计算VEGF的浓度。细胞对照组根据ELISA检测所得的浓度及细胞计数,计算出单位细胞数VEGF的分泌量。
7.流式细胞仪检测细胞周期分布:细胞培养及阿帕替尼处理时间同CCK-8实验。X射线照射后换液继续培养24 h,胰酶消化、离心半径20 cm,1 000 r/min离心5 min。收集培养皿中贴壁及悬浮细胞,磷酸盐缓冲液(PBS)洗涤,加入75%乙醇固定,4℃保存过夜。离心半径20 cm,1 000 r/min离心5 min,去除乙醇,PBS洗涤后离心半径20 cm,1 000 r/min离心5 min,获取细胞,细胞重悬于含RNase(1.87%)的碘化丙啶(PI)溶液中染色,37℃避光温浴30 min后上机检测,用Flowjo软件对细胞周期分布进行计算。独立实验重复3次。
8.Annexin V-FITC和PI双染流式细胞仪检测细胞凋亡率:细胞培养及阿帕替尼处理时间同CCK-8实验,X射线照射后, 换液继续培养24 h,用不含乙二胺四乙酸(EDTA)的胰酶消化各组细胞,计数,制成细胞密度1×106/L的悬液,按Annexin V-FITC细胞凋亡检测试剂盒说明书操作,用流式细胞仪检测,用Flowjo软件对样品的细胞凋亡率进行计算。独立实验重复3次。
9.Western blot法检测ECA-109细胞的P-STAT3、CHK2蛋白表达:收集处理后的各组细胞,提取蛋白,蛋白上样,转移至聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉,37℃温箱中封闭2 h,加入一抗后,4℃孵育过夜,TBST洗膜3次,每次10 min。加入稀释的二抗,室温孵育2 h,杂交膜清洗液(TBST)洗3遍,将含有辣根过氧化物酶底物的化学发光显影液滴加到膜上,在暗室中曝光显影。
10.统计学处理:采用SPSS 20.0软件进行数据分析。所有数据均符合正态分布,数据以x±s表示。两组间比较采用独立样本t检验,多个样本均数间比较,采用析因设计方差分析。P<0.05为差异有统计学意义。
结果1.阿帕替尼对食管癌ECA-109细胞及其干性细胞的增殖抑制作用:CCK-8检测结果显示,阿帕替尼5~40 μmol/L各浓度作用于食管癌ECA-109细胞24、48和72 h,与0 μmol/L浓度比较,差异均有统计学意义(t=4.29~55.88, P<0.05),且IC50值分别为(19.67±0.15)、(15.50±0.18)和(5.87±0.05)μmol/L。5~40 μmol/L浓度的阿帕替尼作用于ECA-109干性细胞24、48和72 h,与0 μmol/L浓度比较,差异亦均有统计学意义(t=5.77~134.52, P<0.05),且IC50值分别为(40.05±0.63)、(37.21±0.41)和(38.74±0.97)μmol/L。以药物浓度的对数为自变量,增殖抑制率为因变量做线性回归分析,两种细胞药物浓度与增殖抑制率均显著相关(亲本细胞:r2=0.94~0.97,P<0.05;干性细胞:r2=0.94~0.98,P<0.05),见表 1。说明阿帕替尼对ECA-109亲本及其干性细胞的增殖抑制作用具有剂量依赖性,且对亲本细胞的作用更显著。
|
|
表 1 阿帕替尼对ECA-109及其干性细胞的增殖抑制率(%,x±s) Table 1 The proliferation inhibition effect of apatinib on ECA-109 and its stem-like cells(%, x±s) |
2.阿帕替尼联合X射线照射对食管癌ECA-109细胞及其干性细胞的增殖抑制作用:CCK-8结果显示,单纯照射组、单纯药物组以及药物+照射组均能不同程度抑制两种细胞的增殖,对ECA-109亲本细胞的增殖抑制较其对干性细胞作用更为显著,联合组对细胞的增殖抑制作用最强。结果见表 2。对ECA-109亲本细胞及干性细胞的联合后的增殖抑制率进行析因设计方差分析,两种细胞单因素及亲本细胞双因素分析,差异均有统计学意义(P<0.05),干性细胞双因素分析,差异无统计学意义(P>0.05)。
|
|
表 2 阿帕替尼联合X射线照射后ECA-109及其干性细胞的增殖抑制率(%,x±s) Table 2 The proliferation inhibition effect of apatinib combined with X-rays on ECA-109 and its stem-like cells(%, x±s) |
3.ECA-109亲本细胞及其干性细胞的VEGF蛋白的表达:结果显示,ECA-109亲本细胞的VEGF蛋白分泌量为(506.71±31.23)pg/106个,干性细胞的VEGF蛋白分泌量为(912.0±44.5 1)pg/106个,两者比较,差异有统计学意义(t=7.454,P<0.05),见表 3。与细胞对照组比,单纯药物组、药物+对照组的两种细胞培养基上清液中VEGF蛋白的浓度均降低,其中亲本细胞差异有统计学意义(t=14.51、26.40,P<0.05),而干性细胞其差异无统计学意义(P>0.05)。
|
|
表 3 ECA-109及其干性细胞分泌VEGF的能力(x±s) Table 3 Secretion of VEGF from ECA-109 and its stem-like cells(x±s) |
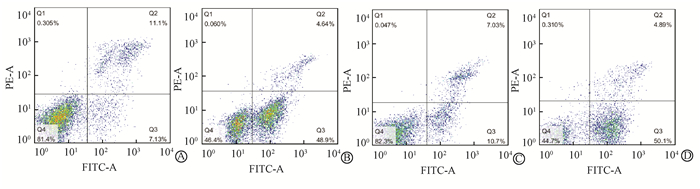
4.阿帕替尼联合X射线照射对食管癌ECA-109亲本细胞周期分布及凋亡的影响:流式细胞仪分析结果显示,药物+照射组G2/M期与细胞对照组比较,差异有统计学意义(t=8.828,P<0.05),单纯药物组及单纯照射组G2/M期与细胞对照组比较,差异均无统计学意义(P>0.05);药物+照射组与单纯照射组比较,差异有统计学意义(t=9.877,P<0.05);药物+照射组细胞G1期的比例降低,与细胞对照组比较,差异有统计学意义(t=4.523,P<0.05),见表 4。单纯药物组、药物+照射组与细胞对照组比,凋亡细胞比例(右下象限)明显增加,差异有统计学意义(t=8.596、11.59,P<0.05)。而单纯照射组与细胞对照组比较,凋亡细胞比例的差异无统计学意义(P>0.05)。ECA-109亲本细胞各实验组细胞凋亡图见图 1。
|
|
表 4 ECA-109细胞的周期分布比例及凋亡率(%,x±s) Table 4 Cell cycle distribution and apoptosis induction of ECA-109 cells among different groups(%, x±s) |
|
图 1 ECA-109细胞凋亡的流式细胞仪分析结果 A.细胞对照组;B.单纯药物组;C.单纯照射组;D.药物+照射组 Figure 1 Apoptosis induction detected by flow cytometry among different groups A. Control group; B. Drug group; C. Radiation group; D. Drug + radiation group |
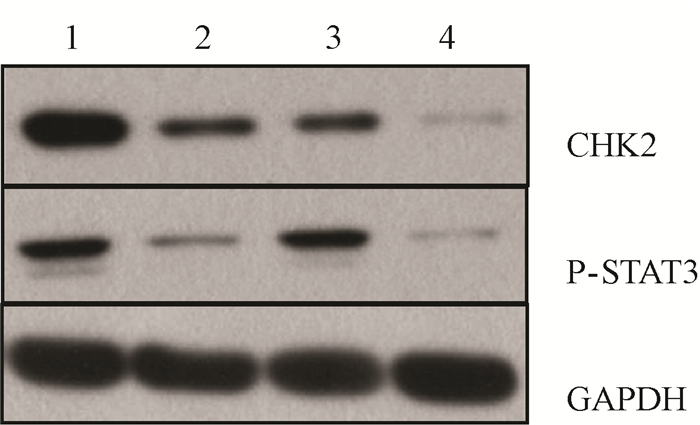
5.阿帕替尼、X射线照射及阿帕替尼联合X射线照射对ECA-109亲本细胞表达P-STAT3、CHK2蛋白影响:Western blot结果显示,单纯药物组CHK2,P-STAT3蛋白的表达(0.47±0.07,0.36±0.07)与细胞对照组(0.91±0.11,0.85±0.09)比下降,差异有统计学意义(t=3.355、4.104,P<0.05)。单纯照射组CHK2蛋白的表达(0.38±0.02)与细胞对照组(0.91±0.11)比下降,差异有统计学意义(t=4.498,P<0.05)。单纯照射组P-STAT3蛋白的表达与细胞对照组比较,差异无统计学意义(P>0.05)。药物+照射组CHK2,P-STAT3蛋白的表达(0.12±0.02,0.32±0.07)低于单纯照射组(0.39±0.02,0.61±0.12),差异有统计学意义(t=9.053、2.357,P<0.05),见图 2。
|
图 2 ECA-109细胞CHK2、P-STAT3蛋白表达电泳图 注:1.细胞对照组;2.单纯药物组;3.单纯照射组;4.药物+照射组 Figure 2 CHK2 and P-STAT3 protein expressions in ECA-109 cells among different groups |
讨论
目前已有临床研究发现,阿帕替尼在很多肿瘤如胃癌、胶质瘤、非小细胞肺癌、乳腺癌等的治疗中显现出较好的疗效[15-17]。也有体外细胞学实验报道,阿帕替尼对宫颈癌、食管癌细胞具有放射增敏作用,但其确切的放射增敏机制尚不清楚。本实验探讨了阿帕替尼对于食管癌ECA-109亲本细胞及其干性细胞的放射增敏作用及其可能机制。
本研究的细胞增殖抑制实验显示,阿帕替尼单药能够抑制ECA-109亲本细胞及干性细胞的增殖,且其干性细胞的IC50明显高于亲本细胞,药物联合X射线对亲本细胞的增殖抑制作用较干性细胞更强,结果提示,干性细胞可能是放射不敏感的主要群体。因此,干性细胞选择更高的浓度进行实验。已有研究证实,VEGF高表达的食管癌患者的死亡风险升高1.82倍[18],且与食管癌的放疗敏感性关系密切[10, 19-20]。本研究也发现,ECA-109干性细胞单位细胞数VEGF蛋白的分泌量明显高于亲本细胞,阿帕替尼能抑制亲本细胞及干性细胞VEGF蛋白的表达,对亲本细胞的抑制作用更强。因此,干性细胞VEGF的高表达可能是干性细胞放射不敏感的原因之一。
本研究发现阿帕替尼对ECA-109细胞具有放射增敏作用,放射增敏的机制包括增强射线对肿瘤细胞的原发性损伤、减弱肿瘤放射后亚致死性损伤与潜在致死性损伤的修复能力、促进肿瘤细胞发生凋亡、诱导细胞周期变化、影响肿瘤细胞信号传导通路等[21]。本研究流式细胞术分析表明,阿帕替尼能够促进ECA-109细胞的凋亡,联合X射线照射后,促凋亡作用更强;阿帕替尼联合X射线照射后,G2/M期细胞的比例明显增加,而细胞在G2/M期对射线较为敏感,其中M期最为敏感。CHK2是一种多功能蛋白激酶,是感知DNA损伤、细胞凋亡及周期阻滞的中心信号分子,CHK2高表达可抑制细胞凋亡,并使细胞周期阻滞在G2期,抑制其表达可以消除X射线引起的G2期阻滞而使细胞放射敏感性增加[22]。本研究Western blot结果显示, 阿帕替尼下调了细胞CHK2蛋白的表达,这提示阿帕替尼可能通过下调CHK2,从而促进肿瘤细胞凋亡、诱导细胞周期再分布,发挥放射增敏作用。已有研究证实,阿帕替尼可与VEGFR-2特异性的结合,靶向阻断VEGF相关通路,抑制VEGF的自分泌[23],VEGF可以通过STAT3通路,影响肿瘤的增殖、迁移、侵袭[24],而STAT3通路与放射敏感性密切相关,STAT3通路能同时激活肿瘤细胞抗凋亡、细胞周期调控及血管生成相关基因,从而产生放射抗拒[25]。本研究ELISA结果表明,阿帕替尼抑制了细胞VEGF的分泌,进一步Western blot发现,阿帕替尼明显下调了细胞P-STAT3蛋白的表达,结果提示阿帕替尼可能通过抑制VEGF分泌从而下调了P-STAT3/CHK2的表达,进而抑制了细胞的增殖、促进了细胞的凋亡、诱导了细胞周期再分布,最终增加了细胞的放射敏感性。
综上所述,阿帕替尼对ECA-109亲本细胞及其干性细胞具有不同程度的放射增敏作用,对亲本细胞的作用强于干性细胞,干性细胞放射抵抗可能与干性细胞更高表达VEGF蛋白有关,阿帕替尼可能是通过抑制VEGF信号通路中的关键靶点来影响细胞的放射敏感性,但其确切机制尚有待进一步的实验研究。
利益冲突 本研究接受常州市科技支撑社会发展项目(CE20165024)、常州市高层次卫生人才项目(2016C2BJ007)、常州市科技局应用基础研究项目(CJ20159050)、江苏省卫生厅指导性科研项目(Z201220)、常州市科技支撑社会发展项目(CE20125021)的资助。全体作者无利益冲突,排名无争议,未因进行该研究而接受任何不正当的职务和财务利益作者贡献声明 孔泽负责实验和论文撰写;汪建林、孙志强负责研究过程指导;王坚负责数据统计;封悦、孙菲、华秋、周梦耘协助完成实验;于静萍参与研究的酝酿和设计实验,提出修改意见
| [1] |
Wang W, Sun QK, He YF, et al. Overexpression of periostin is significantly correlated to the tumor angiogenesis and poor prognosis in patients with esophageal squamous cell carcinoma[J]. Int J Clin Exp Pathol, 2014, 7(2): 593-601. |
| [2] |
Wang JL, Yu JP, Sun ZQ, et al. Radiobiological characteristics of cancer stem cells from esophageal cancer cell lines[J]. World J Gastroenterol, 2014, 20(48): 18296-18305. DOI:10.3748/wjg.v20.i48.18296 |
| [3] |
Wang T, Shigdar S, Gantier MP, et al. Cancer stem cell targeted therapy:progress amid controversies[J]. Oncotarget, 2015, 6(42): 44191-44206. DOI:10.18632/oncotarget.6176 |
| [4] |
Ahmed N, Abubaker K, Findlay JK. Ovarian cancer stem cells:molecular concepts and relevance as therapeutic targets[J]. Mol Aspects Med, 2014, 39: 110-125. DOI:10.1016/j.mam.2013.06.002 |
| [5] |
Croagh D, Frede J, Jones PH, et al. Esophageal stem cells and genetics/epigenetics in esophageal cancer[J]. Ann N Y Acad Sci, 2014, 1325: 8-14. DOI:10.1111/nyas.12521 |
| [6] |
Guo W. Concise review:breast cancer stem cells:regulatory networks, stem cell niches, and disease relevance[J]. Stem Cells Transl Med, 2014, 3(8): 942-948. DOI:10.5966/sctm.2014-0020 |
| [7] |
Lundin A, Driscoll B. Lung cancer stem cells:progress and prospects[J]. Cancer Lett, 2013, 338(1): 89-93. DOI:10.1016/j.canlet.2012.08.014 |
| [8] |
Oshima N, Yamada Y, Nagayama S, et al. Induction of cancer stem cell properties in colon cancer cells by defined factors[J]. PLoS One, 2014, 9(7): e101735. DOI:10.1371/journal.pone.0101735 |
| [9] |
Turpin A, Sharif A, Stoven L, et al. The stem cell niche in glioblastoma:from fundamental aspects to targeted therapies[J]. Bull Cancer, 2015, 102(1): 24-33. DOI:10.1016/j.bulcan.2014.07.001 |
| [10] |
陆文斌, 于静萍, 倪新初, 等. 食管癌患者放化疗中病理反应与血清VEGF变化的关系及其对疗效和预后的影响[J]. 中华放射医学与防护杂志, 2013, 33(3): 299-302. Lu WB, Yu JP, Ni XC, et al. Relation between tumor pathologic response to concurrent chemo-radiotherapy and changes of serum VEGF level and its influence on the efficacy and prognosis in patients with esophageal carcinoma[J]. Chin J Radiol Med Prot, 2013, 33(3): 299-302. DOI:10.3760/cma.j.issn.0254-5098.2013.03.020 |
| [11] |
孙志强, 于静萍, 王坚, 等. 沙利度胺联合放化疗治疗食管癌随机对照研究[J]. 中华放射医学与防护杂志, 2016, 36(11): 815-821. Sun ZQ, Yu JP, Wang J, et al. A randomized controlled study of thalidomide combined with radiochemotherapy in treating esophageal cancer[J]. Chin J Radiol Med Prot, 2016, 36(11): 815-821. DOI:10.3760/cma.j.issn.0254-5098.2016.11.004 |
| [12] |
于静萍, 孙志强, 倪新初, 等. 沙利度胺联合放疗治疗食管癌的临床观察[J]. 中华放射医学与防护杂志, 2012, 32(4): 369-373. Yu JP, Sun ZQ, Ni XC, et al. Clinical effect observation of VEGF expression interfered by Thalidomide combined with radiotherapy in esophageal cancer treatment[J]. Chin J Radiol Med Prot, 2012, 32(4): 369-373. DOI:10.3760/cma.j.issn.0254-5098.2012.04.009 |
| [13] |
孙志强, 于静萍, 张志明, 等. 重组人血管内皮抑素对食管癌细胞的放射增敏作用及其机制[J]. 中华放射医学与防护杂志, 2013, 33(4): 346-350. Sun ZQ, Yu JP, Zhang ZM, et al. Effect of recombinant human endostatin on the radiosensitivity of esophageal carcinoma cells and underlying mechanism[J]. Chin J Radiol Med Prot, 2013, 33(4): 346-350. DOI:10.3760/cma.j.issn.0254-5098.2013.04.003 |
| [14] |
孙菲, 孙志强, 汪建林, 等. 阿帕替尼对食管癌Kyse-150细胞放射敏感性影响的实验研究[J]. 中华放射医学与防护杂志, 2017, 37(11): 805-809, 831. Sun F, Sun ZQ, Wang JL, et al. Radiosensitizing effect of apatinib on esophageal cancer cell line Kyse-150[J]. Chin J Radiol Med Prot, 2017, 37(11): 805-809, 831. DOI:10.3760/cma.j.issn.0254-5098.2017.11.001 |
| [15] |
Hu X, Cao J, Hu W, et al. Multicenter phase Ⅱ study of apatinib in non-triple-negative metastatic breast cancer[J]. BMC Cancer, 2014, 14: 820. DOI:10.1186/1471-2407-14-820 |
| [16] |
Li XF, Tan YN, Cao Y, et al. A case report of gastrointestinal hemorrhage and perforation during apatinib treatment of gastric cancer[J]. Medicine (Baltimore), 2015, 94(39): e1661. DOI:10.1097/MD.0000000000001661 |
| [17] |
Zhang H, Chen F, Wang Z, et al. Successful treatment with apatinib for refractory recurrent malignant gliomas:a case series[J]. Onco Targets Ther, 2017, 10: 837-845. DOI:10.2147/OTT.S119129 |
| [18] |
Chen M, Cai E, Huang J, et al. Prognostic value of vascular endothelial growth factor expression in patients with esophageal cancer:a systematic review and meta-analysis[J]. Cancer Epidemiol Biomarkers Prev, 2012, 21(7): 1126-1134. DOI:10.1158/1055-9965.EPI-12-0020 |
| [19] |
王伟, 刘建波, 李会荣, 等. 食管癌患者放疗前后血清VEGF水平变化及临床意义[J]. 中国老年学, 2015, 35(16): 4574-4576. Wang W, Liu JB, Li HR, et al. Changes of serum VEGF level and clinical significance before and after radiotherapy of esophageal cancer patients[J]. Chin J Gerontol, 2015, 35(16): 4574-4576. DOI:10.3969/j.issn.1005-9202.2015.16.070 |
| [20] |
于静萍, 孙志强, 倪新初, 等. 食管癌患者放疗前后血清血管内皮生长因子变化的临床意义[J]. 中华放射医学与防护杂志, 2011, 31(6): 671-674. Yu JP, Sun ZQ, Ni XC, et al. Clinical significance of changes of serum vascular endothelial growth factor level before and after radiotherapy in patients with esophageal carcinoma[J]. Chin J Radiol Med Prot, 2011, 31(6): 671-674. DOI:10.3760/cma.j.issn.0254-5098.2011.06.013 |
| [21] |
刘华文, 吴敬波. 放射增敏机制的研究进展[J]. 西南军医, 2009, 11(2): 250-252. Liu HW, Wu JB. Progress in the study of radiation sensitization mechanism[J]. J Military Surgeon Southwest China, 2009, 11(2): 250-252. DOI:10.3969/j.issn.1672-7193.2009.02.042 |
| [22] |
王玉祥, 祝淑钗, 封巍, 等. CHK1和CHK2 shrna转染对食管癌细胞照射后G2期阻滞的影响[J]. 中华肿瘤杂志, 2006, 28(8): 572-577. Wang YX, Zhu SC, Feng W, et al. Effect on retardation of G2/M phase in esophageal carcinoma cells transfected with CHK1 and CHK2 shRNA after irradiation[J]. Chin J Oncol, 2006, 28(8): 572-577. DOI:10.3760/j.issn.0253-3766.2006.08.004 |
| [23] |
Peng H, Zhang Q, Li J, et al. Apatinib inhibits VEGF signaling and promotes apoptosis in intrahepatic cholangiocarcinoma[J]. Oncotarget, 2016, 7(13): 17220-17229. DOI:10.18632/oncotarget.7948 |
| [24] |
Chen Z, Han ZC. Stat3:a critical transcription activator in angiogenesis[J]. Med Res Rev, 2008, 28(2): 185-200. DOI:10.1002/med.20101 |
| [25] |
王康, 白静. Stat3信号通路影响肿瘤放射敏感性的研究进展[J]. 临床肿瘤学杂志, 2015(7): 658-661. Wang K, Bai J. Research progress of signal transducer and activator of transcription 3 pathway on radiosensitivity of tumor[J]. Chin Clin Oncol, 2015(7): 658-661. |
 2018, Vol. 38
2018, Vol. 38


