癌症患者在接受放疗后引起一系列的放射性损伤,如放射性口腔黏膜炎、放射性肠炎等,严重影响愈后。放射对于胃肠道的损伤会导致腹泻,使患者产生电解质失衡与脱水,不能吸收食物中的水分,蛋白质等营养物质,是放疗中最常见也是最重要的不良反应[1]。丁酸钠是肠道菌群发酵产生的细胞功能物质,对细胞的增殖和完整性都具有重要的作用[2]。同时丁酸盐对于肠炎患者具有良好的耐受性[3],有文章报道丁酸钠对三硝基苯磺酸诱导的实验性结肠炎有一定的保护作用[4]。但是对于局部放射导致的肠道损伤是否具有作用未见报道,本研究旨在通过照射致大鼠肠损伤模型研究丁酸钠是否具有保护放射性肠损伤的作用,同时研究其可能的作用机制。
材料与方法1.实验动物及主要试剂和仪器:雄性SD大鼠32只,SPF级,体重(200±20) g[湖南斯莱克景达实验动物有限公司,许可证号为SCXK(湘)2013-0004],由武汉大学动物实验中心提供,实验动物饲养设施合格证号为00139132。丁酸钠购自上海阿拉丁试剂有限公司;脂多糖(LPS)测定试剂盒购自厦门鲎试剂实验厂有限公司;肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)测定试剂盒购自武汉博士德生物有限公司;苏木-伊红(HE)染色液与阿利新蓝-过碘酸雪夫氏(AB-PAS)染色液购自武汉谷歌生物有限公司;Varian Ⅸ型电子直线加速器(美国瓦里安公司)。
2.动物分组给药与模型建立:将32只大鼠按照体重采用随机数字表法分为正常对照组、模型对照组、高剂量丁酸钠给药组(20 mg/kg丁酸钠组)、低剂量丁酸钠给药组(5 mg/kg丁酸钠组),每组8只。参照文献[5]将除正常对照组外的各组采用Varian Ⅸ型电子直线加速器6 MV X射线进行辐照,源皮距(SSD)=100 cm,机架角180°,照射野15 cm×15 cm补偿膜为1 cm,剂量率为0.6 Gy/min,照射剂量为10 Gy,放疗范围包括大鼠肛门以上。正常对照组与模型对照组照射前3 d每天灌胃分别给予生理盐水和不同剂量丁酸钠灌胃给予对应剂量的药物,照射后24 h继续给药7 d,1次/d。每2天观察1次大鼠食量水量与体重,同时观察大鼠精神,大便与死亡率。在辐照后第7天处死大鼠,取血浆,解剖取出大鼠小肠、结肠,距回盲部上下5 cm处分别取材,连续取2段2 cm肠组织;一部分于4%多聚甲醛溶液固定备用,用于病理切片检测;另一部分-20℃保存备用。
3. LPS含量测定:取预处理好的血浆样本,按照试剂盒说明书操作,经血浆处理剂处理后,依次加入供试品100 μl,鲎试剂100 μl并37℃温育60 min,再加入显色基质溶液100 μl于37℃温育6 min,最后依次加入3种偶氮化试剂溶液500 μl,静置5 min后于545 nm下测定吸光度(A545)值,并使用标准曲线计算血浆内毒素含量。
4. HE染色与AB-PAS染色:取固定好肠组织,常规脱水,石蜡包埋,切片后进行常规HE染色,在光学显微镜下观察组织的病理形态学改变。AB-PAS染色步骤为脱蜡至水;阿利新蓝染液浸染或滴染5~10 min,稍水洗;0.5%高碘酸水溶液氧化5 min,流水洗;雪夫试剂暗处浸染或滴染15 min,苏木素复染,分化,反蓝;脱水,透明,封片。采用Image J图像分析系统对切片进行分析。
5. TNF-α与IL-1β含量的测定:按照ELISA说明书的步骤操作,在抗体包被的微孔板中,加入血浆50 μl,再加入10 μl生物素标记物,50 μl酶标记物,37℃孵育60 min,缓冲液清洗后加入底物与显色液,室温避光反应15 min,终止反应后测定吸光度A545值,计算结果。
6.统计学处理:各组数据经正态性检验均服从正态分布,实验数据均采用x± s表示。用SPSS 20.0软件进行分析。对体重、TNF-α、IL-1β及LPS水平两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
结果1.大鼠一般情况及死亡率分析:给药期间,正常对照组大鼠毛发光泽、饮食饮水正常,体重逐渐增加,活动敏捷,未出现稀便情况,大鼠肛周洁净;模型对照组分别于辐照后第4天死亡大鼠1只,第5天死亡1只,丁酸钠5 mg/kg组在第7天死亡1只,丁酸钠20 mg/kg组未出现大鼠死亡情况。
2.丁酸钠对辐照大鼠体重的影响:模型对照组大鼠自造模后第2天出现饮食下降,同时出现稀便,实验期间大鼠逐渐毛发失去光泽,稀便状况增多,体重逐渐降低,出现拱背,蜷缩懒动,精神萎靡等症状。在辐照后2 d,各受照组大鼠与正常对照组相比体重均有下降,到辐照第7天时正常对照组体重为(221.6±10.9) g,模型对照组体重(182.3±15.6) g下降了17.8%,与正常对照组比较,差异有统计学意义(t=5.86,P < 0.05)。而20 mg/kg丁酸钠与5 mg/kg丁酸钠组体重分别分别为(208.0±11.9) g和(197.7±9.9) g,下降了7.5%和11.5%,与正常对照组比较,差异均有统计学意义(t=-3.65、-2.52,P < 0.05),见表 1。
|
|
表 1 照射后不同时间各组大鼠的体重(g,x± s) Table 1 The influence of sodium butyrate in body weight after radiation(g, x± s) |
3.肠组织病理学观察:正常对照组大鼠回肠肠绒毛结构完整,结构清晰,隐窝结构清晰可见;照射后,模型对照组大鼠肠绒毛萎缩,变窄,绒毛宽度,黏膜厚度都显著低于正常对照组,且隐窝结构也存在异常,丁酸钠干预后,可以明显改善照射引起的小肠病变。照射后大鼠结肠黏膜厚度变薄,绒毛长度缩短,有明显的炎性细胞浸润;丁酸钠给药干预后,结肠病变改善明显,炎性细胞浸润减弱,黏膜厚度显著高于模型对照组,见图 1。

|
图 1 各组大鼠受照后肠损伤病理观察HE染色×100 Figure 1 The sodium butyrate in radiation induced intestinal damage HE staining×100 |
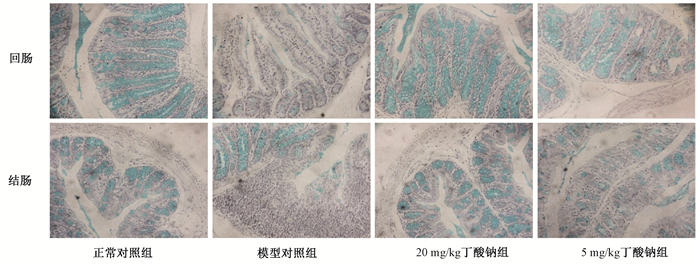
4.肠组织AB-PAS染色结果:AB-PAS染色主要针对肠组织上的杯状细胞中的黏液染色,一般正常情况下,小肠杯状细胞黏液滴分布于肠黏膜上皮内,显蓝色。照射后,大鼠回肠杯状细胞明显减少,染色细胞显著低于正常对照组;给予丁酸钠干预后,可以明显改善放疗引起的大鼠回肠杯状细胞的减少,见图 2。同时,丁酸钠也可以显著增加大鼠结肠组织中杯状细胞的数量。
|
图 2 各组受照大鼠照射后肠黏液分泌的情况AB-PAS染色×100 Figure 2 The sodium butyrate in radiation induced intestinal damage AB-PAS staining ×100 |
5.大鼠血清炎症因子测定:结果列于表 2。由表 2可知,辐射干预后,与正常对照组相比,照射后大鼠血清中TNF-α与IL-1β显著增加(t=5.13、-3.93,P < 0.05);,血清中TNF-α 20 mg/kg丁酸钠组与5 mg/kg丁酸钠组和模型对照组比较,差异均有统计学意义(t=3.25、-2.64,P < 0.05);血清中IL-1β含量较模型对照组相比明显降低,20 mg/kg丁酸钠组与5 mg/kg丁酸钠组和模型对照组比较,差异均有统计学意义(t=3.85、2.77,P < 0.05)。
|
|
表 2 各组受照大鼠体内TNF-α、IL-1β水平(ng/ml,x± s) Table 2 The influence of sodium butyrate in TNF-α and IL-1β level(ng/ml, x± s) |
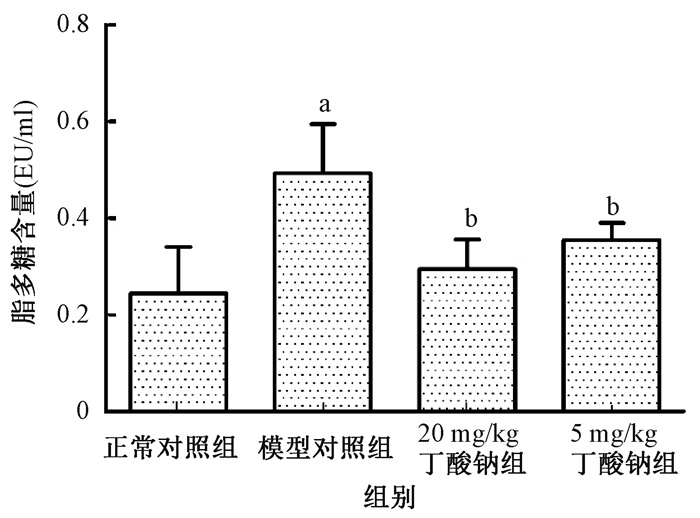
6.丁酸钠对大鼠血清中LPS的影响:结果图 3。由图 3可知,辐射干预后,与正常对照组比较,大鼠血浆中内毒素的含量显著升高(t=3.54,P < 0.05);给予丁酸钠干预后,可以明显降低照射导致的内毒素LPS释放,与模型对照组比较差异均具有统计学意义(t=3.32、2.51,P < 0.05)。
|
图 3 各组受照大鼠体内内毒素水平 注:a与正常对照组比较, t=3.54,P < 0.05;b与模型对照组相比, t=3.32、2.51,P < 0.05 Figure 3 The influence of sodium butyrate in endotoxin secretion |
讨论
丁酸钠作为肠道菌群代谢碳水化合物后产生的一种短链脂肪酸,与其类似的短链脂肪酸还有乙酸、丙酸等,均被认为是肠黏膜上皮细胞的主要能量物质,在保持结肠黏膜功能上有重要的作用。在腹部肿瘤放疗治疗过程中,肠道是最敏感的部位,小肠上皮细胞容易受损导致其屏障功能的损失[6]。其次,肠炎会导致肠道内菌群的紊乱,影响此类短链脂肪酸的代谢合成,影响肠道功能。研究表明,给肠炎患者灌肠给予短链脂肪酸可以明显改善肠炎患者的症状[7]。同时口服丁酸盐后,大部分患者均能缓解症状[8]。丁酸钠可能会通过保护肠道上皮细胞缓解放射导致的肠炎的作用。本研究采用射线辐射大鼠腹部模拟放射致肠炎的模型,研究丁酸对于这类肠炎的作用及可能的作用机制。
肠道作为机体营养物质吸收的关键部位,辐射后造成的损伤会导致患者恶液质体质[9],严重者会因营养吸收不良而死亡,所以寻找有效的预防措施和治疗手段具有重要的意义。研究表明,肠道上皮细胞对于放射线十分敏感,辐射后会启动肠上皮细胞的细胞凋亡、自噬、变性坏死以及有丝分裂灾变死亡,在病理学上表现为隐窝细胞减少、绒毛上皮细胞脱落和绒毛变短,进而造成肠黏膜结构功能破坏,屏障功能受损[10]。多种因素参与了放射导致的肠细胞异常,辐照会使肠道细胞出现DNA损伤、p53、Bcl-2、bax等促凋亡基因基因,炎性因子表达上调蛋白水平的变化,最终导致调控肠道功能受损。本研究结果显示,丁酸钠的干预可以减缓放射造成的体重减轻,降低死亡率。
通过对大鼠小肠与结肠的结构观察,本研究结果显示,辐射后大鼠的小肠结构与结肠结构均发生了显著的变化,主要体现在绒毛数量和高度均降低,腺体萎缩,有部分的炎性细胞浸润,肠道黏膜上皮与固有层脱落。与之前文章报道的放射致肠道结构变化类似[11-13]。完整连续的肠黏膜上皮细胞的是维持屏障功能完整的主要基础,正常的肠黏膜屏障可以有效地阻止外源性致病抗原对机体的侵入,在机体的免疫防御中占重要地位[14]。在黏膜层中,成熟的杯状细胞分泌产物黏蛋白是是上皮细胞黏液层参与上皮的修复过程,阻止致病菌的主要成分,发挥维持肠黏膜的屏障的功能[15]。本实验同时也采用AB-PAS染色法观察肠道黏膜层的杯状细胞中粘液分泌的情况,结果表明在照射后肠道杯状细胞黏液滴显著减少,进一步说明肠黏膜机械屏障发生了损伤。而在丁酸钠干预组,肠黏膜屏障的损伤减少,没有炎性浸润,肠道绒毛数量与长度都有不同程度的恢复,同时杯状细胞数量和黏液分泌也有增加,说明丁酸钠可以通过改善肠屏障来改善腹部放射导致的肠道损伤。
有研究发现,放疗时,体内氧自由基水平提高导致体内炎症水平的增加,如肿瘤坏死因子TNF-α、IL-1、IL-6等产生的炎症因子会造成肠黏膜屏障损伤[16],过度释放会导致细胞坏死,黏膜通透性增加,内毒素易位,加重全身炎症反应[17-18]。大量分泌的炎性因子同样会使正常生长的上皮细胞增殖被抑制,影响肠道正常结构[19]。本研究结果表明,腹部放疗后大鼠血液中TNF-α以及IL-1β含量显著升高,同时LPS含量也增加,也证明了肠道功能受损导致了全身的炎症反应。模型对照组大鼠死亡率高,可能是照射后肠黏膜屏障发生损伤,肠内内毒素等抗原侵入机体,引发一系列炎症反应导致的[20]。丁酸钠干预组无论剂量高低血清TNF-α显著下降,而只有高剂量丁酸钠可以使IL-1β含量显著下降,这一结果提示丁酸钠以抑制TNF-α产生为主,通过降低辐照后大鼠体内炎性因子的释放、保护肠上皮细胞、使肠黏膜屏障通透性增加、减少内毒素进入体内引起炎症,最终降低照射导致的死亡率增加,且有剂量依赖性。
综上所述,补充丁酸钠在一定程度上可以保护放射引起的肠道功能紊乱。本研究结果表明,丁酸钠可以降低照射引起的死亡、腹泻和体重下降等,这可能与丁酸钠降低辐照后大鼠体内炎性因子的释放、保护肠上皮细胞、使肠黏膜屏障通透性降低、减少LPS易位有关,但是丁酸钠是否有更好的给药方案,以及是否具有调节肠道菌群的作用,还需要进一步的研究。
| [1] |
王祯祯, 王海涛, 高光凯, 等. 复方树莓籽粉对急性放射性损伤作用的研究[J].
中华放射医学与防护杂志, 2017, 37 (1): 24-28. Wang ZZ, Wang HT, Gao GK, et al. Effect of compound raspberry seed powder on acute radiation injury[J]. Chin J Radiol Med Prot, 2017, 37 (1): 24-28. DOI:10.3760/cma.j.issn.0254-5098.2017.01.005. |
| [2] | Cavaglieri CR, Nishiyama A, Fernandes LC, et al. Differential effects of short-chain fatty acids on proliferation and production of pro-and anti-inflammatory cytokines by cultured lymphocytes[J]. Life Sci, 2003, 73 (13): 1683-1690. DOI:10.1016/s0024-3205(03)00490-9. |
| [3] | Tsukahara T, Iwasaki Y, Nakayama K, et al. Stimulation of butyrate production in the large intestine of weaning piglets by dietary fructooligosaccharides and its influence on the histological variables of the large intestinal mucosa[J]. J Nutr Sci Vitaminol(Tokyo), 2003, 49 (6): 414-421. DOI:10.3177/jnsv.49.414. |
| [4] |
赖衍宗, 章颖, 杨宏升, 等. 丁酸钠对TNBS结肠炎模型大鼠肠黏膜修复的影响[J].
胃肠病学, 2011, 16 (7): 395-399. Lai YZ, Zhang Y, Yang HS, et al. Effect of sodium butyrate on restoration of colonic mucosa in rats with TNBS induced colitis[J]. Chin J Gastroenterol, 2011, 16 (7): 395-399. DOI:10.3969/j.issn.1008-7125.2011.07.003. |
| [5] |
洪智攀, 武寒飞, 赵克, 等. 不同照射剂量下大鼠急性放射性肠炎模型的建立与比较[J].
中华实验外科杂志, 2012, 29 (11): 2317-2320. Hong ZP, Wu HF, Zhao K, et al. Establishment and comparison of acute radiation enteritis models in rats with difierent irradiationdoses[J]. Chin J Exp Surg, 2012, 29 (11): 2317-2320. DOI:10.3760/cma.j.issn.1001-9030.2012.11.077. |
| [6] | Satoh Y, Nagashima Y, Oomori Y, et al. Scanning electron microscopical observation on the isolated mucosa of rat small intestine:with special reference to the intestinal crypt[J]. Anat Anz, 1985, 159 (1-5): 305-309. DOI:10.1007/BF01545315. |
| [7] | Breuer RI, Soergel KH, Lashner BA, et al. Short chain fatty acid rectal irrigation for left-sided ulcerative colitis:a randomised, placebo controlled trial[J]. Gut, 1997, 40 (4): 485-491. DOI:10.1136/gut.40.4.485. |
| [8] | Sabatino AD, Morera R, Ciccocioppo R, et al. Oral butyrate for mildly to moderately active Crohn's disease[J]. Alimen Pharm Therap, 2005, 22 (9): 789-794. DOI:10.1111/j.1365-2036.2005.02639. |
| [9] | Ng AWY, Yuen KK, Tung SY, et al. Peripheral neuropathy:clinical diagnosis of POEMS syndrome and treatment with radiotherapy[J]. J Hong Kong College Radiol, 2007, 10 (2): 66-69. DOI:10.5772/58308. |
| [10] | François A, Milliat F, Jullien N, et al. Radiotherapy:what therapeutic orientations against the digestive aftereffects?[J]. Med Sci (Paris), 2009, 25 (3): 267-272. DOI:10.1051/medsci/2009253267. |
| [11] |
单信芝, 韩磊, 马爱国, 等. β-胡萝卜素对急性放射损伤大鼠小肠黏膜结构和屏障功能的影响[J].
肠外与肠内营养, 2009, 16 (6): 346-350. Shan XZ, Han L, Ma AG, et al. Effects of beta-carotene on intestine mucosa barrier function in rats damaged by X-ray[J]. Parenter Enter Nutr, 2009, 16 (6): 346-350. DOI:10.3969/j.issn.1007-810X.2009.06.008. |
| [12] |
顾阳春, 张照辉, 梁莉, 等. 放射性肠炎发生的分子机制[J].
中华放射医学与防护杂志, 2013, 33 (2): 211-214. Gu YC, Zhang ZH, Liang L, et al. The molecular mechanisms of radioactive enteritis[J]. Chin J Radiol Med Prot, 2013, 33 (2): 211-214. DOI:10.3760/cma.j.issn.0254-5098.2013.02.027. |
| [13] |
苏旭春, 韦燕梅, 孔嘉欣, 等. 肠和煎液对大鼠放射性肠炎小肠组织的抗氧化损伤作用[J].
广东医学, 2014, 35 (14): 2162-2163. Su XC, Wei YM, Kong JX, et al. Changhe fried liquid effects radioactive enteritis of rat small intestine tissue byimproving oxidation damage[J]. Guangdong Med J, 2014, 35 (14): 2162-2163. DOI:10.3969/j.issn.1001-9448.2014.14.007. |
| [14] |
王岚, 高杰英. 肠粘膜上皮细胞在天然免疫中的作用[J].
生物技术通讯, 2002, 13 (5): 368-370. Wang L, Gao JY. The role of intestinal epithelial cells in innate immune[J]. Lett Biotech, 2002, 13 (5): 368-370. DOI:10.3969/j.issn.1009-0002.2002.05.015. |
| [15] | Nowarski R, Jackson R, Gagliani N, et al. Epithelial IL-18 equilibrium controls barrier function in colitis[J]. Cell, 2015, 163 (6): 1444-1456. DOI:10.1016/j.cell.2015.10.072. |
| [16] |
廖泽云, 刘红, 姜锦林, 等. 生脉散对实验动物小肠辐射损伤的保护作用[J].
中国辐射卫生, 2007, 16 (3): 264-265. Liao ZY, Liu H, Jiang JL, et al. Effects of shengmaisan on the small intestine of mice after 60Co γ-whole body irradiation[J]. Chin J Radiol Health, 2007, 16 (3): 264-265. DOI:10.3969/j.issn.1004-714X.2007.03.004. |
| [17] | Ross AS, Cohen RD. Medical therapy for ulcerative colitis:the state of the art and beyond[J]. Curr Gastroenterol Rep, 2004, 6 (6): 488-495. DOI:10.1007/s11894-004-0071-9. |
| [18] |
中华医学会消化病学分会. 肠屏障功能障碍临床诊治建议[J].
中华消化杂志, 2006, 26 (9): 620 Digestive Disease Branch of Chinese Medical Association. Suggestion on management of intestinal barrier dysfunction[J]. Chin J Digestion, 2006, 26 (9): 620 DOI:10.3760/j.issn:0254-1432.2006.09.014. |
| [19] | Grubskaia LV, Voǐtsitskiǐ VM, Khizhniak SV. The effect of ionizing radiation with low dose rate on the state of electron transfer chain of enterocyte mitochondria of rat small intestine[J]. Ukr Biokhim Zh(1999), 2012, 84 (1): 45-52. DOI:10.1016/b978-0-12-035416-0.50006-9. |
| [20] | Lewis K, Caldwell J, Phan V, et al. Decreased epithelial barrier function evoked by exposure to metabolic stress and nonpathogenic E.coli is enhanced by TNF-alpha[J]. Am J Physiol Gastrointest Liver Physiol, 2008, 294 (3): 669-678. DOI:10.1007/s11894-004-0071-9. |
 2017, Vol. 37
2017, Vol. 37




