2. 安徽医科大学第一附属医院中西医结合肿瘤科,合肥 230022
2. Department of Integration of Chinese and Westen Medicine, First Affiliated Hospital of Anhui Medical University, Hefei 230022, China
宫颈癌是女性最常见的妇科肿瘤之一,根据2023年的癌症统计数据显示,在20~39岁女性中,宫颈癌是导致死亡的第二大原因[1-2]。约2/3的宫颈癌患者需要接受放射治疗。同期放化疗能够改善生存率,但其缺点在于可能引起更多肠道反应[3]。放射性肠炎定义为在腹部或骨盆区接受电离辐射后,肠道黏膜发生的炎症和损伤[4]。放射性肠炎可分为急性和慢性两种形式。急性放射性肠炎(acute radiation enteritis,ARE)发生在辐射直接损伤肠道黏膜快速增殖细胞时。慢性放射性肠炎(chronic radiation enteritis,CRE)是在数月至数年的时间内接受放疗后发展而来,并由闭塞性动脉内膜炎以及功能上皮表面普遍减少所致。放射性肠炎预测因子的重要性尚未产生共识。如何预测CRE并减少不良反应是宫颈癌放疗的核心问题。放射组学是一种新兴影像分析方法,涉及从医学图像中提取高维数据进行量化,并提供有关病理生理特性信息[5-6]。为了准确识别CRE,迫切需要一个结合多种因素的准确预测模型。本研究应用宫颈癌局部病灶磁共振(magnetic resonance imaging,MRI)影像的放射组学特征联合临床特征构建模型预测宫颈癌放射性肠炎的发生,并评估该模型的效能。
1、资料与方法1.研究对象与随访:本研究纳入2018年1月到2023年8月于安徽医科大学第一附属医院行盆腔局部放疗的111例宫颈癌患者作为研究对象。其中57例慢性放射性肠炎患者,54例非放射性肠炎患者。将患者7∶3划分为训练组78例和验证组33例。具体的临床特征列于表 1。本项研究获得安徽医科大学第一附属医院伦理委员会批准(PJ2024-04-03),为回顾性临床研究,免除签署知情同意。
|
|
表 1 接受放疗的宫颈癌患者基线特征 Table 1 Baseline characteristics of patients with cervical cancer undergoing radiotherapy |
纳入标准:①年龄18~80岁,经组织学检查确诊为宫颈癌。②未行手术治疗,首次行盆腔放射治疗。③根据国际妇产科学联盟(FIGO)分期系统第8版分期为ⅠB~ⅣA。④具有完整的影像学随访资料。⑤放射治疗后至少进行12个月的随访。排除标准:①年龄< 18岁或> 80岁。②缺乏术后完整的临床病理学资料。③诊断时存在远处转移(FIGO分期ⅣB)。④既往有恶性肿瘤病史,或随访过程中发现合并其他部位原发恶性肿瘤。⑤患有慢性肠道疾病或代谢病史。⑥其他严重心肺功能异常等严重疾病史。⑦未完成规定的放射治疗。
所有患者均采用调强放疗(intensity modulated radiation therapy,IMRT)。对PTV的处方剂量为45~50 Gy,1.8~2.0 Gy/次,对阳性淋巴结同时进行10~20 Gy的加量,1次/d每周5次。采用腔内近距离放射治疗,以阴道黏膜下0.5 cm为参考点。化疗方案包括紫杉醇联合顺铂或卡铂,并根据美国国立综合癌症网络(NCCN)指南对剂量进行确定和调整。
在放疗前1个月内,收集患者临床资料,包括盆腔增强MRI及基本信息。CRE的诊断标准基于不良事件通用术语评价标准(common terminology criteria for adverse events, CTCAE)5.0版。在放疗后第1~2年的随访期内,每3~6个月随访一次;第3至第5年:每6个月随访一次;第5年后:每年随访一次。随访终点为2024年8月1日。
2.感兴趣区域(ROI)分割与放射影像学特征提取:本研究获取宫颈癌患者盆腔磁共振T1增强像,并导入到3D Slicer软件中(版本5.6.2)。在隐匿患者信息后,由两名拥有5年以上专业经验的放射肿瘤学医师进行原发肿瘤的初始勾画。另一位拥有10年以上经验的放射肿瘤学医生对靶区进行审查,并作出必要的调整。同时将所有体素重新采样到1.0 mm × 1.0 mm × 1.0 mm。随后应用Python 3.6.7软件的PyRadiomics软件包提取放射学特征。利用小波滤波获取了放射学特征,包括一阶统计、邻近灰度级差矩阵(neighbourhood gray-tone difference matrix,NGTDM)、灰度级大小区域矩阵(gray-level size zonematrix,GLSZM)、灰度级依赖矩阵(gray-level dependency matrix,GLDM)、灰度级运行长度矩阵(gray-level run length matrix,GLRLM)、灰度级共生矩阵(gray-level co-occurrence matrix,GLCM)和形状特征。通过Z-score标准化对所有放射学特征值进行预处理后,采用内在一致性系数(ICC)分析,评估放射学特征的可重复性。只有当特征的P < 0.05且ICC≥0.8时,才选择进行后续分析。然后,使用R软件(版本4.0.6)进行绝对最小收缩选择算子(least absolute shrinkage and selection operator,LASSO)回归,以确定与生存期相关的特征,并通过10倍交叉验证确定最优参数(λ)。随后,使用在此过程中确定的非零系数对选定的特征进行加权和线性组合,以计算每个患者的放射学评分(Radscore)。
3.统计学处理:使用了R 4.2.2、SPSS 28.0和Python 3.6.7软件进行分析。分类数据采用χ2检验和精确概率检验进行分析。患者类别和连续基线特征均以频数(百分比)和x±s描述。使用logistic回归模型,进行单变量和多变量分析,以识别与肠炎独立相关的因素。P < 0.05为差异有统计学意义。
2、结果1.基线特征:本研究鳞状细胞癌108例,腺癌3例。31例患者出现盆腔淋巴结转移。FIGO分期Ⅰ~Ⅱ期52例,Ⅲ~Ⅳ期58例。χ2检验显示训练集及验证集差异无统计学意义(P>0.05,表 1)。
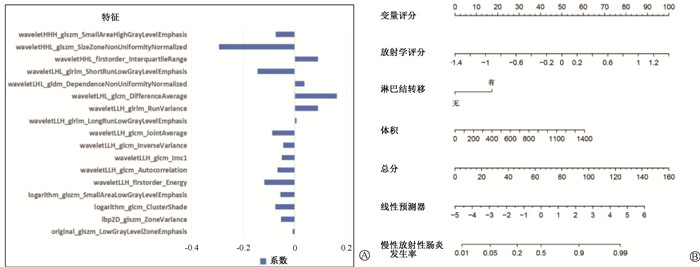
2.特征选择和放射影像学评分计算:通过盆腔MRI T1增强像中提取了1 435种放射学特征。去除冗余特征后获得了1 312个特征。利用LASSO回归,通过10折交叉验证确定最优参数(λ)最终选择了17个特征获得影像组学得分。
3.单变量分析和多变量分析:结果列于表 2,3。单因素分析显示,年龄(HR:1.051,95% CI: 1.002~1.102,P=0.040)、肿瘤体积(HR:4.200,95% CI: 1.608~10.969,P=0.003)、盆腔转移淋巴结(HR:4.722,95% CI: 1.412~15.787,P=0.012)、影像组学得分(HR:14.681,95% CI: 5.126~42.048,P < 0.001)是影像慢性放射性肠炎发生的独立危险因素。多因素分析结果表明,影像组学得分(HR:17.457,95% CI: 5.540~55.009,P < 0.001)、肿瘤体积(HR:3.617,95% CI: 1.293~10.115,P=0.014)、盆腔转移淋巴结(HR:3.559,95% CI: 1.013~12.501,P=0.048)进一步影响患者慢性放射性肠炎的发生。
|
|
表 2 与放射性肠炎相关的单因素回归分析 Table 2 Univariate regression analyses of possible factors associated with radiation enteritis |
|
|
表 3 与放射性肠炎相关的多因素回归分析 Table 3 Multivariate regression analyses of possible factors associated with radiation enteritis |
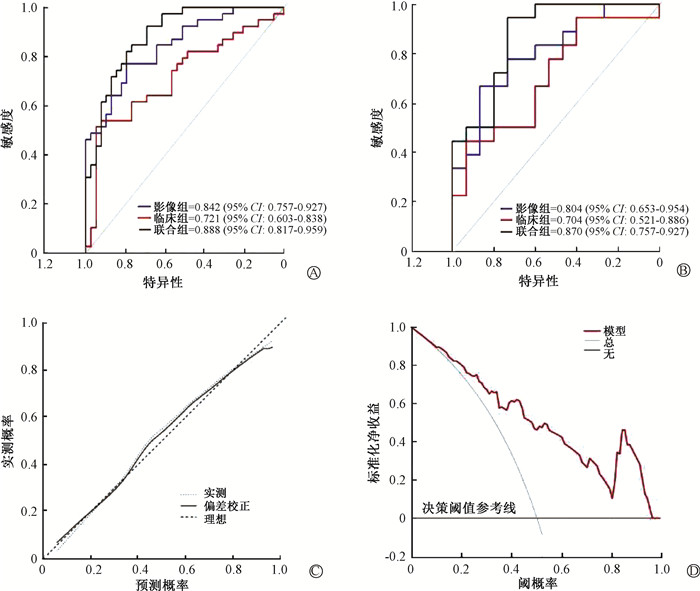
4.构建列线图预测模型:通过整合选择的影像组学得分、肿瘤体积和盆腔转移淋巴结构建了一个用于预测CRE的列线图(图 1)。在训练组中,影像组学联合临床数据的模型曲线下面积(AUC)(0.888,95% CI: 0.817~0.959)高于影像组学(0.842,95% CI: 0.757~0.927)及单纯临床数据模型(0.721,95% CI: 0.603~0.838)。在验证组中,影像组学联合临床数据的模型AUC(0.870,95% CI:0.757~0.927)同样高于单独的影像组学(0.804,95% CI: 0.653~0.954)及单纯临床数据模型(0.704,95% CI: 0.521~0.886)。校准曲线及决策曲线分析(decision curve analysis, DCA)证实了临床影像组学列线图的临床应用价值(图 2)。
|
图 1 筛选影像组学特征并构建列线图 A. 影像组学得分;B.训练组列线图 Figure 1 Screening of radiomic features and establishment of nomograms A. Radiomic scores; B. Nomogram of the training group |
|
图 2 评估临床-影像学评分模型的性能 A. 训练集AUC;B. 验证集AUC; C. 训练集校准曲线;D. 训练集决策曲线 Figure 2 Performance evaluation of the model combining clinical feature and radiomic score. A. AUC of the training group; B. AUC of the validation group; C. Calibration curve of the training group; D. Decision curve of the training group |
3、讨论
对于存在高风险因素并接受子宫全切术后或无法进行手术治疗的患者来说,同期放化疗被认为是首选治疗方法[3, 7]。接受宫颈癌盆腔放疗的患者中,近80%出现早期急性不良反应,而20%则经历晚期不良反应[8]。ARE通常具有自限性且并发症较少;而CRE却更为严重,并且常伴随多种并发症[9]。并不是所有的ARE都会发展为CRE,经过10年放疗后CRE的患病率为10%~20%[10]。CRE患者可能有ARE的所有症状,包括消化不良、严重出血、狭窄、穿孔、瘘管、失禁和肠梗阻等并发症 [11]。
近年在妇科肿瘤放射治疗中,IMRT的临床应用呈现出逐渐上升的趋势。这项放疗技术不仅能够实现满意的靶区剂量覆盖,还能有效降低危及器官如直肠和小肠的辐射剂量(例如V45)[12]。多项研究显示,CRE发生与发展与肠道放射技术、总剂量、总体积、分次剂量以及辐射剂量分布均匀度等因素相关[13-15]。同时,CRE也受到诸如免疫直肠溃伤、结缔组织血管异常以及腹部和盆腔手术史、盆腔感染、糖代谢紊乱和艾滋综合征等因素影响[16]。医学影像作为临床手段,在评估与放疗相关的病理生理和功能过程的不良反应方面发挥着关键作用[17-18]。对靶区和危及器官(organ at risk,OARs)进行放射组学特征分析具有多种应用,例如诊断、风险层次划分、无病存活预测、自动分割、靶区定义、毒性预后、治疗计划优化、自适应再计划、决策支持,以及治疗反应评估和随访[19-20]。
Abdullahi等[21]利用从术前及术后直肠壁MRI中提取的放射组学特征,开发了预测模型并评估其性能。他们发现,一些属于GLRLM家族的特征,与放射不良反应显著相关,这些指标表明组织存在非均匀或异质现象。Mostafaei等[22]认为,包括,GLCM、GLSZM和灰度共生矩阵GLDM对前列腺癌患者放射性膀胱炎和直肠炎相关。本研究显示,包括GLRLM、GLCM、GLSZM和GLDM及等在内的各种纹理是预测肠炎的特征。
全血计数是一种常规、廉价、简单的检查,可以提供有关血液成分的信息。中性粒细胞-淋巴细胞比值、淋巴细胞/单核细胞比值和血小板计数/ 淋巴细胞计数是全身炎症反应的简单指标,已被证实与肠道问题有关,如克罗恩病、溃疡性结肠炎和急性肠梗阻[23-25]。本研究单因素逻辑回归分析显示,淋巴细胞/单核细胞比值、中性粒细胞/淋巴细胞比值、血小板/白蛋白比值、中性粒细胞计数/白蛋白、血小板计数/淋巴细胞计数与CRE发生无显著相关。
对于宫颈癌患者而言,同步化学放射联合治疗有助于提高放射治疗的敏感度,但也会增加不良事件的发生率[26]。本研究多因素分析结果表明,Radsocre评分、肿瘤体积、盆腔转移淋巴结均是影响患者有CRE发生的独立危险因素。
本研究建立一个量化的CRE风险预测模型,以评估相关风险并识别高风险人群,基于CRE独立危险因素构建了CRE发生情况的预测图表模型。经过统计验证,结合放射组学特征与临床特征可以提高模型的性能。影像组学联合临床数据的模型在训练组和验证组的AUC高于影像组学及单纯临床数据模型。校准曲线及决策曲线分析证实了临床影像组学列线图的临床应用价值。
本研究确实存在的局限:首先,未对肠炎分级严重程度进行分析,也未纳入剂量学参数,仅纳入T1增强相,未分析其他序列;其次,作为单中心研究,样本量较小;此外,放射组学策略通常在可重复性和标准化方面存在局限性,这可能限制其应用价值。
目前尚无关于慢性放射性肠炎相关预测因子的共识。本研究评估了放射学特征模型在为宫颈癌患者提供CRE的定量和个性化评估方面的潜力。后期研究将扩大样本,同时纳入更多相关因素分析,以探寻预测CRE的危险因素并降低临床CRE的发生。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 朱礼阳负责统计分析和撰写论文;任正婷负责提出研究思路及协助修改论文;潘淑豪、吕银负责分析数据;李平、陈象逊负责采集数据
| [1] |
Chen F, Gong X, Zhang K, et al. Nomogram predicting grade ≥ 2 acute radiation enteritis in patients with cervical cancer receiving concurrent chemoradiotherapy[J]. Am J Clin Oncol, 2024, 47(7): 317-324. DOI:10.1097/COC.0000000000001096 |
| [2] |
刘明博, 董青青, 周博, 等. 肌少症对同步放化疗宫颈癌患者近期效果和远期预后的影响[J]. 中华放射医学与防护杂志, 2024, 44(6): 497-503. Liu MB, Dong QQ, Zhou B, et al. Impact of sarcopenia on short-term outcomes and long-term prognosis in cervical cancer patients undergoing concurrent chemoradiotherapy[J]. Chin J Radiol Med Prot, 2024, 44(6): 497-503. DOI:10.3760/cma.j.cn112271-20231011-00117 |
| [3] |
Mayadev JS, Ke G, Mahantshetty U, et al. Global challenges of radiotherapy for the treatment of locally advanced cervical cancer[J]. Int J Gynecol Cancer, 2022, 32(3): 436-445. DOI:10.1136/ijgc-2021-003001 |
| [4] |
Webb GJ, Brooke R, De Silva AN. Chronic radiation enteritis and malnutrition[J]. J Dig Dis, 2013, 14(7): 350-357. DOI:10.1136/ijgc-2021-003001 |
| [5] |
Abbaspour S, Barahman M, Abdollahi H, et al. Multimodality radiomics prediction of radiotherapy-induced the early proctitis and cystitis in rectal cancer patients: a machine learning study[J]. Biomed Phys Eng Express, 2023, 10(1): 015017. DOI:10.1088/2057-1976/ad0f3e |
| [6] |
Jiang X, Li J, Kan Y, et al. MRI based radiomics approach with deep learning for prediction of vessel invasion in early-stage cervical cancer[J]. IEEE/ACM Trans Comput Biol Bioinform, 2021, 18(3): 995-1002. DOI:10.1109/TCBB.2019.2963867 |
| [7] |
吴先想, 蔡汉飞, 曹露, 等. 基于Pinnacle脚本构建宫颈癌调强放疗自动计划的研究[J]. 中华放射医学与防护杂志, 2024, 44(8): 650-656. Wu XX, Cai HF, Cao L, et al. Pinnacle script-based construction of automatic intensity-modulated radiotherapy plans for cervical cancer[J]. Chin J Radiol Med Prot, 2024, 44(8): 650-656. DOI:10.3760/cma.j.cn112271-20231022-00133 |
| [8] |
Loge L, Florescu C, Alves A, et al. Radiation enteritis: Diagnostic and therapeutic issues[J]. J Visc Surg, 2020, 157(6): 475-485. DOI:10.1016/j.jviscsurg.2020.08.012 |
| [9] |
Dahiya DS, Kichloo A, Tuma F, et al. Radiation proctitis and management strategies[J]. Clin Endosc, 2022, 55(1): 22-32. DOI:10.5946/ce.2020.288 |
| [10] |
Shen XJ, Liu L, Zhu JY. Radiofrequency ablation in a patient with radiation enteritis: A case report[J]. Medicine (Baltimore), 2018, 97(47): e13328. DOI:10.1097/MD.0000000000013328 |
| [11] |
Lu L, Li W, Chen L, et al. Radiation-induced intestinal damage: latest molecular and clinical developments[J]. Future Oncol, 2019, 15(35): 4105-4118. DOI:10.2217/fon-2019-0416 |
| [12] |
Chino J, Annunziata CM, Beriwal S, et al. Radiation therapy for cervical cancer: Executive summary of an ASTRO clinical practice guideline[J]. Pract Radiat Oncol, 2020, 10(4): 220-234. DOI:10.1016/j.prro.2020.04.002 |
| [13] |
Ren X, Shang F, Yang D, et al. Exploring the role of CD13 and inflammatory factors in radiation enteritis: insights from high-throughput proteomics and Mendelian randomization analysis[J]. Discov Oncol, 2025, 16(1): 681. DOI:10.1007/s12672-025-02494-3 |
| [14] |
Fan J, Lin B, Fan M, et al. Research progress on the mechanism of radiation enteritis[J]. Front Oncol, 2022, 12: 888962. DOI:10.3389/fonc.2022.888962 |
| [15] |
Zhu X, Li Y, Tian X, et al. REG γ mitigates radiation-induced enteritis by preserving mucin secretion and sustaining microbiome homeostasis[J]. Am J Pathol, 2024, 194(6): 975-988. DOI:10.1016/j.ajpath.2024.02.008 |
| [16] |
Ma CY, Zhao J, Gan GH, et al. Establishment of a prediction model for severe acute radiation enteritis associated with cervical cancer radiotherapy[J]. World J Gastroenterol, 2023, 29(8): 1344-1358. DOI:10.3748/wjg.v29.i8.1344 |
| [17] |
Hassaninejad H, Abdollahi H, Abedi I, et al. Radiomics based predictive modeling of rectal toxicity in prostate cancer patients undergoing radiotherapy: CT and MRI comparison[J]. Phys Eng Sci Med, 2023, 46(4): 1353-1363. DOI:10.1007/s13246-023-01260-5 |
| [18] |
Ritlumlert N, Wongwattananard S, Prayongrat A, et al. Improved prediction of radiation-induced hypothyroidism in nasopharyngeal carcinoma using pre-treatment CT radiomics[J]. Sci Rep, 2023, 13(1): 17437. DOI:10.1038/s41598-023-44439-2 |
| [19] |
Di Costanzo G, Ascione R, Ponsiglione A, et al. Artificial intelligence and radiomics in magnetic resonance imaging of rectal cancer: a review[J]. Explor Target Antitumor Ther, 2023, 4(3): 406-421. DOI:10.37349/etat.2023.00142 |
| [20] |
Wang T, Li YY, Ma NN, et al. A MRI radiomics-based model for prediction of pelvic lymph node metastasis in cervical cancer[J]. World J Surg Oncol, 2024, 22(1): 55. DOI:10.1186/s12957-024-03333-5 |
| [21] |
Abdollahi H, Mahdavi SR, Mofid B, et al. Rectal wall MRI radiomics in prostate cancer patients: prediction of and correlation with early rectal toxicity[J]. Int J Radiat Biol, 2018, 94(9): 829-837. DOI:10.1080/09553002.2018.1492756 |
| [22] |
Mostafaei S, Abdollahi H, Kazempour Dehkordi S, et al. CT imaging markers to improve radiation toxicity prediction in prostate cancer radiotherapy by stacking regression algorithm[J]. Radiol Med, 2020, 125(1): 87-97. DOI:10.1007/s11547-019-01082-0 |
| [23] |
Langley BO, Guedry SE, Goldenberg JZ, et al. Inflammatory bowel disease and neutrophil-lymphocyte ratio: A systematic scoping review[J]. J Clin Med, 2021, 10(18): 4219. DOI:10.3390/jcm10184219 |
| [24] |
Woodford EP, Woodford HM, Hort AR, et al. Neutrophil-lymphocyte ratio and platelet-lymphocyte ratio use in detecting bowel ischaemia in adhesional small bowel obstruction[J]. ANZ J Surg, 2022, 92(11): 2915-2920. DOI:10.1111/ans.18073 |
| [25] |
Fu W, Fu H, Ye W, et al. Peripheral blood neutrophil-to-lymphocyte ratio in inflammatory bowel disease and disease activity: A meta-analysis[J]. Int Immunopharmacol, 2021, 101(Pt B): 108235. DOI:10.1016/j.intimp.2021.108235 |
| [26] |
Dahiya DS, Kichloo A, Tuma F, et al. Radiation proctitis and management strategies[J]. Clin Endosc, 2022, 55(1): 22-32. DOI:10.5946/ce.2020.288 |
 2025, Vol. 45
2025, Vol. 45


