2. 山东麦德盈华科技有限公司,临沂 276111
2. Shandong Maide Yinghua Technology Co., Ltd., Linyi 276111, China
计算机体层成像(CT)是临床前实验的常用工具,主要用于呈现病灶的形态或内部组织、器官的结构。实验类动物作为科研和临床应用中的重要研究对象,通常具有相对较小的体型,这种微小尺寸使重建的图像体素限制在50 μm3左右。相比之下,临床CT图像通常采用0.5~1.0 mm3的体素大小,空间分辨力远超小动物成像的5 × 104~ 1×105倍,这种巨大的空间分辨力差异,使得在小动物活体成像中实现高精度的空间信息获取成为一个技术挑战[1]。锥形束CT(CBCT)是CT的一种,具有空间分辨力高、辐射低、成像速度快等优点,非常适合小动物活体成像[2-3]。当前,大多数CBCT的空间分辨力和视野(FOV)尺寸均是预设好的,这使得CBCT在对大样本生物进行扫描时,不仅不能实现对目标区域的整体扫描,而且对于更小的动物或部分组织、器官的扫描,图像质量也不能达到预期的高标准和要求。为了解决这些局限性,本课题组设计并开发了一种可连续调节空间分辨力的商用桌面式小动物CBCT,用来实现临床前实验的各种成像需求。
材料与方法1.理论研究:1977年,Yester和Barnes[4]深入研究CT技术成像性能。他们发现,虽然空间分辨力的提升可以通过重建算法调整像素大小来实现,但这种方法在像素尺寸达到一定极值后,空间分辨力的提升就会停滞不前。进一步的研究揭示,这种现象与CT的设计息息相关,射线源的焦点尺寸、平板探测器的像素大小都是影响空间分辨力的关键因素,此外,设备的几何形状也对空间分辨力产生重大影响。最终得出设备自身空间分辨力与截止频率(fc)、等效射速宽度(ut)的关系见公式(1):
| $ \text { 空间分辨率 }=\frac{1}{2 f_c}=\frac{u_t}{2}=\frac{\sqrt{d^2+(a(M-1))^2}}{2 M} $ | (1) |
式中,d为探测器像素尺寸,μm; a为射线源焦点尺寸,μm; M为CBCT的放大倍数。
通过对现有理论的分析,本研究提出了一套创新的理论框架,用于指导可调空间分辨力CBCT系统的设计,原理如图 1所示:
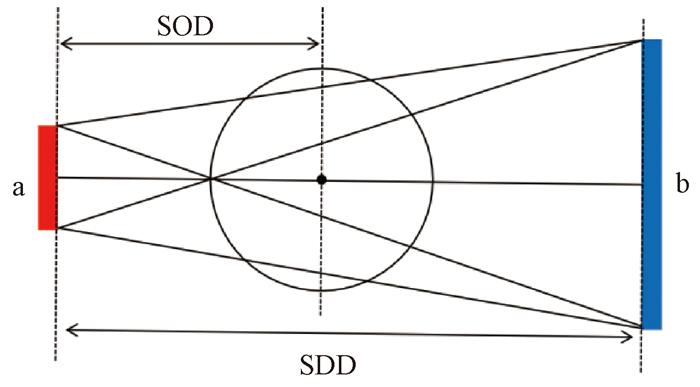
|
注:a. 射线源焦点尺寸; b. 探测器像素尺寸; SOD. 射线源到待测物体中心的距离; SDD. 射线源到探测器的距离 图 1 CBCT扫描几何示意图 Figure 1 Geometric diagram of CBCT scanning |
CBCT的放大倍数M见公式(2):
| $ M=\frac{\mathrm{SDD}}{\mathrm{SOD}} $ | (2) |
式中,SDD为射线源到探测器的距离,mm; SOD为射线源到待测物体中心的距离,mm。设空间分辨力为Y,设备的空间分辨力见公式(3):
| $ \begin{gathered} Y=\frac{\sqrt{d^2+(a(M-1))^2}}{2 M}=\sqrt{\frac{d^2+a^2(M-1)^2}{4 M^2}}= \\ \sqrt{\frac{d^2+a^2}{4 M^2}-\frac{a^2}{2 M}+\frac{a^2}{4}} \end{gathered} $ | (3) |
通过理论分析与数值计算,本研究发现这几个参数对空间分辨力的影响呈现出两种不同模式:当射线源焦点尺寸远大于探测器像素尺寸时,探测器像素尺寸对空间分辨力影响占比大,射线源到探测器距离固定时,待测物体越靠近探测器,空间分辨力越小。当射线源焦点尺寸远小于探测器像素尺寸时,射线源焦点尺寸对空间分辨力影响占比大,射线源到探测器距离固定时,待测物体越靠近射线源,空间分辨力越小。
2.X射线源:与临床CT系统不同,小动物CBCT采用微焦点源,以获得更好的空间分辨力。微焦点源中阳极靶的材料确定了X射线的生成类型,可将其划分为白色X射线和标识X射线[5],其焦点尺寸直接影响小动物成像所需要的高空间分辨力。本研究使用伟杰科技(苏州)有限公司的射线源IXS080BP056P228,其焦点尺寸30~40 μm,管电压可调范围为20~80 kV,管电流可调范围为0.2~0.7 mA,锥束角度呈30°,照射窗到焦点46 mm。
3.实验动物:Wistar大鼠1只,合格证号:20231127Aazz061900862,体质量450 g,C57小鼠1只,合格证号:110011231111531958,体质量50 g,均购自北京维通利华实验动物技术有限公司,饲养于SPF级动物房,均采用异氟烷持续麻醉,氧气流量0.5 L/min,浓度分别为2%和1%。
4.管电压与管电流对图像的影响:小鼠使用管电流200、400、700 μA,管电压30~80 kV进行成像。
5.空间分辨力测试成像条件:均选用70 kV管电压、600 μA管电流分别对小鼠、大鼠进行成像,大鼠FOV为80 mm,小鼠FOV分别为40、60、80 mm。
6.探测器:探测器在CBCT系统中扮演着至关重要的角色,它的主要任务是捕获透过待测物体的X射线并最终转化为可以被计算机处理和分析的数字信号。面阵探测器的类型分为两种:电荷耦合器件(CCD)探测器和平板探测器[6]。由于CCD探测器存在光信号丢失、几何失真、体积大、干扰信号强、热噪声等缺点,最终选取奕瑞新材料科技(太仓)有限公司的Jupi0606X1非晶硅(a-Si)平板探测器,其有效成像面积为153.6 mm × 153.6 mm,屏幕尺寸为186 mm × 184 mm × 52 mm,像素尺寸为100 μm。
7.采集模式:数据采集方式一般分为两种类型:旋转样品设计和旋转机架设计。旋转样品设计模式中,X射线源和探测器是固定不动的,待测样品被放置在可以旋转的载物台上[7-8]; 旋转机架设计中载物台固定不动,X射线源和探测器安装在旋转机架上[9],数据采集时旋转机架带着X射线源和探测器相对静止地做圆周运动。
在此基础上,本研究提出了一种创新的图像采集模式,即“步进-调焦-旋转”模式[10](图 2)。在此模式中,“调焦”和“步进”系统被巧妙地嵌入到“旋转”中。具体而言,射线源与平板探测器保持相对静止,共同构成“调焦”系统。当“步进”系统精确地将待测物运送至预设扫描位置后,“调焦”系统便能够根据不同实验需求,围绕待测物进行线性运动,从而实现空间分辨力的灵活调整。最终,通过“旋转”系统的运作,实现高质量成像效果。

|
图 2 锥形束CT结构设计图A.“调焦-旋转”结构设计图; B. CBCT整体结构设计图 Figure 2 CBCT structural design A. Structural design of the "focusing-rotating"part; B. Overall structural design of CBCT |
8.调焦系统实现:选取购自意大利-法国半导体(ST)集团生产的微控制器和处理器(STM32F091VCT6)作为核心控制单元,为了满足系统的多功能性和高效率要求,本研究设计了一系列定制化的硬件电路,当上位机发出指令,通过CAN总线收集和处理相关信息后,这些数据被准确地传递给负责执行不同任务的伺服驱动器。这样,它们就能根据预设程序控制各个机械部分和运动部件,进而精确地完成预定扫描任务。
硬件电路设计完毕后,还需要进行软件控制逻辑的编写,通过STM32芯片图形化配置工具(STM32CubeMX)完成时钟、定时器、CAN通讯等底层配置后,生成的工程代码在Keil 5打开并根据实际需求自行编写和开发,图 3为实现空间分辨力可调的控制逻辑流程图。
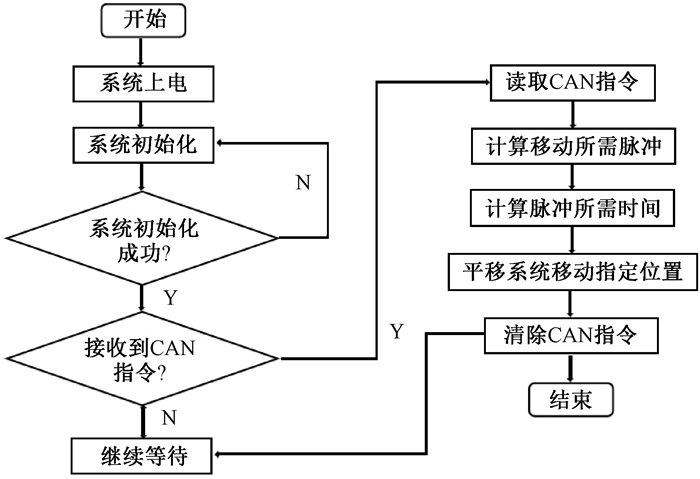
|
图 3 可调空间分辨力控制逻辑流程图 Figure 3 Logic flowchart of adjustable spatial resolution control |
结果
1.CBCT整体结构:可调空间分辨力CBCT的整体结构如图 4所示。

|
图 4 可调空间分辨力锥形束CT整体实物图 Figure 4 Overall physical image of adjustable spatial resolution CBCT |
2.管电压与管电流对图像的影响:重建图像如图 5所示。随着管电压、管电流升高,图像亮度、对比度和清晰度均显著提升,但管电压到达一定程度后软组织成像效果逐渐下降,这表明在活体成像中,需依据样本特性优化管电压与管电流参数组合,以实现最佳成像质量。
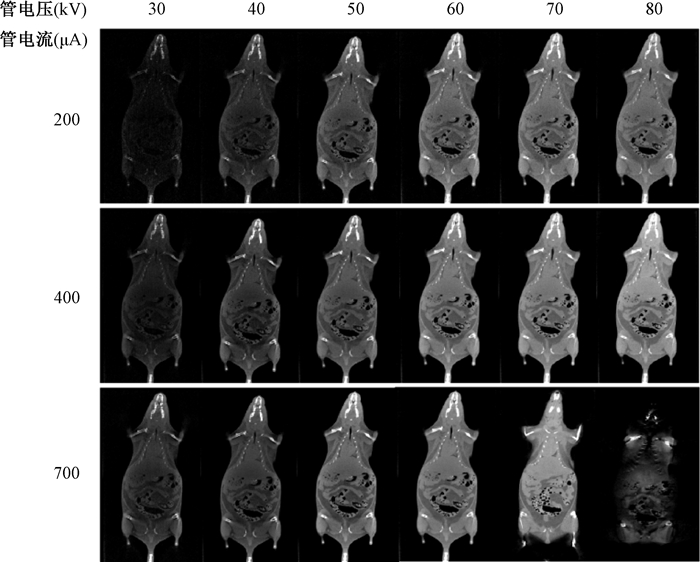
|
图 5 小鼠重建图像 Figure 5 Reconstructed image of a mouse |
3. 空间分辨力测试:重建图像表明,该系统具备对不同体积动物的成像能力,且可保证图像质量。由于大鼠轴向长度较长,单次扫描最大FOV无法覆盖整体结构,故采用轴向多床位扫描与图像拼接策略实现成像(图 6A)。小鼠的重建图像证实,系统具备空间分辨力灵活调节能力,操作者可在设定范围内选择任意FOV重建不同空间分辨力图像,满足特定实验需求(图 6B-D)。

|
图 6 不同视野大鼠脑三维重建图A. 80 mm(图像拼接); B. 80 mm; C. 60 mm; D. 40 mm Figure 6 3D reconstruction of rat brain with different FOV A. 80 mm (image stitching); B. 80 mm; C. 60 mm; D. 40 mm |
选择0.03 mm厚度的铅箔,能够测量的范围是1.5~30 LP/mm,CBCT的管电压设置为70 kV,管电流为600 μA。结果如表 1所示,FOV最小为39.6 mm,对应空间分辨力为35.7 μm,最大为108.0 mm,对应空间分辨力为71.4 μm。
|
|
表 1 线对卡测试的实际性能参数 Table 1 Actual performance parameters of rectangular wave test card |
讨论
如今小动物CBCT设备(如MiLabs U-CT和Bruker SkyScan[11-12])虽然都具备较高空间分辨力和较大视野范围,但仍难以满足临床前研究中多尺度生物样本的精准成像需求。为有效解决这一问题,本研究选用30 μm焦斑X射线源和100 μm像素平板探测器,并提出“步进-调焦-旋转”的图像采集模式,开发出桌面式紧凑型可调空间分辨力CBCT。
在CBCT成像过程中,图像质量主要受到管电流、管电压两个参数的影响。本研究显示随着管电流升高,阴极发射电子数增多,意味着相同时间内有更多的X射线穿过小鼠被探测器接收,图像信噪比显著提高,细微结构更清晰,与张原生等[13]研究一致。管电压调控X射线能量:30 kV时低能射线被组织大量吸收,导致图像整体偏暗、结构缺失,与侯豹等[14]结果基本相符; 40~60 kV阶段射线穿透力增强,图像亮度、对比度及软组织细节显示逐步提升,噪声减小[15]; 70~80 kV阶段高能射线占比增加,小鼠骨骼因高能射线衰减差异显著而显像突出,但软组织对比度下降[16-17]。
成像实验中,CBCT对大鼠成像表现出极佳的完整性和清晰度,证明了该系统在成像质量上的高标准和可靠性。针对小鼠脑部成像,局部区域放大功能可清晰分辨大脑内部微小细节。需注意的是,图像清晰度伴随FOV缩小而提升,60 mm FOV时脑部图像质量显著优于80 mm FOV,同时比40 mm FOV扩展了视野范围,这表明在特定的实验条件下,对于不同的成像需求,需要在空间分辨力和FOV大小之间做出权衡。
空间分辨力作为CBCT核心性能参数,它决定了系统细节信息捕获能力与诊断准确性[18]。本研究采用楔形状线对卡作为评估工具[19],选取其投影图进行评估,最终得出系统的FOV为39.6~108 mm,对应空间分辨力范围为35.7~71.4 μm。
Melnyk和DiBianca[20]基于VRX探测器设计出可变分辨力的CBCT系统,其FOV可由32 cm减小到1 cm,探测器预采样MTF的截止频率从1.39 cycles/mm增加到43.38 cycles/mm。与本研究结果相比,该设计在FOV调节范围与空间分辨力提升方面更具优势,这主要归功于其独特的探测器结构设计,同样也带来一些无法避免的问题。首先,一维探测器由于成像面积的局限性会增加图像采集时间,易产生运动伪影; 其次,由于入射X射线的方向与探测器单元非垂直照射,会出现各晶体单元之间信号的串扰[21]; 最后,即使在装配精度极高的情况下两探测器夹角处也会出现缝隙,造成该区域检测不到X射线,又引发相邻两侧晶体单元信号衰减,引入中心点伪影从而降低图像质量。Lohrabian等[22]研发的可变分辨力锥形束mini-CT可实现FOV由43 cm至9 cm调节,空间分辨力从3.9周期/mm提升到14.4周期/mm,由于其成像过程中小动物始终处于旋转状态,会对小动物造成一定影响从而干扰图像质量,本研究成像模式有效弥补了这一缺陷。但受探测器尺寸限制以及射线源焦点到照射窗间距影响,在视野范围、极限空间分辨力方面存在一定差距,这也为下一步的改进指明了方向。
综上所述,本研究通过对射线源及探测器选型,并提出“步进-调焦-旋转”的图像采集模式,成功研制出具备可调空间分辨力特性的CBCT系统。现代医学研究中,正电子发射计算机断层显像(PET)作为分子影像学核心技术,在临床诊断、药物开发以及生物医学工程等领域发挥着越来越重要的作用[23]。然而,如何有效地将可调空间分辨力CT的解剖数据与PET分子信息进行动态配准融合,构建多模态影像协同机制,是未来一个充满挑战的研究方向。
利益冲突 无
作者贡献声明 李盈旭负责方案设计、实施研究、分析数据和论文撰写; 徐希龙负责方案设计、实施研究; 张延海负责分析数据; 付信磊、林伟、陈宇负责采集数据; 高峰、程阳、李成强协助论文修改; 卢洁指导论文修改
| [1] |
Holdsworth DW, Thornton MM. Micro-CT in small animal and specimen imaging[J]. Trends Biotechnol, 2002, 20(8): S34-S39. DOI:10.1016/s0167-7799(02)02004-8 |
| [2] |
Zikmund T, Novotná M, Kavková M, et al. High-contrast differentiation resolution 3D imaging of rodent brain by X-ray computed microtomography[J]. J Instrum, 2018, 13(2): C02039. DOI:10.1088/1748-0221/13/02/C02039 |
| [3] |
Stokes K, Thieme R, Jennings E, et al. Cone beam computed tomography in dentistry: practitioner awareness and attitudes. A scoping review[J]. Aust Dent J, 2021, 66(3): 234-245. DOI:10.1111/adj.12829 |
| [4] |
Yester MV, Barnes GT. Geometrical limitations of computed tomography(CT)scanner resolution[C]. Boston: Application of Optical Instrumentation in Medicine VI, 1977.
|
| [5] |
Heckert M, Enghardt S, Bauch J. X-Ray white beam interferences on thin crystals[J]. Cryst Res Technol, 2021, 56(10): 2100085. DOI:10.1002/crat.202100085 |
| [6] |
Kapshe N, Pujar M, Jaiswal S. Cone beam computed tomography: a review[J]. Int J Oral Health Dent, 2020, 6(2): 71-77. DOI:10.18231/j.ijohd.2020.017 |
| [7] |
Clark DP, Badea CT. Advances in micro-CT imaging of small animals[J]. Phys Med, 2021, 88: 175-192. DOI:10.1016/j.ejmp.2021.07.005 |
| [8] |
Zhu S, Tian J, Yan G, et al. Cone beam micro-CT system for small animal imaging and performance evaluation[J]. Int J Biomed Imaging, 2009, 2009: 960573. DOI:10.1155/2009/960573 |
| [9] |
Bartling SH, Stiller W, Semmler W, et al. Small animal computed tomography imaging[J]. Curr Med Imaging, 2007, 3(1): 45-59. DOI:10.2174/157340507779940327 |
| [10] |
李盈旭. 可调空间分辨率小动物锥形束CT(CBCT)的研制[D]. 临沂: 临沂大学, 2023. Li YX. Development of cone beam CT (CBCT) for small animals with adjustable spatial resolution[D]. Linyi: Linyi University, 2023. |
| [11] |
Aalbersberg EA, de Wit-van der Veen BJ, Zwaagstra O, et al. Preclinical imaging characteristics and quantification of Platinum-195m SPECT[J]. Eur J Nucl Med Mol Imaging, 2017, 44(8): 1347-1354. DOI:10.1007/s00259-017-3643-2 |
| [12] |
O' Neill M, Huang GO, Lamb DJ. Novel application of micro-computerized tomography for morphologic characterization of the murine penis[J]. J Sex Med, 2017, 14(12): 1533-1539. DOI:10.1016/j.jsxm.2017.10.065 |
| [13] |
张原生, 王晓成, 郭子泉, 等. 数字乳腺X射线摄影中管电流量优化的实验研究[J]. 中华放射医学与防护杂志, 2022, 42(2): 144-149. Zhang YS, Wang XC, Guo ZQ, et al. Experimental study on optimization of mAs indigital mammography[J]. Chin J Radiol Med Prot, 2022, 42(2): 144-149. DOI:10.3760/cma.j.cn112271-20210816-00327 |
| [14] |
侯豹, 黄术兵, 韩佩宇, 等. 应用Micro-CT对小鼠全身脂肪扫描成像研究[J]. 分子影像学杂志, 2024, 47(2): 111-117. Hou B, Huang SB, Han PY, et al. Application of Micro-CT in whole-body fat scanning imaging of mice[J]. J Mol Imaging, 2024, 47(2): 111-117. DOI:10.12122/j.issn.1674-4500.2024.02.01 |
| [15] |
刘雨欣, 陈凡秀, 孙洁, 等. 管电压管电流和开机时间对CT图像质量的影响[J]. 实验力学, 2024, 39(1): 17-26. Liu YX, Chen FX, Sun J, et al. Influence of tube voltage tube current and boot time on CT image quality[J]. J Exp Mech, 2024, 39(1): 17-26. DOI:10.7520/1001-4888-23-041 |
| [16] |
朱蕾, 刘云福, 康天良, 等. 低管电压扫描技术在CT泪囊造影成像中的应用研究[J]. 中华放射医学与防护杂志, 2021, 41(3): 212-216. Zhu L, Liu YF, Kang TL, et al. Study of the application of low tube potemtial scanning in dacryocystography CT[J]. Chin J Radiol Med Prot, 2021, 41(3): 212-216. DOI:10.3760/cma.j.issn.0254-5098.2021.03.010 |
| [17] |
Saidu AM, Garba I, Abba M, et al. Evaluation of image quality and radiation dose in computed tomography urography following tube voltage optimisation[J]. Radiography (Lond), 2024, 30(1): 301-307. DOI:10.1016/j.radi.2023.11.023 |
| [18] |
Anam C, Fujibuchi T, Budi WS, et al. An algorithm for automated modulation transfer function measurement using an edge of a PMMA phantom: Impact of field of view on spatial resolution of CT images[J]. J Appl Clin Med Phys, 2018, 19(6): 244-252. DOI:10.1002/acm2.12476 |
| [19] |
郭智敏, 倪培君. CT系统空间分辨率测试方法研究进展[J]. 兵器材料科学与工程, 2010, 33(2): 113-117. Guo ZM, Ni PJ. Research on assessment techniques for CT system ' s spatial resolution[J]. Ordnance Mater Sci Eng, 2010, 33(2): 113-117. DOI:10.3969/j.issn.1004-244X.2010.02.031 |
| [20] |
Melnyk R, DiBianca FA. Modeling and measurement of the detector presampling MTF of a variable resolution X-ray CT scanner[J]. Med Phys, 2007, 34(3): 1062-1075. DOI:10.1118/1.2436977 |
| [21] |
Arabi H, Asl AR, Ay MR, et al. Novel detector design for reducing intercell x-ray cross-talk in the variable resolution x-ray CT scanner: a Monte Carlo study[J]. Med Phys, 2011, 38(3): 1389-1396. DOI:10.1118/1.3555035 |
| [22] |
Lohrabian V, Kamali-Asl A, Hossein A, et al. Design and construction of a variable resolution cone-beam small animal mini-CT prototype for in vivo studies[J]. Radiat Phys Chem, 2019, 162: 199-207. DOI:10.1016/j.radphyschem.2018.10.019 |
| [23] |
Liu Q, Li C, Liu J, et al. Performance evaluation of a small-animal PET/CT system based on NEMA NU 4-2008 standards[J]. Med Phys, 2021, 48(9): 5272-5282. DOI:10.1002/mp.15088 |
 2025, Vol. 45
2025, Vol. 45


