2. 胜利油田中心医院放射科, 东营 257034;
3. 青岛大学附属医院放疗科, 青岛 266000;
4. 河北省人民医院肿瘤科, 石家庄 050051;
5. 安徽大学电气工程与自动化学院, 合肥 230039
2. Department of Radiology, Shengli Oilfield Central Hospital, Dongying 257034, China;
3. Department of Radiology, Affiliated Hospital of Qingdao University, Qingdao 266000, China;
4. Department of Oncology, Hebei Provincial People's Hospital, Shijiazhuang 050051, China;
5. School of Electrical Engineering and Automation, Anhui University, Hefei 230039, China
125I放射性粒子植入近距离治疗恶性肿瘤,以其局部剂量高、控制率高和微创安全等特点,在临床上应用越来越广泛[1-2]。在欧美等国家,已经成为前列腺癌的标准治疗[1]。近20年来,其在国内应用的领域逐步扩展到几乎全身各部位恶性肿瘤,特别是在胶质瘤方面,作为一种挽救性治疗手段,应用于切除后/放疗后进展性或复发性患者,临床疗效显著[2]。据统计,国内接受125I放射性粒子治疗的患者以每年30%的速度递增,为规范临床诊疗,2017年国家卫健委医政司发布了相关临床应用规范和质量控制指标[3-4]。然而,125I放射性粒子的治疗靶区和剂量学规划都是参照外放疗的理论体系,甚至治疗的关键工具放射治疗计划系统(treatment planning system, TPS)也是基于外放疗理论。如何明确内放疗和外放疗的生物学机制区别、探讨125I放射性粒子的独特生物学机制,已成为当前研究的热点。125I放射性粒子体外细胞实验是其机制研究的重要方法,而体外实验模型的设计近年来并无明显进展。现有体外实验模型在剂量计算及剂量分布均一性方面、特定剂量设定等方面仍有待改进。本研究建立了应用TPS及3D打印技术联合设计新型放射性粒子体外实验照射模型,应用于小鼠胶质瘤细胞等剂量内外放疗对比研究,并取得了初步研究结果,报道如下。
材料与方法1.材料与设备:125I放射性粒子为天津赛德生物制药有限公司生产,大小为0.8 mm × 4.5 mm,镍钛合金包壳,活度为3.7 × 107 Bq半衰期59.6 d,射线能量31.4 keV。放射性粒子组织间治疗计划系统(TPS)为北京启麟科技有限公司V4.72版本。3D打印设备由山东卓业医疗科技有限公司提供的RSPro 600 3D打印机。外放疗设备为美国Varian-23EX加速器。单光子发射计算机体层成像(SPECT)/CT设备为德国西门子Symbia T16 SPECT/CT仪。
2. 125I放射性粒子体外照射模型的建立
(1) 模型大小设计:根据实验要求可设计不同大小、形状的实验模板,本研究以直径100 mm培养皿为靶工具目标展开研究。
(2) 模型剂量计算:不同体外实验要求的剂量率及累计照射剂量不同,参照临床常规外照射剂量为2 Gy/次,本研究剂量设定粒子照射模型24 h累计吸收剂量为200 cGy。计算初始剂量率为200 cGy/24 h= 8.3 cGy/h。计算实际吸收剂量=初始剂量率× 1.44 ×粒子半衰期×照射时间= 8.3× 1.44 × 59.4 × 24= 17 107.2 cGy≈171 Gy。即表示模型达到初始剂量率8.3 cGy/h所需模型区域内细胞实际吸收剂量为171 Gy。125I放射性粒子半衰期长,实验照射为72 h内,粒子活度衰减极小,实验时间内可认定粒子活度、剂量率恒定,1.44为单粒子源空气比释能率。
(3) TPS模型设计:以直径为100 mm的圆形培养皿为实验靶工具,在TPS系统中勾画与培养皿大小等同的直径100 mm的靶区。设置粒子活度3.7 × 107 Bq,参照临床实际操作于圆形模板内10 mm等间距设计粒子植入纵线共11列。粒子位置根据圆形靶区边界,均匀分布于各纵行内,粒子间距5 ~ 10 mm不等,粒子分布尽量对称、均匀。最终达到171 Gy等剂量曲线覆盖距离粒子5 mm层面,以此得出所需粒子数量及粒子位置。应用TPS验证等剂量曲线均匀,细胞平面上各个点的辐射剂量分布差异<10%(图 1)。

|
注:TPS. 治疗计划系统 图 1 TPS模型设计图示粒子位置及等剂量曲线 Figure 1 Diagram showing radioactive seed positions and isodose curves of the model designed using a TPS |
(4) 3D模型打印:将TPS所得粒子分布模型应用3D打印系统软件设计打印模型图形。每个粒子位置设置粒子凹槽。粒子凹槽大小与放射性粒子大小等同,使粒子可完全固定于凹槽内。圆形模型四周设置4个高5 mm支撑架以固定培养皿至粒子层面距离。模型应用RSPro 600 3D打印设备采用立体光刻成型(SLA)技术完成模型打印,打印材料采用光敏树脂材料。粒子置于凹槽内,上方无封闭及遮挡,不会造成射线的遮挡及剂量减退。
(5) 模型剂量验证:将放射性粒子装入制作好的模型内,将模型置于SPECT/CT扫描床行常规扫描,观察模型内射线照射均匀性、有无明显冷区。
3.体外细胞内外放疗机制对比研究
(1) 动物模型制作:选用GL261小鼠胶质瘤细胞系为实验对象,铺设于100 mm培养皿(美国Corning公司)中进行实验,接种密度为106个/皿。待细胞密度达到80% ~ 85%后进行照射实验,每组3个重复。
(2) 分组实验:分为对照组(Control)、外放疗组(EBRT)及内放疗组(BT)。对照组细胞不接受任何照射治疗。外放疗组将培养皿置于Varian-23EX加速器,单次照射剂量2 Gy,1次/d。内放疗组将培养皿置于装载放射性粒子的模型上方支撑架上,照射时间24 h,累计照射剂量2 Gy。为了使细胞接受均匀照射,照射一半时间之后,可旋转培养皿,让细胞受到的照射剂量分布更加均匀。各组细胞分别设置2、4和6 Gy亚组进行不同剂量对比研究。
(3) 实验室检测
① 细胞活力检测:通过测量CCK确定细胞存活率。具体地,辐照后的细胞消化后接种到96孔板(美国Corning公司)中,接种密度为5 000个/孔,每组3个重复。待培养箱培养24 h后,吸取原有培养基,加入含10% CCK8的完全培养基,孵育1 h。用微孔板分光光度计在570 nm处测量溶液的吸光度(A)值,A值与细胞活力呈正相关。
② 细胞增殖检测:通过克隆形成实验确定细胞增殖情况。具体地,辐照后的细胞消化后接种到6孔板(美国Corning公司)中,接种密度为1 000个/孔,每组3个重复。在37℃、5% CO2环境下孵育12 d,待对照组细胞集落形成,使用显微镜观察细胞克隆的形成情况,并记录克隆的数量。
③ 细胞内ROS的氧化应激检测:辐射后的细胞即刻检测ROS水平,加入10 μmol/L DCF-DA,37℃孵育30 min,通过荧光显微镜及流式细胞仪检测分析,每组3个重复。
4.统计学处理:采用SPSS 24.0对实验数据进行统计分析。计量资料经正态性检验符合正态分布采用x±s表示。两组间的比较采用独立样本t检验,多组别间的比较采用One-Way ANOVA单因素方差分析。P < 0.05为差异有统计学意义。
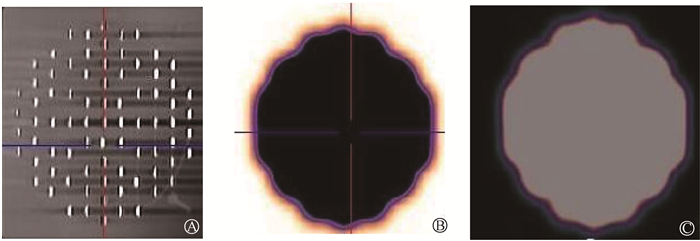
结果1.模型制作情况:放射性粒子体外照射实验模型设计和制作顺利,将放射性粒子装入制作好的模型内,将模型置于SPECT/CT扫描床行常规扫描,观察模型内射线照射均匀性良好,验证模型内放射性分布均匀、无明显冷区(图 2,3),后续等待进行照射实验。

|
注:数字1~11为粒子位置纵列序数 图 2 放射性粒子体外实验照射模型3D打印实物图 Figure 2 3D-printed physical model for experiments on in vitro irradiation with radioactive seeds |
|
图 3 放射性粒子体外实验照射模型SPECT/CT扫描验证图 A. SPECT/CT扫描显示模版及粒子位置图像;B.模版内射线放射性分布图,模版内射线均匀、无明显冷区;C. 图B的镜像显示图 Figure 3 SPECT/CT validation of the model for experiments on in vitro irradiation with radioactive seeds A. SPECT/CT showing the model and radioactive seed positions; B. Diagram showing the radioactive distribution of rays within the model, evealing uniform radiation with no significant cold spots; C. Mirror image of B |
2.细胞实验结果
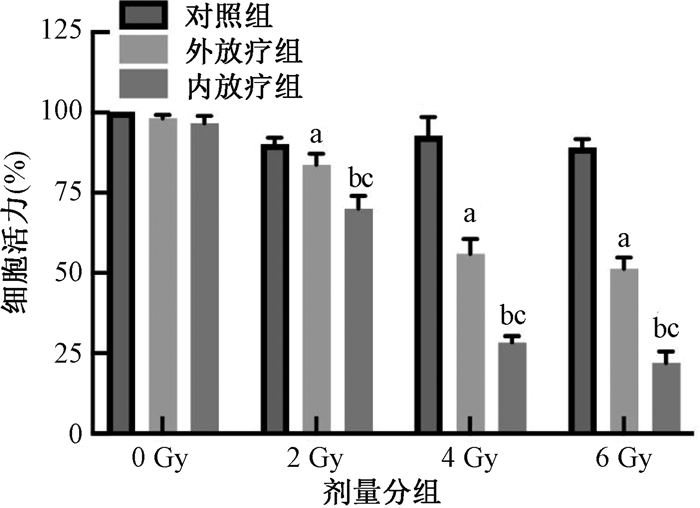
(1) CCK-8细胞活力检测结果:随着照射剂量增加,两组接受放射治疗的细胞其细胞活性逐渐降低;其中同等照射剂量下,内放疗组细胞活性明显低于外放疗组,提示同等剂量下放射性粒子内放疗可显著抑制胶质细胞瘤活性。具体地,与对照组(90% ± 1.33%)相比,2 Gy照射剂量下外放疗组和内放疗组细胞活性轻度降低,以内放疗组降低最为显著(83.67%± 2.44% vs. 70.00% ± 2.67%, t= 4.45, P < 0.05);随剂量增加,4和6 Gy照射剂量下外放疗组和内放疗组细胞活性明显降低,其中仍以内放疗组降低最为显著(4 Gy: 51.33% ± 2.44% vs. 28.33% ± 1.56%, t = 9.52, P < 0.05; 6 Gy: 51.33% ± 2.44% vs. 22.00% ± 2.67%,t = 10.94, P < 0.05,图 4)。考虑到外放疗组细胞活力在6 Gy时达50%左右,后续实验研究均应用6 Gy照射剂量进行。
|
注:a对照组比较,t =-2.71、-14.84、-8.54, P < 0.05; b与对照组比较,t =-7.75、-17.92、-10.94, P < 0.05;c与外放疗组比较,t =-4.45、-9.52、-25.95, P < 0.05 图 4 CCK-8检测不同剂量照射下内、外放疗对GL261细胞活力的影响 Figure 4 CCK-8-assayed impacts of BT and EBRT on GL261 cell viability at different radiation doses |
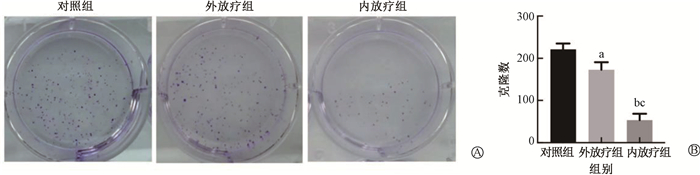
(2) 细胞克隆实验检测结果:与对照组(211.00 ± 10.67)相比,6 Gy照射剂量下外放疗组和内放疗组细胞克隆数目明显降低;其中,以内放疗组细胞克隆数目降低最为显著(EBRT组vs. BT组: 172.67 ± 13.11 vs. 53.67 ± 10.22, t = 8.73, P < 0.05)。克隆实验结果显示,内放疗具有更优异的细胞增殖抑制能力(图 5)。
|
注:与对照组比较,at =-3.65, bt =-14.17, P < 0.05; c与外放疗组比较,t =-8.73, P < 0.05 图 5 内、外放疗对GL261细胞增殖的影响 A.平板克隆;B.克隆数差异分析 Figure 5 Impacts of BT and EBRT on GL261 cell proliferation A. Colony formation on a plate; B. Analysis of differences in clone counts |
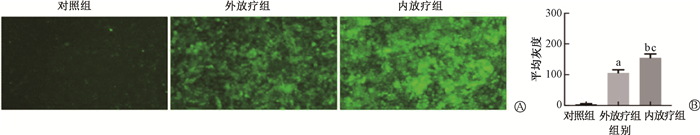
(3) ROS含量测定结果:ROS生成作为放射治疗的主要作用机制,准确地评估其生成能力,对于验证内外放疗的效率具有重要意义。采用荧光显微镜和流式细胞仪对GL261在6 Gy照射剂量下ROS的产生水平进行检测。荧光显微镜检测结果显示,与对照组(平均灰度值:3.73 ± 1.33)相比,外放疗组及内放疗组荧光强度明显增强;其中内放疗组荧光强度显著高于外放疗组(EBRT组vs. BT组:102.52 ± 6.87 vs. 144.81 ± 6.01, t = -5.26, P < 0.05,图 6)。该部分结果显示,内放疗能诱导胶质瘤细胞产生更多ROS,从而具有更高的胶质瘤细胞杀伤潜力。
|
注:与对照组比较,at = 17.31, bt=20.48, P < 0.05;c与外放疗组比较,t =5.26, P < 0.05 图 6 内、外放疗对GL261细胞内ROS水平的影响 A.ROS的荧光图;B.平均灰度统计分析 Figure 6 Impacts of BT and EBRT on the level of ROS in GL261 cells A. Fluorescence image of ROS; B. Statistical analysis of mean gray scale values |
讨论
目前,125I粒子植入已广泛应用非小细胞肺癌、胰腺癌等各种实体肿瘤的治疗,同时作为一种有效的挽救性治疗逐步应用于脑胶质瘤、脑转移瘤等颅内肿瘤[5]。Yang等[6]对比研究证实,放射性粒子植入治疗肺癌脑转移瘤的局部控制率优于外照射治疗。射线治疗肿瘤的主要作用机制包括诱导DNA的损伤、抑制细胞修复,诱导细胞凋亡等。外放疗的生物学效应已通过大量基础研究明确,放疗后肿瘤细胞的变化、放疗抵抗机制、放疗增敏等实验研究也已广泛开展。125I放射性粒子内放射治疗的优势在于小剂量长时间持续照射、靶区累计照射剂量高而周围正常组织损伤小。由于缺乏内外放射治疗对比研究,125I放射性粒子治疗的处方剂量、靶区划定等TPS治疗策略仍是参考外放射治疗体系进行制定。国内外大量的临床实践中发现内放疗和外放疗在生物学和物理学方面均存在根本的不同。在脑胶质瘤放射性粒子治疗研究中,即使把靶区扩大到高级别脑胶质瘤可见边界的外1 cm,把处方剂量逐渐提高到超过外放疗的极限量,超过常见肿瘤放射治疗的根治量,即使达到90~210 Gy,仍然是安全的,脑水肿的远期发生率 < 1.5%,并未出现严重的脑坏死[7-8]。内放疗和外放疗作用于肿瘤的生物学机制有什么不同,如何建立一种工具方法去研究,已成为当前绕不开的科学问题。
体外照射实验是研究125I放射性粒子生物学特性的重要方法。近年来放射性粒子照射模型设计无明显进展,虽然不同研究模型设计采用培养皿及介质各有区别,但放射性粒子布源均按照曼特斯特系统进行设计[9]。Ma等[10]多项国内研究亦采用此方法设计圆形模型开展实验。该模型设计将1颗放射性粒子置于直径60 mm的石蜡圆盘中心,8颗放射性粒子均匀置于直径35 mm的圆周中,实验时在125I粒子辐照模型上放置35 mm培养皿进行照射研究。该模型的优点是制作简单、操作简便。然而其采用培养皿较小,单次照射细胞数量较少,难以高效满足实验需求。因模型粒子数量较少,细胞累计接受2和4 Gy剂量的照射时间分别达44和92 h,培养时间过长。多项研究显示,肿瘤细胞累计接受放射性粒子4 Gy以上照射方可明显抑制细胞增殖、促进细胞凋亡[5]。而此模型累计达到所需剂量需要时间过长,同时该模型放射性粒子与细胞之间间隔多层培养皿壁,大大增加了射线的衰减,这些因素进一步增加了实验的难度及剂量误差率。
本研究采用剂量模拟方法,充分发挥TPS计划系统优势,应用计算机系统进行剂量设定、粒子分布设计、剂量均匀性验证,打破固有体外实验设计方法开展新型模型设计。参照外照射常规剂量,设定模型24 h累计剂量2 Gy,确定初始剂量率为8.3 cGy/h,根据TPS公式计算实际吸收剂量。同时根据实验要求确定模型大小,应用TPS计划系统计算模板范围内达到实际吸收剂量所需的放射性粒子数目及位置,均匀布源的同时,有效缩短了照射时间,精确了照射剂量。24 h累积剂量2 Gy的设定,与外放疗常规剂量对等,提高了内外放疗对比实验的合理性及均衡性。应用本研究的模型设计,72 h即可达到累计6 Gy的吸收剂量,而72 h内放射性粒子的衰变极为微弱,基本可认为粒子活度及平均剂量率无明显改变。近年来随着3D打印技术在医疗领域应用和推广,高精度模型已广泛应用于125I放射性粒子植入治疗中[11-12]。本研究所设计放射性粒子体外照射模型,因所需粒子数目较多,TPS设定粒子位置及间距离要求绝对严格以避免冷区的形成,应用3D打印技术可完美实现模型制作的精确性。本研究所设计的新模型弥补了既往模型剂量衰减大、照射时间长、吸收剂量误差大的缺点,达到了精准等剂量对比体外照射的目的。新模型的缺点在于剂量率较高,所需放射性粒子数量较多、费用较大。后续可根据培养皿大小、形状不同,设计相应大小和形状的照射模型,减少放射性粒子使用数目的同时,满足不同实验的要求。
既往开展的125I放射性粒子相关的基础实验已经证实了其治疗恶性肿瘤的部分生物学机制。Siddiqi等[13]发现125I放射性粒子降低了细胞的增生能力,与细胞增生正相关的指标明显下降。国内学者通过多项体外照射实验及裸鼠移植瘤体内照射实验,从蛋白水平证明了125I放射性粒子近距离照射可以通过上调Caspase-9、Bax基因并抑制Bcl-2的表达起到促进肿瘤细胞凋亡的作用,还可降低移植瘤组织VEGF的表达,并在蛋白质、mRNA水平降低移植瘤组织HIF-1α的表达[14-15]。125I放射性粒子可以有效治疗进展性或复发性高级别胶质瘤。Wang等[2, 16]多项研究显示,放射性粒子植入可有效控制胶质瘤生长,延长生存时间,部分肿瘤明显缩小后可获得二期根治性切除的机会。然而,125I放射性粒子植入治疗脑胶质瘤的确切作用机制及其生物学效应尚未明确,个别基础研究仅初步验证了其在细胞增殖和凋亡方面的影响[17],尚无深层次的机制研究。与外放疗的等剂量对比研究,亦少见报道。本研究根据实际临床需求,采用GL261细胞系进行初步的体外细胞等剂量内外放疗对比研究。通过2、4、6 Gy不同剂量的对比研究发现,随着照射剂量增加,内放疗组和外放疗组细胞CKK8活性逐渐降低;同等照射剂量下,内放疗组细胞活性明显低于外放疗组,体现了内放疗小剂量长时间照射显著抑制胶质细胞瘤活性的优势。在同等6 Gy照射剂量下,内放疗组细胞克隆数目明显低于外放疗组,验证了内放疗在抑制胶质细胞增殖方面的优势。ROS作为放射治疗的主要作用机制,本研究结果显示在同等6 Gy照射剂量下,内放疗组ROS含量显著高于外放疗组。这些研究结果证实了放射性粒子持续照射在降低细胞活性、抑制细胞增殖、增加细胞ROS含量等方面优于外照射治疗,从一定程度上解释了放射性粒子治疗脑胶质瘤的机制及与外放射治疗对比的优势。同时也验证了应用新型放射性粒子体外实验照射模型进行等剂量内外放疗对比研究的合理性及可行性。
本研究初步研究结果证实了新型模型的合理性及实验设计的可行性。同时体外细胞实验研究结果明确了放射性粒子内放疗与外放疗在细胞活性和增殖ROS含量等方面的差异,初步验证了内外放疗的区别,为进一步开展等剂量内外放疗对比研究提供了实验依据及研究方向。
利益冲突 本研究中全体作者未接受相关公司的任何赞助,不涉及任何不正当利益和冲突
作者贡献声明 李学达、田川负责实验操作和撰写论文;王文斐、姜鹏、张宏涛、王从晓负责协助实验和论文修改;刘士锋、胡效坤、李腾指导实验设计和论文修改
| [1] |
Zhang W, Li J, Li R, et al. Efficacy and safety of iodine-125 radioactive seeds brachytherapy for advanced non-small cell lung cancer-A meta-analysis[J]. Brachytherapy, 2018, 17(2): 439-448. DOI:10.1016/j.brachy.2017.11.015 |
| [2] |
Wang C, Liu S, Peng L, et al. Permanent iodine-125 brachytherapy for patients with progressive or recurrent high-grade gliomas[J]. BMC Cancer, 2020, 20(1): 591. DOI:10.1186/s12885-020-07086-8 |
| [3] |
中国医师协会放射性粒子治疗技术专家委员会, 中国抗癌协会肿瘤微创治疗专业委员会粒子治疗分会. 放射性粒子植入治疗技术管理规范(2017年版)[J]. 中华医学杂志, 2017, 97(19): 1450-1451. Chinese Medical Doctor Association radioactive particle therapy technical expert committee, Chinese Anti-Cancer Association Minimally invasive tumor therapy Committee Particle Therapy branch. Technical management code for radioactive particle implantation therapy(2017 edition)[J]. Nat Med J China, 2017, 97(19): 1450-1451. DOI:10.3760/cma.j.issn.0376-2491.2017.19.004 |
| [4] |
中国医师协会放射性粒子治疗技术专家委员会, 中国抗癌协会肿瘤微创治疗专业委员会粒子治疗分会. 放射性粒子植入治疗技术临床应用质量控制指标(2017年版)[J]. 中华医学杂志, 2017, 97(19): 1452-1454. Chinese Medical Doctor Association Radioactive Particle Therapy Technical Expert Committe, Chinese Anti-Cancer Association Minimally Invasive Tumor Therapy Committee Particle Therapy Branch. Quality control index of clinical application of radioactive particle implantation therapy(2017 edition)[J]. Nat Med J China, 2017, 97(19): 1452-1454. DOI:10.3760/cma.j.issn.0376-2491.2017.19.005 |
| [5] |
Liu Y, Jiang P, Zhang H, et al. Safety and efficacy of 3D-printed templates assisted CT-guided radioactive iodine-125 seed implantation for the treatment of recurrent cervical carcinoma after external beam radiotherapy[J]. J Gynecol Oncol, 2021, 32(2): e15. DOI:10.3802/jgo.2021.32.e15 |
| [6] |
Yang L, Wang C, Zhang W, et al. Iodine-125 brachytherapy treatment for newly diagnosed brain metastasis in non-small cell lung cancer: A biocentric analysis[J]. Front Oncol, 2022, 12: 1005876. DOI:10.3389/fonc.2022.1005876 |
| [7] |
Hu X, Qiu H, Zhang L, et al. Recurrent gliomas: comparison of computed tomography (CT)-guided 125I seed implantation therapy and traditional radiochemotherapy[J]. Cancer Biol Ther, 2012, 13(10): 840-847. DOI:10.4161/cbt.20834 |
| [8] |
胡效坤, 张福君, 肖越勇. CT介入治疗学[M]. 2版. 北京: 人民卫生出版社, 2012. Hu XK, Zhang FJ, Xiao YY. CT guided interventional therapy[M]. 2nd ed. Beijing: People's Medical Publishing House, 2012. |
| [9] |
Paterson R, Parker H. A dosage system for gamma ray therapy. 1934[J]. Br J Radiol, 1995, 68(808): H60-100, H59. DOI:10.1259/0007-1285-68-808-H60 |
| [10] |
Ma JX, Jin ZD, Si PR, et al. Continuous and low-energy 125I seed irradiation changes DNA methyltransferases expression patterns and inhibits pancreatic cancer tumor growth[J]. J Exp Clin Cancer Res, 2011, 30(1): 35. DOI:10.1186/1756-9966-30-35 |
| [11] |
中华医学会放射肿瘤治疗学分会, 中国医师学会放射治疗专业委员会, 中国研究型医院放射治疗专业委员会, 等. 3D打印模板辅助CT引导放射性125I粒子植入治疗肿瘤专家共识[J]. 中华放射医学与防护杂志, 2017, 37(3): 161-170. The Society of Radiation Oncology of the Chinese Medical Association, Radiation Therapy Professional Committee of the Chinese Medical Doctor Association, China Research Hospital Radiation Therapy Professional Committee, et al. Expert consensus on 3D printing template assisted CT-guided radioactive 125I seed implantation branchtherapy[J]. Chin J Radiol Med Prot, 2017, 37(3): 161-170. DOI:10.3760/cma.j.issn.0254-5098.2017.03.001 |
| [12] |
Zhou G, Liu W, Zhang Y, et al. Erratum: An erratum on "Application of three-dimensional printing in interventional medicine"[J]. J Interv Med, 2020, 3(3): 156. DOI:10.1016/j.jimed.2020.06.001 |
| [13] |
Siddiqi SN, Provias J, Laperriere N, et al. Effects of iodine-125 brachytherapy on the proliferative capacity and histopathological features of glioblastoma recurring after initial therapy[J]. Neurosurgery, 1997, 40(5): 910-918. DOI:10.1097/00006123-199705000-00005 |
| [14] |
Li F, Xu J, Zhu Y, et al. Analysis of cells proliferation and microRNAs expression profile in human chondrosarcoma SW1353 cells exposed to Iodine-125 seeds irradiation[J]. Dose Response, 2020, 18(2): 1559325820920525. DOI:10.1177/1559325820920525 |
| [15] |
李洁清, 宋现让, 刘伟, 等. HIF-1α基因沉默对人肺癌放射敏感性及移植瘤生长的影响[J]. 中华放射医学与防护杂志, 2011, 31(6): 640-643. Li JQ, Song XR, Liu W, et al. Effect of HIF-1α siliencing on human lung cancer xenografts radiosensitivity in nude mice[J]. Chin J Radiol Med Prot, 2011, 31(6): 640-643. DOI:10.3760/cma.j.issn.0254-5098.2011.06.005 |
| [16] |
Wang C, Liu C, Chen J, et al. Effect of neoadjuvant iodine-125 brachytherapy upon resection of glioma[J]. BMC Cancer, 2022, 22(1): 397. DOI:10.1186/s12885-022-09504-5 |
| [17] |
Palle K, Vaziri C. Rad18 E3 ubiquitin ligase activity mediates Fanconi anemia pathway activation and cell survival following DNA Topoisomerase 1 inhibition[J]. Cell Cycle, 2011, 10(10): 1625-1638. DOI:10.4161/cc.10.10.15617 |
 2025, Vol. 45
2025, Vol. 45


