2. 中国计量科学研究院, 北京 100029;
3. 中日友好医院放射肿瘤科, 北京 100029
2. National Institute of Metrology of China, Beijing 100029, China;
3. Department of Radiation Oncology, China-Japan Friendship Hospital, Beijing 100029, China
电子近距离放射治疗(electronic brachytherapy, eBT)是一种癌症治疗技术,它利用与病灶紧密接触的X射线管产生低能X射线(≤ 50 keV)进行治疗。微型X射线管的最新发展催生了诸如德国Zeiss公司的INTRABEAM、美国iCAD公司的Xsoft Axxent等新型治疗系统。其中,INTRABEAM系统是目前临床常用的eBT系统[1]。除了其显著的医疗效益外,eBT的主要优势在于治疗过程的便捷性和高效性,且无需使用放射源。这种技术的单次治疗持续20~50 min,相当于传统外部放射治疗大约30次常规疗程的效果。INTRABEAM系统通过施源器与肿瘤直接接触,将约20 Gy的高剂量辐射精准照射在肿瘤床表面,而随着辐射深入,剂量迅速降低,从而有效保护了周围的健康组织。
INTRABEAM系统最初于20世纪90年代被开发出来,用于治疗脑肿瘤[2]。随着施源器的问世,该系统也被应用于其他医疗适应证。自1998年以来,它主要用于乳腺癌的术中放疗(intraoperative radiotherapy, IORT)[3]。目前,国内已有几十家医院引进了INTRABEAM系统,为患者提供精准且有效的治疗。然而,目前在使用eBT设备为患者提供规定剂量时,医学物理师大多依赖于制造商提供的数据库,而缺乏独立于制造商的剂量测定数据。剂量分布决定了辐射对肿瘤的杀伤力及对健康组织的保护程度,因此剂量准确测量是确保eBT安全性和疗效的关键。通过准确掌握其剂量分布特性,能够更有效地指导临床剂量规划,优化治疗效果,并减少对正常组织的损伤。本研究采用蒙特卡罗模拟和实验方法研究INTRABEAM系统的剂量特性,旨在为eBT的临床应用提供可靠的剂量参考依据。
材料与方法1.INTRABEAM系统及小型X射线源简介:INTRABEAM系统主要利用电子束打靶产生的轫致辐射X射线,用于治疗浅表肿瘤。该系统采用球形施源器确保剂量在各个方向上的均匀分布,其治疗深度为1.0~2.0 cm,照射直径范围为1.5~5.0 cm。治疗过程中,系统能够实现的最大剂量率为10 Gy/min[4]。INTRABEAM系统主要组成部件有小型X射线源、射线源控制台、光电二极管阵列、探头调节器和电离室容器、电离室等。
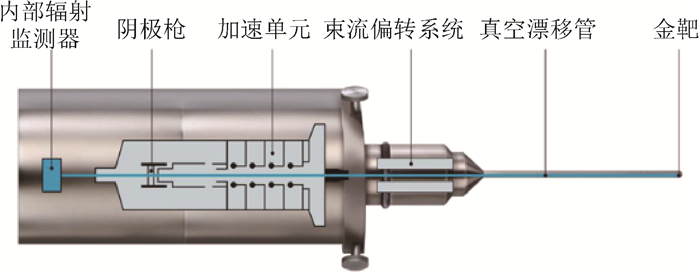
小型X射线源由内部辐射监测器、阴极枪、加速单元、束流偏转系统、真空漂移管和金靶组成,如图 1所示。其中X射线源是一个微型X射线发生装置,阴极枪产生的电子在40或50 kV的高压电场的作用下加速,经磁场控制的束流偏转系统对电子束位置进行精细微调[5]。随后,电子束经过10 cm长的真空漂移管,最终轰击漂移管半球形尖端。在尖端,电子与尖端金靶相互作用产生近似4π分布的X射线。
|
图 1 INTRABEAM系统小型X射线源 Figure 1 Compact X-rays Source of the INTRABEAM System |
2.蒙特卡罗模型建立:通过蒙特卡罗软件开展剂量特性研究,包括注量谱、半价层、百分深度剂量等模拟研究。首先构建了INTRABEAM系统小型X射线源真空漂移管模型、电子源模型和4 cm球形施源器的三维模型,详见下文介绍。其中光束的平均能量根据式(1)进行计算。此外,为了提高电子和光子传输的效率,并缩短跟踪电子所需的时间,调整了轫致辐射光子数的产生倍率以减少运算时间和减小方差。
| $ \bar{E}=\frac{\sum E_i I_i}{\sum I_i} $ | (1) |
式中,Ei为光子能量,keV;Ii为对应光子能量的注量,cm-2。
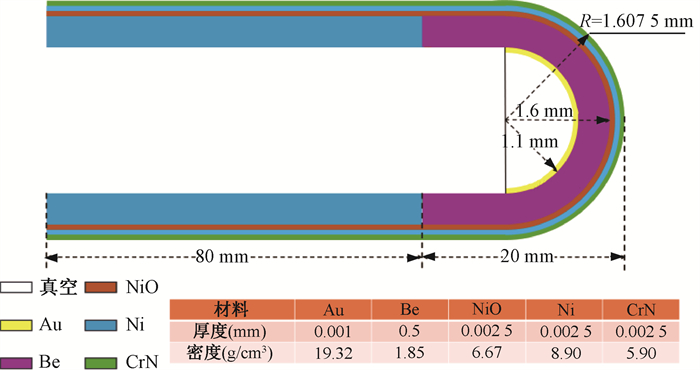
(1) 小型X射线源真空漂移管模型:小型X射线源真空漂移管的模型及其尺寸和材料如图 2所示。模拟过程涉及电子在真空漂移管中的运动,并对金靶进行轰击。真空漂移管采用圆柱形设计,顶端为半球形,管长100 mm,直径3.2 mm。漂移管后端80 mm的管壁由镍(Ni)材料构成,以提供磁场屏蔽和增强刚性,前段20 mm的管壁由金属铍(Be)构成,作为X射线出射窗口。漂移管尖端内部涂有1 μm厚的金靶[6],以确保最大程度地沉积电子能量,同时保持靶对光子的穿透性[7]。尖端半球形管壁的半径为1.1 mm,整个管壁最外侧涂有生物相容性材料,由内而外分别为NiO、Ni、CrN,每层厚度2.5 μm[8]。
|
图 2 小型X射线源真空漂移管模型的结构与材料 Figure 2 Structure and materials for modeling vacuum drift tubes for small X-ray sources |
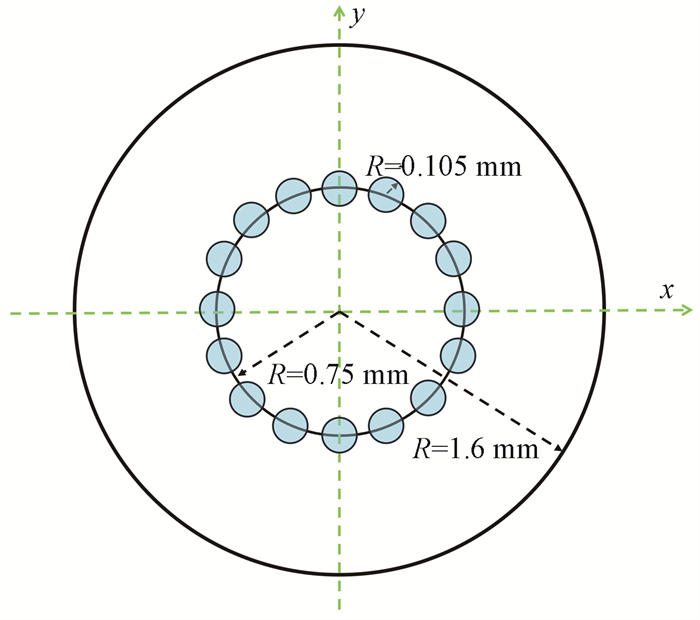
(2) 电子源模型:据Beatty等[5]、Yanch和Harte[9]的研究,轰击金靶的电子束能量分布接近高斯分布,围绕中心轴振荡,以优化辐射场的各向同性,这种振荡产生了16个轫致辐射焦点,这些焦点呈圆形且在光管尖端等距分布。Sievers等[10]通过针孔照相技术观测到了INTRABEAM系统X射线源的16个焦点。因此,在蒙卡模拟设置中,电子源模型如图 3所示。电子能量服从高斯分布,平均能量为50 keV,半高宽为5 keV,标准偏差为1.06 keV,用于模拟50 kVp条件下产生的X射线。
|
图 3 小型X射线源的电子源模型 Figure 3 Electron source modeling for small X-rays sources |
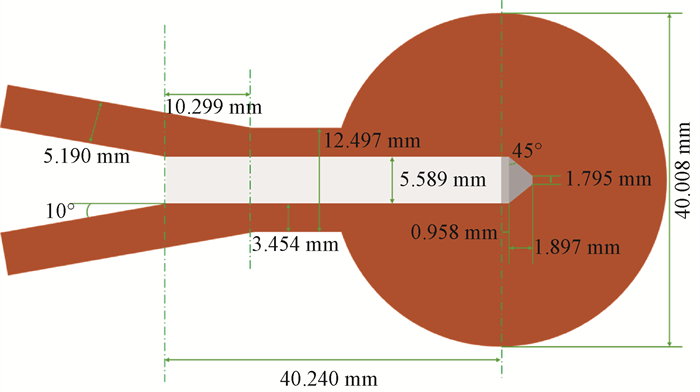
(3) 4 cm球形施源器模型:INTRABEAM系统可提供8种不同直径的球形施源器,其直径介于15~50mm之间,施源器的几何设计使其能够适用于多种不同的解剖部位,从而允许临床医生根据目标体积进行精确匹配[11]。特别是直径为4 cm的球形施源器在临床上广泛用于肿瘤切除术后的放射治疗,并且是TARGIT临床试验所采用的标准[12]。本研究选取了4 cm球形施源器为研究模型,并使用微型CT扫描仪对具体尺寸进行了测量[13]。其工作原理是通过X射线从多个角度扫描物体,生成详细的横截面图像,适用于测量物体内部和外部尺寸。施源器的材料是生物相容性热塑性树脂聚醚酰亚胺(C37H24O6N2),其密度为1.27 g/ cm3。重量百分比组成如下:H,0.040 821;C,0.749 918;N,0.047 272;O,0.161 99。球形施源器中心点与真空漂移管尖端中心点重合,球体内部包含一个直径约为5.6 mm的圆柱形空腔,腔内充满空气;顶部为一个高度约2 mm的截顶锥体,专为光管插入而设计。4 cm球形施源器的模型结构如图 4所示。
|
图 4 4 cm球形施源器模型结构图 Figure 4 Structure of the 4 cm spherical applicator model |
结果
1.真空漂移管和配置4 cm球形施源器注量谱:注量谱描述的是单位能量区间内,通过某一指定区域的粒子注量分布,反映了粒子在不同能量范围内的数量分布情况。使用蒙特卡罗软件分别对裸真空漂移管配置以及配备4 cm球形施源器的INTRABEAM源在空气中产生的注量谱进行模拟。在模拟裸真空漂移管配置的注量谱时,设置了一个半球壳型记录栅元,位于距离漂移管尖端3 cm处,厚度为1 mm。将能量记录范围设定为1~51 keV,粒子数为1×109。如图 5所示,裸真空漂移管配置下的注量谱的特征峰清晰可见,包括Au的3条L线特征峰,分别为9.8、11.5和13.5 keV,Ni元素的K线特征峰7.5和8.3 keV,以及Cr元素的K线特征峰5.4和6.0 keV。
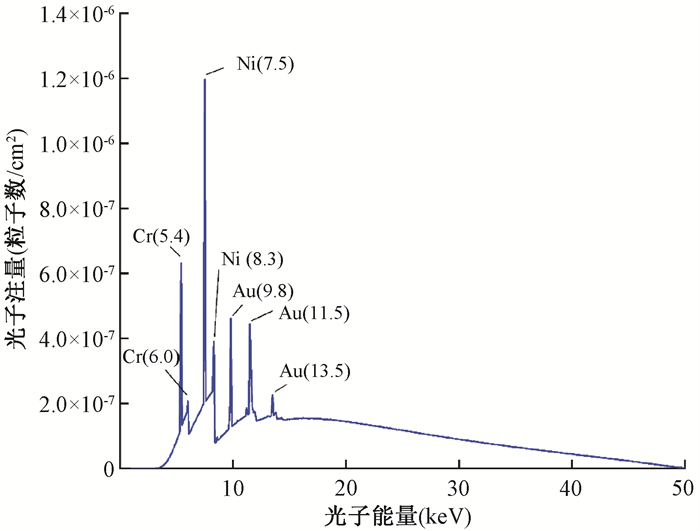
|
图 5 裸真空漂移管配置X射线的注量谱 Figure 5 Bare vacuum drift tube configuration for X-rays fluence specturm |
针对配备4cm球形施源器的注量谱,分别进行了轴向和径向的模拟计算。记录栅元紧贴施源器表面,其轴向记录栅元为圆柱型,半径为1.6 mm,厚度为1 mm。径向记录栅元为环带型,厚度为1 mm,宽度为2 mm。模拟结果示于图 6,轴向和径向的注量谱几乎相同。与裸漂移管配置下注量谱相比,4cm球形施源器配置下的注量谱仅显示出两个微小的特征峰,对应于Au的L线特征峰,分别为11.5和13.5keV。然而其轴向和径向的注量谱存在细微差异,这是由于光子沿光管轴向的衰减较小所致。实际上,衰减效应导致能谱变硬,即减少低能部分,相应的提升了高能部分的比例。因此模拟结果表明,径向的注量谱相较轴向来说平均能量更大。
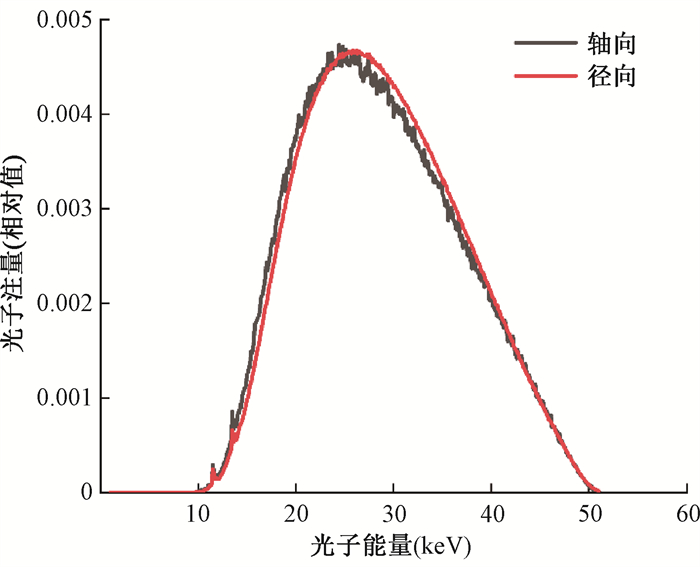
|
图 6 配备4 cm球形施源器X射线的轴向径向注量谱 Figure 6 Axial-radial fluence spectrum of X-rays with a 4 cm spherical sizer |
根据式(1)计算得到裸真空漂移管配置下的平均能量为20.8 keV。此外,对于4 cm球形施源器配备下,其轴向和径向的平均能量分别为28.7和29.0 keV,径向平均能量比轴向高1.0%。
2.X射线半价层:半价层可用于表征束线能量信息,通过模拟X射线在空气中经过不同厚度铝片的相对沉积能量变化来计算半价层。在模拟中,铝吸收片的半径为3 cm,放置在距离漂移管尖端15 cm的位置,其厚度变化从0.01 mm递增至0.50 mm。记录栅元呈圆柱形,半径为1.5 mm,厚度为1 mm,其尺寸与PTW23342电离室灵敏体积相匹配。通过对沉积能量曲线进行指数拟合,采用的拟合模型为ExpDec2,调整后的R2值为0.999 72,表明拟合效果极佳。计算得到裸漂移管配置下X射线在空气中的半价层为0.08 mm Al。该衰减曲线示于图 7。
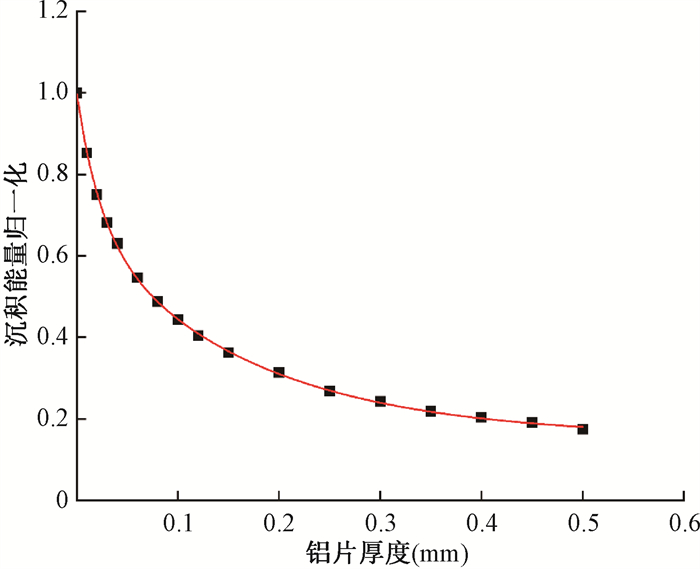
|
图 7 X射线经过不同厚度铝片衰减曲线 Figure 7 Attenuation curves for X rays passing through aluminum sheets of different thicknesses |
3.X射线百分深度剂量:百分深度剂量(percentage depth dose, PDD)是指在水体膜中心轴上某一点的剂量值与参考深度处剂量值之比所形成的曲线,是计算组织中三维剂量分布的基础,是治疗计划系统的基准值。PDD曲线描述了沿射束轴方向不同深度处的剂量分布情况。
本研究综合运用了蒙特卡罗模拟技术与实验验证相结合的方法。在模拟过程中,所构建的水箱模型精确地复制了实际三维水箱的尺寸,具体为21.5 cm×20.5 cm×15.5 cm。测量栅元为圆柱形,内部填充介质为水,其半径为1.6 mm,厚度为0.1 mm。
在实验部分,采用PTW34013电离室。该电离室是一个小灵敏体积的平板电离室,空间分辨率高,能准确测量高剂量率;入射窗薄,对光子的衰减小;且能量响应平坦,适用于15~70 kV低能光子的剂量测量。在充满去离子水的三维水箱内,对裸真空漂移管X射线的百分深度剂量进行测量。实验中,INTRABEAM系统的加速电压设为50 kV,电流为40 μA,处方剂量为90 Gy,治疗深度设为30 mm。静电计则选用了INTRABEAM系统自带的UNIDOS E型,电离室工作电压设为300 V,每60 s记录1次电荷值,每个深度均进行五次测量并取其平均值以提高数据的准确性。数据归一化处理是以探针等中心点为原点,并将测量电离电荷归一化至距探针等中心的最近距离3.5 mm处。
实验结果与模拟数据的对比,如图 8所示,两者所呈现的PDD曲线高度一致,拟合结果清晰地表明,随着深度的增加,吸收剂量呈现出迅速减少的趋势,其变化趋势基本呈反比例三次方衰减。
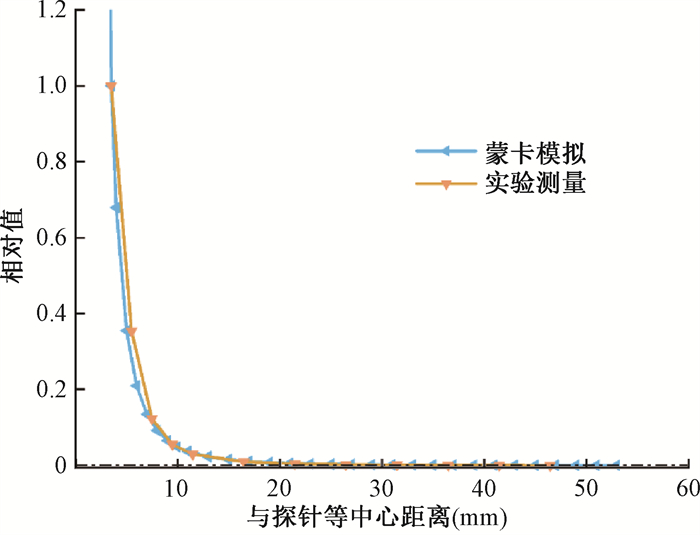
|
注:PDD.百分深度剂量 图 8 X射线在水中沿轴向的PDD曲线 Figure 8 The PDD curve of X-rays along the axial direction in water |
4.X射线在水中径向剂量均匀性:为评估X射线在水中径向的均匀性,实验采用了Zeiss三维水箱。通过旋转X射线源并将其锁紧至不同的螺孔进行定位,每个位置间距45°。将电离室探测窗与X射线源漂移管尖端等中心径向对齐之后,在8个方位对INTRABEAM系统X射线在水中的剂量一致性进行了评估,其结果表明均匀性优于99.5%,具体情况如表 1所示。
|
|
表 1 X射线在水中不同方向的径向剂量均匀性 Table 1 Radial dose uniformity of X-rays in water |
讨论
本研究对INTRABEAM系统的裸真空漂移管及其配备4 cm球形施源器时的剂量特性进行了初步探讨。通过蒙特卡罗模拟,获取了裸真空漂移管配置下X射线的注量谱,并精确计算出其在空气中的平均能量为20.8 keV。相比之下,Chin等[14]构建的INTRABEAM系统X射线源模型模拟计算得出的平均能量为21.19 keV,这一差异主要源于模型参数的不同。已有研究表明,在组织非均质性存在的情况下,低能光子能谱会发生显著衰减,这可能导致靶区内剂量出现不可接受的大幅变化。根据Sethi等[15]的测量结果,当2 mm厚的组织被空气取代时,剂量增强16%;若被骨组织取代,剂量则降低58%。因此,Bouzid等[16]建议采用基于CT的治疗计划,并结合蒙特卡罗剂量计算,以优化放射治疗的剂量处方与评估。
同时,本研究模拟结果也揭示了X射线的半价层厚度为0.08 mmAl,与已有研究结果相同[17]。针对配备4 cm球形施源器的INTRABEAM源,在轴向与径向分别对其注量谱进行了模拟研究,发现两者具有高度一致性,但径向注量谱表现出更为“硬化”的特征,即高能部分的占比增加,这一现象可能与光子沿轴向的衰减较小有关。配置4 cm球形施源器的平均能量比裸真空漂移管的平均能量增加38%,主要是因为光子经施源器后部分低能光子被吸收,这一点在治疗时应尤其注意。此外,实验与模拟所得X射线的PDD结果也呈现出较高的一致性,并与反比例三次方衰减的下降趋势极为接近,这与制造商提供的数据相符,这种随深度快速衰减的PDD曲线可实现剂量在浅表靶区的有效集中,同时显著降低深部组织剂量暴露,在近距离放疗中具有明显的临床优势。本研究还测量了X射线在水中的径向剂量均匀性,结果显示>99.5%,远优于国际辐射单位与测量委员会(International Commission on Radiation Units and Measurements, ICRU)推荐的±5%剂量均匀性标准,这表明本系统在实际应用中具有良好的剂量分布稳定性。总体而言,INTRABEAM系统低能X射线具备浅层高效剂量沉积、深部组织保护性强及剂量分布均匀等特点,为浅表肿瘤及近距离照射提供了良好的剂量学支持。本研究通过模拟分析与实验测量相结合的方法对INTRABEAM系统裸真空漂移管及配备4 cm球形施源器的剂量特性进行了探讨,为其应用提供了剂量学基础。未来,有必要进一步针对不同规格的施源器和临床应用环境下的剂量特性开展深入研究,以进一步提升术中放疗的精准度和安全性。
利益冲突 所有作者声明无利益冲突
作者贡献声明 唐煜杰负责实验设计、模型建立、数据分析与论文撰写;刘川凤指导研究和论文修改;王冠博、王华贵负责数据采集与整理;李德红、刘义保、张晓乐、黄建微、张璇、成建波指导研究和论文修改;戴甜甜、史泰玮提供材料支持
| [1] |
Abdullah Abudra'A. Development of new dosimetric standards for low energy X-rays (≤ 50 keV) used in contact radiotherapy[D]. Paris: Universit'e Paris-Saclay, 2017.
|
| [2] |
Douglas RM, Beatty J, Gall K, et al. Dosimetric results from a feasibility study of a novel radiosurgical source for irradiation of intracranial metastases[J]. Int J Radiat Oncol Biol Phys, 1996, 36(2): 443-450. DOI:10.1016/s0360-3016(96)00293-3 |
| [3] |
Gunderson LL, Willett CG, Harrison LB, et al. Intraoperative irradiation: Techniques and results[M]. Totwa, NJ: Humana Press, 2011.
|
| [4] |
冯威. kV级X射线术中放疗的剂量学特征及其质量保证研究[D]. 长春: 吉林大学, 2019. Feng W. The study for the dosimetry characteristics and quality assurance of IORT in kiovoltage X-ray[D]. Changchun: Jilin University, 2019. |
| [5] |
Beatty J, Biggs PJ, Gall K, et al. A new miniature x-ray device for interstitial radiosurgery: dosimetry[J]. Med Phys, 1996, 23(1): 53-62. DOI:10.1118/1.597791 |
| [6] |
Tran AK, Truong HTL, Mai VN, et al. Study on the characteristics of X-ray spectra in imaging diagnosis using Monte Carlo simulations[J]. J Korean Phys Soc, 2016, 69(7): 1168-1174. DOI:10.3938/jkps.69.1168 |
| [7] |
Dinsmore M, Harte KJ, Sliski AP, et al. A new miniature X-ray source for interstitial radiosurgery: device description[J]. Med Phys, 1996, 23(1): 45-52. DOI:10.1118/1.597790 |
| [8] |
Nwankwo O, Clausen S, Schneider F, et al. A virtual source model of a kilo-voltage radiotherapy device[J]. Phys Med Biol, 2013, 58(7): 2363-2375. DOI:10.1088/0031-9155/58/7/2363 |
| [9] |
Yanch JC, Harte KJ. Monte Carlo simulation of a miniature, radiosurgery X-ray tube using the ITS 3.0 coupled electron-photon transport code[J]. Med Phys, 1996, 23(9): 1551-1558. DOI: 10.1118/1.597885.
|
| [10] |
Sievers P, Schneider T, Michel T, et al. X-ray spectroscopy with photon counting imaging detectors such as Timepix, Valencia, Spain, 2011[C]. New York: IEEE, 2012: 1826-1828. DOI: 10.11091NSSMIC.2011.6154692.
|
| [11] |
Sethi A, Emami B, Small W Jr, et al. Intraoperative radiotherapy with INTRABEAM: Technical and dosimetric considerations[J]. Front Oncol, 2018, 8: 74. DOI:10.3389/fonc.2018.00074 |
| [12] |
Vaidya JS, Joseph DJ, Tobias JS, et al. Targeted intraoperative radiotherapy versus whole breast radiotherapy for breast cancer (TARGIT-A trial): An international, prospective, randomised, non-inferiority phase 3 trial[J]. Lancet, 2010, 376(9735): 91-102. DOI:10.1016/S0140-6736(10)60837-9 |
| [13] |
Garcia Yip F, Šolc J, Behrens R, et al. Dose distributions of the INTRABEAM electronic brachytherapy system measured with traceable detectors[J]. J Instrum, 2023, 18(7): 07049. DOI:10.1088/1748-0221/18/07/P07049 |
| [14] |
Chin M, Rowshanfarzad P, Neveri G, et al. Dosimetric evaluation of an intraoperative radiotherapy system: a measurement-based and Monte-Carlo modelling investigation[J]. Phys Eng Sci Med, 2023, 46(2): 687-701. DOI:10.1007/s13246-023-01243-6 |
| [15] |
Sethi A, Chinsky B, Gros S, et al. Tissue inhomogeneity corrections in low-kV intra-operative radiotherapy (IORT)[J]. Transl Cancer Res, 2015, 4(2): 182-188. DOI:10.3978/j.issn.2218-676X.2015.04.08 |
| [16] |
Bouzid D, Bert J, Dupre PF, et al. Monte-Carlo dosimetry for intraoperative radiotherapy using a low energy X-ray source[J]. Acta Oncol, 2015, 54(10): 1788-1795. DOI:10.3109/0284186X.2015.1016623 |
| [17] |
Watson P, Popovic M, Seuntjens J. Determination of absorbed dose to water from a miniature kilovoltage X-ray source using a parallel-plate ionization chamber[J]. Phys Med Biol, 2017, 63(1): 015016. DOI:10.1088/1361-6560/aa9560 |
 2025, Vol. 45
2025, Vol. 45


