2. 吉林大学白求恩第三医院病理科, 长春 130033
2. Department of Pathology, Third Bethune Hospital of Jilin University, Changchun 130033, China
超低位直肠癌的保肛治疗一直是临床医学中的一个挑战,外科手术往往会导致肛门的结构和功能受损,术后患者生活质量较差[1-2]。125I放射性粒子植入作为一种内放射治疗手段,在局部控制肿瘤生长和减少治疗不良反应方面显示了显著优势。与传统的手术治疗相比,125I放射性粒子植入能够较好地保护肛门和直肠结构,降低术后肛门功能损伤的风险。结合全身化疗,提高了局部控制率并降低转移风险。这一治疗方式为超低位直肠癌患者提供了一种有效的保肛治疗新手段。本文通过1例病例报告,探讨了125I放射性粒子植入联合奥沙利铂加卡培他滨(CAPEOX)化疗方案在超低位直肠癌患者中的应用和疗效,旨在为该类患者提供新的治疗策略和临床参考。
一、临床资料2018年3月,66岁男性患者因排便次数增多伴血便1个月就诊,直肠指检距肛缘1 cm触及环周生长质硬肿物,指套染血。CT影像示于图 1,腹部CT见直肠下段肠壁呈环形不均匀增厚,最厚处约2.5 cm,肠腔偏心性狭窄,周围脂肪间隙可见多发淋巴结影。病理图像示于图 2,肠镜见齿状线至其上方7 cm环周生长溃疡型病变,病理组织活检提示为腺癌。实验室检查未见明显异常。既往无特殊病史,近半年体重下降约10 kg。术前诊断为直肠癌。完善相关检查后拟行经腹会阴联合直肠癌切除术,因患者拒绝永久性腹壁结肠造口,与患者及家属沟通后决定采取125I放射性粒子植入联合CAPEOX化疗方案治疗。
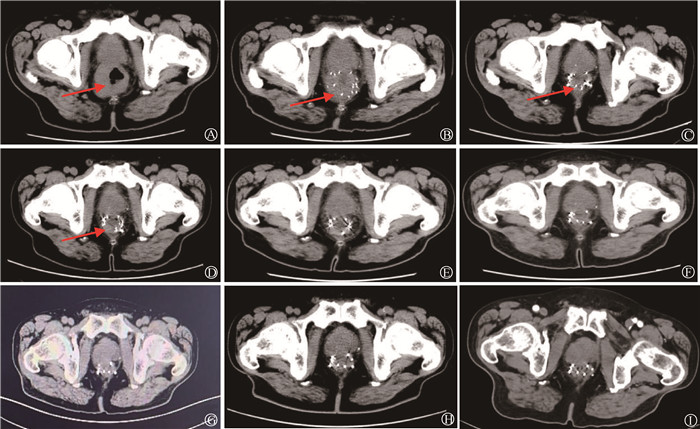
|
注:箭头显示肿瘤位置 图 1 直肠癌患者治疗前后影像学表现 A. 术前腹部CT图像;B. 放射性粒子植入术后CT图像;C. 放射性粒子补种后肿瘤图像;D.放射性粒子首次植入术后10个月CT图像;E. 术后12个月CT图像; F. 术后21个月CT图像;G. 术后38个月PET/CT图像; H、I. 术后41和79个月CT图像 Figure 1 Images before and after treatment, with arrows indicating the tumor location A. Preoperative CT image of the abdomen; B. CT image after radioactive seeds implantation; C. Tumor image after supplementary radioactive seeds implantation; D. CT image 10 months after the first radioactive seeds implantation; E. CT image 12 months after the operation; F. CT image 21 months after operation; G. PET/CT image 38 months after operation without tumor residue; H-I. CT images 41 and 79 months after the operation |
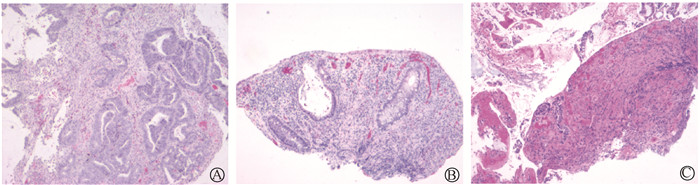
|
图 2 直肠癌患者肠镜下取溃疡组织活检病理图片HE染色×100 A. 术前病理提示腺癌;B. 粒子植入术后联合化疗后病理提示,溃疡性病变,黏膜急慢性炎症改变;C.全部疗程结束2个月后病理提示,黏膜组织见炎细胞浸润局部腺体呈低级别上皮内瘤变,小范围区呈高级别上皮内瘤变 Figure 2 Pathological images of ulcer tissue biopsy obtained via colonoscopy HE ×100 A. Preoperative pathological showing adenocarcinoma; B. Pathological image after radioactive seed implantation combined with chemotherapy, indicating ulcerative lesions with acute and chronic inflammatory changes in the mucosa; C. Pathological image 2 months after the entire treatment course, suggesting that mucosal tissues suffer from inflammatory cell infiltration and local gland with low-grade intraepithelial neoplasia (LGIN) generally and local high-grade intraepithelial neoplasia (HGIN) in a small range |
全麻下行超声引导直肠癌及周围淋巴结125I放射性粒子植入术,按术前计划(TPS)植入粒子70颗,粒子活度为0.8 mCi,即2.96 × 107 Bq(1 Ci = 3.7 × 1010 Bq),处方剂量120 Gy。术后第2天复查腹部CT,验证粒子空间分布符合术前计划,术后验证D90为121.54 Gy。术后患者会阴部存在烧灼感,症状逐渐缓解。之后共计行6个疗程CAPEOX方案化学治疗。术后3个月复查肠镜:距肛门4~6 cm处见环周溃疡性病变,基底被白苔,周边堤样隆起,病理组织活检提示:溃疡性病变,黏膜急慢性炎症改变。术后5个月复查肠镜,距肛门2.5~5.0 cm环周2/3溃疡病变,表面不平,覆厚苔,周边黏膜充血水肿,病理组织活检提示黏膜组织见炎细胞浸润局部腺体呈低级别上皮内瘤变,小范围区呈高级别上皮内瘤变,边缘见坏死及炎性渗出物(图 2)。考虑肿瘤退缩及粒子随着肿瘤脱落而脱落,肿瘤局部存在剂量冷区,遂补种9颗粒子,术后第1天CT验证粒子空间分布符合术前计划。术后患者持续随访观察,首次放射性粒子植入术后10个月复查腹部CT,肿瘤明显退缩;术后12个月复查腹部CT,肿瘤基本完全退缩;术后21个月复查腹部CT,肿瘤完全退缩;术后38个月患者PET/CT检查结果:直肠下段肠壁稍增厚伴糖代谢增高,考虑炎性改变可能性大,无局部复发及远处转移;术后41个月复查腹部CT,无肿瘤复发;术后79个月复查腹部CT,无肿瘤复发(图 1)。随访至今近7年,患者一般状态良好,直肠和肛门功能正常,无肿瘤局部复发及远处转移。
二、讨论超低位直肠癌保肛仍是一项待解决的难题。目前,Miles手术仍然是许多外科医生及患者的主要选择之一。国内外学者在保肛治疗上都在进行各种尝试。手术方式的创新,如结肠肛管吻合术、经括约肌间切除术、经肛门全系膜切除术等保肛术式,虽在结构上保留了肛门,但一定程度上损伤了直肠及肛门结构,术后肛门功能欠佳[1-2];强化的新辅助治疗方案,如CinClare研究方案、FOWARC研究方案、全程新辅助治疗(total neoadjuvant therapy, TNT)等,这些强化治疗增加了低位直肠癌患者的保肛机会。有研究表明,TNT将CAPEOX方案放在根治性手术之前,能够更好的早期消灭潜在微小转移灶、增加局部控制率和降低远处转移率[3-6];通过密切随访的“观察等待(watch and wait, W&W)”治疗策略,W&W保留直肠及肛门结构完整,密切随访肿瘤控制情况,将根治性手术作为补救措施[7]。然而,目前低位直肠癌的保肛治疗尚无统一定论。
125I放射性粒子植入治疗是一种常用的内放射治疗恶性肿瘤的方法,可以作为新辅助放疗参与恶性肿瘤的治疗。与体外放疗相比,125I粒子半衰期59.4 d,有效辐射时间可长达180余天,犹如无数个间期极短的分割放疗,可在肿瘤增殖、分裂的任何时期产生抑制作用,局部控制显著增强;与根治性手术相比,根治性手术切除直肠壶腹结构导致直肠容积减小[8]、损伤内括约肌导致肛管静息压降低[9-10]、破坏直肠的蠕动波[11]、损伤括约肌间沟的神经和盆腔自主神经[12]等,术后往往出现一系列肛门功能的问题。而125I粒子辐射半径短,持续时间长,能够在肿瘤内达到根治性处方剂量,在肿瘤周围达到匹配周边剂量,因此可对肿瘤周围正常组织损伤降至最低,最大程度保护直肠及肛门结构,保证肛门功能正常。
本例患者临床表现已无法保肛手术治疗,但拒绝永久性腹壁结肠造口且拒绝长疗程放疗,因此,采用125I放射性粒子植入联合6个疗程的CAPEOX方案治疗。125I粒子植入后肿瘤退缩明显,局部控制效果理想。本例患者术后出现会阴部烧灼感考虑为选用粒子活度为2.96 × 107 Bq(0.8 mCi)所致,提示在距离皮肤较近的区域植入粒子治疗时应降低植入粒子活度至1.11 × 107~1.48 × 107 Bq(0.3~0.4 mCi)较为合适[13],以提高患者的生活质量。为加强全身治疗,受TNT治疗启示,辅以6个疗程的CAPEOX方案治疗,早期消除全身潜在转移灶和降低远处转移率。7年来随访表明,患者局部达到临床缓解状态、全身无转移、肛门功能正常。125I粒子局部治疗联合全身化疗可作为超低位直肠癌保肛治疗的有效手段之一。
利益冲突 无
作者贡献声明 向新负责论文撰写;顾宇负责数据整理与分析;盖保东指导论文修改
| [1] |
Nguyen TH, Chokshi RV. Low anterior resection syndrome[J]. Curr Gastroenterol Rep, 2020, 22(10): 48. DOI:10.1007/s11894-020-00785-z |
| [2] |
Emmertsen KJ, Laurberg S. Low anterior resection syndrome score: development and validation of a symptom-based scoring system for bowel dysfunction after low anterior resection for rectal cancer[J]. Ann Surg, 2012, 255(5): 922-928. DOI:10.1097/SLA.0b013e31824f1c21 |
| [3] |
Fernandez-Martos C, Garcia-Albeniz X, Pericay C, et al. Chemoradiation, surgery and adjuvant chemotherapy versus induction chemotherapy followed by chemoradiation and surgery: long-term results of the Spanish GCR-3 phase Ⅱ randomized trial[J]. Ann Oncol, 2015, 26(8): 1722-1728. DOI:10.1093/annonc/mdv223 |
| [4] |
Cercek A, Goodman KA, Hajj C, et al. Neoadjuvant chemotherapy first, followed by chemoradiation and then surgery, in the management of locally advanced rectal cancer[J]. J Natl Compr Canc Netw, 2014, 12(4): 513-519. DOI:10.6004/jnccn.2014.0056 |
| [5] |
Yoo RN, Kim HJ. Total neoadjuvant therapy in locally advanced rectal cancer: Role of systemic chemotherapy[J]. Ann Gastroenterol Surg, 2019, 3(4): 356-367. DOI:10.1002/ags3.12253 |
| [6] |
Sutera P, Solomina J, Wegner RE, et al. Post-Operative morbidity and mortality following total neoadjuvant therapy versus conventional neoadjuvant chemoradiotherapy in locally advanced rectal cancer[J]. J Gastrointest Cancer, 2021, 52(3): 976-982. DOI:10.1007/s12029-020-00401-3 |
| [7] |
Habr-Gama A, Perez RO, Nadalin W, et al. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results[J]. Ann Surg, 2004, 240(4): 711-717, 717-718. DOI:10.1097/01.sla.0000141194.27992.32 |
| [8] |
Keighley MR, Matheson D. Functional results of rectal excision and endo-anal anastomosis[J]. Br J Surg, 1980, 67(10): 757-761. DOI:10.1002/bjs.1800671021 |
| [9] |
Lestar B, Penninckx F, Kerremans R. The composition of anal basal pressure. An in vivo and in vitro study in man[J]. Int J Colorectal Dis, 1989, 4(2): 118-122. DOI:10.1007/BF01646870 |
| [10] |
Kitaguchi D, Nishizawa Y, Sasaki T, et al. Clinical benefit of high resolution anorectal manometry for the evaluation of anal function after intersphincteric resection[J]. Colorectal Dis, 2019, 21(3): 335-341. DOI:10.1111/codi.14528 |
| [11] |
Koda K, Yamazaki M, Shuto K, et al. Etiology and management of low anterior resection syndrome based on the normal defecation mechanism[J]. Surg Today, 2019, 49(10): 803-808. DOI:10.1007/s00595-019-01795-9 |
| [12] |
Stelzner S, Böttner M, Kupsch J, et al. Internal anal sphincter nerves - a macroanatomical and microscopic description of the extrinsic autonomic nerve supply of the internal anal sphincter[J]. Colorectal Dis, 2018, 20(1): O7-O16. DOI:10.1111/codi.13942 |
| [13] |
中国抗癌协会肿瘤微创治疗专业委员会, 中国医师协会放射性粒子植入技术专家委员会. 放射性碘-125粒子植入治疗局部晚期分化型甲状腺癌中国专家共识(2023版)[J]. 中华医学杂志, 2023, 103(3): 149-157. Chinese Anti-Cancer Association Minimally Invasive Tumor Therapy Committee, Chinese Medical Doctor Association Radioactive Seed Implantation Technology Expert Committee. Chinese expert consensus on the treatment of locally advanced differentiated thyroid cancer with radioactive iodine-125 seed implantation (2023 edition)[J]. Chin Med J, 2023, 103(3): 149-157. DOI:10.3760/cma.j.cn112137-20220905-01873 |
 2025, Vol. 45
2025, Vol. 45


