放射治疗剂量建成效应对浅表区域的剂量分布影响较大。为了克服这一问题,乳腺癌根治术后放疗(PMRT)临床常采用组织补偿膜(bolus)来确保这些浅表区域得到足够的剂量[1-2]。尽管当前对于bolus的使用仍存在一定的争议,且缺乏明确的临床证据指导其应用[1, 3],2020版中国医师协会乳腺癌放射治疗指南仍推荐在胸壁皮肤表面放置bolus,以保证皮肤获得充分的剂量[4]。
对于PMRT患者,常常在计划设计时使用虚拟补偿膜,而在实际治疗时使用常规商用补偿膜,往往造成二者的剂量差异。此外,由于患者身体轮廓不规则,常用的常规商用补偿膜与皮肤表面不完全贴合,常存在一定空隙,导致实际剂量与理想情况下的剂量存在差异[5-6]。尽管3D打印补偿膜在理论上具有较好的皮肤贴合性[7-8],能够更好地解决这一问题,但其在实际应用中存在加工复杂、耗时、成本高、需要二次CT扫描和延长治疗等待时间等一系列问题,限制了其普遍应用。为此,本研究提出了可视化温感变色补偿膜的创新应用,该补偿膜由医用级硅胶和温感颗粒构成, 通过颜色变化可以实时反映补偿膜的贴合情况,便于个性化定制,确保剂量准确分布。相比传统补偿膜,可视化温感变色补偿膜不仅提高了贴合度,还通过实时反馈机制优化了治疗过程,减少了剂量误差。目前已有个体化硅胶在乳腺癌根治术后放疗中的应用[9],但鲜有可视化温感变色补偿膜在临床中应用的报道。
本研究旨在通过比较理想情况下的虚拟补偿膜与可视化温感变色补偿膜和常规商用补偿膜的剂量学差异,以及皮肤不良反应情况,验证可视化温感变色补偿膜在乳腺癌根治术后放疗中的应用可行性和优势。
资料与方法1.患者资料及补偿膜:本研究选取了2023年6月至2024年6月苏州大学附属第二医院放疗科接受治疗的40例乳腺癌根治术后患者,年龄34~74岁,中位年龄57岁,所有患者均签署知情同意书。所使用的可视化温感变色补偿膜(南京茂宇公司)由医用低硬度硅胶制成,密度(1.06 g/cm3)与人体胸壁皮肤的密度接近。膜内加入温度感应变色颗粒,能够根据接触物体温度实时变化颜色,且可根据临床需求设置不同温度临界点。补偿膜采用多层结构设计,优化了硬度、粘度和韧性,确保与皮肤的良好贴合性。
2.体位固定及CT图像扫描:所有患者均采用仰卧位乳腺托架固定,双臂外展上举。使用美国GE公司(RT 590)16排大孔径CT扫描。按照随机标签法将患者分为A、B两组,每组20例。A组患者扫描2次CT图像得到A1、A2,A1图像为不加补偿膜直接CT增强扫描;A2图像为在胸壁添加0.3 cm厚度可视化温感变色补偿膜,可根据患者胸壁情况个性化裁剪制作。B组患者同样扫描2次CT图像得到B1、B2,B1图像为不加补偿膜直接CT增强扫描;B2图像为在胸壁添加0.3 cm厚常规商用硅胶补偿膜(30 cm × 30 cm)。
3.勾画及计划设计:临床医师使用MIM软件在A1、B1图像上勾画靶区和危及器官,靶区包括锁骨上和胸壁,危及器官包括双肺、心脏、健侧乳腺、脊髓。采用图像融合,将A1、B1图像上的靶区和危及器官分别复制到A2、B2图像上。将所有图像和结构传到Pinnacle计划系统(荷兰飞利浦公司,v9.8),处方剂量计划靶体积(PTV)为50 Gy,2 Gy/次,共25次。计划要求V50 Gy≥95%、Dmax < 60 Gy;患侧肺V20 Gy < 30%,靶区位于左侧时心脏平均剂量Dmean < 6 Gy, 靶区位于右侧时心脏平均剂量Dmean < 4 Gy。
目前,临床应用中常使用虚拟补偿膜做计划,而在治疗时使用常规商用补偿膜。本研究在放疗计划系统中为A1图像添加虚拟补偿膜设计满足临床计划的A1-Plan(最为理想情况),为A2图像设计满足临床要求的计划A2-Plan(可视化温感变色补偿膜计划),两组计划射野角度和目标优化函数相同;将A1-Plan移植到A2图像上得到A3-Plan(模拟用虚拟补偿膜做计划而治疗时使用可视化温感变色补偿膜的情况)。同样为B1图像添加虚拟补偿膜设计满足临床计划的B1-Plan(理想情况),为B2图像设计满足临床要求的计划B2-Plan(常规商用补偿膜计划);将B1-Plan移植到B2图像上得到B3-Plan(模拟用虚拟补偿膜做计划而实际治疗时使用常规商用补偿膜的计划)。A1-Plan与A2-Plan比较虚拟补偿膜计划与可视化温感变色补偿膜计划差异,A1-Plan与A3-Plan比较虚拟补偿膜计划与使用虚拟补偿膜做计划实际治疗时使用可视化温感变色补偿膜差异。同样,B1-Plan与B2-Plan比较虚拟补偿膜计划与常规商用补偿膜计划差异,B1-Plan与B3-Plan比较虚拟补偿膜计划与使用虚拟补偿膜做计划而在治疗时使用常规商用补偿膜差异。A2-Plan与B2-Plan,A3-Plan与B3-Plan比较两种不同膜之间的差异。
每例患者均采用8野调强放疗(IMRT)计划,射野角度以切线方向为主。左侧乳腺癌的射野角度为300°~345°和100°~135°,额外再加1个355°射野;右侧乳腺癌的射野角度为25°~60°和220°~265°,额外再加1个5°射野;射野角度根据靶区形状略有调整,以避免射野对穿。靶区剂量参数包括V50 Gy、Dmax、均匀性指数(HI)和适形度指数(CI)。其中CI=TV50 Gy/V50 Gy;HI=(D2%-D98%)/D50%,TV50 Gy和V50 Gy分别为靶区和身体内部被50 Gy剂量线所包绕的体积,Dx%为覆盖靶区x%体积的剂量。皮肤评估参数包括胸壁靶区范围内皮肤最大剂量Dmax和平均剂量Dmean。正常组织的剂量参数包括患侧肺V5 Gy、V10 Gy和V20 Gy,心脏Dmean及健侧乳腺Dmean。
4.计划实施与验证:计划经临床医师审核后经网络传至医科达Synergy加速器,6 MV X射线。患者在首次治疗时使用二维平板探测器(美国Sun Nuclear,Mapcheck)进行计划验证,探测器水平放置于治疗床上,所有射野进行0°机架角归一后,分析单野剂量分布,γ通过率达到95%及以上(3 mm,2%)实施治疗,治疗首次及后续每周1次进行锥形束CT(CBCT)位置验证。A组患者治疗时在胸壁添加0.3 cm厚度可视化温感变色补偿膜;B组患者治疗时在胸壁添加0.3 cm厚度常规商用补偿膜。
5.补偿膜与皮肤空隙测量:将两组患者CBCT图像传输至Monaco5.0软件,使用阈值分割方式提取患者体表与补偿膜间的空腔数据,重建得到各例患者的空气间隙三维模型。测量各例患者空气间隙三维模型体积,对补偿膜到皮肤表面距离进行分析,确定最大距离所在位置并测量。
6.患者皮肤反应:根据美国放射治疗肿瘤学组(RTOG)的放射损伤分类评估PMRT期间和放疗结束后的皮肤不良反应,分级如下:1级,轻度红斑、干性脱屑或两者兼有;2级,中度红斑或斑片状湿性脱屑;3级,混合性湿性脱屑、点状水肿和触痛;4级,坏死、溃疡或出血。皮肤不良反应分级由2~3名放疗人员进行评估,以确保准确性。从放疗开始到放疗结束后4周,所有患者每周接受1次评估。医生建议患者在放疗期间保持受照射胸壁干燥,减少摩擦,并使用辐射防护喷剂。
7.统计学处理:采用SPSS 19.0软件对数据进行统计处理。数据满足正态分布,结果用x±s表示。对肿瘤靶区、危及器官数据结果进行配对样本t检验,采用Pearson相关性分析,计算身体质量指数(BMI)、胸壁平坦度与空腔体积的相关性。P < 0.05为差异有统计学意义。
结果1.可视化温感变色补偿膜效果:乳腺癌根治术后患者应用可视化温感变色补偿膜的效果,刚开始因补偿膜与皮肤在手术切口处、褶皱处和凹陷处为不完全贴合,补偿膜呈现紫色。微调补偿膜使其完全与皮肤贴合后紫色消失变为透明色,见图 1。
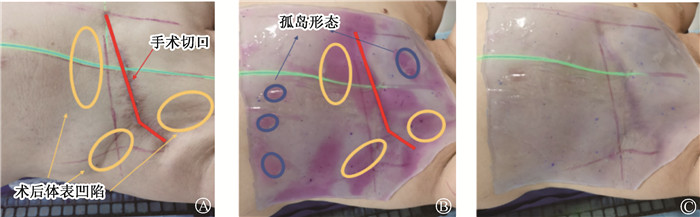
|
图 1 乳腺癌根治术后放疗患者可视化温感变色补偿膜应用效果 A. 根治术后患者CT定位使用补偿膜前表面形态;B. 可视化温感变色补偿膜覆盖在患者体表初形态,在疤痕处、褶皱处补偿膜呈现紫色;C. 可视化温感变色补偿膜覆盖在患者体表末形态,完全贴合紫色消失 Figure 1 Application effect of visualized thermosensitive color-changing bolus on the body surface of a PMRT-treated patient with breast cancer A. CT-localized body surface morphology of a PMRT-treated patient before using bolus; B. Initial morphology of visualized thermosensitive color-changing bolus on the patient′s body surface, appearing purple at scars and folds; C. Final morphology of visualized thermosensitive color-changing bolus on the patient′s body surface, with the purple color disappearing and completely adhering to the body surface |
2.靶区剂量参数比较:A组和B组两种PTV参数比较结果详见表 1,A组中A3-Plan与A1-Plan相比,尽管在V50 Gy、最大剂量Dmax、HI、CI差异有统计学意义(t=5.04、-5.08、-3.39、2.53,P < 0.05),但是两者结果相差非常小,如果使用虚拟补偿膜做计划而实际治疗时使用可视化温感变色补偿膜,其靶区覆盖度、HI和CI上不会受到太大影响。B组中B1-Plan与B3-Plan两种计划在处方剂量包绕靶区体积V50 Gy、最大剂量Dmax、HI差异均有统计学意义(t=8.49、2.99、-4.93,P < 0.05),使用虚拟补偿膜做计划而实际治疗时使用常规商用补偿膜的计划在靶区覆盖度上、CI和HI上降低。组间比较,A组中A2-Plan与B组中B2-Plan两种计划在处方剂量包绕靶区体积V50、最大剂量Dmax、CI上均相近,差异有统计学意义(t=-2.84、-2.69、3.62,P < 0.05),A2-Plan适形度更好。A3-Plan与B3-Plan比较,两种计划在V50 Gy、最大剂量Dmax、HI、CI差异有统计学意义(t=2.78、2.29、-0.47、0.51,P < 0.05),可视化温感变色补偿膜A3-Plan靶区处方剂量覆盖度、HI和CI优于B组的常规商用补偿膜B3-Plan。
|
|
表 1 乳腺癌根治术后放疗患者A、B两组计划靶区剂量参数比较(x±s) Table 1 Comparison of dose parameters for planning target volumes (PTVs) of PMRT-treated patients with breast cancer in groups A and B (x±s) |
3.危及器官受量比较:A组和B组计划危及器官受量详见表 2。A组计划A1-Plan与A2-Plan比较,患侧肺V5、V10、V20,皮肤最大剂量Dmax和平均剂量Dmean,心脏平均剂量Dmean,健侧乳腺平均剂量Dmean均相近,差异无统计学意义(P>0.05)。A3-Plan与A1-Plan相比,胸壁皮肤剂量有所增加,但差异较小。B组计划B1-Plan与B2-Plan比较,危及器官差异无统计学意义(P>0.05)。B3-Plan与B1-Plan比较,患侧肺V5、V10,胸壁皮肤最大剂量Dmax和平均剂量Dmean,心脏平均剂量Dmean,健侧乳腺平均剂量Dmean均相近(P>0.05),B3-Plan使用常规商用补偿膜时皮肤平均剂量有所降低(t=3.24,P < 0.05)。组间比较,A2-Plan与B2-Plan危及器官比较,差异无统计学意义(P>0.05)。B3-Plan与A3-Plan比较,使用常规商用补偿膜时皮肤平均剂量有所降低(t=3.13,P < 0.05)。
|
|
表 2 乳腺癌根治术后放疗患者A、B两组计划靶区危及器官剂量参数比较(x±s) Table 2 Comparison of dose parameters for OARs of PMRT-treated patients with breast cancer in groups A and B (x±s) |
4.补偿膜与皮肤贴合性:对所有患者的空腔体积进行阈值勾画,可视化温感变色补偿膜的空腔体积均值为(3 833±3 185)mm3,空腔最大距离均值为(3.6±1.7)mm;常规商用补偿膜的空腔体积均值为(21 498±6 863)mm3,空腔最大距离均值为(9.7±4.0)mm,两者比较差异均有统计学意义(t=-9.65、-5.22,P < 0.001)。采用Pearson相关性分析,发现BMI、胸壁平坦度和空腔体积、空腔最大距离无明显相关性(P>0.05)。图 2为常规商用补偿膜和可视化温感变色补偿膜在临床中的应用情况,无论在体表轮廓比较平坦的患者还是体表轮廓陡峭的患者,可视化温感变色补偿膜与皮肤贴合性更好。
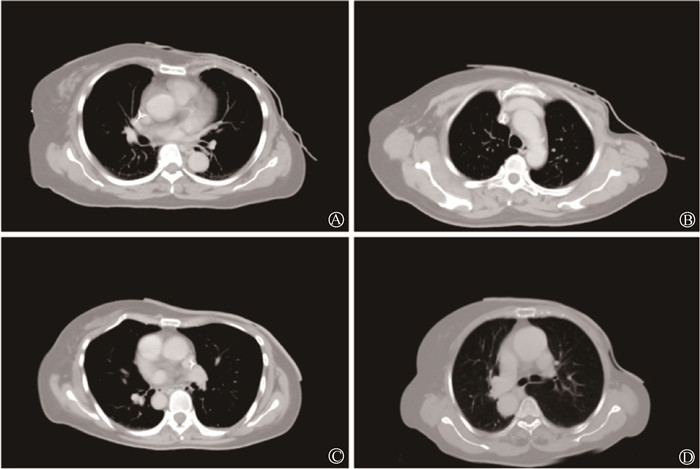
|
图 2 常规商用补偿膜和可视化温感变色补偿膜在乳腺癌患者根治术后放疗中的CT图像 A、C.患者体表轮廓比较平坦;B、D.患者体表轮廓较陡峭;A、B为常规商用补偿膜图像;C、D为可视化温感变色补偿膜图像 Figure 2 CT scanning images of conventional commercial bolus and visualized thermosensitive color-changing bolus on the body surfaces of PMRT-treated patients with breast cancer A, C. Relatively flat body surface profiles; B, D. Steeper body surface profiles; A, B. Images of conventional commercial bolus; C, D. Images of visualized thermosensitive color-changing bolus |
5.皮肤不良反应情况:在入组的40例患者中,所有患者均在20次撤掉补偿膜以保证皮肤剂量足量。A组和B组患者皮肤不良反应均为1级,未发生2级及2级以上皮肤反应。
讨论本研究旨在探讨可视化温感变色补偿膜在PMRT患者放疗期间的剂量学特性、有效性和安全性。本研究结果显示,使用可视化温感变色补偿膜可确保这一患者群体有足够的皮肤剂量、胸壁剂量均匀、重要器官限制良好以及皮肤不良反应可接受。
可视化温感变色补偿膜主要由医用级硅胶加温感颗粒组成。温感颗粒微胶囊(微米级)是由电子转移型有机化合物体系制备的,当其接触的物体温度达到特定值时,微米级胶囊内电子转移,颜色发生变化,为可逆的物理反应,安全无毒。这种变色物质不仅颜色鲜艳,而且可以实现从“有色到无色”状态的颜色变化,这是重金属复盐络合物型和液晶型可逆感温变色物质所不具备的。通过颜色变化可以实时观测空腔的位置和面积,治疗师在患者摆位时可以有效排出空腔内气体,完全贴合由紫色变透明。较常规商用补偿膜,可视化温感变色补偿膜与皮肤空腔体积缩小了近1/7,空腔最长径缩小了近1/3,甚至低于文献报道3D打印补偿膜的空腔体积[10]。在整个放疗周期每周1次CBCT显示,可视化温感变色补偿膜显示出较好的重复一致性,且无论体表轮廓比较平坦的患者还是体表轮廓陡峭的患者,温感个性化补偿膜与皮肤贴合性较常规商用补偿膜更好。
本研究中对照组(B组)中B3-Plan与B1-Plan在靶区剂量比较上存在明显差异,实际治疗的靶区覆盖度和HI明显降低;由于空腔的存在,胸壁处的皮肤平均剂量降低,这与胡作怀等[11]对组织补偿膜添加方式引起的剂量学差异的研究结果相似。B1-Plan使用的虚拟补偿膜是紧贴患者体表,而实际治疗的常规补偿膜有一定硬度,与体表形成一定空隙,导致了与理想情况下的剂量分布差异。有多项研究表明空气间隙会影响靶区的剂量分布,降低预期剂量和HI[12]。试验组(A组)使用的可视化温感变色补偿膜贴合性好,与虚拟补偿膜计划相比,无论靶区剂量覆盖度、HI、CI还是危及器官的受量均相似,差异无统计学意义。将虚拟补偿膜的计划移植到可视化温感变色补偿膜上发现靶区剂量覆盖度、HI、CI差异较小,一致性较好,说明即使使用虚拟补偿膜做计划而治疗时使用可视化温感变色补偿膜差异较小,明显优于常规商用补偿膜。
在入组的40例患者中,A组和B组皮肤不良反应均为1级。补偿物的使用次数是决定靶区覆盖和皮肤剂量的重要决定因素。Dahn等[1]报告,每天使用补偿膜,3级皮肤不良反应发生率为45%~88%。杨翠等[13]的研究表明对于全程25次的乳腺癌根治术后调强计划的放疗进程,15~20次使用补偿物可以很好地平衡靶区和皮肤剂量。在本研究中,所有患者都在20次撤掉补偿膜以保证皮肤剂量足量;所用可视化温感变色补偿膜是由硅胶材料制成的,这种材料比传统材料更安全,更环保[14]。此外,患者宣教减少皮肤摩擦,保持胸壁皮肤干燥,并使用辐射防护喷剂,在降低放射治疗期间皮肤不良反应风险方面也发挥了重要作用。
总之,可视化温感变色补偿膜与皮肤贴合度好,有助于克服乳腺癌放射治疗中不必要的空隙造成的剂量差异,提高了患者舒适性,可根据患者情况个性化裁剪,具有低成本、可视化等特点,减少日常摆位的不确定性。在靶区剂量覆盖度、HI和危及器官保护方面与理想情况下的虚拟补偿膜一致,没有增加皮肤不良反应。因此,可视化温感变色补偿膜可以取代目前所用的常规补偿膜,有望在PMRT的患者中进行临床应用。
利益冲突 无
作者贡献声明 王勇设计研究方案,制作补偿膜,撰写论文;孙彦泽、钱建军负责技术指导,论文修改;韩文敏、赵培峰负责数据分析;陈列松、朱雅群、田野负责提供临床病例
| [1] |
Dahn HM, Boersma LJ, de Ruysscher D, et al. The use of bolus in postmastectomy radiation therapy for breast cancer: a systematic review[J]. Crit Rev Oncol Hematol, 2021, 163: 103391. DOI:10.1016/j.critrevonc.2021.103391 |
| [2] |
Nichol A, Narinesingh D, Raman S, et al. The effect of bolus on local control for patients treated with mastectomy and radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2021, 110(5): 1360-1369. DOI:10.1016/j.ijrobp.2021.01.019 |
| [3] |
Jiang T, Tian J, Lei P, et al. The impact of bolus on clinical outcomes for post-mastectomy breast cancer patients treated with IMRT: data from China[J]. Radiat Oncol, 2024, 19(1): 64. DOI:10.1186/s13014-024-02456-z |
| [4] |
中国医师协会放射肿瘤治疗医师分会. 乳腺癌放射治疗指南(中国医师协会2020版)[J]. 中华放射肿瘤学杂志, 2021, 30(4): 321-342. Radiation Oncology Physicians Branch of Chinese Medical Doctor Association. Guidelines for radiotherapy of breast cancer (Chinese Medical Doctor Association 2020 edition)[J]. Chin J Radiat Oncol, 2021, 30(4): 321-342. DOI:10.3760/cma.j.cn113030-20210107-00010 |
| [5] |
Khan Y, Villarreal-Barajas JE, Udowicz M, et al. Clinical and dosimetric implications of air gaps between bolus and skin surface during radiation therapy[J]. J Cancer Ther, 2013, 4(7): 1251. DOI:10.4236/jct.2013.47147 |
| [6] |
孔栋, 惠琳, 魏贤顶, 等. Bolus与皮肤间空腔对浅层组织剂量沉积影响研究[J]. 中华放射肿瘤学杂志, 2019, 28(1): 27-31. Kong D, Hui L, Wei XD, et al. Research of effect of cavity between bolus and skin on dose deposition in shallow tissues[J]. Chin J Radiat Oncol, 2019, 28(1): 27-31. DOI:10.3760/cma.j.issn.1004-4221.2019.01.006 |
| [7] |
Wang J, Xiang ZZ, Tan CF, et al. Individualized 3D-printed bolus promotes precise postmastectomy radiotherapy in patients receiving breast reconstruction[J]. Front Oncol, 2023, 13: 1239636. DOI:10.3389/fonc.2023.1239636 |
| [8] |
Kong Y, Yan T, Sun Y, et al. A dosimetric study on the use of 3D-printed customized boluses in photon therapy: a hydrogel and silica gel study[J]. J Appl Clin Med Phys, 2019, 20(1): 348-355. DOI:10.1002/acm2.12489 |
| [9] |
Chen XM, Xu CD, Zeng LP, et al. Analysis of individualized silicone rubber bolus using fan beam computed tomography in postmastectomy radiotherapy: a dosimetric evaluation and skin acute radiation dermatitis survey[J]. Technol Cancer Res Treat, 2024, 23: 15330338241229367. DOI:10.1177/15330338241229367 |
| [10] |
闫昱萤, 叶荣, 张薇莎, 等. 3D打印与常规组织的补偿膜在乳腺癌根治术后放疗中的临床应用比较[J]. 中国肿瘤临床, 2023, 50(16): 834-837. Yan YY, Ye R, Zhang WS, et al. Comparison of clinical application of 3d-printed or conventional tissue compensation membrane in radiotherapy after radical mastectomy[J]. Chin J Clin Oncol, 2023, 50(16): 834-837. DOI:10.12354/j.issn.1000-8179.2023.20230652 |
| [11] |
胡作怀, 付建东, 陈芳, 等. 组织补偿膜添加方式引起的放疗剂量差异研究[J]. 中华放射肿瘤学杂志, 2016, 25(4): 388-390. Hu ZH, Fu JD, Chen F, et al. Difference in radiotherapy dose caused by different ways of adding bolus[J]. Chin J Radiat Oncol, 2016, 25(4): 388-390. DOI:10.3760/cma.j.issn.1004-4221.2016.04.018 |
| [12] |
Lobo D, Banerjee S, Srinivas C, et al. Influence of air gap under bolus in the dosimetry of a clinical 6 MV photon beam[J]. J Med Phys, 2020, 45(3): 175-181. DOI:10.4103/jmp.JMP_53_20 |
| [13] |
杨翠, 杨昭志, 胡伟刚, 等. 乳腺癌根治术后放疗中不同补偿物使用策略对剂量分布的影响[J]. 中华放射医学与防护杂志, 2023, 43(1): 30-35. Yang C, Yang ZZ, Hu WG, et al. Effects of different bolus strategies on doses in postmastectomy radiotherapy[J]. Chin J Radiol Med Prot, 2023, 43(1): 30-35. DOI:10.3760/cma.j.cn112271-20220804-00318 |
| [14] |
Park SY, Choi CH, Park JM, et al. A patient-specific polylactic acid bolus made by a 3D printer for breast cancer radiation therapy[J]. PLoS One, 2016, 11(12): e0168063. DOI:10.1371/journal.pone.0168063 |
 2025, Vol. 45
2025, Vol. 45


