随着核辐射技术的快速发展与广泛应用,公众暴露于低剂量电离辐射(low dose ionizing radiation,LDIR)的可能性增加,如放射工作人员、矿工、天然高本底地区居民[1]。联合国原子辐射效应科学委员会(United Nations Scientific Committee on the Effects of Atomic Radiation,UNSCEAR)2021年发布的报告中将LDIR定义为剂量≤ 100 mGy或剂量率≤ 0.1 mGy/min的X和γ射线外照射[2]。流行病学研究表明,长期暴露于LDIR可能会导致心血管疾病、白内障、癌症等发病风险升高[3-6]。因此,寻找适用于LDIR暴露后的生物标志物将有助于对人群进行剂量监测以及筛选分类[7]。目前应用最为广泛的辐射生物标志物是细胞遗传学指标,如染色体畸变、微核和核质桥等,但这些指标存在实验周期长、对分析人员技术要求高等缺点[8],特别是在低剂量电离辐射的剂量评估中,需要分析更多的细胞。因此,需要寻找更适用于低剂量电离辐射的生物标志物。
长链非编码RNA(long non-coding RNA,lncRNAs)是指长度超过200个核苷酸的几乎不编码蛋白质的RNA转录本。研究表明,lncRNAs在与辐射应答相关的生物学过程中发挥着重要作用,如DNA损伤修复、细胞周期与增殖、细胞死亡和自噬、活性氧的调控、细胞表型的改变等[9]。lncRNAs可以通过全血、血清、尿液等多种方式获得,并通过高通量的方式对受照射人群进行快速分类[10]。目前,在高剂量电离辐射领域中已鉴定出一些具有良好的辐射响应性的候选lncRNAs,如PVT1、GM14005、GAS5和SNHG8等[11],但在LDIR领域仍处于探索阶段。因此,本研究将探究LDIR诱导人淋巴细胞lncRNAs表达谱改变及其作为生物标志物的可能性。
材料与方法1.主要仪器和试剂:7500 Fast实时荧光定量PCR仪购自美国Appliedd Biosystem公司;NanoDrop 2000紫外分光光度仪购自美国ThermoFisher公司。正常人永生化淋巴细胞株AHH-1购自美国ATCC公司;SYBR Green qPCR Mix和RNAprep Pure高效血液总RNA提取试剂盒购自天根生化科技(北京)有限公司;cDNA反转录试剂盒购自日本TaKaRa公司;High-Capacity cDNA反转录试剂购自美国Appliedd Biosystem公司;TRIzol试剂和胎牛血清均购自美国ThermoFisher公司;RPMI 1640购自美国GIBCO公司。
2.细胞培养与照射:AHH-1细胞培养于含10%胎牛血清和1%青-链霉素的RPMI 1640培养基中,培养条件为37℃、CO2体积分数5%。细胞为悬浮生长,浓度约为1 × 107/ml时进行细胞传代。本研究中的离体照射实验均在北京市辐照中心进行,采用60Co γ源进行照射,源靶距为2.9 m,平均照射野为30 cm × 30 cm,剂量率60 mGy/min。用于测序的细胞样品照射剂量点为0、0.05和0.1 Gy,照后培养24 h。用于细胞水平剂量效应关系研究照射剂量点为0、0.02、0.05、0.075、0.1和0.2 Gy,照后培养4、24、48、72、96和120 h。人外周血离体照射为0、0.02、0.05、0.075、0.1和0.2 Gy,照射后培养24和48 h。
3.细胞总RNA提取与cDNA的合成:使用PBS清洗残留培养基,采用TRIzol法提取总RNA,利用紫外分光光度计检测浓度与纯度,取1 μg RNA样品,加入DEPC水至7 μl,随后加入1 μl gDNAEraser和2 μl的5×gDNAEraser缓冲液,充分混匀,42℃ 2 min,随后冷却至4℃;使用4 μl的RNase Free dH2O、4 μl的5×PrimeScript缓冲液、1 μl的RT Primer Mix和1 μl的PrimeScript RT Enzyme Mix配置反应液,每份样品加10 μl的反应液,充分混匀,37℃ 15 min,85℃ 5 s,随后冷却至4℃,在-20℃中保存。
4.转录组测序:对测序细胞样品在照射后24 h提取总RNA进行转录组测序,初步筛选差异表达的lncRNAs。每个剂量点3组细胞,采用编号为0 Gy-1、0 Gy-2、0 Gy-3、0.05 Gy-1、0.05 Gy-2、0.05 Gy-3、0.1 Gy-1、0.1 Gy-2和0.1 Gy-3。首先利用探针杂交捕获法去除样品中的rRNA,以富集mRNA和其他非编码RNA,包括lncRNAs;随后将得到的lncRNAs随机打断,按照链特异性建库方式进行建库。库检合格后,根据目标下机数据量的需求,将归一化后的文库按照一定比例进行混合后进行Illumina测序。
5.生物信息学分析:使用Metascape数据库(http://www.metascape.org)中的Gene Ontology(GO)数据集对上调和下调的基因进行功能富集分析。
6.血样采集与血液总RNA的提取和cDNA的合成:本研究已通过中国疾病预防控制中心辐射防护与核安全医学所医学伦理委员会审批(审批号:LLSC2023-026),在签署知情同意书的前提下,采集8例健康人外周血(无吸烟、饮酒史、半年内无射线和化学毒物接触史),男性4名,女性4名,年龄22~25岁,每人抽取静脉血样24 ml,乙二胺四乙酸(EDTA)抗凝,将血样平均分为6份。利用RNAprep Pure高效血液总RNA提取试剂盒提取总RNA,紫外分光光度计检测RNA浓度,用High-Capacity cDNA反转录试剂盒进行反转录。
7.实时荧光定量PCR:以β-肌动蛋白、B2M为对照,进行qRT-PCR,所用引物序列见表 1。反应条件为95℃2 min,95℃10 s、60℃30 s,进行40次循环,72℃ 10 min。以2-ΔΔCT法计算照射组与0 Gy间lncRNAs相对表达水平的变化。所有样品检测均设置3个平行样,实验至少重复3次。
|
|
表 1 qRT-PCR引物序列 Table 1 qRT-PCR primer sequences |
8.统计学处理:采用SPSS 25.0软件进行统计学分析,用Graphpad Prism8.0软件作图,对数据进行描述性分析。符合正态分布、方差齐的实验数据采用 x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析和LSD检验。P < 0.05为差异具有统计学意义。
结果1.LDIR对AHH-1细胞lncRNAs表达谱的影响:经测序分析,与0 Gy相比,在0.05 Gy照射后,共有234个lncRNAs表达上调,199个lncRNAs表达下调(t=-5.02~5.12,P < 0.05);在0.1 Gy照射后,共有257个lncRNAs表达上调,219个lncRNAs表达下调(t=-5.60~6.88,P < 0.05),见图 1。以上结果表明,LDIR诱导AHH-1细胞lncRNAs表达谱发生了明显的改变。
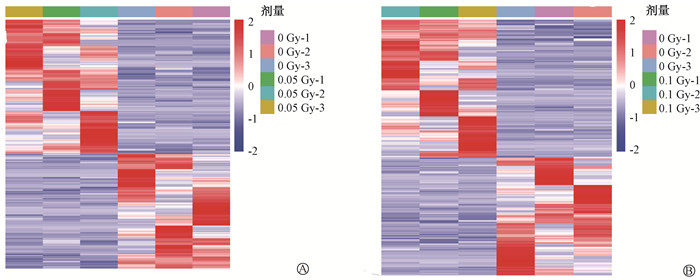
|
图 1 低剂量电离辐射照射AHH-1细胞差异表达lncRNAs热图 A.0.05 Gy与0 Gy比较;B.0.1 Gy与0 Gy比较 Figure 1 Heat maps of differentially expressed lncRNAs in AHH-1 cells induced by LDIR A. 0.05 Gy vs. 0 Gy; B. 0.1 Gy vs. 0 Gy |
2.差异表达lncRNAs的GO富集分析:与0 Gy相比,0.05 Gy照射后,差异lncRNAs主要参与成骨细胞增殖负调控和骨矿化正调控过程,在细胞组成中存在于含胶原蛋白的细胞外基质中,分子功能上参与钙离子结合等(图 2A)。在0.1 Gy照射后,差异表达lncRNAs主要参与单核细胞活化和骨骼肌细胞分化等过程,在细胞组成中主要存在于血小板α颗粒和神经元投射中,分子功能上主要参与染色质的结构成分等(图 2B)。
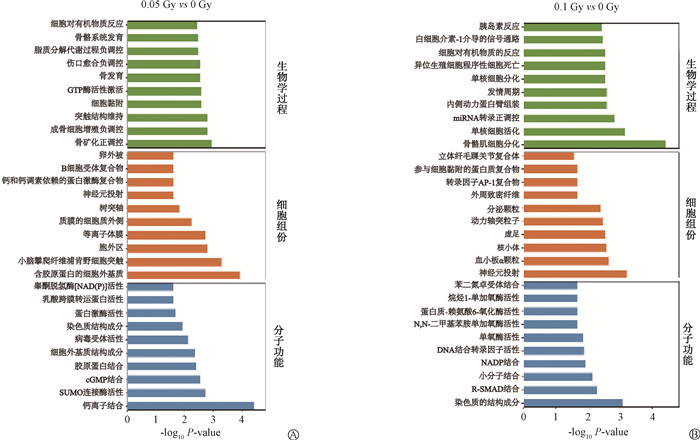
|
图 2 低剂量电离辐射照射差异表达lncRNAs的GO分析 A. 0.05 Gy与0 Gy比较;B. 0.1 Gy与0 Gy比较 Figure 2 GO analysis of differentially expressed lncRNAs induced by LDIR A. 0.05 Gy vs. 0 Gy; B. 0.1 Gy vs. 0 Gy |
3.筛选不同剂量照射后共同变化的lncRNAs及初步验证:为了筛选两个剂量照射下共同上调或下调的基因,根据0 Gy≤ 0.05 Gy < 0.1 Gy或0 Gy≥ 0.05 Gy > 0.1 Gy的标准进行第一步筛选,如图 3,在0.05和0.1 Gy照射后都上调的lncRNAs有19个,都下调的lncRNAs有25个(t=-2.53~4.28,P < 0.05);结合基因的差异倍数(fold change,FC)和每千碱基转录本每百万映射片段数(fragments per kilobase of exon model per million mapped fragments,FPKM)进行第二步筛选,两步共筛选出在两个剂量点表达改变均>2且表达趋势上调的4个lncRNAs为PRC1-AS1、NEAT1、SNHG1和SNHG15,应用qRT-PCR对筛选出的lncRNAs进行初步验证(图 4)。结果显示,PRC1-AS1在0.05 Gy照射后,表达水平显著升高,约为0 Gy的2倍(t=-44.69,P < 0.05),0.1 Gy照射后表达水平略有升高,但差异无统计学意义(P > 0.05);NEAT1在0.05 Gy照射后表达水平约为0 Gy组的1.5倍(t=-11.88,P < 0.05);SNHG1在照射后表达水平略有上调,但差异无统计学意义(P > 0.05);SNHG15在0.05 Gy照射后表达水平约为0 Gy组的1.8倍(t=-4.04,P < 0.05)。
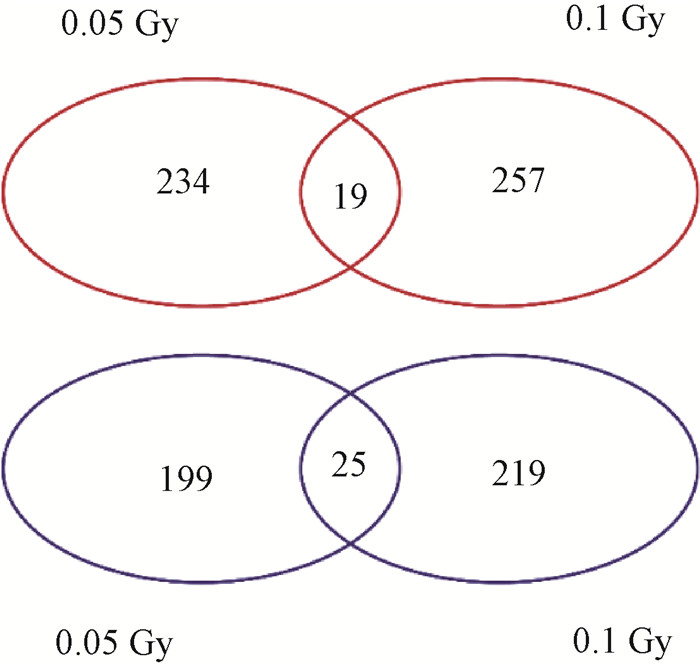
|
图 3 LDIR照射AHH-1细胞差异lncRNAs维恩图 Figure 3 Venn diagram of differentially expressed lncRNAs in AHH-1 cells induced by LDIR |
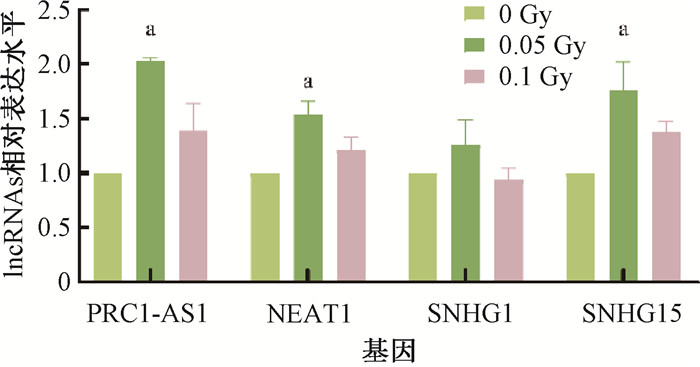
|
注:a与0 Gy相比,t=-44.69、-11.88、-4.04,P < 0.05 图 4 差异表达lncRNAs的验证 Figure 4 Validation of differentially expressed lncRNAs |
4.候选lncRNAs在细胞水平上的验证:利用0、0.02、0.05、0.075、0.1和0.2 Gy γ射线照射AHH-1细胞,照后4、24、48、72、96和120 h收取细胞提取RNA分析候选lncRNAs相对表达水平变化情况。结果显示,在照射后4~48 h,PRC1-AS1的相对表达水平显著升高,特别是在照射后24 h 0.1 Gy剂量组表达水平达到最高,约为0 Gy的3.5倍(t=-4.49,P < 0.05,图 5A)。lncRNA NEAT1在照射后4~48 h,0~0.2 Gy剂量组表达水平显著升高,在照射后4 h的0.075 Gy剂量组表达水平最高,约为未照射组的3.6倍(t=-6.60,P < 0.05),且NEAT1在0.02 Gy照射4~48 h后,表达水平均有不同程度的升高(图 5 B)。SNHG1在照后72 h的0.075~0.2 Gy组表达水平呈现出剂量依赖性升高(t=-2.97~-3.37,P < 0.05)(图 5 C)SNHG15相对表达量在照射后120 h 0~0.1 Gy组表现出随剂量增加而增加的变化趋势(t=-5.44~-4.72,P < 0.05)(图 5 D)。
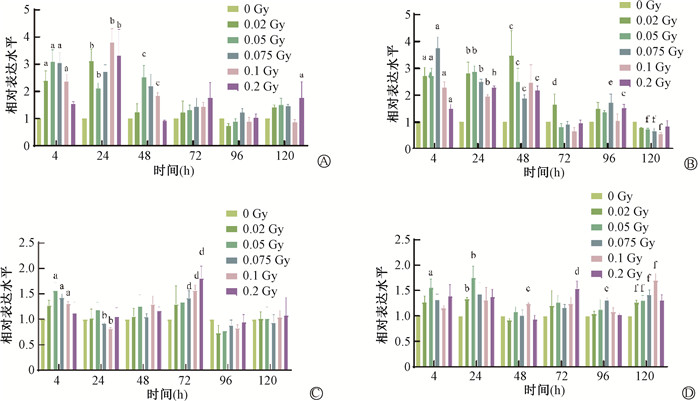
|
注:a与0 Gy相比,t=-8.60~-3.07,P < 0.05;b与0 Gy相比,t=-14.03~4.35,P < 0.05;c与0 Gy相比,t=-16.89~2.54,P < 0.05;d与0 Gy相比,t=-6.26~-2.97,P < 0.05;e与0 Gy相比,t=-4.67~-3.48,P < 0.05;f与0 Gy相比,t=-5.44~7.18,P < 0.05 图 5 LDIR照射AHH-1细胞4~120 h后PRC1-AS1(A)、NEAT1(B)、SNHG1(C)、SNHG15(D)表达水平变化 Figure 5 Changes in the relative expression levels of PRC1-AS1(A), NEAT1(B), SNHG1(C), and SNHG15(D) in AHH-1 cells subjected to LDIR for 4 h to 120 h |
5.候选lncRNAs在人外周血水平上的验证:结果显示,与0 Gy相比,照后24 h,lncRNA PRC1-AS1、NEAT1、SNHG1、SNHG15相对表达水平在各剂量点均显著升高(t=-1.85~-1.32,P < 0.05),其中0.2 Gy照射后PCR1-AS1、NEAT1、SNHG1、SNHG15的相对表达水平分别为0 Gy的3.5、2、2.5和2.5倍(t=-3.79~-2.87,P < 0.05),见图 6。
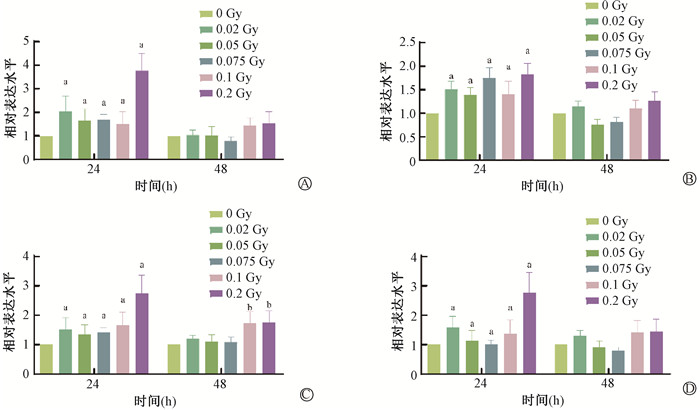
|
注:a与0 Gy相比,t=-3.79~-1.09,P < 0.05;b与0 Gy相比,t=-0.58、-1.41,P < 0.05 0.05 图 6 LDIR照射人外周血淋巴细胞不同时间PRC1-AS1(A)、NEAT1(B)、SNHG1(C)、SNHG15(D)相对表达水平变化 Figure 6 Changes in the relative expression levels of PRC1-AS1(A), NEAT1(B), SNHG1(C), and SNHG15(D) in human peripheral blood lymphocytes subjected to LDIR for 24 h and 48 h |
讨论
目前,关于低剂量电离辐射的生物效应机制尚不清楚,但已有研究表明,长期暴露于低剂量电离辐射可能会导致白内障和癌症等疾病的发生风险升高,因此,寻找特异敏感的辐射生物标志物,对长期暴露于低剂量电离辐射的人群筛选分类健康风险评估以及剂量估算是十分有必要的。近年来,非编码RNA在电离辐射生物标志物方面展现出巨大的潜力,有研究表明非编码RNA表达水平变化在辐射暴露后的几个月也可以被检测到[12],并且lncRNAs检测方法成熟,作为低剂量电离辐射生物标志物有很大优势。因此,本研究将探讨lncRNAs表达水平改变作为低剂量电离辐射生物标志物的可能性。研究表明,医疗照射是公众最主要的人为受照来源,约占总量的14%。目前,医疗诊断照射的平均有效剂量为3 mSv/人年,放射科医生和介入医生年平均有效剂量达到了5 mSv/年,而进行心血管成像的工作人员3年平均累积剂量达到23.1 mSv[13]。2013年UNSCEAR报告中指出,福岛核事故发生后3年内受到辐射暴露的妇女的甲状腺平均有效剂量比对照组至少高出20 mGy[14]。由此可见,无论是医疗照射、职业照射还是辐射事故,都与LDIR相关。因此,在本研究中选择了0、0.02、0.05、0.075、0.1和0.2 Gy的照射剂量进行实验,旨在更好地代表这些潜在照射,并有助于了解LDIR辐射生物效应。
本研究首先使用0、0.05和0.1 Gy γ射线照射AHH-1细胞,初步筛选出0.05和0.1 Gy照射后都上调的lncRNAs有19个,都下调的lncRNAs有25个。通过GO分析发现,0.05和0.1 Gy照射后差异表达的lncRNAs与成骨细胞增殖负调控、单核细胞活化和骨骼肌细胞分化等功能有关,这些分析结果显示,LDIR有可能影响细胞免疫代谢和细胞增殖等过程。在一个关于长期和单一LDIR暴露的小鼠模型研究中,使用0.05 Gy照射10次和0.5 Gy照射1次后发现,小鼠照射后有16个lncRNAs在免疫反应、炎症反应、免疫系统过程和免疫细胞激活方面显著富集[15]。因此推断,LDIR可能通过调控lncRNAs的表达,对细胞免疫代谢、细胞增殖以及免疫相关功能产生重要影响。为进一步明确候选lncRNAs的剂量效应关系,近年来许多研究通过使用细胞和血液等模型筛选低剂量辐射敏感的lncRNAs[15-16],在既往研究基础上,本研究应用0~0.2 Gy 6个剂量点照射AHH-1细胞和人外周血,分别在照射后4~120 h与24和48 h在细胞和人外周血水平上对候选lncRNAs的基因表达水平进行系统研究。人外周血离体培养时间过长后血细胞的活力以及数量可能会明显下降,进而影响RNA的浓度和质量,因此在人外周血水平的验证本研究选择了24和48 h。结果表明,LDIR诱导的PRC1-AS1和NEAT1基因表达水平改变满足作为辐射生物标志物的基本条件。
Martello等[17]研究发现,PRC1-AS1在肝脏损伤模型中有作为辐射生物标志物的潜力;Zhang等[18]发现,PRC1-AS1与肺鳞状细胞癌预后有关,可以作为肺鳞状细胞癌新的治疗靶点。NEAT1是核旁斑(paraspeckles)的重要组成部分,在多种生物学过程中发挥重要作用,如细胞活力、增殖、分化,肿瘤发生等[19-21]。有研究表明,电离辐射可能通过p53介导的途径调节NEAT1,并随后通过miR-448/GSDME轴影响人类结直肠癌细胞的焦亡和活力,从而增强放射抗性[22]。除此之外,PRC1-AS1和NEAT1都与m6A修饰有关,进而影响lncRNA的功能[18, 23-24]。SNHG1是人类癌症中最重要的调节基因之一,在结直肠癌、肝细胞癌、肺癌和食管癌等癌症中异常表达,与血管浸润、晚期肿瘤大小和总生存期等癌症的重要临床特征显著相关,可以作为多种癌症诊断、预后的标志物[25]。SNHG15在胃癌、骨肉瘤、乳腺癌等发展中作为致癌因子,在甲状腺癌中作为抑癌因子。SNHG15可以作为许多癌症的独立预后指标,并且可能是癌症诊断和治疗的前瞻性和有效的生物标志物[26]。
日常生活中的低剂量电离辐射更多的是长期照射,因此本研究下一步将在低剂量辐射暴露的人群血样中进行验证。综上所述,本研究初步证明了PRC1-AS1与NEAT1表达水平改变有作为LDIR之后的生物标志物的潜力。
利益冲突 无
作者贡献声明 王亚林负责实验设计和实施、数据采集和分析、撰写论文;李爽负责设计实验、论文修改和审阅;孙鑫负责采集数据、蔡恬静、陆雪指导论文撰写;刘青杰负责实验设计和论文修改
| [1] |
Belli M, Indovina L. The response of living organisms to low radiation environment and its implications in radiation protection[J]. Front Public Health, 2020, 8: 601711. DOI:10.3389/fpubh.2020.601711 |
| [2] |
United Nations Scientific Committee on the Effects of Atomic Radiation. UNSCEAR 2020/2021 report: biological mechanisms relevant for the inference of cancer risks from low-dose and low-dose-rate radiation[R]. New York: UNSCEAR, 2021: 1.
|
| [3] |
Little MP, Wakeford R, Borrego D, et al. Leukaemia and myeloid malignancy among people exposed to low doses (< 100 mSv) of ionising radiation during childhood: a pooled analysis of nine historical cohort studies[J]. Lancet Haematol, 2018, 5(8): e346-e358. DOI:10.1016/S2352-3026(18)30092-9 |
| [4] |
Mu H, Sun J, Li L, et al. Ionizing radiation exposure: hazards, prevention, and biomarker screening[J]. Environ Sci Pollut Res Int, 2018, 25(16): 15294-15306. DOI:10.1007/s11356-018-2097-9 |
| [5] |
Ainsbury EA, Barnard S. Sensitivity and latency of ionising radiation-induced cataract[J]. Exp Eye Res, 2021, 212: 108772. DOI:10.1016/j.exer.2021.108772 |
| [6] |
Baselet B, Rombouts C, Benotmane AM, et al. Cardiovascular diseases related to ionizing radiation: The risk of low-dose exposure (Review)[J]. Int J Mol Med, 2016, 38(6): 1623-1641. DOI:10.3892/ijmm.2016.2777 |
| [7] |
Pernot E, Hall J, Baatout S, et al. Ionizing radiation biomarkers for potential use in epidemiological studies[J]. Mutat Res, 2012, 751(2): 258-286. DOI:10.1016/j.mrrev.2012.05.003 |
| [8] |
Endesfelder D, Kulka U, Einbeck J, et al. Improving the accuracy of dose estimates from automatically scored dicentric chromosomes by accounting for chromosome number[J]. Int J Radiat Biol, 2020, 96(12): 1571-1584. DOI:10.1080/09553002.2020.1829152 |
| [9] |
Aryankalayil M, Bylicky MA, Chopra S, et al. Biomarkers for biodosimetry and their role in predicting radiation injury[J]. Cytogenet Genome Res, 2023, 163(3-4): 103-109. DOI:10.1159/000531444 |
| [10] |
Hall J, Jeggo PA, West C, et al. Ionizing radiation biomarkers in epidemiological studies-An update[J]. Mutat Res Rev Mutat Res, 2017, 771: 59-84. DOI:10.1016/j.mrrev.2017.01.001 |
| [11] |
Aryankalayil MJ, Chopra S, Levin J, et al. Radiation-induced long noncoding RNAs in a mouse model after whole-body irradiation[J]. Radiat Res, 2018, 189(3): 251-263. DOI:10.1667/RR14891.1 |
| [12] |
Kozlowska-Maslon J, Guglas K, Paszkowska A, et al. Radio-lncRNAs: Biological function and potential use as biomarkers for personalized oncology[J]. J Pers Med, 2022, 12(10): 1605. DOI:10.3390/jpm12101605 |
| [13] |
Tang FR, Loganovsky K. Low dose or low dose rate ionizing radiation-induced health effect in the human[J]. Environ Radioact, 2018, 192: 32-47. DOI:10.1016/j.jenvrad.2018.05.018 |
| [14] |
Ishikawa T. Radiation doses and associated risk from the fukushima nuclear accident[J]. Asia Pac J Public, 2017, 29(2 Suppl): 18S-28S. DOI:10.1177/1010539516675703 |
| [15] |
Qi Z, Guo S, Li C, et al. Integrative analysis for the roles of lncRNAs in the immune responses of mouse PBMC exposed to low-dose ionizing radiation[J]. Dose Response, 2020, 18(1): 1559325820913800. DOI:10.1177/1559325820913800 |
| [16] |
Konkova M, Abramova M, Kalianov A, et al. Mesenchymal stem cells early response to low-dose ionizing radiation[J]. Front Cell Dev Biol, 2020, 8: 584497. DOI:10.3389/fcell.2020.584497 |
| [17] |
Martello S, Ueda Y, Bylicky MA, et al. Developing an RNA signature for radiation injury using a human liver-on-a-chip model[J]. Radiat Res, 2024, 202(3): 489-502. DOI:10.1667/RADE-24-00047 |
| [18] |
Zhang P, Li H, Cheng X, et al. Comprehensive analysis of immune cell infiltration of m6A-related lncRNA in lung squamous cell carcinoma and construction of relevant prognostic models[J]. Biomed Res Int, 2022, 2022: 9139823. DOI:10.1155/2022/9139823 |
| [19] |
Lo P K, Wolfson B, Zhou Q. Cellula, physiological and pathological aspects of the long non-coding RNA NEAT1[J]. Front Biol (Beijing), 2016, 11(6): 413-426. DOI:10.1016/j.molcel.2022.05.027 |
| [20] |
Idogawa M, Nakase H, Sasaki Y, et al. Prognostic effect of long noncoding RNA NEAT1 expression depends on p53 mutation sstatus in Cancer[J]. J Oncol, 2019, 2019: 4757046. DOI:10.1155/2019/4368068 |
| [21] |
Jiang MC, Ni JJ, Cui W Y, et al. Emerging roles of lncRNA in cancer and therapeutic opportunities[J]. Am J Cancer Res, 2019, 9(7): 1354-1366. |
| [22] |
Su F, Duan J, Zhu J, et al. Long non-coding RNA nuclear paraspeckle assembly transcript 1 regulates ionizing radiation-induced pyroptosis via microRNA-448/gasdermin E in colorectal cancer cells[J]. Int J Oncol, 2021, 59(4): 79. DOI:10.3892/ijo.2021.5259 |
| [23] |
Lan Y, Liu B, Guo H. The role of m6A modification in the regulation of tumor-related lncRNAs[J]. Mol Ther Nucleic Acids, 2021, 24: 768-779. DOI:10.1016/j.omtn.2021.04.002 |
| [24] |
Farzaneh M, Masoodi T, Ghaedrahmati F, et al. An updated review of contribution of long noncoding RNA-NEAT1 to the progression of human cancers[J]. Pathol Res Pract, 2023, 245: 154380. DOI:10.1016/j.omtn.2021.04.002 |
| [25] |
Thin KZ, Tu JC, Raveendran S. Long non-coding SNHG1 in cancer[J]. Clin Chim Acta, 2019, 494: 38-47. DOI:10.1016/j.cca.2019.03.002 |
| [26] |
Shuai Y, Ma Z, Lu J, et al. LncRNA SNHG15:a new budding star in human cancers[J]. Cell Prolif, 2020, 53(1): e12716. DOI:10.1111/cpr.12716 |
 2025, Vol. 45
2025, Vol. 45


