2. 中国医学科学院放射医学研究所 天津市放射医学与分子核医学重点实验室,天津 300192
2. Tianjin Key Laboratory of Radiation Medicine and Molecular Nuclear Medicine, Institute of Radiation Medicine, Chinese Academy of Medical Sciences, Tianjin 300192, China
放射治疗是癌症治疗的有效手段,但不可避免地会伴随不良反应的发生,并导致多种临床并发症,严重影响患者的生活质量和治疗效果[1]。放射性肠损伤是放疗过程中最常见的并发症之一,导致肠黏膜屏障结构和功能受损,如上皮细胞损伤、促炎因子释放、肠道菌群失调等[2],以及肠壁黏膜下小动脉的血管内皮细胞受损伤,导致黏膜缺血、缺氧,进而引发炎症反应。吲哚-3-甲醛(indole-3-aldehyde, I3A)是色氨酸代谢的重要产物。已有研究表明,I3A在机体炎症反应中发挥重要作用,主要通过降低促炎细胞因子的表达、保护肠道屏障功能和激活抗氧化等机制减轻炎症反应和促进损伤修复[3]。菊粉(inulin)是一种天然的可溶性膳食纤维,菊粉作为益生元,能够促进肠道内有益菌群(如双歧杆菌和乳酸菌)的生长,从而改善肠道内微生态的平衡,增强肠道屏障功能。菊粉水凝胶是一种由菊粉衍生而来的水凝胶材料,不仅具有良好的生物相容性,还具有多种生物活性,且更易负载I3A,在放射性肠损伤的治疗中表现出一定的潜力。因此,本实验选择菊粉水凝胶作为I3A的递送载体。本研究旨在通过探讨菊粉水凝胶负载I3A对放射性肠损伤的防护作用和机制,为放射性肠损伤防护提供新的策略和方法。
材料与方法1.主要试剂与仪器:小鼠肠上皮细胞(Mode-k)购自美国典型培养物保藏中心(ATCC)。I3A购自上海麦克林生化科技有限公司,菊粉购自上海维乐夫生物有限公司,DMEM完全培养基购自美国GIBCO公司,CCK-8试剂盒购自上海碧云天生物技术有限公司,Anti-Ki67购自英国Abcam公司,原位末端标记(Tunel)细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,PCR引物购自上海生工生物工程股份有限公司,倒置荧光显微镜购自日本Nikon公司,流变仪购自美国TA Instruments公司,酶标仪购自美国ThermoFisher公司,137Cs γ射线放射源(Gammacell-40)购自加拿大Best Theratronics公司。
2.实验动物及照射条件:雄性C57BL/6小鼠(合格证号:No.110322241101901137),6~8周龄,体质量18~20 g,由北京华阜康生物科技股份有限公司提供[许可证号:SCXK(京)2024-0003],饲养于中国医学科学院北京协和医学院放射医学研究所实验动物中心。所有小鼠在无特定病原体(SPF)环境下,室内维持恒温(23 ± 2)℃、相对湿度45%~50%及空气过滤(净化级别达100级),给予12 h昼夜交替光源,实验动物所用的笼具、垫料、饲料、饮水等均经过严密消毒。所有实验动物均在过量异氟烷麻醉下无痛进行。所有动物的饲养和实验均已获得中国医学科学院放射医学研究所动物实验伦理委员会批准[批准号:SYXK(津)024-0003]。
将18只雄性C57BL/6小鼠按体重分层随机分为对照组(不予任何处理的健康小鼠)、单纯照射组(137Cs γ射线腹部照射,剂量为17 Gy)和照射+ 水凝胶防护组,每组6只。照射+水凝胶防护组小鼠腹部照射前2 d给予200 μl/d的负载I3A的菊粉水凝胶灌胃,其中I3A的浓度为10 μg/μl[4]。第3天进行17 Gy单次照射。第5和6天连续给予照射+ 水凝胶防护组相同剂量水凝胶。照射组在相同时间段给予等量的无菌水灌胃。第7天处死并收集小鼠肠组织和粪便。取十二指肠至肛门处肠道测量总长度,取空肠中部肠组织置于4%多聚甲醛溶液中固定,用于后续组织病理学研究。取小鼠回肠中段置于液氮中保存用于检测炎性因子含量。收集粪便用于16S rRNA测序。
3.负载I3A的菊粉水凝胶的制备及理化性质评价:将菊粉与超纯水以1∶1的质量比混合并加入I3A(10 μg/μl),在60℃水浴锅中反应2 h后,涡旋搅拌均匀,室温放置,待自然冷却后翻转小瓶,判断其是否成胶。采用流变仪检测储能模量G′与损耗模量G″变化趋势,以说明菊粉水凝胶在时间、剪切应变和角速率不同的条件下的机械性能。
4.CCK-8实验检测生物相容性:取对数生长期的Mode-k细胞以9 × 103/孔接种于96孔板中,加入DMEM培养基并将其置于37℃、5%CO2的细胞孵育箱中培养。待细胞贴壁后,添加不同浓度菊粉水凝胶,分别培养24和48 h后,超净台中避光加入含10 μl/孔CCK-8检测液的100 μl DMEM培养液,在孵箱中继续培养0.5 h,使用波长为450 nm的酶标仪上机检测。根据吸光度(A)值计算细胞的存活率,在体外考察负载I3A的菊粉水凝胶的生物相容性。
5.苏木精-伊红(HE)染色检测肠上皮组织病理变化:将固定好的组织样本进行脱水、透明化、石蜡包埋、4 μm切片、脱蜡、HE染色及封片。将染色后的切片在显微镜下随机选取5个不重叠的肠组织视野进行观察记录,分析不同组的小肠组织的病理结构和细胞形态。
6.Ki67染色检测细胞增殖: 将制作好的肠组织切片通过免疫组织化学(IHC)染色检测Ki67的表达,评估肠上皮细胞的增殖状态。将3组切片进行脱蜡和复水、抗原修复、5%胎牛血清(BSA)进行封闭、与Ki67抗体(1∶200稀释)4℃下孵育过夜、37℃二抗孵育、二氨基联苯胺(DAB)显色、HE染色细胞核、封片。然后在光学显微镜下随机选取5个不重叠的肠组织视野进行观察拍照。
7.TUNEL检测细胞凋亡:将肠组织石蜡切片烤片后置于二甲苯中脱蜡处理,然后乙醇梯度复水(100%、95%、85%、75%)。向切片中的肠组织上滴加20 μg/ml不含DNase的蛋白酶K,常温下作用30 min后用磷酸盐缓冲液(PBS)将蛋白酶K洗涤干净。使用TUNEL细胞凋亡检测试剂盒检测。反应完成后PBS洗涤,抗荧光淬灭封片液封片,在荧光显微镜下随机选取5个不重叠的肠组织视野拍照记录。
8.实时荧光定量PCR检测肠组织炎性细胞因子和抗氧化因子:使用总RNA提取试剂(TRIzol)法,提取回肠组织中的总RNA,应用反转录试剂盒将所提取的RNA反转录为cDNA,并以cDNA为模板通过qPCR定量检测促炎基因、抗炎基因和抗氧化基因的表达,包括IL-1β、IL-6、TNF-α、IL-10、NRF-2、HO-1。将基因表达相对GAPDH(甘油醛-3-磷酸脱氢酶)标准化。扩增条件为:95℃,2~5 min;95℃,15~30 s;50~65℃,15~30 s; 72℃,30 s~60 s,进行35个循环。各基因引物如表 1所示,应用2-ΔΔCt法进行分析目的基因的相对表达量。
|
|
表 1 RT-PCR引物序列 Table 1 RT-PCR primer sequences |
9.粪便16S rRNA测序检测肠道菌群变化:收集单纯照射组和照射+ 水凝胶防护组小鼠的粪便送至青岛百迈客生物科技有限公司进行16S rRNA测序分析。基于特征分析结果,对样品在各个分类水平上进行分类学分析,获得各组在门、纲、目、科、属、种分类学水平上的群落结构图。通过α多样性分析,研究单个样品内部的物种多样性,统计了各样品的Ace、Chao1、Shannon指数。通过β多样性分析,比较不同样品在物种多样性方面(群落组成及结构)存在的差异。
10.统计学处理:数据应用GraphPad Prism 9软件进行统计学分析,所有实验至少重复3次。实验数据符合正态分布,方差齐,采用 x±s表示。两组间的差异使用Student′s t检验。多组独立样本间采用单因素方差分析,选择LSD法进行组间的两两比较。P<0.05为差异具有统计学意义。
结果1.负载I3A的菊粉水凝胶的制备、理化性质表征及体外安全性评价:示于图 1角频率(ω)为1 rad/s,剪切应变(γ)为1%,时间为1~150 s范围内与γ为1%,ω在1~30 rad/s内,储能模量G′始终大于损耗模量G″,说明该材料在上述两种条件下表现出稳定的凝胶状态。ω为10 rad/s的条件下,γ在1%~100%范围内变化,储能模量G′大于损耗模量G″,随剪切应变继续增加,曲线出现交叉点,说明此时材料呈流体状态,即表明材料具备可注射性。
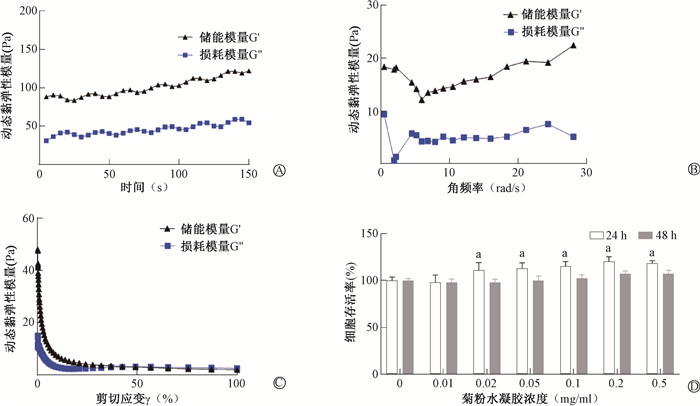
|
注:a与0 mg/ml比较,t=2.59、3.98、5.45、7.31、8.75,P < 0.05 图 1 菊粉水凝胶的物化表征 A.储能/损耗模量(G′/G″)随时间(1~150 s)的变化曲线;B.储能/损耗模量(G′/G″)随角频率(1~30 rad/s)的变化曲线;C.储能/损耗模量(G′/G″)随剪切应变(1%~100%)的变化曲线;D. Mode-k细胞存活率 Figure 1 Characterization of inulin-based hydrogel A. Changes in storage/loss modulus (G′/G″) over time(1~150 s); B. Changes in storage/loss modulus (G′/G″) with angular frequency (1 to 30 rad/s); C. Changes in storage/loss modulus (G′/G″) with shear strain (1% to 100%); D. Mode-k cell viability |
不同浓度的菊粉水凝胶(0、0.01、0.02、0.05、0.1、0.2和0.5 mg/ml)与肠上皮细胞共培养24 h后,除0.01 mg/ml外,均显示其存活细胞的比例较0 mg/ml组略有升高,差异具有统计学意义(t=2.59、3.98、5.45、7.31、8.75,P < 0.05)。提示菊粉水凝胶在一定程度上促进小鼠肠上皮细胞增殖。
2.负载I3A的菊粉水凝胶可促进肠道形态学的改善: 结果显示,照射+水凝胶防护组小鼠的红细胞(5.43±0.69)×1012/L、白细胞(2.24±0.88)×109/L和淋巴细胞(0.99±0.31)×109/L与单纯照射组比较差异无统计学意义(P > 0.05),说明菊粉水凝胶没有产生血液学不良反应。如图 2所示,单纯照射组小鼠空肠组织严重受损,肠壁变薄,小肠绒毛脱落和隐窝的深度增加。由表 2可见,照射+水凝胶防护组小鼠的肠道总长度明显高于单纯照射组(t=3.24,P < 0.05)。与单纯照射组比,照射+水凝胶防护组肠道组织的结构完整性明显增强,且肠绒毛长度有显著改善(t=14.66,P < 0.05),表明菊粉水凝胶负载I3A可有效改善辐射对肠组织的损伤。
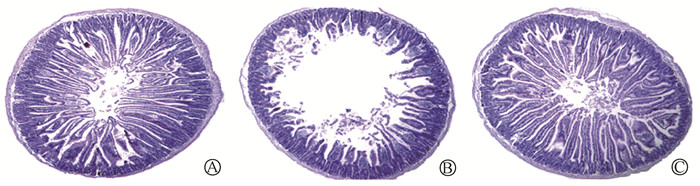
|
图 2 各组小鼠辐射后肠损伤情况HE染色×5 A.空白对照组;B.单纯照射组;C.照射+水凝胶防护组 Figure 2 The intestinal injury conditions of mice in each group after radiation HE staining ×5 A. Control group; B. Irradiation group; C. Irradiation + Hydroge group |
|
|
表 2 各组小鼠的肠道总长度及绒毛长度(x±s) Table 2 Total intestinal lengths and villus lengths of various groups of mice (x±s) |
3. 负载I3A的菊粉水凝胶促进受损肠组织中的细胞增殖:照射+水凝胶防护组中Ki67+细胞(73.00±5.19)%明显多于单纯照射组(44.33±2.88)%,两组比较差异有统计学意义(t=8.35,P < 0.05)。各组的空肠Ki67+细胞免疫组织化学染色,见图 3。因此,负载I3A的照射+水凝胶防护组的细胞增殖活跃,肠道组织可以有效地进行修复。
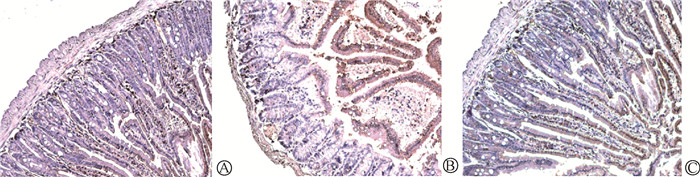
|
图 3 Ki67+细胞在小鼠空肠隐窝基底部的增殖染色图Ki67染色×20 A.空白对照组;B.单纯照射组;C.照射+水凝胶防护组 Figure 3 Immunohistochemical staining of Ki67+ cell proliferation in the mouse jejunal crypt base Ki67 staining ×20 A. Control group; B. Imadiation group; C. Irradiation+Hydrogel group |
4. 负载I3A的菊粉水凝胶可减缓肠组织中细胞凋亡:与单纯照射组的(50.67±2.08)%相比,照射+ 水凝胶防护组的细胞凋亡水平为(23.67±5.50)%,差异有统计学意义(t=7.94,P < 0.05)。
5.负载I3A的菊粉水凝胶对放射性肠损伤起到抗炎抗氧化的作用: 照射+水凝胶防护组小鼠促炎因子IL-1β、IL-6、TNF-α的mRNA相对表达量较单纯照射组明显降低(t=5.15、3.82、3.83,P < 0.05)。相反,抗炎因子IL-10的相对表达量则显著升高(t=3.16,P < 0.05)。另外,照射+水凝胶防护组中的抗氧化因子NRF-2、HO-1的表达远高于单纯照射组,这表明负载I3A的菊粉水凝胶不仅改善了辐射诱导的炎症反应,而且增强了肠道组织的抗氧化防御机制(t=24.83、5.92,P < 0.05),见表 3。
|
|
表 3 各组小鼠炎症及抗氧化因子mRNA相对表达量(x±s) Table 3 Relative mRNA expression levels of pro-inflammatory and antioxidant factors in various groups of mice (x±s) |
6.负载I3A的菊粉水凝胶调节的肠道菌群:结果示于图 4。α多样性指数差异分析表明,空白对照组、单纯照射组和照射+水凝胶防护组之间的物种丰富度和多样性差异无统计学意义(P>0.05)。β多样性中主坐标分析表明,照射+水凝胶防护组与单纯照射组相比,小鼠肠道中微生物群的组成发生了改变。为进一步探讨不同组中的肠道菌群变化情况,对科水平的物种分布图做出统计分析。结果显示,以乳酸菌科(Lactobacillaceae)和拟杆菌科(Bacteroidaceae)为代表的益生菌菌群在照射+水凝胶防护组的物种丰度较照射组明显升高(t=2.75、2.31,P < 0.05)。相反,有害菌群如厄里斯皮氏菌科(Erysipelotrichaceae)在照射+水凝胶防护组中的丰度则有所降低(t=2.47,P < 0.05),见表 4。
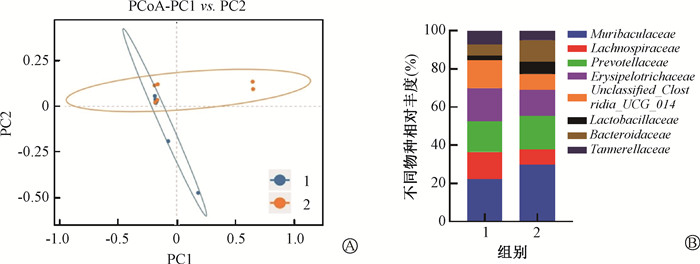
|
注:1.单纯照射组;2.照射+水凝胶防护组 图 4 两组小鼠粪便16S rRNA测序分析 A. Beta多样性主成分分析;B. 物种分布图 Figure 4 16S rRNA sequencing analyses of fecal from two groups of mice A. Beta diversity principal coordinate analysis; B. Species distribution map |
|
|
表 4 两组小鼠肠道菌群在科水平的相对丰度(%,x±s) Table 4 Relative abundance of gut microbiota at the family level in two groups of mice (%, x±s) |
讨论
腹部放疗引发的放射性肠损伤是临床不可忽视的问题[5-6], 放射性肠损伤涉及多个分子通路。首先,放射线能够引起细胞内DNA的单链和双链断裂,进而导致细胞凋亡或失控的细胞增殖[7]。其次,辐射通过水分子的电离作用产生自由基(如羟基自由基),导致细胞膜、蛋白质和DNA的氧化损伤,进一步损伤细胞结构,引发炎症反应。例如,炎症因子(TNF-α、IL-6、IL-1β等)的表达升高会激活NF-κB、MAPK等信号通路,导致肠道炎症和损伤[8]。本研究PCR结果显示,照射组炎症因子的表达量高于空白对照组和照射+ 水凝胶防护组,而抗氧化因子的表达则显著低于其他两组。这一结果表明,辐射确实激活了相关的炎症通路和抗氧化机制。因此,负载I3A的菊粉水凝胶通过减少炎症和增强抗氧化防御来提供双重益处。
免疫反应的失调可能导致肠道微生物群的改变,从而进一步影响肠道的功能和整体健康[9]。已有研究表明,肠道菌群与维持肠道屏障及免疫调节密切相关[10]。健康的肠道菌群能够通过竞争性排斥和产生抗微生物物质来抑制病原体的生长,从而保护宿主免受感染[11]。此外,某些益生菌(如乳酸杆菌和双歧杆菌)被认为具有增强免疫反应的能力,可以提高宿主对感染的抵抗力[12]。研究表明,电离辐射直接影响肠道菌群的多样性和丰度,尤其是对厌氧菌和乳酸菌等有益菌群的抑制,从而导致肠道微生态失衡[13]。这种失衡可能促进病原菌的增殖,从而加剧肠道炎症反应,进一步损害肠道屏障。因此,本研究通过粪便测序研究发现负载I3A的菊粉水凝胶通过抑制有害菌群、促进有益菌群来调节肠道菌群的组成。
目前,针对放射性肠损伤的防护措施主要包括药物治疗(如抗氧化剂和抗炎药物)、营养支持和肠道保护剂等[14]。然而,这些方法往往伴随着不同程度的不良反应,且治疗效果有限[15]。有研究报道,菊粉能够调节肠道微生物群的结构,促进有益菌的增殖并限制有害菌生长,最终对肠道健康和抑制炎症产生积极的辅助作用[16]。另外,I3A能有效增强小鼠肠道上皮屏障功能,抑制小鼠结肠炎的发生,具有抗炎抗氧化并维持肠道稳态的功能[17-18]。但大多数研究集中在通过调节色氨酸代谢,间接调控机体中I3A的含量以发挥其作用[19]。更重要的一点是为了避免溶解I3A过程中所用有机溶剂的毒性以及简化材料的制备过程[20]。所以本研究选用菊粉水凝胶负载I3A,期望能够提升其稳定性和生物利用度,发挥抗炎和免疫调节方面的联合效应。结果表明,本实验制备负载I3A的菊粉水凝胶,一方面可以避免肠道辐射后组织结构的严重紊乱,抑制辐射诱导的肠道缩短;另一方面,由于水凝胶特有的三维立体结构和黏弹性可为细胞培养提供一定的力学支撑,所以不仅促进了肠道细胞的增殖,还降低了因辐射引起的细胞凋亡,从而有利于维持辐射损伤后肠道组织的完整性和功能,为肠道屏障修复提供了有利条件。
本研究存在的不足:负载I3A的菊粉水凝胶的抗炎及抗氧化作用仅讨论了细胞因子层面的作用,后续实验可对相关信号通路进一步探究;其次,对于菊粉水凝胶在肠道内的缓释性和靶向性,还需要进一步研究和验证。由于建模时间较短,研究并未表现出对血液的防护效果以及肠道菌群在α多样性指数分析上的差异。未来将进一步探索其在临床上的应用,为放射性肠损伤防护提供新的思路和方法,为癌症患者提供更为安全有效的放射治疗辅助方案。
利益冲突 无
作者贡献声明 李拓负责实验设计、实验操作、数据整理、撰写论文;马菲菲、管杰冰、谢思宇、王宁、何宁宁、李建国负责协助部分实验和论文整理;宋会娟、刘强指导实验设计和论文修改
| [1] |
Wang K, Tepper JE. Radiation therapy-associated toxicity: etiology, management, and prevention[J]. CA Cancer J Clin, 2021, 71(5): 437-454. DOI:10.3322/caac.21689 |
| [2] |
Xin JY, Wang J, Ding QQ, et al. Potential role of gut microbiota and its metabolites in radiation-induced intestinal damage[J]. Ecotoxicol Environ Saf, 2022, 248: 114341. DOI:10.1016/j.ecoenv.2022.114341 |
| [3] |
Zelante T, Puccetti M, Giovagnoli S, et al. Regulation of host physiology and immunity by microbial indole-3-aldehyde[J]. Curr Opin Immunol, 2021, 70: 27-32. DOI:10.1016/j.coi.2020.12.004 |
| [4] |
Swimm A, Giver CR, DeFilipp Z, et al. Indoles derived from intestinal microbiota act via type I interferon signaling to limit graft-versus-host disease[J]. Blood, 2018, 132(23): 2506-2519. DOI:10.1182/blood-2018-03-838193 |
| [5] |
江津, 张松灵, 赵舒雅, 等. 海藻糖对小鼠放射性肠损伤的防护作用及机制研究[J]. 国际放射医学核医学杂志, 2024, 48(4): 244-256. Jiang J, Zhang SL, Zhao SY, et al. Protective effect and mechanism of trehalose on ionizing radiation induced intestinal damage in mice[J]. Int J Racliat Med Nucl Med, 2024, 48(4): 244-256. DOI:10.3760/cma.j.cn121381\|202403011\|00414 |
| [6] |
梁洋帆, 田思佳, 路倩颖, 等. 非编码RNA在放射性肠损伤中的研究进展[J]. 国际放射医学核医学杂志, 2024, 48(9): 595-600. Liang YF, Tian SJ, Lu QY, et al. Research aclvancement on non|coding RNA in radiation|induced intestinal injury[J]. Int J Racliat Med Nucl Med, 2024, 48(9): 595-600. DOI:10.3760/cma.j.cn121381-202309021-00446 |
| [7] |
Hu B, Jin C, Li HB, et al. The DNA-sensing AIM2 inflammasome controls radiation-induced cell death and tissue injury[J]. Science, 2016, 354(6313): 765-768. DOI:10.1126/science.aaf7532 |
| [8] |
Chaves-Pérez A, Yilmaz M, Perna C, et al. URI is required to maintain intestinal architecture during ionizing radiation[J]. Science, 2019, 364(6443): eaaq1165. DOI:10.1126/science.aaq1165 |
| [9] |
Wang L, Lynch C, Pitroda SP, et al. Radiotherapy and immunology[J]. J Exp Med, 2024, 221(7): e20232101. DOI:10.1084/jem.20232101 |
| [10] |
Paone P, Cani PD. Mucus barrier, mucins and gut microbiota: the expected slimy partners[J]. Gut, 2020, 69(12): 2232-2243. DOI:10.1136/gutjnl-2020-322260 |
| [11] |
Kim S, Seo SU, Kweon MN. Gut microbiota-derived metabolites tune host homeostasis fate[J]. Semin Immunopathol, 2024, 46(1-2): 2. DOI:10.1007/s00281-024-01012-x |
| [12] |
Suez J, Zmora N, Segal E, et al. The pros, cons, and many unknowns of probiotics[J]. Nature Med, 2019, 25(5): 716-729. DOI:10.1038/s41591-019-0439-x |
| [13] |
Wang W, Cui B, Nie Y, et al. Radiation injury and gut microbiota-based treatment[J]. Protein Cell, 2024, 15(2): 83-97. DOI:10.1093/procel/pwad044 |
| [14] |
Zhou Y, Li K, Adelson DL. An unmet need for pharmacology: treatments for radiation-induced gastrointestinal mucositis[J]. Biomed Pharmacother, 2024, 175: 116767. DOI:10.1016/j.biopha.2024.116767 |
| [15] |
Wu J, Gou W, Wang Z, et al. Discovery of the radio-protecting effect of Ecliptae Herba, its constituents and targeting p53-mediated apoptosis in vitro and in vivo[J]. Acta Pharm Sin B, 2023, 13(3): 1216-1230. DOI:10.1016/j.apsb.2022.09.003 |
| [16] |
Tawfick MM, Xie H, Zhao C, et al. Inulin fructans in diet: Role in gut homeostasis, immunity, health outcomes and potential therapeutics[J]. Int J Biol Macromol, 2022, 208: 948-961. DOI:10.1016/j.ijbiomac.2022.03.218 |
| [17] |
Ma M, Wang Y, Fan S, et al. Urolithin a alleviates colitis in mice by improving gut microbiota dysbiosis, modulating microbial tryptophan metabolism, and triggering ahr activation[J]. J Agric Food Chem, 2023, 71(20): 7710-7722. DOI:10.1021/acs.jafc.3c00830 |
| [18] |
Scott SA, Fu J, Chang PV. Microbial tryptophan metabolites regulate gut barrier function via the aryl hydrocarbon receptor[J]. Proc Natl Acad Sci USA, 2000, 117(32): 19376-19387. DOI:10.1073/pnas.2000047117 |
| [19] |
Wang Y, Ji X, Zhao M, et al. Modulation of tryptophan metabolism via AHR-IL22 pathway mediates the alleviation of DSS-induced colitis by chitooligosaccharides with different degrees of polymerization[J]. Carbohydr Polym, 2023, 319: 121180. DOI:10.1016/j.carbpol.2023.121180 |
| [20] |
Xie LW, Cai S, Lu HY, et al. Microbiota-derived I3A protects the intestine against radiation injury by activating AhR/IL-10/Wnt signaling and enhancing the abundance of probiotics[J]. Gut Microbes, 2024, 16(1): 2347722. DOI:10.1080/19490976.2024.2347722 |
 2025, Vol. 45
2025, Vol. 45


