2. 空军军医大学预防医学系辐射防护医学教研室/特殊作业环境危害评估与防治教育部重点实验室,西安 710032
2. Radiation Protection Medicine, Department of Preventice Medicine, Air Force Medical University Ministry of Education Key Lab of Hazard Assessment and Control in Special Operational Environment, Xi′an 710032, China
电离辐射损伤与受照组织中氧化应激增加密切相关[1],通过分解水分子等方式导致活性氧(reactive oxygen species,ROS)增加[2]。ROS迅速与蛋白质等大分子反应,导致细胞功能障碍和凋亡[1],且损伤呈非线性[3],高剂量电离辐射加剧ROS生成、脂质过氧化,削弱抗氧化防御[4],低于0.5 Gy电离辐射所致ROS对受照组织的生物学效应尚不明确[5-6]。机体中ROS的来源有还原型辅酶Ⅱ(NADPH)氧化酶(NOX)[7]、胱硫醚γ-赖氨酸酶(cystathionine γ-lyase,CSE)等。0.5 Gy电离辐射引起ROS升高由NOX介导[8]。NOX激活可能在辐射诱导的氧化应激和结肠癌发生中发挥重要作用[9-10]。胃肠道中高表达NOX家族成员[11-12],ROS持续表达对肠道功能影响大[13]。但小剂量电离辐射是否通过NOX使机体持续产生ROS影响肠道尚不清楚。本研究中,建立0.1、0.2和0.5 Gy γ射线小鼠全身辐射模型,探究小剂量电离辐射对肠道ROS水平和NOX的影响,为评估小剂量电离辐射生物学效应提供理论和实验依据。
材料与方法1.主要试剂和仪器:60 Co γ射线源由空军军医大学放射教研室提供,NOX1、NOX4抗体购自美国Affinity公司,DUOX2抗体购自美国Santa Cruz Biotechnology公司,GAPDH抗体购自美国Proteintech公司,p65 NF-κB、β-肌动蛋白购自英国abcam公司,过氧化氢检测试剂盒购自上海碧云天公司,RIPA缓冲液购自美国Thermo公司,TRIzol试剂溶液购自美国Invitrogen公司,PrimeScriptTMRT可去除gDNA的PCR反转录试剂盒购自日本TaKaRa公司,兔源性抗原免疫组化试剂盒购自上海翌圣生物公司,梯度PCR仪器购自美国ABI公司。
2.实验动物及照射条件:采用SPF级别6~8周龄雄性C57BL/6小鼠[第四军医大学动物中心,生产许可证号:scxk (陕)2024-007],体质量18~25 g,饲养于空军军医大学动物中心,室温22~24℃,湿度50%~60%,昼夜规律(12 h/12 h),自由饮食。采用60Co γ射线对小鼠进行全身照射,吸收剂量率为13 mGy/min,照射距离为80 cm,分为0、0.1、0.2和0.5 Gy组,每组10只。本研究中所有的动物实验均经空军军医大学动物福利委员会批准(审批号:IACUC—20220123)。照射后20周处死小鼠,收集空肠、结肠、回肠组织。肠道组织分别用10%甲醛固定和液氮速冻,进行后续检测。
3.免疫组织化学检测:取空肠、回肠、结肠组织标本4 μm切片,进行苏木精-伊红(HE)染色。在光镜下采用Chiu′s评分评估肠组织损伤:正常为0分;绒毛顶端上皮下间隙增宽为1分;绒毛顶端上皮下间隙进一步扩大,绒毛尖端上皮抬高与固有膜剥离为2分;绒毛上皮成块脱落为3分;上皮完全脱落,仅有固有膜为4分;固有膜层崩裂,出现出血与溃疡为5分。
对NADPH氧化酶进行免疫组织化学染色。一抗在4℃孵育12 h,NOX1抗体、NOX4抗体、DUOX2抗体稀释浓度为1∶250,后用50 μl生物素标记的羊抗兔IgG,37℃孵育30 min,随后用50 μl辣根酶标记的链酶卵白素37℃孵育20 min。每张切片滴加新鲜配制的二氨基联苯胺(DAB)工作液50 μl孵育3~5 min,光学显微镜下观察染色结果;显色后用自来水冲洗切片终止显色,苏木素孵育1~5 min,自来水冲洗5 min。在光学显微镜下进行细胞计数,每张切片随机选择10个视野,细胞质内无染色计0分,淡黄色计1分,棕色计2分,棕褐色计3分。
4.实时定量PCR检测:使用TRIzol试剂提取总RNA。1 μg总RNA使用可去除gDNA的PCR反转录试剂盒在20 μl反应体系中合成cDNA,37℃ 15 min,85℃ 5 s,4℃ 10 min。采用Primer3.0设计引物(表 1)。qRT-PCR采用ABI 7500实时荧光定量PCR系统。反应过程从95℃开始,持续30 s,然后进行40个循环,95℃变性5 s,60℃延伸40 s。采用比较Ct(2-ΔΔCt)法测定靶基因mRNA的相对表达量,并归一化为18S rRNA的表达量。
|
|
表 1 RT-PCR引物序列 Table 1 RT-PCR primer sequences |
5.蛋白印迹检测:取各组小鼠结肠、回肠、空肠样本每250 mg加入1 mlRIPA裂解液后用研磨珠研磨组织,冰上静置后提取蛋白。二喹啉甲酸(bicinchoninic acid assay, BCA)蛋白定量后,加上样缓冲液煮沸,样品进行SDS-聚丙烯酰胺凝胶电泳分离,浓缩胶80 V 30 min,分离胶120 V 60 min,之后恒流250 mA湿转90 min到PVDF膜后,于5%脱脂奶粉封闭液封闭2 h,依次孵育一抗NOX1、NOX4、DUOX2、GAPDH、p65-κB、β-肌动蛋白, 稀释浓度为1∶1 000,4℃过夜和二抗抗体室温1 h。二抗稀释比例为1∶4 000。电化学发光试剂A和B液等比例混合后平铺于膜上,使用电化学发光(ECL)成像系统反应曝光,Image lab图像处理系统分析目标蛋白条带的灰度值,以GADPH、β-肌动蛋白作内参照对比得到的相对灰度值进行分析。
6.活性氧水平测定:各肠道组织按照每5~10 mg加入100~200 μl裂解液的比例进行匀浆。4℃约12 000 r/min,离心3~5 min,离心半径8 cm,取上清用于后续测定。根据试剂盒说明书,使用过氧化氢检测测定上清液中的H2O2水平。
7.统计学处理:采用SPSS 22.0软件进行分析,作图工具选用GraphPad Prism 9.5.1、ImageJ软件。计量资料符合正态分布、方差齐,数据以 x±s表示,两组间比较采用独立样本t检验。P<0.05为差异具有统计学意义。
结果1.不同剂量γ射线照射后20周小鼠肠道形态的影响:如图 1所示,在光学显微镜下0 Gy组小鼠空肠、回肠、结肠黏膜结构完整,柱状上皮细胞排列整齐,无炎性细胞浸润及水肿迹象。与0 Gy组相比,0.5 Gy照射组小鼠空肠中绒毛较粗短,与其他组相比绒毛长度略短,但差异均有统计学意义(t=2.48、3.25、2.15,P < 0.05); 潘氏细胞略微增多,但差异无统计学意义(P > 0.05);回肠中肠道绒毛有融合现象;结肠中隐窝间隙变大,染色变淡;而0.1和0.2 Gy剂量组无明显形态学变化。各照射剂量组均未达到Chiu′s评分中肠损伤的标准。提示0.5 Gy辐射剂量可轻微改变小鼠的空肠、回肠和结肠形态学结构,而0.2 Gy剂量对小鼠肠道形态学无明显影响。
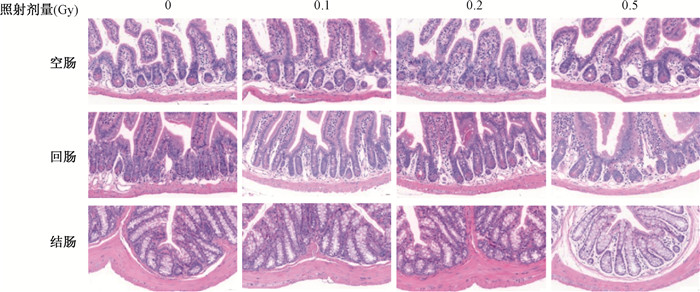
|
图 1 不同剂量γ射线照射后小鼠肠道形态组织学变化HE染色×400 Figure 1 Histological changes in the intestinal morphologies of mice at different doses of γ-rays HE ×400 |
2.不同剂量γ射线对小鼠肠道黏膜氧化应激的影响:由表 2可见,与0 Gy组相比,0.1和0.5 Gy组小鼠空肠中H2O2表达量显著增高,差异有统计学意义(t=4.12、8.67,P < 0.05);0.1 Gy组小鼠回肠中H2O2表达量增高,差异有统计学意义(t=3.12,P < 0.05);0.1和0.5 Gy组小鼠结肠H2O2表达量增高,差异有统计学意义(t=4.46、8.69,P < 0.05);0.2 Gy组小鼠空肠、回肠、结肠中H2O2表达量与0 Gy组相比差异无统计学意义(P > 0.05)。提示0.1 Gy电离辐射剂量全身照射能够诱导小鼠肠道产生氧化应激反应,0.5 Gy电离辐射剂量全身照射能够诱导小鼠空肠及结肠产生氧化应激反应。
|
|
表 2 不同剂量组小鼠空肠、回肠、结肠黏膜H2O2相对表达量(x±s) Table 2 Relative expression levels of H2O2 in jejunal, ileal, and colonic mucosa of mice in each dose group (x±s) |
3. γ射线对小鼠肠道黏膜NADPH氧化酶蛋白的影响:如图 2和表 3,0.1 Gy组小鼠空肠中DUOX2水平显著升高,与各剂量组比较差异均有统计学意义(t=3.03、2.53、2.93,P < 0.05);各剂量组DUOX2、NOX4和NOX1表达差异均无统计学意义(P>0.05)。图 3、表 3显示,与0 Gy组相比,0.1 Gy组小鼠回肠中DUOX2表达量升高(t=10.29,P < 0.05),与0.2和0.5 Gy组比较,差异均有统计学意义(t=6.78、7.63,P < 0.05);与0和0.5 Gy组比较0.1 Gy组的NOX4表达量均上调,差异均有统计学意义(t=2.25、2.45,P < 0.05);各剂量组小鼠回肠中NOX1表达差异均无统计学意义(P> 0.05);0.2 Gy照射组小鼠DUOX2、NOX4表达量略有提高,差异无统计学意义(P > 0.05)。结肠免疫组织化学结果(图 4、表 3)显示,与0、0.2和0.5 Gy组相比,0.1 Gy组小鼠结肠中DUOX2表达量升高(t=2.74、2.74、3.86,P < 0.05);各照射组小鼠空肠中NOX4和NOX1表达差异均无统计学意义(P> 0.05);0.2及0.5 Gy照射组小鼠结肠中的DUOX2、NOX4、NOX1表达差异均无统计学意义(P> 0.05)。
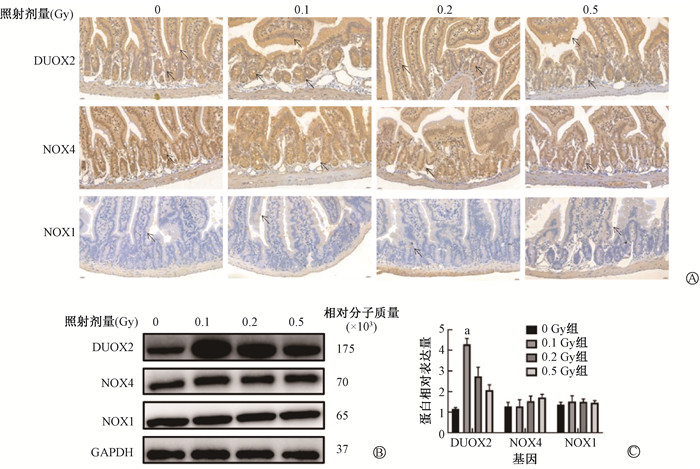
|
注:a与同基因0 Gy、0.2 Gy和0.5 Gy组相比,t=16.32,6.28,10.83,P < 0.01 图 2 不同剂量γ射线对小鼠空肠NADPH氧化酶蛋白的影响 A. 空肠DUOX2、NOX4、NOX1蛋白免疫组化染色×400;B. Western blot检测空肠DUOX2、NOX4、NOX1的电泳图;C.半定量图 Figure 2 Impacts of varying doses of γ-rays on NOX proteins in the jejunum of mice A. Immunohistochemical staining of DUOX2, NOX4, and NOX1 proteins in the jejunum ×400; B. Electrophoretic images showing the Western blot-derived expression levels of DUOX2, NOX4, and NOX1 proteins in the jejunum; C. Semi-quantitative analysis results |
|
|
表 3 各剂量组不同氧化酶在空肠、回肠、结肠免疫组织化学染色结果定量表(x±s) Table 3 Quantitative immunohistochemical results of DUOX2, NOX4 and NOX1 in the jejunum, ileum, and colon at different doses(x±s) |
与0、0.2和0.5 Gy组相比,0.1 Gy组小鼠空肠中(图 2B、C)DUOX2蛋白表达量明显升高(t=16.32、6.28、10.83,P < 0.05),各照射组NOX4以及NOX1蛋白表达差异均无统计学意义(P > 0.05);与0、0.2和0.5 Gy组比较,0.1 Gy组回肠中(图 3B、C)DUOX2表达量升高(t=21.32、5.15、10.51,P < 0.05);NOX4表达量升高(t=4.35、4.44、8.32,P < 0.05),各照射组NOX1蛋白表达差异无统计学意义(P > 0.05);与0、0.2和0.5 Gy组相比,0.1 Gy组结肠中(图 4B、C)DUOX2表达量升高(t=8.81、9.71、7.21,P < 0.05),各照射组NOX4和NOX1蛋白表达差异无统计学意义(P > 0.05)。以上结果提示,0.1 Gy电离辐射对小鼠小肠上皮细胞中DUOX2蛋白的表达具有显著的促进作用,且这种作用在空肠、回肠和结肠中均存在。
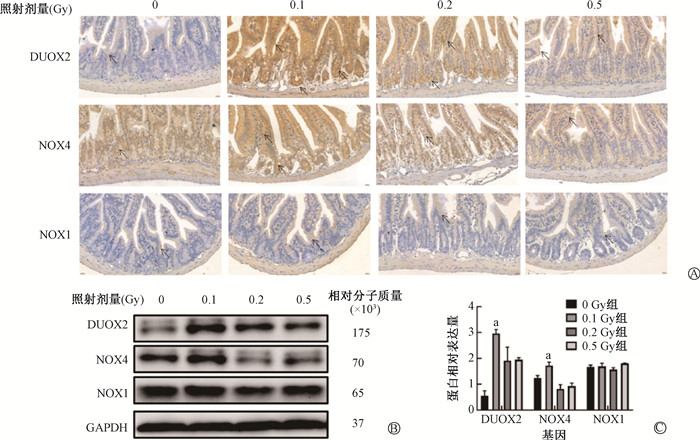
|
注:a与同基因各组相比,t=21.32,5.15,10.51,4.35,4.44,8.31,P < 0.05 图 3 不同剂量γ射线对小鼠回肠NADPH氧化酶蛋白的影响 A. 回肠DUOX2、NOX4、NOX1蛋白免疫组织化学染色×400;B. Western blot检测回肠DUOX2、NOX4、NOX1的表达水平结果图;C.半定量图 Figure 3 Impacts of varying doses of γ-rays on NOX proteins in the ileum of mice A. Immunohistochemical staining of DUOX2, NOX4, and NOX1 proteins in the ileum ×400; B. Western blot-derived expression levels of DUOX2, NOX4, and NOX1 in the ileum; C. Semi-quantitative analysis results |
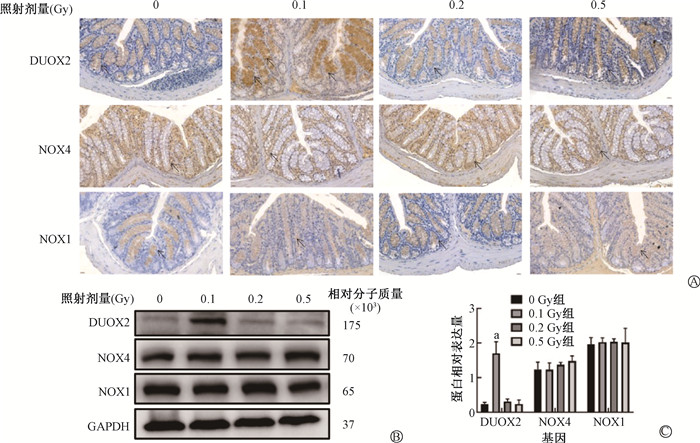
|
注:a 0.1 Gy组DUOX2蛋白相对表达量与各组相比,t=8.81,9.71,7.21,P < 0.05 图 4 不同剂量γ射线对小鼠结肠NADPH氧化酶蛋白的影响 A. 结肠DUOX2、NOX4、NOX1蛋白免疫组化染色×400;B. Western blot检测结肠DUOX2、NOX4、NOX1的表达水平结果图;C.半定量图 Figure 4 Impacts of different doses of γ-rays on NOX proteins in the colon of mice A. Immunohistochemical staining of DUOX2, NOX4, and NOX1 proteins in the colon ×400; B. Western blot-derived expression levels of DUOX2, NOX4, and NOX1 in the colon; C. Semi-quantitative analysis results |
4.不同剂量γ射线对小鼠肠道黏膜NADPH氧化酶mRNA的影响:如表 4所示,在小鼠空肠中,与0、0.2和0.5 Gy组相比,0.1 Gy组DUOX2 mRNA水平显著升高(t=12.75、5.83、9.17,P < 0.05),0.2 Gy组NOX4 mRNA水平升高,与0、0.1和0.5 Gy组比较,差异有统计学意义(t=4.54、6.15、5.69,P < 0.05),其余照射组各指标无明显变化(P>0.05)。在小鼠回肠中,与0、0.2和0.5 Gy组相比,0.1 Gy组NOX4 mRNA水平升高(t=4.13、4.28、4.22,P < 0.05),和DUOX2 mRNA水平升高,与0和0.5 Gy组比较,差异有统计学意义(t=4.12、4.12,P < 0.05),与0 Gy组比较,0.2 Gy组DUOX2 mRNA水平升高(t=4.50,P < 0.05),0.5 Gy组NOX1 mRNA水平升高(t=5.15,P < 0.05)。在小鼠结肠中,与0、0.2和0.5 Gy相比,0.1 Gy组DUOX2 mRNA、0.5 Gy组NOX1和DUOX2 mRNA水平升高明显升高(t=11.14、7.38、4.26、4.38,P < 0.05)。以上结果揭示了不同肠道部位中NADPH氧化酶家族成员(DUOX2、NOX4、NOX1)mRNA水平在0.1、0.2和0.5 Gy辐射后的变化特点。提示0.1 Gy辐射可促进DUOX2基因的转录,且NOX4和NOX1基因的转录变化表现出较强的组织特异性和剂量依赖性。
|
|
表 4 不同剂量γ射线照射后对小鼠肠道不同部位中NOX1、NOX2、NOX4、DOUX2、p22PHOX氧化酶mRNA相对表达水平(x±s) Table 4 Relative mRNA expression levels of of NOX1, NOX2, NOX4, DOUX2, and p22PHOX oxidases in different intestinal regions of mice after irradiation with varying doses of γ-rays (x±s) |
5.不同剂量γ射线对小鼠肠道黏膜NF-κB表达的影响: 如图 5所示,与0、0.2和0.5 Gy组相比, 0.1 Gy组小鼠空肠、回肠和结肠中的NF-κB的磷酸化水平显著升高(t=4.96~10.52,P < 0.05), 0.2和0.5Gy照射组空肠、回肠、结肠中-κB的磷酸化水平无明显变化。提示NF-κB信号通路对辐射剂量的反应可能具有阈值效应, 0.1 Gy电离辐射可能会触发小肠各部位中NF-κB信号通路的快速响应。

|
图 5 0.1、0.2和0.5 Gy γ射线照射后Western blot检测空肠、回肠、结肠道黏膜NF-κB表达情况 Figure 5 Western blot-derived NF-κB expression levels in the jejunal, ileal, and colonic mucosa after irradiation with 0.1, 0.2, and 0.5 Gy γ-rays |
讨论
近年来,医疗诊治过程中的小剂量电离辐射暴露日益受到人们的关注[14],低剂量的照射对人群健康是否有害则尚未定论。在100及以上剂量时,电离辐射对健康的损害风险增加。研究表明,< 0.1 Gy的电离辐射可能与癌症、心血管系统疾病、神经系统疾病及免疫功能障碍有关[15-17]。然而,低于0.5 Gy剂量的电离辐射对肠道的远后效应尚不明确。为此,本研究聚焦于0.1、0.2和0.5 Gy电离辐射后20周的小鼠肠道变化。结果显示,与对照组相比,0.1与0.2 Gy全身照射的小鼠肠道形态学未发生明显变化,0.5 Gy全身照射的小鼠肠道形态学与其他各组相比有轻微变化,推测是0.5 Gy射线照射后的继发效应,而非肠绒毛急性期辐射损伤后未修复导致。在此基础上,进一步检测了肠道内活性氧的变化情况,发现0.1及0.5 Gy全身照射组H2O2表达水平显著升高,而0.2 Gy全身照射组H2O2表达水平虽升高但差异无统计学意义。0.1 Gy全身照射后,H2O2表达水平的升高而肠道形态学未产生异常。可能是细胞对ROS的复杂调控机制导致。在正常生理状态下,细胞的ROS基础水平低,使细胞能够耐受一定程度的ROS波动而不会受到损害[18]。因此,在0.1 Gy电离辐射后,尽管H2O2水平升高但未对肠道组织形态造成明显损伤。
肠腔中的H2O2主要来自NADPH氧化酶及肠道部分细菌。为进一步探究H2O2表达呈“V”字型趋势的原因,检测了肠道内NADPH氧化酶的表达水平。结果显示,只有DUOX2蛋白的表达量在0.1 Gy全身照射组小鼠结肠、空肠、回肠肠道黏膜中都明显升高。DUOX2作为肠道黏膜的首道防御屏障,通过生成H2O2来抵御细菌的侵入并调控肠道菌群平衡[19-20]。DUOX2蛋白表达增高可能是0.1 Gy组小鼠肠道H2O2水平升高的原因之一。0.5 Gy组小鼠肠道DUOX2蛋白水平未发现明显增高,但H2O2水平却显著增加。研究显示,0.5 Gy全身照射可诱导小鼠肠道菌群的多样性及结构发生显著变化[21],推测0.5 Gy组小鼠肠道H2O2水平的改变可能与肠道菌群的变化有关。0.2 Gy组小鼠肠道中H2O2水平和NADPH酶的表达都没有升高。因此,肠腔中的H2O2水平在0.1、0.2和0.5 Gy电离辐射后呈“V”字型趋势。
对肠道内4种NADPH氧化酶进行了实时定量PCR检测,以进一步验证蛋白检测结果。肠道不同部位DUOX2 mRNA检测结果与蛋白结果基本一致。空肠中0.2 Gy照射组NOX4 mRNA水平升高而蛋白水平无变化,回肠中0.2 Gy照射组DUOX2 mRNA水平升高而蛋白水平无变化,0.5 Gy照射组NOX1 mRNA水平升高而蛋白水平无变化,结肠中0.5 Gy照射组NOX1及DUOX2 mRNA水平升高而蛋白水平无变化,mRNA水平升高通常提示该序列启动子或者增强子的激活,蛋白水平升高则与功能增强有关。两者非有完全一致性,NOX4、NOX1、DUOX2蛋白转录和翻译的过程受到多种机制调控并非与mRNA的合成具有一致性。空肠、回肠、结肠中,0.1 Gy照射后DUOX2 mRNA水平与蛋白表达趋势具有一致性,考虑DUOX2蛋白高表达原因之一为其启动子激活。
0.1 Gy电离辐射可致NF-κB磷酸化[22],DUOX2近端启动子较少,NF-κB是DUOX2近端启动子的转录因子结合位点之一。结合0.1、0.2和0.5 Gy受照后DUOX2表达量升高的实验结果,推测小剂量电离辐射可通过调节NF-κB磷酸化从而上调DUOX2的表达,促进ROS的生成[23]。DUOX2在多种放射敏感组织中表达,包括甲状腺、气道上皮细胞、唾液腺和胃肠道,表明其在维持组织稳态和应对电离辐射刺激中的重要作用,DUOX2是化疗和低剂量辐射联合治疗中上调最为明显的基因之一[24]。因此,考虑0.1 Gy全身辐射使NF-κB磷酸化上调DUOX2表达,促进H2O2水平升高,结论需要进一步验证。
ROS水平的适度增加可能反而触发了细胞的防御反应,如NF-κB信号通路的激活就是一种可能的防御反应,它能够帮助细胞应对外界的压力和刺激,从而维护细胞的稳态和生存。此外,DUOX2的下调可增强细胞的辐射抗性[24]。0.1 Gy照射后,小鼠肠道细胞可能通过增加DUOX2的表达和适度提高H2O2的水平来增强自身的防御能力,介导了肠道细胞的超敏辐射性,以应对辐射带来的潜在威胁。未来的研究可更加深入探讨DUOX2与NF-κB信号通路之间的相互作用机制,以及这种调控作用在肠道辐射损伤防护和修复中可能存在的潜在应用前景。
综上,本研究发现了0.1、0.2和0.5 Gy剂量照射后20周小鼠小肠中NADPH氧化酶DUOX2表达显著升高,这一变化可能导致肠道细胞对辐射的超敏反应。DUOX2在肠道防御机制中的核心作用,也是肠道细胞对小剂量辐射的一种适应性或防御性反应。本研究不仅初步揭示了0.1、0.2和0.5 Gy剂量电离辐射对小鼠小肠的影响及其可能的机制,还为小剂量辐射对人体肠道健康的影响提供了新的视角,并为探索有效的肠道辐射防护策略提供了科学依据。
利益冲突 无
作者贡献声明 吴卓君负责实验操作、数据整理、撰写论文;黄志飞负责实验操作及论文修改;李姜怡负责数据分析;王星、郭玲协助部分实验操作;丁桂荣负责课题设计,指导论文撰写
| [1] |
Buonanno M, de Toledo SM, Pain D, et al. Long-term consequences of radiation-induced bystander effects depend on radiation quality and dose and correlate with oxidative stress[J]. Radiat Res, 2011, 175(4): 405-415. DOI:10.1667/rr2461.1 |
| [2] |
Cui F, Ma N, Han X, et al. Effects of 60Co γ irradiation on the reproductive function of caenorhabditis elegans[J]. Dose Response, 2019, 17(1): 1-6. DOI:10.1177/1559325818820981 |
| [3] |
Barazzuol L, Hopkins SR, Ju L, et al. Distinct response of adult neural stem cells to low versus high dose ionizing radiation[J]. DNA Repair (Amst), 2019, 76: 70-75. DOI:10.1016/j.dnarep.2019.01.004 |
| [4] |
Zhang J, Wei Y, Yue Y, et al. RIPK4 promotes oxidative stress and ferroptotic death through the downregulation of ACSM1[J]. Proc Natl Acad Sci USA, 2024, 121(40): e2410628121. DOI:10.1073/pnas.2410628121 |
| [5] |
Jella KK, Moriarty R, McClean B, et al. Reactive oxygen species and nitric oxide signaling in bystander cells[J]. PLoS One, 2018, 13(4): e0195371. DOI:10.1371/journal.pone.0195371 |
| [6] |
Kataoka T. Study of antioxidative effects and anti-inflammatory effects in mice due to low-dose X-irradiation or radon inhalation[J]. Radiat Res, 2013, 54(4): 587-596. DOI:10.1093/jrr/rrs141 |
| [7] |
Lumniczky K, Impens N, Armengol G, et al. Low dose ionizing radiation effects on the immune system[J]. Environ Int, 2021, 149: 106212. DOI:10.1016/j.envint.2020.106212 |
| [8] |
Kumar S, Suman S, Moon BH, et al. Low dose radiation upregulates Ras/p38 and NADPH oxidase in mouse colon two months after exposure[J]. Mol Biol Rep, 2023, 50(3): 2067-2076. DOI:10.1007/s11033-022-08186-3 |
| [9] |
Juhasz A, Markel S, Gaur S, et al. NADPH oxidase 1 supports proliferation of colon cancer cells by modulating reactive oxygen species-dependent signal transduction[J]. J Biol Chem, 2017, 292(19): 7866-7887. DOI:10.1074/jbc.M116.768283 |
| [10] |
Ramonaite R, Skieceviciene J, Kiudelis G, et al. Influence of NADPH oxidase on inflammatory response in primary intestinal epithelial cells in patients with ulcerative colitis[J]. BMC Gastroenterol, 2013, 13: 159. DOI:10.1186/1471-230x-13-159 |
| [11] |
Larsson E, Tremaroli V, Lee YS, et al. Analysis of gut microbial regulation of host gene expression along the length of the gut and regulation of gut microbial ecology through MyD88[J]. Gut, 2012, 61(8): 1124-1131. DOI:10.1136/gutjnl-2011-301104 |
| [12] |
Van der Post S, Birchenough GMH, Held JM. NOX1-dependent redox signaling potentiates colonic stem cell proliferation to adapt to the intestinal microbiota by linking EGFR and TLR activation[J]. Cell Rep, 2021, 35(1): 108949. DOI:10.1016/j.celrep.2021.108949 |
| [13] |
Sommer F, Nookaew I, Sommer N, et al. Site-specific programming of the host epithelial transcriptome by the gut microbiota[J]. Genome Biol, 2015, 16(1): 62. DOI:10.1186/s13059-015-0614-4 |
| [14] |
National Council on Radiation Protection & Measurements. NCRP Report No. 184. Medical radiation exposure of patients in the united states[R]. United States: NCRP, 2019: 146-163.
|
| [15] |
Richardson DB, Leuraud K, Laurier D, et al. Cancer mortality after low dose exposure to ionising radiation in workers in France, the United Kingdom, and the United States (INWORKS): cohort study[J]. BMJ, 2023, 382: e074520. DOI:10.1136/bmj-2022-074520 |
| [16] |
Laurier D, Richardson DB, Cardis E, et al. The international nuclear workers study (Inworks): A collaborative epidemiological study to improve knowledge about health effects of protracted low-dose exposure[J]. Radiat Prot Dosim, 2017, 173(1-3): 21-25. DOI:10.1093/rpd/ncw314 |
| [17] |
Sommer F, Bäckhed F. The gut microbiota engages different signaling pathways to induce Duox2 expression in the ileum and colon epithelium[J]. Mucosal Immunol, 2015, 8(2): 372-379. |
| [18] |
Lipinski S, Till A, Sina C, et al. DUOX2-derived reactive oxygen species are effectors of NOD2-mediated antibacterial responses[J]. J Cell Sci, 2009, 122(Pt 19): 3522-3530. DOI:10.1242/jcs.050690 |
| [19] |
段敏, 杨喆, 刘莹, 等. γ射线全身照射小鼠肠组织损伤效应及对肠道微生物的影响研究[J]. 军事医学, 2024, 48(9): 641-649. Duan M, Yang Z, Liu Y, et al. Intestinal tissue injury and gut microbiome changes in mice treated with whole body irradiation by gamma rays[J]. Mil Med, 2024, 48(9): 641-649. DOI:10.7644/j.issn.1674-9960.2024.09.001 |
| [20] |
Gorrini C, Harris S, Mak TW. Modulation of oxidative stress as an anticancer strategy[J]. Nat Rev Drug Discov, 2013, 12(12): 931-947. DOI:10.1038/nrd4002 |
| [21] |
Mohan N, Meltz ML. Induction of nuclear factor kappa B after low-dose ionizing radiation involves a reactive oxygen intermediate signaling pathway[J]. Radiat Res, 1994, 140(1): 97-104. |
| [22] |
Lendeckel U, Wolke C. Redox-regulation in cancer stem cells[J]. Biomedicines, 2022, 10(10): 2227-9059. DOI:10.3390/biomedicines10102413 |
| [23] |
Parekh PR, Solano-Gonzalez E, Martins MB, et al. DUOX2, a new biomarker for disseminated gastric cancer′s response to low dose radiation in mice[J]. Cancers, 2021, 13(16): 4186. DOI:10.3390/cancers13164186 |
| [24] |
Nguyen DM, Parekh PR, Chang ET, et al. Contribution of dual oxidase 2 (DUOX2)to hyper-radiosensitivity in human gastric cancer cells[J]. Radiat Res, 2015, 184(2): 151-160. DOI:10.1667/rr13661.1 |
 2025, Vol. 45
2025, Vol. 45


