专家组组长:王俊杰(北京大学第三医院肿瘤放疗科)
专家组成员 (按姓氏汉语拼音排序):陈意(北京大学第三医院肿瘤放疗科),段学章(中国人民解放军总医院第五医学中心放射治疗科),吉喆(北京大学第三医院肿瘤放疗科),姜玉良(北京大学第三医院肿瘤放疗科),李光(中国医科大学附属第一医院放疗科),练祖平(广西中医药大学附属瑞康医院肿瘤科),刘士新(吉林省肿瘤医院放疗科),邱斌(北京大学第三医院肿瘤放疗科),孙海涛(北京大学第三医院肿瘤放疗科),王恩敏(复旦大学附属华山医院神经外科),王俊杰(北京大学第三医院肿瘤放疗科),韦婷婷(广西中医药大学附属瑞康医院肿瘤科),伍钢(华中科技大学同济医学院附属协和医院肿瘤中心),谢有科(广西中医药大学附属瑞康医院肿瘤科),徐本华(福建医科大学附属协和医院放疗科),徐飞(北京大学第三医院肿瘤放疗科),薛军(华中科技大学同济医学院附属协和医院肿瘤中心),张火俊(海军军医大学第一附属医院放疗科)
原发性肝癌(以下简称肝癌)的发病率居全球恶性肿瘤发病率第6位,每年新增约90余万例;死亡率居全球恶性肿瘤死亡率第3位[1]。亚洲是肝癌高发区,约占全球发病数的70%,其中国内占全球发病数的45%[1]。肝癌包括肝细胞癌(75%~85%)和肝内胆管细胞癌(10%~15%),本共识中的肝癌主要指肝细胞癌。我国肝癌主要的危险因素是乙型或丙型肝炎病毒感染、过度饮酒、非酒精性脂肪性肝炎、其他原因引起的肝硬化以及有肝癌家族史等[1-2]。
肝癌的治疗方法主要包括外科治疗、经动脉化疗栓塞(transarterial chemoembolization, TACE)、消融、放射治疗、化疗、靶向治疗及免疫治疗等[3-4]。最佳治疗方案取决于肿瘤分期和患者的状况,如年龄、潜在的肝脏疾病和肝功能等。多学科团队(multidisciplinary team, MDT)对于确定最佳治疗方案至关重要[5]。放射治疗技术主要包括立体定向放疗(stereotactic radiotherapy, SRT)、三维适形放疗(3-dimensional conformal radiotherapy,3-DCRT)、调强放疗(intensity modulated radiotherapy,IMRT)、质子或重粒子放疗及90Y介入栓塞(transarterial radioembolization,TARE)[6-12]。近年来,放射治疗取得巨大进步,自适应放疗、核磁引导放疗、质子或重离子放疗、生物标记引导放疗等成为主要研究方向,特别是在早期肝癌及合并门静脉癌栓的患者中[13-16]。
本共识主要涉及射波刀治疗系统,其为利用灵活的机械臂操控的6 mV X射线小型直线加速器,实现三维空间多角度、全方位聚焦照射的立体定向放疗机器人系统,具有单次剂量大、治疗周期短和治疗分次少的优势[17]。射波刀治疗系统利用实时金标追踪和同步呼吸追踪系统,最大限度地避免因呼吸运动造成的肿瘤脱靶,肿瘤靶区剂量适形度高、周边正常组织剂量跌落迅速,真正意义上实现了肿瘤的精确定位、精确计划和精确治疗,进而达到消融放疗的目的[17-18]。
一、共识制定方法学1. 检索策略:纳入2024年12月以前发表的文献,使用PubMed、Embase进行检索。检索词包括“radiotherapy”、“Cyberknife”、“liver cancer”、“hepatocellular carcinoma”、“SBRT”。
2. 证据等级:本专家共识参照牛津大学循证医学中心证据水平及推荐级别[19]进行推荐(表 1)。本专家共识首先由编写团队进行文献综合分析,然后进行文献筛选和集体讨论,形成初步推荐意见及其证据等级。针对证据不足的情况,专家团队也提出了专家意见,并通过德尔菲法则达成共识。
|
|
表 1 牛津大学循证医学中心证据水平及推荐级别[19] Table 1 Evidence levels and recommendation grades developed by Oxford Centre for Evidence-Based Medicine[19] |
二、肝癌诊断及分期
肝癌的诊断分为临床诊断和病理诊断。临床诊断主要依靠病史和影像学检查,包括超声造影、增强CT、多参数磁共振成像(magnetic resonance imaging, MRI)及肝细胞特异性对比剂钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid, Gd-EOB-DTPA)增强MRI。由乙肝病毒或丙肝病毒感染或由任何原因引起的肝硬化患者:发现肝内直径≤2 cm的结节,以上4种影像学检查中至少有2项显示典型的肝癌影像学表现,结合血清学检测,可以做出肝癌的临床诊断;对于发现肝内直径>2 cm的结节,上述4种影像学检查中只要有1项典型特征,即可临床诊断为肝癌。血清甲胎蛋白(alpha-fetoprotein, AFP)是当前肝癌诊断和疗效监测的重要指标,血清AFP≥400 μg/L,在排除妊娠、慢性或活动性肝病、生殖腺胚胎源性肿瘤以及消化道肿瘤后,提示肝癌;而血清AFP轻度升高者,应结合影像学检查或进行动态观察,并与肝功能变化对比分析。具有典型肝癌影像学特征的肝占位性病变,符合肝癌临床诊断标准的患者,通常不需要穿刺活检,但是随着免疫治疗、靶向治疗的进展,越来越多的患者需要进行穿刺活检,以获得分子和基因检测结果。难以临床诊断者可考虑经皮肝穿刺活检获得病理学诊断[2]。
肝癌分期标准主要为TNM分期、巴塞罗那临床肝癌(Barcelona clinic liver cancer,BCLC)分期和中国肝癌临床分期。国际上较为常用的肝癌分期标准为BCLC分期[4](表 2)。中国肝癌临床分期根据肝脏肿瘤的数目、大小、血管侵犯、肝外转移、Child-Pugh分级以及体力状况(performance status, PS)评分6个因素,综合判定肿瘤分期[2](表 3)。
|
|
表 2 BCLC分期标准 Table 2 Barcelona clinic liver cancer (BCLC) staging system |
|
|
表 3 中国肝癌临床分期标准 Table 3 China liver cancer (CNLC) staging system |
三、射波刀治疗的适应证和禁忌证
1. 适应证:①患者不能耐受或拒绝手术的早期肝癌,肿瘤最大直径≤5 cm(2a级证据,B类推荐)[6, 20];②无法手术的进展期肝癌序贯或联合治疗(1b级证据,A类推荐)[21-24],门静脉或下腔静脉癌栓的局部治疗[24-25](1b级证据,A类推荐);③肝外寡转移灶的局部治疗(2a级证据,B类推荐)[20];④晚期肝癌的挽救或姑息性治疗(2a级证据,B类推荐)[24, 26];⑤复发肝癌的放疗或再程放疗(3b级证据,B类推荐)[27];⑥手术前的新辅助治疗或转化治疗,肝移植前的过渡或桥接治疗(1b级证据,A类推荐)[28-30]。
2. 禁忌证:①合并严重或未控的基础疾病,预期无法耐受者;②精神病患者、或依从性差、或其他原因无法配合治疗者;③肝内病灶弥漫分布或正常肝组织少,预期无法耐受者;④肝功能Child-Pugh C级经内科治疗无明显改善者,或合并肝功能失代偿严重并发症,如黄疸、肝性脑病、难治性腹水或肝肾综合征。
四、治疗前准备(一)病情评估:根据患者病史、临床表现、实验室检查、影像学资料等进行病情评估。建议包括有肝胆外科、放疗科、消化肿瘤内科、介入科等医师参与的MDT对患者进行病情评估,确定治疗方案[2, 31]。
对合并症进行积极治疗,使其处于稳定状态后方可进行射波刀治疗。术前评估患者是否适合金标植入(有无金标植入适应证、禁忌证、植入路径、植入影像引导方式及相关风险性),是否有造影剂过敏,是否可行肝脏MRI检查。
(二)签署知情同意书:患者治疗前签署知情同意书,向患者充分交待治疗获益、风险及预后。
(三)金标植入:由于呼吸运动的影响,建议采用金标追踪实施射波刀治疗(4级证据,C类推荐)[32],增加治疗的精确性,但金标植入非强制步骤,对于不适合金标植入的患者可采用呼吸控制技术,减少呼吸运动对治疗的影响。如采用金标追踪则需要在肿瘤边缘或肿瘤内植入金标。建议通过超声引导或CT引导金标植入。为防止金标植入后可能出现金标移位,建议金标植入后5~7 d开始CT模拟定位。金标通常植入3~6颗,金标之间三维空间上的间隔2~4 cm。因射波刀采用45°交互X射线进行影像引导,为避免金标在X射线方向上重叠,相邻金标的角度尽量避免在45°±15°和135°±15°范围内。
(四)放疗定位
1. 定位前准备:预先进行体位和呼吸训练,定位前需空腹4~6 h,对于病灶距离肠道较近的患者,建议定位前口服造影剂进行肠道显影,一般定位前0.5 h口服300 ml水+10 ml造影剂。
2. 体位固定:患者取仰卧位,平静呼吸,双侧上肢置于身体两侧或置于额前,体部真空垫塑形固定。
3. 模拟定位:CT扫描层厚1~1.5 mm;连续、无间距扫描;扫描范围至少包括肝脏上、下缘以外15 cm;如无碘过敏等禁忌,推荐多期增强CT扫描。采用非金标追踪方式时,定位时则须同时扫描4D-CT。建议同时联合MRI(带有平板与MRI兼容的固定设备的专用MRI扫描系统,层厚度通常≤3 mm)定位(4级证据,C类推荐)[33],体位与CT模拟定位相同,包括T1、T2及弥散成像。如无MRI定位,则建议将诊断MRI图像传输至治疗计划系统,采用影像融合后辅助靶区勾画。
五、靶区勾画及处方剂量建议结合多模态影像学检查来确定靶区范围,包括多期增强CT、MRI及正电子发射计算机体层成像(positron emission tomography,PET)-CT等。
(一)靶区勾画
1. 大体肿瘤体积(gross tumor volume, GTV):结合平扫和增强定位CT图像,并参考多模态MRI定位图像来确定GTV范围。建议对原发肿瘤及血管癌栓进行独立勾画。原发肿瘤宜在动脉期勾画,癌栓宜在静脉期或者延迟期勾画。
2. 计划靶体积(planning target volume, PTV):若采用金标追踪,则GTV外扩3~5 mm生成PTV。若采用其他方式追踪,则建议4D-CT扫描确定内靶区(internal target volume, ITV),推荐在4D-CT各时相上分别勾画GTV然后叠加生成ITV,或在4D-CT最大强度投影重建(maximum intensity projection, MIP)像上勾画ITV。ITV外放3~5 mm生成PTV。在不损失GTV的情况下,允许医师酌情在结肠肝曲等相邻关键结构处进行调整,不推荐与胃、结肠等危及器官重叠。
3. 危及器官勾画:建议包括正常肝脏组织、胃、结肠(结肠肝曲)、十二指肠、食管、心脏、双肾、脊髓等。
(二)推荐处方剂量
1.处方剂量:射波刀治疗肝癌的最佳剂量及分割模式,目前尚未达成统一共识。具体剂量与分割方式建议综合考虑肝功能储备、周围正常器官耐受剂量、肿瘤大小、数量和部位等诸多因素后决定。
本共识的处方剂量推荐为30~60 Gy,分3~6次完成[6, 34](2a级证据,B类推荐),该推荐基于2项系统性综述的研究结果,即相对生物学剂量(biologically effective dose,BED)在60~180 Gy,局部控制率差异无统计学意义。但亦有研究显示,BED至少达到74 Gy,如可耐受则>100 Gy,处方剂量与患者预后密切相关[6, 35]。
2. 危及器官限制:危及器官耐受剂量受总剂量、分割次数、肝功能分级、正常肝脏体积等诸多因素影响。建议可依据美国医学物理学家协会的推荐进行剂量限制(表 4)[36]或我国原发性肝癌诊疗指南(2024年版)的推荐进行剂量限制(表 5)[2]。
|
|
表 4 美国医学物理学家协会(AAPM)推荐的不同分割次数危及器官限量(Gy) Table 4 Dose limits for organs at risk recommended by American Association of Physicists in Medicine (AAPM)(Gy) |
|
|
表 5 我国原发性肝癌诊疗指南(2024年版)推荐的不同分割次数危及器官限量 Table 5 Dose limits for organs at risk recommended by Chinese standard for diagnosis and treatment of primary liver cancer (2024 edition) |
六、治疗计划设计及治疗实施
射波刀治疗计划系统采用逆向设计、计算治疗计划。审核计划质量,主要评估PTV是否达到处方剂量(通常评价达到一定靶区体积百分比的剂量和达到一定比例处方剂量的靶区体积百分比)及危及器官限量是否达标。邻近胃肠、胆管、胆囊、膈肌等或位于第一肝门区、肝包膜下等部位,均为高风险部位。射波刀治疗高风险部位肿瘤可能损伤邻近胃肠道或胆管,导致穿孔、肿瘤破裂、出血等,因此要格外谨慎。针对位于高风险部位的肿瘤,邻近高危器官靶区应尽可能避免高剂量区覆盖,以便对周围邻近的组织脏器进行保护。
计划完成后进行剂量验证,通过剂量测量设备与模体,验证放疗计划的剂量准确性,测量误差在允许范围内方可批准用于治疗。计划实施前应确保摆位、固定方式和相关门控设备与放疗定位时保持一致。采用射波刀自带的45°正交X射线获取正交二维影像,同时依据计划设计时的匹配方式进行位置验证。当位置精度满足临床需求时,方可实施治疗。
金标追踪模式治疗过程中,患者须佩戴红外发射固定马甲,利用治疗床尾端红外探测器,通过金标+呼吸追踪模式实施治疗。射波刀治疗肝癌技术流程图示于图 1。
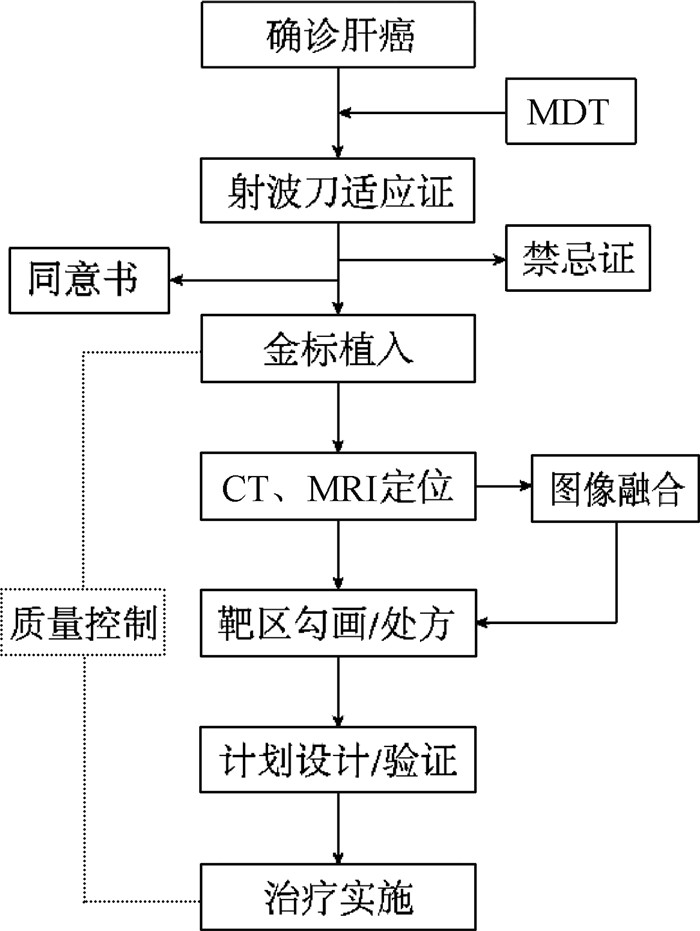
|
注:MDT.多学科团队;MRI.磁共振成像 图 1 射波刀治疗肝癌技术流程图 Figure 1 Flow chart of Cyberknife treatment for liver cancer |
七、随访
首次复查在射波刀治疗后1个月左右进行,2年内每3~6个月随访一次,2~5年内每6~12个月随访一次,5年后每年随访一次[2]。随访内容包括症状、体征、血常规、肝功能、肿瘤标志物及腹部多期增强CT或MRI,病毒性肝炎患者同时复查病毒载量。射波刀治疗后,应遵循美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南[31]或者中国原发性肝癌治疗指南[2]进行综合治疗。
利益冲突 无
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
国家卫生健康委员会. 原发性肝癌诊疗指南(2024年版)[J]. 中华肝脏病杂志, 2024, 32(7): 581-630. National Health Commission of the People′s Republic of China. Standard for diagnosis and treatment of primary liver cancer (2024 edition)[J]. Chin J Hepatol, 2024, 32(7): 581-630. DOI:10.3760/cma.j.cn501113-20240611-00290 |
| [3] |
Vogel A, Meyer T, Sapisochin G, et al. Hepatocellular carcinoma[J]. Lancet, 2022, 400(10360): 1345-1362. DOI:10.1016/S0140-6736(22)01200-4 |
| [4] |
Reig M, Forner A, Rimola J, et al. BCLC strategy for prognosis prediction and treatment recommendation: the 2022 update[J]. J Hepatol, 2022, 76(3): 681-693. DOI:10.1016/j.jhep.2021.11.018 |
| [5] |
Villanueva A. Hepatocellular carcinoma[J]. N Engl J Med, 2019, 380(15): 1450-1462. DOI:10.1056/NEJMra1713263 |
| [6] |
Bae SH, Chun SJ, Chung JH, et al. Stereotactic body radiation therapy for hepatocellular carcinoma: meta-analysis and international stereotactic radiosurgery society practice guidelines[J]. Int J Radiat Oncol Biol Phys, 2024, 118(2): 337-351. DOI:10.1016/j.ijrobp.2023.08.015 |
| [7] |
Wei X, Jiang Y, Zhang X, et al. Neoadjuvant three-dimensional conformal radiotherapy for resectable hepatocellular carcinoma with portal vein tumor thrombus: a randomized, open-label, multicenter controlled study[J]. J Clin Oncol, 2019, 37(24): 2141-2151. DOI:10.1200/JCO.18.02184 |
| [8] |
Wu F, Chen B, Dong D, et al. Phase 2 evaluation of neoadjuvant intensity-modulated radiotherapy in centrally located hepatocellular carcinoma: a nonrandomized controlled trial[J]. JAMA Surg, 2022, 157(12): 1089-1096. DOI:10.1001/jamasurg.2022.4702 |
| [9] |
Kim TH, Koh YH, Kim BH, et al. Proton beam radiotherapy vs. radiofrequency ablation for recurrent hepatocellular carcinoma: a randomized phase Ⅲ trial[J]. J Hepatol, 2021, 74(3): 603-612. DOI:10.1016/j.jhep.2020.09.026 |
| [10] |
Shiba S, Shibuya K, Okamoto M, et al. Clinical impact of hypofractionated carbon ion radiotherapy on locally advanced hepatocellular carcinoma[J]. Radiat Oncol, 2020, 15(1): 195. DOI:10.1186/s13014-020-01634-z |
| [11] |
Tomizawa K, Shibuya K, Shiba S, et al. Repeated carbon-ion radiation therapy for intrahepatic recurrent hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2023, 16(5): 1100-1109. DOI:10.1016/j.ijrobp.2023.02.036 |
| [12] |
Sangro B, Iñarrairaegui M, Bilbao JI. Radioembolization for hepatocellular carcinoma[J]. J Hepatol, 2012, 56(2): 464-473. DOI:10.1016/j.jhep.2011.07.012 |
| [13] |
Jackson WC, Tang M, Maurino C, et al. Individualized adaptive radiation therapy allows for safe treatment of hepatocellular carcinoma in patients with child-turcotte-pugh B liver disease[J]. Int J Radiat Oncol Biol Phys, 2021, 109(1): 212-219. DOI:10.1016/j.ijrobp.2020.08.046 |
| [14] |
Liu Y, Chou B, Yalamanchili A, et al. Local therapies for hepatocellular carcinoma and role of MRI-guided adaptive radiation therapy[J]. J Clin Med, 2023, 12(10): 3517. DOI:10.3390/jcm12103517 |
| [15] |
Tsai CL, Hsu FM, Cheng JC. How to improve therapeutic ratio in radiotherapy of HCC[J]. Liver Cancer, 2016, 5(3): 210-220. DOI:10.1159/000367767 |
| [16] |
Cuneo KC, Herr DJ. Advances in radiation therapy for primary liver cancer[J]. Surg Oncol Clin N Am, 2023, 32(3): 415-432. DOI:10.1016/j.soc.2023.02.002 |
| [17] |
Kilby W, Dooley JR, Kuduvalli G, et al. The CyberKnife robotic radiosurgery system in 2010[J]. Technol Cancer Res Treat, 2010, 9(5): 433-452. DOI:10.1177/153303461000900502 |
| [18] |
Arakia F, Moribe N, Shimonobou T, et al. Dosimetric properties of radiophotoluminescent glass rod detector in high-energy photon beams from a linear accelerator and cyber-knife[J]. Med Phys, 2004, 31(7): 1980-1986. DOI:10.1118/1.1758351 |
| [19] |
Oxford Centre for Evidence-Based Medicine (OCEBM) Levels of Evidence Working Group. The Oxford levels of evidence 2 [EB/OL]. (2010-10-07)[2024-07-30]. https://www.cebm.ox.ac.uk/resources/levels-of-evidence/ocebm-levels-of- evidence.
|
| [20] |
Shanker MD, Moodaley P, Soon W, et al. Stereotactic ablative radiotherapy for hepatocellular carcinoma: a systematic review and meta-analysis of local control, survival and toxicity outcomes[J]. J Med Imaging Radiat Oncol, 2021, 65(7): 956-968. DOI:10.1111/1754-9485.13309 |
| [21] |
Chen LC, Chiou WY, Lin HY, et al. Comparing stereotactic ablative radiotherapy (SABR) versus re-trans-catheter arterial chemoembolization (re-TACE) for hepatocellular carcinoma patients who had incomplete response after initial TACE (TASABR): a randomized controlled trial[J]. BMC Cancer, 2019, 19(1): 275. DOI:10.1186/s12885-019-5461-3 |
| [22] |
Comito T, Loi M, Franzese C, et al. Stereotactic radiotherapy after incomplete transarterial (chemo-) embolization (TAE\\TACE) versus exclusive TAE or TACE for treatment of inoperable HCC: a phase Ⅲ trial (NCT02323360)[J]. Curr Oncol, 2022, 29(11): 8802-8813. DOI:10.3390/curroncol29110692 |
| [23] |
Juloori A, Katipally RR, Lemons JM, et al. Phase 1 randomized trial of stereotactic body radiation therapy followed by Nivolumab plus Ipilimumab or Nivolumab alone in advanced/unresectable hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2023, 115(1): 202-213. DOI:10.1016/j.ijrobp.2022.09.052 |
| [24] |
Shanker MD, Liu HY, Lee YY, et al. Stereotactic radiotherapy for hepatocellular carcinoma: expanding the multidisciplinary armamentarium[J]. J Gastroenterol Hepatol, 2021, 36(4): 873-884. DOI:10.1111/jgh.15175 |
| [25] |
Hu Y, Zhou M, Tang J, et al. Efficacy and safety of stereotactic body radiotherapy combined with Camrelizumab and Apatinib in patients with hepatocellular carcinoma with portal vein tumor thrombus[J]. Clin Cancer Res, 2023, 29(20): 4088-4097. DOI:10.1158/1078-0432.CCR-22-2592 |
| [26] |
Rim CH, Kim HJ, Seong J. Clinical feasibility and efficacy of stereotactic body radiotherapy for hepatocellular carcinoma: a systematic review and meta-analysis of observational studies[J]. Radiother Oncol, 2019, 131: 135-144. DOI:10.1016/j.radonc.2018.12.005 |
| [27] |
Huang WY, Jen YM, Lee MS, et al. Stereotactic body radiation therapy in recurrent hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2012, 84(2): 355-361. DOI:10.1016/j.ijrobp.2011.11.058 |
| [28] |
Méndez Romero A, van der Holt B, Willemssen FEJA, et al. Transarterial chemoembolization with drug-eluting beads versus stereotactic body radiation therapy for hepatocellular carcinoma: outcomes from a multicenter, randomized, phase 2 trial (the TRENDY trial)[J]. Int J Radiat Oncol Biol Phys, 2023, 117(1): 45-52. DOI:10.1016/j.ijrobp.2023.03.064 |
| [29] |
Andolino DL, Johnson CS, Maluccio M, et al. Stereotactic body radiotherapy for primary hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4): e447-e453. DOI:10.1016/j.ijrobp.2011.04.011 |
| [30] |
Wong TC, Lee VH, Law AL, et al. Prospective study of stereotactic body radiation therapy for hepatocellular carcinoma on waitlist for liver transplant[J]. Hepatology, 2021, 74(5): 2580-2594. DOI:10.1002/hep.31992 |
| [31] |
National Comprehensive Cancer Network. Hepatocellular Carcinoma. NCCN Guidelines Version 4. 2024. [ EB/OL]. [2025-1-10]. https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1514.
|
| [32] |
Dutta D, Kataki KJ, George S, et al. Prospective evaluation of fiducial marker placement quality and toxicity in liver CyberKnife stereotactic body radiotherapy[J]. Radiat Oncol J, 2020, 38(4): 253-261. DOI:10.3857/roj.2020.00472 |
| [33] |
Tsegmed U, Kimura T, Nakashima T, et al. Functional image-guided stereotactic body radiation therapy planning for patients with hepatocellular carcinoma[J]. Med Dosim, 2017, 42(2): 97-103. DOI:10.1016/j.meddos.2017.01.005 |
| [34] |
Ohri N, Tomé WA, Méndez Romero A, et al. Local control after stereotactic body radiation therapy for liver tumors[J]. Int J Radiat Oncol Biol Phys, 2021, 110(1): 188-195. DOI:10.1016/j.ijrobp.2017.12.288 |
| [35] |
Su TS, Liu QH, Zhu XF, et al. Optimal stereotactic body radiotherapy dosage for hepatocellular carcinoma: a multicenter study[J]. Radiat Oncol, 2021, 16(1): 79. DOI:10.1186/s13014-021-01778-6 |
| [36] |
Benedict SH, Yenice KM, Followill D, et al. Stereotactic body radiation therapy: the report of AAPM Task Group 101[J]. Med Phys, 2010, 37(8): 4078-4101. DOI:10.1118/1.3438081 |
 2025, Vol. 45
2025, Vol. 45
