肺癌为全球癌症相关死亡的主要原因[1],早期肺癌的5年生存率超过50%,而晚期则为4%~17%[2]。胸部低剂量CT(low dose computed tomography,LDCT)作为一种早期肺癌筛查技术,能清晰地显示肺组织解剖结构、纵隔器官形态及周围组织间隙,其有效剂量(E)≤ 1 mSv[3]。LDCT应用于早期肺癌筛查可将肺癌死亡率降低约20%[4]。许多卫生组织制定了肺癌筛查指南,根据各指南要求,肺癌筛查中检出的不确定结节需要定期进行LDCT扫描随访,重复的CT扫描导致受检者的辐射剂量累积增加[5-7]。由此,根据可合理达到的尽可能低(as low as reasonably achievable,ALARA)原则,胸部超低剂量CT(ultra-low dose computed tomography,ULDCT)扫描技术被引入临床实践。ULDCT是一种优化扫描参数以实现超低辐射剂量的CT检查技术。其定义是相对于LDCT而言,旨在尽可能降低辐射剂量的同时,保持足够的图像质量以满足临床诊断需求,其辐射剂量与单次正侧位胸部X线检查相近[8]。
能谱纯化技术、高级的重建算法、管电流调制技术及扫描参数优化等都有利于实现ULDCT扫描[9-11]。其中使用能谱纯化技术进行光谱整形可在辐射剂量较低的情况下提高图像质量[12-14]。基于此,本研究使用能谱纯化技术,结合不同的参考管电流量对胸部体模和模拟肺结节进行ULDCT扫描并评估其图像质量和肺结节的显示,探索更合适的ULDCT扫描参数。验证ULDCT能否在满足图像诊断要求的前提下,最大限度地减少患者的辐射剂量。
材料与方法1. 材料:本研究使用的体模为多用途成年男性胸部体模N1(日本Kyoto Kagaku公司),高度45 cm,胸围94 cm,重量18 kg。体模内置16枚模拟肺结节,包括5枚直径为3 ~12 mm的实性结节(CT值为100 HU);6枚直径为15 ~20 mm的混合磨玻璃结节(磨玻璃成分CT值为-650 HU,实性成分CT值为-50 ~50 HU);3枚直径为15 mm纯磨玻璃结节(CT值为-750 ~-150 HU)。
2. 仪器与方法:采用第三代双源CT(Somatom Force,德国西门子公司)对胸部体模和模拟肺结节进行LDCT和ULDCT扫描。所有扫描均采用自动管电流调制技术。LDCT组扫描方案如下:参考管电流量25 mAs,螺距1.0。ULDCT组采用能谱纯化技术(锡滤线板),根据参考管电流量设为:ULDCT1(50 mAs)、ULDCT2(100 mAs)、ULDCT3(150 mAs)和ULDCT4(200 mAs),螺距1.5。其余扫描参数保持一致:管电压100 kV,旋转时间0.25 s,准直宽度192 mm × 0.6 mm,层厚和层间距均为5 mm。扫描范围为肺尖到肋膈角。重建算法为高级建模迭代重建(advanced modeled iterative reconstruction,ADMIRE),重建等级为3。肺窗重建5和1 mm的图像,其卷积核分别为Bl57和Br40,纵隔窗仅重建5 mm的图像,卷积核为Br40。
为减少随机误差,将模拟肺结节按照5种分布位置固定于体模肺野中,每种分布位置固定之后均进行4组ULDCT和1组LDCT的扫描,共得到25组图像。所有扫描数据均传输到图像存储与传输系统(picture archiving and communication system,PACS)进行图像质量分析。
3. 辐射剂量:从PACS上读取每次扫描的剂量报告,记录容积CT剂量指数(volume CT dose index,CTDIvol)和剂量长度乘积(dose length product,DLP),计算E,其中k = 0.014 mSv/(mGy·cm)[15]:
| $ E=\mathrm{DLP} \times k $ | (1) |
4. 图像质量分析
(1) 客观图像质量:客观图像质量评价指标包括图像噪声、信噪比(signal-to-noise ratio,SNR)和对比噪声比(contrast-to-noise ratio,CNR)。在隐藏图像信息后,由1名具有10年以上胸部影像诊断经验的医师在肺窗薄层图像上进行兴趣区(region of interest,ROI)勾画,得出各ROI的平均CT值和CT值的标准差(standard deviation,SD)。ROI分别位于主动脉弓、主动脉弓层面的气管腔内、胸部体模前方的空气处和各结节的最大径层面,ROI大小、位置在所有扫描组图像上保持一致。为避免周围间隙效应,模拟肺结节的ROI大小为结节最大层面直径的2/3,其余ROI的面积为100 mm2。以主动脉弓层面气管腔内ROI的SD值作为图像噪声。SNR和CNR的计算公式如下[16]:
| $ \mathrm{SNR}=\frac{C T}{S D} $ | (2) |
| $ \mathrm{CNR}=\frac{C T-C T_{ {air }}}{S D_{ {air }}} $ | (3) |
式中,CT和SD为各ROI的CT值和SD值;CTair和SDair为胸部体模前方空气的CT值和SD值。
(2) 主观图像质量:2名具有10年以上胸部影像诊断经验的医师在不知图像信息的情况下在PACS上独立阅片,以LDCT图像作为参考,采用4分制对ULDCT图像进行主观图像质量评分:1分,图像质量不可接受;2分,图像质量较LDCT差;3分,图像质量与LDCT相当;4分,图像质量优于LDCT。评价内容包括两个部分:整体图像质量和肺结节的显示情况。其中,整体图像质量包括噪声、对比度和锐利度。噪声为图像颗粒感,对比度和锐利度为辨别不同密度解剖结构的相对能力和解剖结构边缘的视觉可感锐利度及其与临近组织分界情况。肺结节的显示根据结节的均匀性和边缘的清晰度综合评分。
5. 统计学处理:采用SPSS 22.0软件进行数据分析。采用Shapiro-Wilk检验确定数据分布类型。符合正态分布的变量以x±s表示,不符合正态分布的变量以中位数和四分位数间距表示[M(IQR)]。根据不同数据类型采用重复测量方差分析或Friedman秩和检验比较不同扫描组间的CTDIvol、DLP、E、图像噪声、SNR和CNR的差异。对于总体组间比较有差异的变量,采用Bonferroni法或Dunnett’s T3法进行事后检验。对于主观评分一致性,采用组内相关系数(intra-class correlation coefficient,ICC)评估,ICC值0.00~0.20为一致性差,0.21~0.40为一致性一般,0.41~0.60为一致性中等,0.61~0.80为一致性好,0.81~1.00为一致性优[17]。P < 0.05为差异具有统计学意义。
结果1. 5个扫描组的辐射剂量差异:CTDIvol、DLP和E的总体组间差异均具有统计学意义(χ2=20.00,20.00,20.00,P < 0.001)。其中,4组ULDCT的E均较LDCT更低(t = -39.92,-30.04,-21.65,-17.30,P < 0.001),详见表 1。
|
|
表 1 5个扫描组的辐射剂量差异分析结果 Table 1 Analytical results of radiation dose differences among five scan groups |
2. 客观图像质量分析结果
(1) 5个扫描组的图像噪声差异:图像噪声的总体组间差异具有统计学意义(F = 156.10,P < 0.001),其中,在ULDCT各组中,ULDCT3和ULDCT4的图像噪声最小,且两组的图像噪声差异无统计学意义(P > 0.05),详见表 2。
|
|
表 2 5个扫描组的图像噪声及主动脉弓和肺结节的信噪比与对比噪声比差异分析结果 Table 2 Analytical results of differences in image noise and the SNRs and CNRs of the aortic arch and pulmonary nodules among five scan groups |
(2) 5个扫描组的主动脉弓和肺结节的SNR差异:主动脉弓和肺结节的SNR总体组间差异具有统计学意义(F = 58.32,χ2 = 227.26,P < 0.001)。主动脉弓的SNR在ULDCT4较LDCT更高(t = 3.55,P < 0.05)。肺结节的SNR在ULDCT4与LDCT的差异无统计学意义(P > 0.05),详见表 2。
(3) 5个扫描组的主动脉弓和肺结节的CNR差异:主动脉弓和肺结节的CNR总体组间差异具有统计学意义(F = 69 661.54,χ2 = 578.39,P < 0.001)。主动脉弓的CNR在ULDCT4较LDCT更高(t = 71.96,P < 0.001)。肺结节的CNR在ULDCT3与LDCT的差异无统计学意义(P > 0.05),详见表 2。
3. 主观图像质量分析结果:2位医师的主观评分一致性为优(ICC = 0.90,P < 0.001)。噪声、对比度和锐利度及肺结节的得分的总体组间差异均具有统计学意义(H = 36.37,30.12,85.40,P < 0.001),详见表 3。ULDCT4的主观图像质量得分均> 3分(优于LDCT)。对于整体图像质量,ULDCT4图像的噪声得分为3.80±0.46,对比度和锐利度得分为3.70±0.46。对于肺结节的显示,ULDCT4图像的得分为3.37±0.66。ULDCT4和LDCT的图像示例见图 1。
|
|
表 3 4组ULDCT的主观图像质量评分结果(x±s) Table 3 Subjective assessment results of image quality for four ULDCT groups (x±s) |
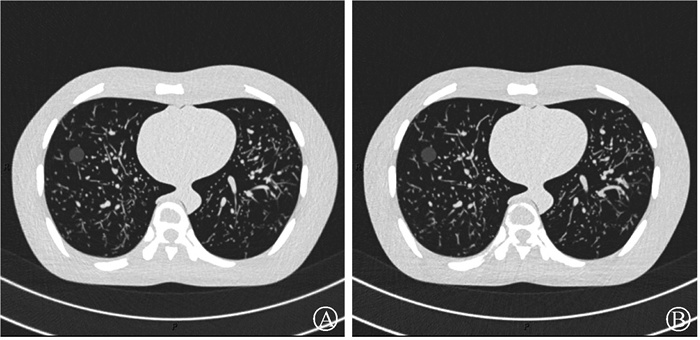
|
注:主观图像质量得分均>3分(优于LDCT图像),有效剂量为0.29、0.51 mSv 图 1 ULDCT4(200 mAs)和LDCT(25 mAs)的扫描图像示例A. ULDCT4扫描图像;B. LDCT扫描图像 Figure 1 CT images of ULDCT4 (200 mAs) and LDCT (25 mAs) A. ULDCT4 image; B. LDCT image |
讨论
尽管LDCT在肺癌筛查中至关重要,但肺结节多次随访会导致受检者的辐射剂量累积增加。因此,优化扫描参数,以更低的辐射剂量获得满足诊断要求的图像质量十分重要。本研究评估了使用能谱纯化技术的ULDCT在不同参考管电流下的图像质量及肺结节显示。结果表明,与LDCT相比,ULDCT4在辐射剂量减少43.14%的情况下,具有较好的图像质量和肺结节显示能力。
许多既往研究对ULDCT的扫描参数进行了优化,但由于使用的扫描设备和重建算法不同,其ULDCT的E从0.13到0.29 mSv不等[18-21]。使用锡滤线板的能谱纯化技术可以过滤掉高电压X射线管输出中的低能X射线,使能谱向高能侧偏移,从而在较低辐射剂量水平减少噪声,改善图像质量[14, 22]。既往研究表明,使用锡滤线板的胸部CT在明显减少辐射剂量的情况下,能保证足够的肺结节诊断可信度[23-24]。为了确保不同类型肺结节尤其是纯磨玻璃结节的显示,本研究调整了参考管电流量,以避免在追求超低剂量时,肺结节的显示不佳。因此,本研究ULDCT的E为0.29 mSv,略高于既往研究[23, 25-26]。
在客观图像质量方面,既往研究表明,ULDCT的图像噪声较LDCT更高[18, 23, 25, 27]。本研究也得到了一致的结果。在肺结节显示方面,既往研究表明,ULDCT中磨玻璃结节的图像质量较差,且更容易出现漏诊[27-28]。然而,本研究结果表明,肺结节的SNR在ULDCT4与LDCT之间的差异无统计学意义,CNR则ULDCT4较LDCT更高。由此,当ULDCT的参考管电流量为200 mAs时,其图像质量满足诊断要求,并可以有效地显示肺结节。
在主观图像质量方面,本研究结果表明,ULDCT4的整体图像质量和肺结节的显示较LDCT更好。既往研究对主观图像质量的评价方法各异。有研究使用了5分制对图像质量直接进行评分,结果表明,ULDCT的整体图像质量满足诊断要求,但主观评分低于标准剂量的图像[23]。Guo等[25]也采用了这种评价方法,并得到了类似的结果。而另一项研究采用了不同的评价方法,其将两组不同管电流的LDCT图像设为参考图像,采用5分制对ULDCT图像进行评分[29]。本研究也采用了类似的评价方法,以LDCT图像为参考图像,使用4分制对ULDCT图像进行评分,更好地评估ULDCT和LDCT之间的主观图像质量差异。
本研究尚存在一些不足之处:一是仅使用了ADMIRE 3进行图像重建,未探讨其它重建级别对图像质量的影响;二是体模实验无法完全反映不同体质指数患者的成像效果,且模拟肺结节类型有限。未来研究需要扩大样本量、涵盖不同体质指数人群、测试更多类型的肺结节,并探索多种重建算法,以增强ULDCT的临床适用性。
综上所述,参考管电流量为200 mAs、管电压为100 kV并使用能谱纯化技术的ULDCT扫描方案能在辐射剂量较LDCT减少43.14%的情况下,图像质量优于LDCT。使用能谱纯化技术的ULDCT有望替代LDCT用于早期肺癌筛查。
利益冲突 无
作者贡献声明 康承欣负责体模扫描、图像数据的测量与整理、统计结果分析、论文撰写及修改;李王佳负责体模扫描、分析解释数据、论文修改;付彬洁负责分析解释数据和论文修改及指导;褚志刚负责图像质量评价、分析解释数据和论文修改及指导;吕发金负责图像质量评价、指导研究设计和论文修改
| [1] |
Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263. DOI:10.3322/caac.21834 |
| [2] |
Hirsch FR, Scagliotti GV, Mulshine JL, et al. Lung cancer: current therapies and new targeted treatments[J]. Lancet, 2017, 389(10066): 299-311. DOI:10.1016/s0140-6736(16)30958-8 |
| [3] |
The American Association of Physicists in Medicine. Lung cancer screening CT protocols version 6.0[OL]. 2023-11-09. https://www.aapm.org/pubs/CTProtocols/documents/LungCancerScreeningCT.pdf.
|
| [4] |
Aberle DR, Adams AM, Berg CD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409. DOI:10.1056/NEJMoa1102873 |
| [5] |
Hoffman RM, Sanchez R. Lung cancer screening[J]. Med Clin North Am, 2017, 101(4): 769-785. DOI:10.1016/j.mcna.2017.03.008 |
| [6] |
范亚光, 周清华, 乔友林, 等. 中国肺癌低剂量CT筛查指南(2023年版)[J]. 中国肺癌杂志, 2023, 26(1): 1-9. Fan YG, Zhou QH, Qiao YL, et al. China national lung cancer screening guideline with low-dose computed tomography (2023 version)[J]. Chin J Lung Cancer, 2023, 26(1): 1-9. DOI:10.3779/j.issn.1009-3419.2023.102.10 |
| [7] |
Wood DE, Kazerooni EA, Baum SL, et al. Lung cancer screening, version 3.2018, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2018, 16(4): 412-441. DOI: 10.6004/jnccn.2018.0020.
|
| [8] |
Ohana M, Ludes C, Schaal M, et al. What future for chest X-ray against ultra-low-dose computed tomography?[J]. Rev Pneumol Clin, 2017, 73(1): 3-12. DOI:10.1016/j.pneumo.2016.09.007 |
| [9] |
Chang KJ, Collins S, Li B, et al. Optimizing CT technique to reduce radiation dose: effect of changes in kVp, iterative reconstruction, and noise index on dose and noise in a human cadaver[J]. Radiol Phys Technol, 2017, 10(2): 180-188. DOI:10.1007/s12194-016-0382-1 |
| [10] |
Yan C, Xu J, Liang C, et al. Radiation dose reduction by using CT with iterative model reconstruction in patients with pulmonary invasive fungal infection[J]. Radiology, 2018, 288(1): 285-292. DOI:10.1148/radiol.2018172107 |
| [11] |
Klink T, Obmann V, Heverhagen J, et al. Reducing CT radiation dose with iterative reconstruction algorithms: the influence of scan and reconstruction parameters on image quality and CTDIvol[J]. Eur J Radiol, 2014, 83(9): 1645-1654. DOI:10.1016/j.ejrad.2014.05.033 |
| [12] |
Samir A, El-Husseiny RM, Sweed RA, et al. Ultra-low-dose chest CT protocol during the second wave of COVID-19 pandemic: a double-observer prospective study on 250 patients to evaluate its detection accuracy[J]. Egypt J Radiol Nucl Med, 2021, 52(1): 136. DOI:10.1186/s43055-021-00512-2 |
| [13] |
Zhang M, Qi W, Sun Y, et al. Screening for lung cancer using sub-millisievert chest CT with iterative reconstruction algorithm: image quality and nodule detectability[J]. Br J Radiol, 2018, 91(1090): 20170658. DOI:10.1259/bjr.20170658 |
| [14] |
Greffier J, Pereira F, Hamard A, et al. Effect of tin filter-based spectral shaping CT on image quality and radiation dose for routine use on ultralow-dose CT protocols: a phantom study[J]. Diagn Interv Imaging, 2020, 101(6): 373-381. DOI:10.1016/j.diii.2020.01.002 |
| [15] |
Christner JA, Kofler JM, McCollough CH. Estimating effective dose for CT using dose-length product compared with using organ doses: consequences of adopting international commission on radiological protection publication 103 or dual-energy scanning[J]. AJR Am J Roentgenol, 2010, 194(4): 881-889. DOI:10.2214/ajr.09.3462 |
| [16] |
Kim H, Park CM, Chae HD, et al. Impact of radiation dose and iterative reconstruction on pulmonary nodule measurements at chest CT: a phantom study[J]. Diagn Interv Radiol, 2015, 21(6): 459-465. DOI:10.5152/dir.2015.14541 |
| [17] |
Yu Q, Ning Y, Wang A, et al. Deep learning-assisted diagnosis of benign and malignant parotid tumors based on contrast-enhanced CT: a multicenter study[J]. Eur Radiol, 2023, 33(9): 6054-6065. DOI:10.1007/s00330-023-09568-2 |
| [18] |
Nagatani Y, Takahashi M, Murata K, et al. Lung nodule detection performance in five observers on computed tomography (CT) with adaptive iterative dose reduction using three-dimensional processing (AIDR 3D) in a Japanese multicenter study: comparison between ultra-low-dose CT and low-dose CT by receiver-operating characteristic analysis[J]. Eur J Radiol, 2015, 84(7): 1401-1412. DOI:10.1016/j.ejrad.2015.03.012 |
| [19] |
Jiang B, Li N, Shi X, et al. Deep learning reconstruction shows better lung nodule detection for ultra-low-dose chest CT[J]. Radiology, 2022, 303(1): 202-212. DOI:10.1148/radiol.210551 |
| [20] |
Milanese G, Ledda RE, Sabia F, et al. Ultra-low dose computed tomography protocols using spectral shaping for lung cancer screening: comparison with low-dose for volumetric lungrads classification[J]. Eur J Radiol, 2023, 161: 110760. DOI:10.1016/j.ejrad.2023.110760 |
| [21] |
Yoon HJ, Chung MJ, Hwang HS, et al. Adaptive statistical iterative reconstruction-applied ultra-low-dose CT with radiography-comparable radiation dose: usefulness for lung nodule detection[J]. Korean J Radiol, 2015, 16(5): 1132-1141. DOI:10.3348/kjr.2015.16.5.1132 |
| [22] |
Gordic S, Morsbach F, Schmidt B, et al. Ultralow-dose chest computed tomography for pulmonary nodule detection: first performance evaluation of single energy scanning with spectral shaping[J]. Invest Radiol, 2014, 49(7): 465-473. DOI:10.1097/rli.0000000000000037 |
| [23] |
Messerli M, Kluckert T, Knitel M, et al. Ultralow dose CT for pulmonary nodule detection with chest x-ray equivalent dose - a prospective intra-individual comparative study[J]. Eur Radiol, 2017, 27(8): 3290-3299. DOI:10.1007/s00330-017-4739-6 |
| [24] |
Li C, Liu B, Meng H, et al. Efficacy and radiation exposure of ultra-low-dose chest CT at 100 kVp with tin filtration in CT-guided percutaneous core needle biopsy for small pulmonary lesions using a third-generation dual-source CT scanner[J]. J Vasc Interv Radiol, 2019, 30(1): 95-102. DOI:10.1016/j.jvir.2018.06.013 |
| [25] |
Guo X, Jia D, He L, et al. Evaluation of ultralow-dose computed tomography on detection of pulmonary nodules in overweight or obese adult patients[J]. J Appl Clin Med Phys, 2022, 23(4): e13589. DOI:10.1002/acm2.13589 |
| [26] |
Janssen S, Overhoff D, Froelich MF, et al. Detectability of lung nodules in ultra-low dose CT[J]. Anticancer Res, 2021, 41(10): 5053-5058. DOI:10.21873/anticanres.15320 |
| [27] |
Lee SW, Kim Y, Shim SS, et al. Image quality assessment of ultra low-dose chest CT using sinogram-affirmed iterative reconstruction[J]. Eur Radiol, 2014, 24(4): 817-826. DOI:10.1007/s00330-013-3090-9 |
| [28] |
Neroladaki A, Botsikas D, Boudabbous S, et al. Computed tomography of the chest with model-based iterative reconstruction using a radiation exposure similar to chest X-ray examination: preliminary observations[J]. Eur Radiol, 2013, 23(2): 360-366. DOI:10.1007/s00330-012-2627-7 |
| [29] |
Goto M, Nagayama Y, Sakabe D, et al. Lung-optimized deep-learning-based reconstruction for ultralow-dose CT[J]. Acad Radiol, 2023, 30(3): 431-440. DOI:10.1016/j.acra.2022.04.025 |
 2025, Vol. 45
2025, Vol. 45


