2. 中国医学科学院放射医学研究所天津市放射医学与分子核医学重点实验室, 天津 300192;
3. 山东枣庄市山亭区人民医院放射科, 枣庄 277200
2. Tianjin Key Laboratory of Radiation Medicine and Molecular Nuclear Medicine, Institute of Radiation Medicine, Chinese Academy of Medical Sciences & Peking Union Medical College, Tianjin 300192, China;
3. Department of Radiology, Shanting District People's Hospital, Zaozhuang 277200, China
乳腺癌是女性常见恶性肿瘤[1],且发病率逐年上升,已位列女性恶性肿瘤第一位。放疗是乳腺癌重要的治疗方法之一[2],射线在杀灭肿瘤细胞的同时,还可促进机体释放各种免疫因子,增强全身性的抗肿瘤免疫应答。但由于放疗对肿瘤免疫的影响是双向的[3],一方面射线可以杀死肿瘤细胞;另一方面,放疗可能通过诱导肿瘤血管新生、激活免疫抑制细胞及肿瘤相关成纤维细胞,导致放疗抵抗与肿瘤复发。有研究表明,适量的活性氧(reactive oxygen species, ROS)可以激活T细胞参与机体适应性抗肿瘤免疫应答[4]。APR-246是一种小分子化合物,它不仅可以通过恢复TP53突变细胞中的野生型p53功能以恢复肿瘤的抑制功能,并在多种癌细胞类型中诱导细胞死亡,还可通过提高细胞内ROS水平诱导细胞凋亡[5]。本研究首先从细胞水平考察了APR-246联合照射对肿瘤细胞内ROS及脂质过氧化(lipid peroxidation,LPO)水平的影响及对细胞凋亡的影响,然后通过动物水平考察APR-246联合照射对T细胞活化及巨噬细胞极化的调控能力,有望为乳腺癌的联合治疗提供新策略。
材料与方法1. 细胞及实验动物:小鼠乳腺癌4T1细胞购自中国科学院细胞库,由美国模式菌种收集中心(ATCC)提供。雌性BALB/c小鼠(合格证号:No.110011241105564363),6~8周龄,体重(20 ± 2)g,由北京维通利华实验动物技术有限公司提供[许可证号:SCXK(京)2021-0006],饲养于中国医学科学院北京协和医学院放射医学研究所实验动物中心。所有小鼠饲养在无特定病原体(SPF)环境下,室内维持恒温(23℃ ± 2℃)、恒湿(45%~50%),空气过滤(净化级别达100级),小鼠所用的笼具、垫料、饲料、饮水等都经过严密消毒。所有动物的饲养和实验均已获得中国医学科学院放射医学研究所动物实验伦理委员会批准[许可证号:SYXK(津)2024-0004]。
2. 主要试剂与仪器:APR-246购自上海瀚香生物科技有限公司;RPMI 1640完全培养基购自美国GIBCO公司;胰蛋白酶含EDTA、凋亡检测试剂盒购自美国Proteintech公司;DCFH-DA探针购自北京索莱宝科技有限公司;脂质过氧化传感器(BODIPYTM 581/591 C11)购自美国ThermoFisher公司;CCK-8试剂盒购自上海碧云天生物技术有限公司;小鼠淋巴细胞分离液购自深圳达科为生物工程有限公司;流式抗体(CD3-FITC,CD4-APC,CD8-PE,F4/80-FITC,CD86-PERCP,CD206-PE)购自美国BioLegend公司;流式细胞仪购自深圳迈瑞生物医疗;137Cs γ射线放射源(Gammacell-40)购自加拿大Best Theratronics公司。
3. CCK-8实验:取对数生长期的4T1细胞接种在96孔板中,密度为每孔1 × 104细胞。将96孔板置于37℃、5%CO2的细胞培养箱中,显微镜下观察细胞贴壁后,将RPMI 1640培养基更换为含有不同浓度的APR-246的新1640培养基(0、0.3、0.6、1.25、2.5、5.0、10.0、20.0 μg/ml)后,继续在37℃、5%CO2培养箱中培养24 h,然后在超净台中避光加入每孔含10 μl CCK-8试剂的RPMI 1640培养液,每孔总体积100 μl,再放入培养箱避光孵育1 h,使用波长为450 nm的酶标仪检测各孔吸光度(A)值,并计算各组细胞存活率,以考察不同浓度APR-246对4T1细胞活力的影响。细胞存活率(%)=(实验组A值-空白对照组A值)/(对照组A值-空白对照组A值)×100%。
4. 克隆形成实验:取对数生长期的4T1细胞接种在6孔板中,密度为每孔1 × 104细胞。分为照射组(0、2、4、6 Gy)和照射+给药组,0、2、4、6 Gy分别接种相应的细胞数(1 000、1 000、2 000、2 000/孔),置入37℃、5% CO2的细胞培养箱中过夜培养,APR-246给药浓度为0.2 μg/ml,给药后2 h进行照射,照射后放入培养箱,72 h后更换培养基继续培养5 d,肉眼可见菌落后终止细胞培养。磷酸盐缓冲液(PBS)清洗3次,使用浓度为0.25%结晶紫染色5 min。使用显影仪拍照并克隆计数(≥ 50细胞为1个克隆)。根据计数的克隆群落数,计算克隆形成率(克隆形成率=克隆群落数/接种细胞数×100%)。
5. 细胞凋亡实验:将4T1细胞以2 × 105/孔的密度接种于6孔板,分为对照组、给药组、照射组和照射+给药组,细胞贴壁后更换新鲜培养基并加药,APR-246给药浓度6 μg/ml,给药2 h后进行6 Gy照射,照射24 h后使用凋亡检测试剂盒抗体孵育细胞1 h,使用流式细胞仪上机检测。
6. 总ROS检测:将4T1细胞以2 × 105/孔的密度接种于6孔板,分为对照组、给药组、照射组和照射+给药组,细胞贴壁后更换新鲜培养基并加药,APR-246给药浓度6 μg/ml,给药2 h后进行6 Gy照射,照射24 h后使用DCFH-DA试剂避光孵育1 h,使用荧光显微镜拍照、流式细胞仪检测细胞内荧光强度。
7. 脂质过氧化检测:将4T1细胞以2 × 105/孔的密度接种于6孔板,分为对照组、给药组、照射组和照射+给药组,细胞贴壁后更换新鲜培养基并加药,APR-246给药浓度6 μg/ml,给药2 h后进行6 Gy照射,照射24 h后按照说明书使用BODIPYTM 581/591 C11避光孵育1 h,使用流式细胞仪检测细胞内荧光强度。
8. 荷瘤小鼠模型构建及抑瘤实验:在小鼠乳腺原位接种4T1肿瘤细胞(1 × 106/只),按完全随机分为4组:对照组、给药组、照射组、照射+给药组,每组5只。接种肿瘤第10天进行单次小鼠乳腺肿瘤局部照射,剂量为10 Gy。源皮距15 cm,射线为137Cs γ射线,剂量率0.82 Gy/min,射野为小鼠乳腺局部照射(直径4 cm);给药组及照射+ 给药组在照射前1 d进行首次腹腔给药,每只100 mg/kg,后续给药频率为每2天1次,于照射后11 d处死并取材。所有实验都在动物麻醉下无痛进行。
9. 苏木精-伊红(H&E)染色:将小鼠各组心肝脾肺肾样本浸泡在4%的多聚甲醛24 h,随后通过乙醇梯度脱水、组织透明、浸蜡、包埋及切片程序,获得4 μm厚度的组织切片,使用H&E染色,中性树脂封片。每张片子随机选取5个不重叠的组织视野拍照。
10. 流式细胞仪检测肿瘤组织中T细胞及巨噬细胞的比例:首先取小鼠新鲜肿瘤组织,制备单细胞悬液。随后根据不同抗体的说明书进行抗体标记,4℃避光条件下孵育30 min。随后,使用PBS进行两次洗涤后进行上机检测。
11. 统计学处理:采用GraphPad Prism 9软件进行统计学分析,计数资料采用χ2检验,计量资料符合正态分布,以x±s表示,两组间的差异使用t检验。P < 0.05为差异具有统计学意义。实验至少重复3次。
结果1. APR-246抑制4T1肿瘤细胞的增殖:CCK-8实验结果表明,加入0.3、0.6、1.25、2.5、5.0、10.0、20.0 μg/ml APR-246,细胞存活分数分别为(97.75±2.31)%、(94.97±1.55)%、(90.11±1.45)%、(80.18±3.76)%、(57.65±1.66)%、(31.52±0.19)%、(17.60±1.08)%。与0 μg/ml相比,随着给药浓度增高,自0.6 μg/ml起4T1细胞的增殖活力降低,差异有统计学意义(t=4.96、9.12、9.90、34.23、72.10、75.85,P < 0.05),且呈浓度依赖性。APR-246对4T1细胞的IC50为6.22 μg/ml。
2. APR-246联合照射可降低4T1细胞的存活率:克隆形成实验结果显示,与照射组相比,不同照射剂量的照射+给药组4T1细胞存活率均降低(图 1),且与2、4、6 Gy照射组相比,照射+给药组细胞生存率下降均具有统计学意义(t =2.89、4.15、2.62,P < 0.05),表明APR-246联合照射可导致4T1细胞的存活率下降。
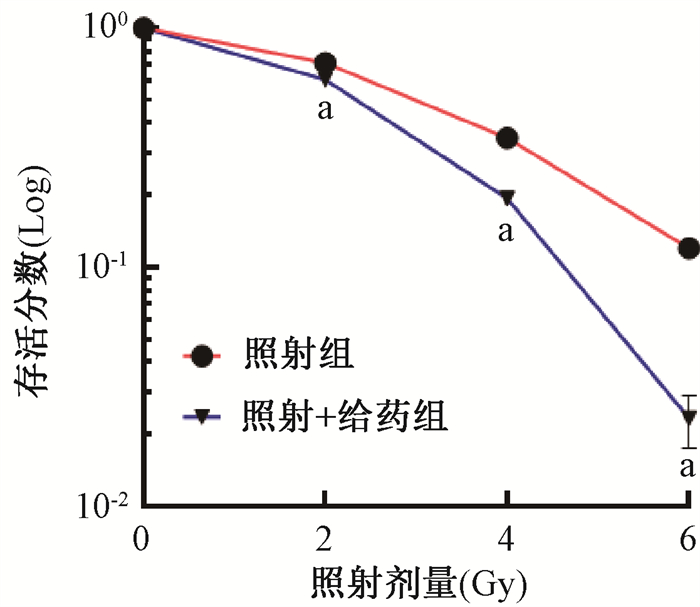
|
注:a与照射组相比,t=2.89、4.15、2.62,P < 0.05 图 1 APR-246联合照射4T1细胞存活曲线 Figure 1 Survival curves of 4T1 cells treated with APR-246 combined with irradiation |
3. APR-246有效增强辐射诱导的4T1细胞凋亡:结果显示,与对照组(8.03% ± 1.70%)相比,6 Gy照射组及给药组的凋亡细胞比例(28.20% ± 1.27%、26.15% ± 2.56%)升高(图 2),且照射+给药组能有效提高辐射诱导的凋亡水平(62.53% ± 3.91%),与照射组相比差异具有统计学意义(t =10.99,P < 0.05)。

|
注:1.对照组;2.给药组;3.照射组;4.照射+给药组 图 2 各处理组凋亡细胞的比例 Figure 2 The proportion of apoptotic cells in each group |
4. APR-246提高辐射诱导的4T1肿瘤细胞的ROS及LPO水平:ROS荧光图及流式细胞术分析显示,与对照组相比,各处理组细胞内ROS水平升高,且与照射组相比,照射+给药组ROS水平升高且差异具有统计学意义(图 3A~B,t =16.95,P < 0.05),这表明APR-246与电离辐射对4T1细胞内ROS升高具有协同作用。

|
注:1.对照组;2.给药组;3.照射组;4.照射+给药组;a与照射组相比,t =16.95、6.09,P < 0.05 图 3 各处理组细胞内的ROS及LPO水平 A.各处理组ROS免疫荧光染色×20;B~C.各处理组4T1细胞ROS和LPO平均荧光强度统计图 Figure 3 Reactive oxygen species (ROS) and lipid peroxidation (LPO) levels in cells in each group A. Fluorescence image of ROS for each group (×20); B-C. The mean fluorescence intensities of ROS and LPO in 4T1 cells in each group |
同样地,与对照组相比,6 Gy照射组及给药组的LPO水平升高,而照射+给药组LPO水平与照射组比较差异具有统计学意义(图 3C, t=6.09,P < 0.05),这说明APR-246联合照射对提高LPO水平也具有协同作用。
5. APR-246联合照射的体内安全性评价:结果显示,与对照组相比,照射+给药组的重要脏器(心脏、肝脏、脾脏、肾脏及肺)的病理结构无明显差异(图 4)。照射导致小鼠体质量下降,但照射+给药组小鼠体质量高于照射组(P > 0.05),说明APR-246联合照射的体内方案不会加重体质量减轻,具有安全性。

|
图 4 不同处理组小鼠重要脏器H&E染色×40 Figure 4 H&E staining of major organs of mice in each group ×40 |
6. APR-246联合照射有效抑制体内4T1肿瘤生长:从小鼠肿瘤体积变化曲线观察到对照组的小鼠肿瘤体积增长速度高于各处理组。与对照组相比,照射组及给药组的肿瘤体积变化增长较慢,但到肿瘤生长后期,给药组无法有效遏制肿瘤生长。注瘤后第16天起,照射+给药组与照射组相比差异有统计学意义(图 5,t =2.38~2.91,P < 0.05),可有效抑制小鼠肿瘤的生长。以上结果说明药物联合照射能有效促进电离辐射对实体肿瘤的抑制。

|
注:a与照射组相比,t =2.38~2.91,P < 0.05 图 5 不同时间各处理组肿瘤体积变化 Figure 5 Changes in tumor volume in each group at different time |
7. APR-246联合照射有效激活抗肿瘤免疫反应:结果见图 6,与对照组、给药组及照射组相比,照射+给药组可提高肿瘤微环境中CD4+与CD8+T细胞及M1/M2型巨噬细胞的比例,且照射+给药组与照射组相比差异具有统计学意义(t=9.96、6.28、15.30,P<0.05)。以上结果证明APR-246联合照射可有效激活抗肿瘤免疫反应。

|
注:1.对照组;2.给药组;3.照射组;4.照射+给药组;a与照射组相比,t=9.96、6.28、15.30,P < 0.05 图 6 APR-246联合照射对肿瘤免疫细胞的影响A~B. CD4+、CD8 + T细胞流式结果;C~E.各处理组CD4+、CD8+T细胞及M1型与M2型巨噬细胞的比例 Figure 6 Effects of APR-246 combined with irradiation on immune cells A-B. Representative flow cytometry images of CD4+ and CD8+ T cells; C-E. The proportions of CD4+ and CD8+ T cells and the ratio of M1/M2 macrophages in each group |
讨论
肿瘤微环境(TME)是指肿瘤周围的所有细胞、细胞外基质和液体成分的总和[3]。在TME中,免疫微环境由多种免疫细胞和分子组成,在肿瘤的发生、发展和治疗中扮演着重要角色。放疗杀灭肿瘤细胞的同时,可通过诱导肿瘤血管新生、激活免疫抑制细胞及肿瘤相关成纤维细胞,导致放疗抵抗与肿瘤复发。在放疗过程中,电离辐射与水发生相互作用可产生具有细胞毒性的ROS,使细胞发生氧化应激及程序性死亡[6]。过高的ROS水平还可以导致细胞内谷胱甘肽(GSH)耗竭以及增强肿瘤细胞的铁死亡[7]。有研究发现,铁死亡过程中ROS的上调可引起LPO水平的升高,导致内质网应激,从而促进钙网蛋白(CRT)的暴露,促进免疫原性细胞死亡(ICD)[8],在体内激活细胞毒性T淋巴细胞(CTLs)介导的抗肿瘤免疫应答[9]。但由于过量射线对机体伤害巨大,所以在安全照射剂量范围内,照射引起升高的ROS水平有限。
APR-246是一种新型的小分子药物,属于抗肿瘤靶向药物[4, 10-11]。已有研究表明,APR-246可以通过消耗GSH和抑制硫氧还蛋白还原酶增加氧化应激,导致ROS的积累,进一步促进肿瘤细胞死亡[12]。在机制上,APR-246已被证实可靶向抑制细胞氧化还原平衡的关键调节因子-野生型硒蛋白硫氧还蛋白还原酶1 (TrxR1),通过修饰TrxR1 c端基序中的Sec残基,将该酶转化为专用的NADPH氧化酶,从而导致ROS产生并诱导细胞死亡[13]。然而,使用APR-246治疗的患者可能会产生耐药性,尤其是当肿瘤细胞产生新的BCR-ABL融合基因突变或通过其他机制介导免疫逃逸[14]。所以,迫切需要开发一种可以与APR-246联合以避免其耐药性的产生并激活抗肿瘤免疫的联合治疗策略。
基于放疗及APR-246均可提高肿瘤细胞内的ROS水平,但各自又具有局限性。本研究利用APR-246联合照射增加肿瘤细胞内ROS的持续积累以激活抗肿瘤免疫的多重治疗模式,旨开发乳腺癌临床疗法的新策略。在目前的研究中,选用了在免疫原性,转移特性和生长特征方面都非常接近人类乳腺癌的免疫原性低而恶性程度高的小鼠4T1乳腺癌细胞进行体内外实验[15-17]。本研究不仅验证APR-246与照射联合可有效促进细胞内ROS水平升高,还进一步研究了二者联合对小鼠4T1乳腺癌的体内抗肿瘤免疫的影响。结果显示,在体外实验中,APR-246联合照射不仅可以抑制4T1细胞的增殖及降低存活率,还可以有效增强辐射诱导的4T1细胞凋亡水平。体内实验首先评估了药物联合照射对小鼠重要脏器的安全性,其次证实了与对照组、给药组及照射组相比,药物联合照射可以有效抑制小鼠原位乳腺癌的生长。这可能是由于联合照射有效地激活了CD4与CD8+T细胞,并提高了M1/M2巨噬细胞比例,这表明联合治疗的确可诱导抗肿瘤免疫反应。
本实验证实APR-246联合照射可有效抑制4T1肿瘤细胞增殖并诱导抗肿瘤免疫反应,但是还有很多需要进一步探索的不足之处。首先,本研究仅使用4T1作为乳腺癌细胞系和动物模型,研究结果的普适性可能受限,在下一步研究中,将使用多种细胞系再次进行相关抗肿瘤实验;其次,ROS可以通过多种通路诱导细胞凋亡[18-19],如丝裂原活化蛋白激酶通路、核因子-κB通路等,下一步可以针对联合治疗如何促进凋亡进行相关机制及通路进行探究;最后,本研究虽然检测到联合照射不仅升高了ROS水平,还使肿瘤细胞内的LPO水平提高,但并未进一步探究联合照射增强肿瘤细胞铁死亡及ICD相关机制。因此,还需要进一步在细胞水平探究肿瘤细胞内ROS升高对DAMP及多种模式识别受体的影响,并在动物水平进一步探究联合照射诱导抗肿瘤免疫反应的相关机制。更进一步,将通过APR-246联合放疗及免疫检查点抑制剂等进行肿瘤多重联合治疗,评估其抗肿瘤效果及体内安全性,希望为乳腺癌的临床治疗提供一个安全有效的新策略。
综上所述,本实验提出了一种有效治疗4T1乳腺癌的多重联合策略,其不仅有效升高肿瘤细胞内的ROS水平及LPO水平,促进肿瘤细胞凋亡,而且在荷瘤小鼠体内具备安全性与可行性。联合治疗可激活CD4与CD8+T细胞并提高M1/M2巨噬细胞比例,从而诱导抗肿瘤免疫反应,抑制肿瘤生长。本研究结果不仅提示APR-246联合照射在乳腺癌治疗策略中的可行性,同时也证明免疫调节策略在肿瘤治疗中的重要性,这种多重联合疗法有望为乳腺癌治疗策略提供一种新思路。
利益冲突 无
作者贡献声明 马菲菲负责实验设计、实验操作、数据整理、撰写论文;李拓、王宁、张焕腾、管杰冰负责协助部分实验和论文整理;陆淑娟、李建国、刘强指导实验设计和论文修改
| [1] |
Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48. DOI:10.3322/caac.21763 |
| [2] |
Douek M, De Silva-Minor S, Davies L, et al. Breast cancer radiation therapy[J]. Lancet, 2020, 396(10262): 1558-1559. DOI:10.1016/S0140-6736(20)32323-0 |
| [3] |
Barker HE, Paget JT, Khan AA, et al. The tumour microenvironment after radiotherapy: mechanisms of resistance and recurrence[J]. Nat Rev Cancer, 2015, 15(7): 409-425. DOI:10.1038/nrc3958 |
| [4] |
Ren Y, Wang R, Weng S, et al. Multifaceted role of redox pattern in the tumor immune microenvironment regarding autophagy and apoptosis[J]. Mol Cancer, 2023, 22(1): 130. DOI:10.1186/s12943-023-01831-w |
| [5] |
Kobayashi T, Makino T, Yamashita K, et al. APR-246 induces apoptosis and enhances chemo-sensitivity via activation of ROS and TAp73-Noxa signal in oesophageal squamous cell cancer with TP53 missense mutation[J]. Br J Cancer, 2021, 125(11): 1523-1532. DOI:10.1038/s41416-021-01561-0 |
| [6] |
Lee SY, Jeong EK, Ju MK, et al. Induction of metastasis, cancer stem cell phenotype, and oncogenic metabolism in cancer cells by ionizing radiation[J]. Mol Cancer, 2017, 16(1): 10. DOI:10.1186/s12943-016-0577-4 |
| [7] |
Song H, Sun H, He N, et al. Glutathione depletion-induced versatile nanomedicine for potentiating the ferroptosis to overcome solid tumor radioresistance and enhance immunotherapy[J]. Adv Healthc Mater, 2024, 13(9): e2303412. DOI:10.1002/adhm.202303412 |
| [8] |
Zhang W, Chen G, Chen Z, et al. Mitochondria-targeted polyprodrug nanoparticles induce mitochondrial stress for immunogenic chemo-photodynamic therapy of ovarian cancer[J]. J Control Release, 2024, 371: 470-483. DOI:10.1016/j.jconrel.2024.06.014 |
| [9] |
Li C, Tu L, Xu Y, et al. A NIR-light-activated and lysosomal-targeted Pt(Ⅱ) metallacycle for highly potent evoking of immunogenic cell death that potentiates cancer immunotherapy of deep-seated tumors[J]. Angew Chem Int Ed Engl, 2024, 63(37): e202406392. DOI:10.1002/anie.202406392 |
| [10] |
Ceder S, Eriksson SE, Cheteh EH, et al. A thiol-bound drug reservoir enhances APR-246-induced mutant p53 tumor cell death[J]. EMBO Mol Med, 2021, 13(2): e10852. DOI:10.15252/emmm.201910852 |
| [11] |
Lambert JM, Gorzov P, Veprintsev DB, et al. PRIMA-1 reactivates mutant p53 by covalent binding to the core domain[J]. Cancer Cell, 2009, 15(5): 376-388. DOI:10.1016/j.ccr.2009.03.003 |
| [12] |
Zhang J, Gao Z, Yang Y, et al. SNF2L maintains glutathione homeostasis by initiating SLC7A11 transcription through chromatin remodeling[J]. Cell Death Dis, 2024, 15(11): 820. DOI:10.1038/s41419-024-07221-4 |
| [13] |
Peng X, Zhang MQ, Conserva F, et al. APR-246/PRIMA-1MET inhibits thioredoxin reductase 1 and converts the enzyme to a dedicated NADPH oxidase[J]. Cell Death Dis, 2013, 4(10): e881. DOI:10.1038/cddis.2013.417 |
| [14] |
Mohell N, Alfredsson J, Fransson Å, et al. APR-246 overcomes resistance to cisplatin and doxorubicin in ovarian cancer cells[J]. Cell Death Dis, 2015, 6(6): e1794. DOI:10.1038/cddis.2015.143 |
| [15] |
McGinnis CS, Miao Z, Superville D, et al. The temporal progression of lung immune remodeling during breast cancer metastasis[J]. Cancer Cell, 2024, 42(6): 1018-1031. DOI:10.1016/j.ccell.2024.05.004 |
| [16] |
Liu XL, Dong X, Yang SC, et al. Biomimetic liposomal nanoplatinum for targeted cancer chemophototherapy[J]. Adv Sci (Weinh), 2021, 8(8): 2003679. DOI:10.1002/advs.202003679 |
| [17] |
Yan G, Xiao Q, Zhao J, et al. Brucea javanica derived exosome-like nanovesicles deliver miRNAs for cancer therapy[J]. J Control Release, 2024, 367: 425-440. DOI:10.1016/j.jconrel.2024.01.060 |
| [18] |
Fan J, Ren D, Wang J, et al. Bruceine D induces lung cancer cell apoptosis and autophagy via the ROS/MAPK signaling pathway in vitro and in vivo[J]. Cell Death Dis, 2020, 11(2): 126. DOI:10.1038/s41419-020-2317-3 |
| [19] |
Liu Z, Yao X, Jiang W, et al. Advanced oxidation protein products induce microglia-mediated neuroinflammation via MAPKs-NF-κB signaling pathway and pyroptosis after secondary spinal cord injury[J]. J Neuroinflammation, 2020, 17(1): 90. DOI:10.1186/s12974-020-01751-2 |
 2025, Vol. 45
2025, Vol. 45


