2. 青岛市中医医院 青岛大学附属青岛市海慈医院核医学科,青岛 266034;
3. 山东第一医科大学附属肿瘤医院儿童肿瘤科,济南 250117
2. Department of Nuclear Medicine, Qingdao Traditional Chinese Medicine Hospital, Qingdao Hiser Hospital Affiliated of Qingdao University, Qingdao 266034, China;
3. Department of Pediatric Oncology, Shandong First Medical University and Shandong Academy of Medical Sciences, Shandong Cancer Hospital and Institute, Jinan 250117, China
177Lu-1, 4, 7, 10-四氮杂环十二烷-1, 4, 7, 10-四乙酸-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽(1, 4, 7, 10-tetraazacyclododecane-1, 4, 7, 10-tetraacetic acid-D-Phe1-Tyr3-Thr8-octreotide, DOTATATE) 肽受体放射性核素治疗(peptide receptor radionuclide therapy, PRRT)是近年来新兴的治疗难治性儿童神经母细胞瘤(neuroblastoma, NB)的一项技术[1-4]。177Lu-DOTATATE是一种放射性标记的生长抑素类似物,与NB细胞表面过表达的生长抑素受体结合,从而提供了一种直接向肿瘤传递靶向辐射的方法[5]。177Lu的物理半衰期为6.73 d,发射β和γ粒子。177Lu的最大β粒子能量为0.498 MeV,最大软组织穿透深度为1.7 mm。除β粒子外,177Lu在113(相对丰度6%)和208 keV(相对丰度11%)有两种γ射线[6]。在治疗患者的同时,γ射线也会对周围人群产生辐射。接受治疗的儿童需要看护者(通常为患者父母)较长时间的照顾和护理[7],其看护者存在更高的辐射风险,然而目前国内缺乏177Lu-DOTATATE治疗对看护者和公众放射防护的研究。本研究回顾性收集18例接受177Lu-DOTATATE治疗的儿童神经母细胞瘤患者,通过生物动力学分析,估算患者对看护者和公众的外照射辐射剂量,并确定接触限制的时间,为相关的辐射防护措施提供重要的参考依据。
资料与方法1. 研究对象:回顾性收集2023年6月至2023年7月间在山东第一医科大学附属肿瘤医院核医学科接受177Lu-DOTATATE治疗的18例儿童神经母细胞瘤患者,其中男性11例,女性7例,年龄3~13(6.72±2.72)岁。纳入标准:年龄0~18岁;组织学确诊的晚期或难治性神经母细胞瘤患者;原发性或转移性肿瘤在18F-NOTATATE PET/CT上的摄取超过肝脏摄取;生命体征平稳,预期寿命不少于3个月。排除标准:疾病进展迅速;接受过或正在接受其他生长抑素类似物治疗;存在其他恶性肿瘤,正在发展或需要积极治疗。本研究获得山东第一医科大学附属肿瘤医院伦理委员会批准(审批号:SDTHEC2024004028),所有患者均签署知情同意书。
2. 治疗流程:患者于治疗前采用德国Siemens Biograph Horizon 16 Slice PET/CT行18F-AlF-NOTATATE(由山东第一医科大学附属肿瘤医院核医学科自主合成)显像,使用MIM ver.7.3.2软件(美国Cleveland公司)勾画全身病灶感兴趣体积(volume of interest, VOI),得到全身病灶总体积。177Lu-DOTATATE(由山东第一医科大学附属肿瘤医院核医学科自主合成)给药前进行水化及氨基酸输注,然后,将放射性药物经静脉注射至少20 min。给药剂量为(180±20)MBq/kg,最大给药剂量不超过7 400 MBq[2]。为了评估放射性药物的分布,注射后1(排泄前)、4、24、48和96 h进行全身平面显像。所有图像均通过NM 870 SPECT/CT(美国GE公司)使用中能准直器获取。
3. 药代动力学分析:使用HERMES Hybrid ViewerTM(瑞典HERMES Medical Solutions公司)软件手动绘制全身扫描的感兴趣区域(region of interest, ROI),得到各时间点前后视图总计数的几何平均值,排泄前得到的全身计数为100%滞留,以此计算各时间点患者体内177Lu滞留的百分比。通过双指数函数拟合得到相应数学方程,计算出有效半衰期[8]。
4. 患者周围空气吸收剂量率测量:使用美国International Medcom公司手持式X、γ辐射剂量仪(型号XH-2020)测量患者周围空气吸收剂量率(absorbed dose rate in air),其剂量率探测范围为0.001~ 1 500 μSv/h。在患者完成静脉注射后1、4、24、48和96 h,分别于距患者0、0.1、0.5、1.0和2.0 m处测量空气吸收剂量率,测量时监测剂量仪探头平行于患者胸部中心水平,测量时间为60 s,取平均值。所有数据均扣除本底。
5. 暴露因子(occupancy factor, OF):OF是指在核素治疗患者附近花费的时间的比例[9]。为估计患者出院后其家庭成员和公众所接受的辐射剂量,使用Barrington等[10]对社交接触时间的假设:
家庭成员:患者白天在距离家庭成员1 m的地方接触6 h,OF(1 m)= 0.25,夜晚在距离家庭成员0.1 m的地方接触8 h,OF(0.1 m)= 0.33。
父母:假设父母是患者的主要看护者,根据患者的年龄,适用以下接触模式:对于2~5岁的儿童,父母每天在距离患者0.1 m处接触4 h,在距离患者1 m处接触8 h,OF(0.1 m)= 0.17,OF(1 m)= 0.33;对于5~13岁的儿童,父母每天在距离患者0.1 m处接触2 h,OF(0.1 m)= 0.08,在距离患者1 m处接触4 h,OF(1 m)= 0.17。
其他儿童:患者每天与其他儿童在相距1 m处接触8 h,OF(1 m)= 0.33。
在无其他乘客在场的情况下,患者乘坐私人交通工具时,将与司机间隔1 m的距离;乘坐公共交通工具时,将与其他乘客间隔0.1 m的距离。
6. 有效剂量(effective dose, E):本研究采用Mountford[11]法,通过假设社交接触模式估算看护者及公众的E。根据国际原子能机构(International Atomic Energy Agency,IAEA)安全报告63号[12]及Han等[9]的研究,由不同的OF值,从给药后的时间t到无穷大时间,E可按公式(1)计算如下:
| $ E=1.44 \cdot D R \cdot O F \cdot \int \sum\limits_{i=1}^2 F_i \cdot T_{e_i} \cdot e^{-\frac{\ln (2) t}{T_{e_i}}} \mathrm{~d} t $ | (1) |
式中,Fi为177Lu-DOTATATE在长衰变组分和短衰变组分中的相对分布分数;Tei为177Lu-DOTATATE在长衰变组分和短衰变组分中的有效半衰期,h;t为177Lu-DOTATATE给药后的时间,h;积分下限为假设出院时间(4、24和48 h),积分上限为无穷大时间。
7. 限制期:根据邓颖等[13]的研究,由Mountford[11]法估计公众接触患者时的E,当时间趋近于无穷大时,日受照剂量趋于无穷小,从无穷小剂量开始向前累积,当累积剂量达到相应人群的年总有效剂量限值时,对应当天为接触限制期(t′)。基于不同的OF值,计算患者与公众之间的接触限制期如公式(2):
| $ 1 \mathrm{mSv}=1.44 \cdot D R \cdot O F \cdot \int\limits_r^{\infty} \sum\limits_{i=1}^2 F_i \cdot T_{e_i} \cdot e^{-\frac{\ln (2) t}{T_{e_i}}} \mathrm{~d} t $ | (2) |
计算治疗后患者每日最多允许乘车时间如公式(3):
| $ 1 \mathrm{mSv}=1.44 \cdot D R \cdot \chi \cdot \int\limits_i^{t+24} \sum\limits_{i=1}^2 F_i \cdot T_{e_i} \cdot e^{-\frac{\ln (2) t}{T_{e_i}}} \mathrm{~d} t $ | (3) |
式中,起始时间t设为0 h,每次递增24 h替换,而χ则是患者每日允许的最大乘车时间分数。
8. 统计学处理:采用SPSS 27.0软件进行数据分析。符合正态分布的数据以x ± s表示,根据皮尔森相关性分析得出r值及相应的P值;不符合正态分布的数据以中位数(四分位数间距)表示,根据斯皮尔曼相关性分析得出r值及相应的P值。P < 0.05为差异有统计学意义。
结果1. 药物排泄:18例神经母细胞瘤患者的177Lu-DOTATATE给药剂量为(4 353.42±1 451.51)MBq,范围为2 619.60~7 401.85 MBq。全身药物残留活度占初始给药活度的比例随时间的变化如图 1所示。短衰变组分半衰期为(2.45±0.18)h,长衰变组分半衰期为(36.29±10.18)h。在给药后的前4 h内,约排出(55.50±4.76)% 给药活度;在给药后的前24 h内,约排出(76.70±3.99)%给药活度;在给药后的前48 h内,约排出(82.10±2.86)%给药活度;在给药后的前96 h内,约排出(90.12±1.83)%给药活度。
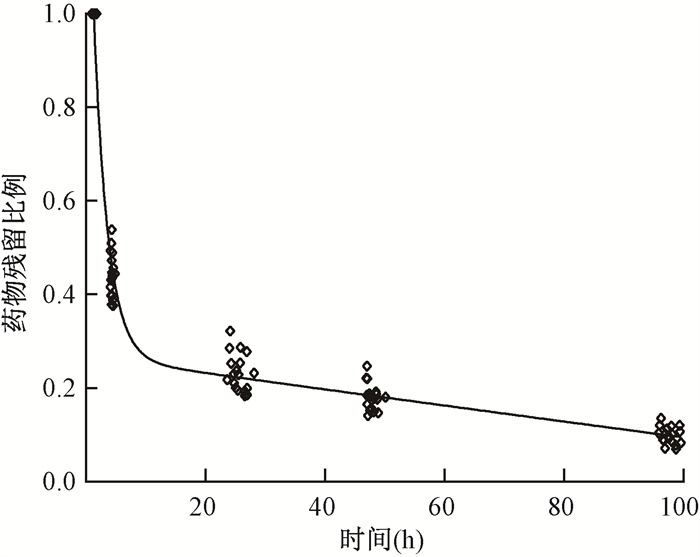
|
图 1 全身177Lu-DOTATATE药物残留-时间曲线 Figure 1 Whole-body 177Lu-DOTATATE retention-time curve |
2. 患者周围空气吸收剂量率:患者注射药物后不同时间、不同距离测得的空气吸收剂量率详见表 1。由表 1可知,患者177Lu-DOTATATE治疗后,随着测量距离的增加,空气吸收剂量率逐渐降低。给药后1 h距患者胸前体表 0 m处空气吸收剂量率平均值为399.18 μSv/h,最低为200 μSv/h,最高可达579 μSv/h。给药后经机体代谢,测量值逐日减低,给药后24 h距患者胸前体表 0 m处平均值为104.12 μSv/h,其范围为70.37~167.8 μSv/h。
|
|
表 1 177Lu-DOTATATE给药后不同时间不同距离测得的空气吸收剂量率(μSv/h,x ± s) Table 1 Absorbed dose rates in air measured at different distances and time post administration of 177Lu-DOTATATE (μSv/h, x ± s) |
3. 空气吸收剂量率与临床指标及病灶总体积相关性分析:由表 2可知,患者177Lu-DOTATATE给药后1、4、24、48和96 h,测量距离为1 m处的空气吸收剂量率均与患者的体重和给药剂量呈正相关(P < 0.05);给药后4、24、48和96 h,测量距离为1 m处的空气吸收剂量率均与年龄呈正相关(P < 0.05)。患者全身病灶总体积与给药后各时间点距患者1 m处测量值均无显著相关性(P>0.05)。
|
|
表 2 177Lu-DOTATATE给药后1 m处不同时间测量空气吸收剂量率与临床指标及病灶总体积的相关性分析 Table 2 Correlation of dose rate measured at 1 m distance at various times post administration of 177Lu-DOTATATE with clinical indicators and total lesion volume |
4. 有效剂量:患者在177Lu-DOTATATE治疗后不同时间出院对家庭成员及公众的E如表 3所示。所有患者均于177Lu-DOTATATE给药后24 h出院。出院后,2~5岁和5~13岁的儿童对看护者的辐射剂量分别为(2.47±1.80)和(0.88±0.47)mSv。
|
|
表 3 不同接触模式下177Lu-DOTATATE治疗患者辐射总剂量及不同出院时间对公众的辐射剂量(mSv) Table 3 Total effective dose and discharge time-related doses to the public following 177Lu-DOTATATE treatment in different contact modes (mSv) |
5. 限制期:患者与家庭成员夜间睡眠接触限制期为2 d,与其他儿童接触限制期为1 d。患者完成治疗后乘坐私人交通工具没有时间限制;完成治疗后的5 d内,需限制公共交通工具乘坐时间,治疗后第1、2、3、4和5天,分别限乘4、5、12、17和23 h,从第6天开始没有时间限制。
讨论177Lu-DOTATATE PRRT为难治或复发儿童神经母细胞瘤的治疗提供了一种可能性[2-3],但同时也可能对患儿家庭成员及公众产生辐射。本研究结果表明,177Lu-DOTATATE给药后,随着药物排泄,患者周围空气吸收剂量率逐渐减低,与其密切接触的看护者较一般家庭成员和公众受到更高的辐射剂量。
本研究中,177Lu-DOTATATE给药后4、24和96 h体内总药量清除分别为55.50%、76.70%和90.12%,目前国内外尚缺乏177Lu-DOTATATE在儿童体内的药代动力学分析,而之前Calais与Turner[14]在接受177Lu-DOTATATE治疗的成人患者群体中得到了4 h体内总药量清除为46%的结果,Levart等[5]也在另一组成人患者群体中得到了24和96 h体内总药量清除分别为67%和83%的结果,这一方面源于儿童与成人在药物代谢方面存在差异,另一方面可能是因为本研究在给药前进行了水化以达到保护肾脏的目的。
实测患者出院时距其1 m处中位空气吸收剂量率为3.68 μSv/h,接近Levart等[5]在177Lu-DOTATATE治疗的成人患者群体中估算的给药后18 h距患者1 m处空气吸收剂量率为7 μSv/h的结果,但低于耿建华等[15]估算177Lu-DOTATATE治疗的成人患者给药后24 h距患者1 m处空气吸收剂量率为11.04 μSv/h的结果。这可能是由人体中177Lu-DOTATATE的空间分布和组织对射线的衰减所致。给药后第4天(96 h),随着体内药物大部分清除,空气吸收剂量率下降到较低水平。此外,177Lu-DOTATATE给药后随着测量距离的增加,各时间点测量的患者周围辐射剂量率减低,表明有必要进行距离防护,陪护者应尽可能与患者保持距离,以减少可能受到的辐射。
本研究还首次探讨了177Lu-DOTATATE治疗患者周围空气吸收剂量率与给药剂量的关系,发现空气吸收剂量率与患者的年龄、体重及给药剂量呈正相关,而与病灶总体积无关。这与江英等[16]在131I治疗的患者群体中得到的空气吸收剂量率与年龄正相关而与给药剂量无相关性有差异。这可能是因为177Lu-DOTATATE患者的给药剂量是基于体重确定的,而儿童体重通常随年龄的增长而增加[7],这也提示给药剂量更高的患者的陪护人员可能受到更高的辐射风险。
在几种接触模式中,与患儿夜间同眠和陪护2~5岁的患儿所接受的辐射剂量最高。建议患儿24 h后出院,以确保其家庭成员中的成年人所受辐射剂量在5 mSv以内,同时其家庭成员中的儿童和公众所受辐射剂量不得超过1 mSv[17]。尽管国外已有研究证明了门诊治疗的安全性和可行性[5, 18],但对于需要长时间陪护和照顾的儿童患者而言,住院治疗不仅有助于看护者实施门诊治疗难以实现的屏蔽防护措施,更重要的是能有效减少排放到生活环境中的放射性废物。此外,住院治疗还能允许给药后第2天(24 h)使用SPECT成像观察药物在体内的分布是否正常。
对于患儿成年家属,建议与患儿夜间同眠限制期为2 d,并尽可能保持1 m以上距离;而与患者单纯日间接触不设限制期。对于其他儿童,与患儿接触限制期为1 d,但也应尽可能缩短近距离接触时间。需要指出的是,国际放射防护委员会(ICRP)建议,对于参与探视和照顾的非婴幼儿人员,应灵活使用辐射剂量限制值。对于病情严重的患儿家长,接受较高的辐射剂量可能是合理的[19]。在规定其辐射限制时,必须权衡对看护者可能带来的风险和对患者及其亲属或朋友可能产生的生理和心理益处[20]。考虑患儿病情及生理心理需要,建议治疗后4 d内尽可能由1~ 2位家庭成员分担看护任务,同时非必要时与患者保持1 m以上距离。本研究与耿建华等[15]利用177Lu-DOTATATE体内动力学数据估算成人患者对周围人群辐射剂量的研究建议一致,在公众放射防护方面,建议出院时尽可能乘坐私人交通工具(出租车或私家车)并与周围人员保持距离,给药后第6天起乘坐公共交通工具不设时间限制。
本研究分析了177Lu-DOTATATE治疗儿童神经母细胞瘤的外照射辐射安全性,但也存在局限性。首先,这是一个单中心研究,纳入的样本量较小。其次,患者对看护者和公众的辐射剂量是根据177Lu-DOTATATE体内生物动力学数据和假设社交接触模式估算得到的,所得结果可能高估[21]。因此,为了确定预防措施的可靠性,有必要实际测量受照个体的剂量。
综上所述,通过儿童神经母细胞瘤177Lu-DOTATATE治疗后测量患者周围空气吸收剂量率及接触人群辐射剂量估计,发现治疗后仍需关注辐射防护,患者与看护者和公众有必要限制接触。实施预防措施可将看护者和公众每年接受的剂量控制在限制值以下,这表明177Lu-DOTATATE治疗是一种较为安全的放射性核素治疗方案。
利益冲突 所有作者声明无利益冲突
作者贡献声明 孙莹莹负责设计实验,撰写论文;左迪负责修改文章,分析解释数据;郑菲、王涵负责实施研究,统计分析;杨昊、刘宇轩负责采集及分析数据,协助研究实施;孙晓蓉负责研究指导,论文审阅
| [1] |
Gains JE, Bomanji JB, Fersht NL, et al. 177Lu-DOTATATE molecular radiotherapy for childhood neuroblastoma[J]. J Nucl Med, 2011, 52(7): 1041-1047. DOI:10.2967/jnumed.110.085100 |
| [2] |
Gains JE, Moroz V, Aldridge MD, et al. A phase IIa trial of molecular radiotherapy with 177-lutetium DOTATATE in children with primary refractory or relapsed high-risk neuroblastoma[J]. Eur J Nucl Med Mol Imaging, 2020, 47(10): 2348-2357. DOI:10.1007/s00259-020-04741-x |
| [3] |
Fathpour G, Jafari E, Hashemi A, et al. Feasibility and therapeutic potential of combined peptide receptor radionuclide therapy with intensive chemotherapy for pediatric patients with relapsed or refractory metastatic neuroblastoma[J]. Clin Nucl Med, 2021, 46(7): 540-548. DOI:10.1097/RLU.0000000000003577 |
| [4] |
Malcolm JC, Falzone N, Gains JE, et al. Impact of cyclic changes in pharmacokinetics and absorbed dose in pediatric neuroblastoma patients receiving[177Lu]Lu-DOTATATE[J]. EJNMMI Phys, 2022, 9(1): 24. DOI:10.1186/s40658-022-00436-4 |
| [5] |
Levart D, Kalogianni E, Corcoran B, et al. Radiation precautions for inpatient and outpatient 177Lu-DOTATATE peptide receptor radionuclide therapy of neuroendocrine tumours[J]. EJNMMI Phys, 2019, 6(1): 7. DOI:10.1186/s40658-019-0243-1 |
| [6] |
Bodei L, Mueller-Brand J, Baum RP, et al. The joint IAEA, EANM, and SNMMI practical guidance on peptide receptor radionuclide therapy (PRRNT) in neuroendocrine tumours[J]. Eur J Nucl Med Mol Imaging, 2013, 40(5): 800-816. DOI:10.1007/s00259-012-2330-6 |
| [7] |
Gains JE, Walker C, Sullivan TM, et al. Radiation exposure to comforters and carers during paediatric molecular radiotherapy[J]. Pediatr Blood Cancer, 2015, 62(2): 235-239. DOI:10.1002/pbc.25250 |
| [8] |
Liu B, Tian R, Peng W, et al. Radiation safety precautions in 131I therapy of Graves' disease based on actual biokinetic measurements[J]. J Clin Endocrinol Metab, 2015, 100(8): 2934-2941. DOI:10.1210/jc.2015-1682 |
| [9] |
Han S, Jin S, Yoo SH, et al. A practical individualized radiation precaution based on the dose rate at release time after inpatient 131I ablation therapy[J]. PLoS One, 2021, 16(5): e0251627. DOI:10.1371/journal.pone.0251627 |
| [10] |
Barrington SF, Kettle AG, O'Doherty MJ, et al. Radiation dose rates from patients receiving iodine-131 therapy for carcinoma of the thyroid[J]. Eur J Nucl Med, 1996, 23(2): 123-130. DOI:10.1007/BF01731834 |
| [11] |
Mountford PJ. Estimation of close contact doses to young infants from surface dose rates on radioactive adults[J]. Nucl Med Commun, 1987, 8(11): 857-863. DOI:10.1097/00006231-198711000-00002 |
| [12] |
International Atomic Energy Agency. IAEA publications. Release of patients after radionuclide therapy. Safety report series No 63[S]. Vienna: IAEA, 2009.
|
| [13] |
邓颖, 何丽萌, 孙占良, 等. 177Lu-PSMA-617治疗前列腺癌对公众人群外照射辐射剂量研究[J]. 中华核医学与分子影像杂志, 2022, 42(9): 529-533. Deng Y, He LM, Sun ZL, et al. External exposure dose of 177Lu-PSMA-617 to the public in the treatment of prostate cancer[J]. Chin J Nucl Med Mol Imaging, 2022, 42(9): 529-533. DOI:10.3760/cma.j.cn321828-20210427-00139 |
| [14] |
Calais PJ, Turner JH. Radiation safety of outpatient 177Lu-octreotate radiopeptide therapy of neuroendocrine tumors[J]. Ann Nucl Med, 2014, 28(6): 531-539. DOI:10.1007/s12149-014-0843-8 |
| [15] |
耿建华, 张锦明, 王晓涛, 等. 177Lu-Dotatate治疗的放射防护评估[J]. 中国辐射卫生, 2021, 30(6): 710-719. Geng JH, Zhang JM, Wang XT, et al. Radiation protection assessment for 177Lu-Dotatate therapy[J]. Chin J Radiol Health, 2021, 30(6): 710-719. DOI:10.13491/j.issn.1004-714X.2021.06.011 |
| [16] |
江英, 朱玉泉, 胡凤琼, 等. 甲亢患者131I治疗后周围剂量当量率的变化及其影响因素的研究[J]. 国际放射医学核医学杂志, 2022, 46(5): 284-289. Jiang Y, Zhu YQ, Hu FQ, et al. Study on the changes of ambient dose equivalent rate and its influencing factors in patients with hyperthyroidism after 131I treatment[J]. Int J Radiat Med Nucl Med, 2022, 46(5): 284-289. DOI:10.3760/cma.j.cn121381-202105010-000183 |
| [17] |
国家卫生健康委员会. GBZ 120-2020核医学放射防护要求[S]. 北京: 中国标准出版社, 2020. National Health Commission of the People's Republic of China. GBZ 120-2020 Requirements for radiological protection nuclear medicine[S]. Beijing: Standards Press of China, 2020. |
| [18] |
Olmstead C, Cruz K, Stodilka R, et al. Quantifying public radiation exposure related to lutetium-177 octreotate therapy for the development of a safe outpatient treatment protocol[J]. Nucl Med Commun, 2015, 36(2): 129-134. DOI:10.1097/MNM.0000000000000232 |
| [19] |
International Commission on Radiological Protection. The 2007 Recommendations of the International Commission on Radiological Protection. ICRP publication 103[J]. Ann ICRP, 2007, 37(2-4): 1-332. DOI:10.1016/j.icrp.2007.10.003 |
| [20] |
Mair C, Warwitz B, Fink K, et al. Radiation exposure after 177Lu-DOTATATE and 177Lu-PSMA-617 therapy[J]. Ann Nucl Med, 2018, 32(7): 499-502. DOI:10.1007/s12149-018-1264-x |
| [21] |
Liu B, Peng W, Huang R, et al. Thyroid cancer: radiation safety precautions in 131I therapy based on actual biokinetic measurements[J]. Radiology, 2014, 273(1): 211-219. DOI:10.1148/radiol.14132234 |
 2025, Vol. 45
2025, Vol. 45


