2. 中国科学技术大学附属第一医院放疗科,合肥 230031;
3. 安徽慧软科技有限公司,合肥 230088
2. Department of Radiotherapy, First Affiliated Hospital of USTC, Hefei 230031, China;
3. Anhui Wisdom Technology Co. Ltd, Hefei 230088, China
浅层X射线放射治疗系统已广泛应用于各种良性或恶性皮肤疾病的治疗,相较于加速器X射线放疗系统和电子束治疗,其在便携性、浅层剂量分布以及成本方面均展现出显著优势[1]。该治疗系统通常使用的能量范围为50~150 kV[2],适用于治疗靶区深度在5 mm以下的病变,且通过调节X射线能量和过滤器厚度可以精确控制治疗深度[3]。在放射治疗系统中,使用过滤器的主要目的是降低皮肤剂量,确保正常组织所受剂量处于安全范围内[4]。此外,过滤器的调整能够使皮下剂量分布更加均匀[5]。在目前临床上广泛应用的低能X射线商用放射治疗系统中,通常采用厚度不超过3 mm的铝质薄板过滤器,但文献中少见详细的剂量学数据支持[6-8]。考虑到浅层放射治疗中靶区形状和厚度的多样和特殊性,深入探究和优化过滤器的设计对浅层放射治疗具有重要意义。
蒙特卡罗方法因其对于几何建模的灵活性和高精度的剂量模拟计算能力在剂量学研究中广为使用。本研究采用蒙特卡罗方法参考一种浅层X射线放射治疗系统,进行建模和模拟,从剂量学优化的视角出发,详细探究不同能量和不同厚度过滤器对深度剂量分布的影响;并通过比较使用几种不同设计的铝制过滤器的剂量分布,探讨患者个性化过滤器设计的可行性。
材料与方法1. 设备建模:本研究使用基于通用蒙特卡罗软件Geant 4 (10.07.p03)的用户软件TOPAS(版本3.8.1)进行建模[9]。浅层放疗设备参照现有的商业X射线管配套设备在空间直角坐标系下对焦斑、铍窗、铅屏蔽、施源器和水箱进行了建模(图 1)。X射线管的焦斑直径设为1 mm,开角为70°,距水箱6 cm,其能谱由Spekpy软件生成[10]。焦斑两侧设置了铅屏蔽,下方的75 μm铍窗保证了焦斑处于真空状态。施源器由厚度为5 mm的塑料(PMMA)制成,呈喇叭状,与水箱表面接触的内直径为4 cm。一个由1 mm × 1 mm × 1 mm的体素组成的6 cm × 6 cm × 4 cm(深度方向)大小的水箱模体用于剂量计算。TOPAS中物理模型设置为emstandard_opt4,对所有粒子截至能量独立设置为0.000 5 μm。
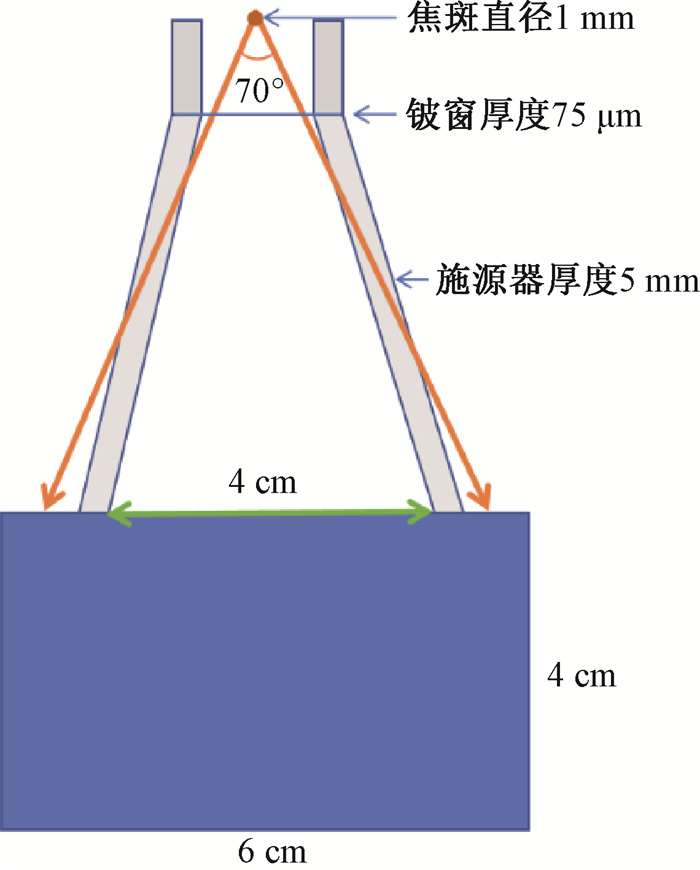
|
图 1 浅层放疗设备X射线管配套设备建模示意图 Figure 1 Schematic diagram of modeling of spherical tube supporting equipment of superficial radiotherapy unit |
2. 不同过滤器参数的模拟分析:为了探究不同能量与过滤器厚度对剂量分布的影响,本研究利用Spekpy软件模拟分别生成了50、70、90、110、130和150 kV 6种能量分别搭配0.5、1.0、1.5、2.0、3.0 mm 5种厚度的常规的圆柱薄片状铝制过滤器下的X射线能谱。利用TOPAS程序在建模的基础上进行模拟,并采用TOPAS的“EnergyDeposit”计数卡进行能量沉积计数,输出“Sum”值。由于水箱密度分布均匀,可以直接计算百分剂量深度比(PDD),计算公式如下:
| $ \operatorname{PDD}[i]=\frac{\operatorname{Sum}[i]}{\text { Sum. } \max } $ | (1) |
式中,PDD[i]为第i个体素下的PDD值;Sum[i]为第i个体素下“EnergyDeposit”的“Sum”输出值,Sum.max为体素下“EnergyDeposit”的“Sum”输出的最大值。
需要注意的是,PDD的计算仅考虑了中心轴上的单元。每个单元的长度为1 mm,在绘制图表时,第一个值取值于第一个单元中心点(0.5 mm处),之后每个值也都取值于相应单元的中心点。PDD曲线与文献中的测量值进行对比,验证其正确性。后续分析剂量分布时,统一使用此相对剂量进行分析。为了直观分析剂量分布,采用线性插值法计算90%、80%、20%和10%的最大剂量对应的深度位置,并绘制剂量三维直方图和中心轴剖面的二维等高剂量图。
浅层X射线放疗中,剂量优化的效果需从靶区内剂量均匀性和正常组织收到的剂量两方面进行考虑。不均匀性优化用靶区范围的最大剂量与最小剂量的差值表示,差值越小,剂量在靶区范围内的均匀性越好。本次研究中,对深度的剂量不均匀性优化和横向剂量的不均匀性优化皆有考虑。深度剂量的不均匀性计算为中心轴深度方向,横向剂量的不均匀性计算为深度剖面中心轴施源器以内的剂量。正常组织接收到的剂量又分为深度方向的正常组织和横向上的正常组织,深度方向上一般为靶区之后的正常组织,横向上的正常组织一般为施源器覆盖部分以外的正常组织。
由于Spekpy软件可以直接生成常规过滤器下不同能量的能谱,在Topas中不需要对过滤器进行额外建模,因此大大提高了蒙特卡罗模拟过程的粒子的利用率,粒子数设置为109时,统计误差结果 < 1%,可以生成可供临床剂量参考的PDD表格数据。模拟在配备AMD EPYC 7763×2 CPU和1 024 GB内存的服务器上进行,利用256个线程进行运算。
3. 个性化过滤器设计:鉴于放射治疗中靶区形状的多样性,常规的圆柱薄片状过滤器可能无法满足所有需求。因此,为了提供更好的过滤器选择方案参考,本研究对图 2所示3种不同形状的铝制过滤器进行模拟及剂量学分析。
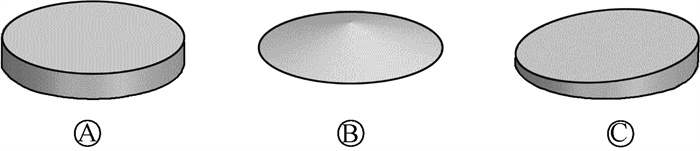
|
图 2 3种过滤器设计图 A. 圆柱形薄片过滤器;B. 圆锥形过滤器;C. 斜柱形过滤器 Figure 2 Three designs of personalized filters A. Cylindrical thin film filter; B. Conical filter; C. Oblique columnar filter |
3种过滤器分别为:3 mm厚圆柱薄片过滤器;圆锥过滤器,边缘厚度为0,中心厚度3 mm;不规则斜柱过滤器,最高厚度为3 mm,最低厚度为1 mm(图 2)。在原有的设备建模上,于铍窗下方分别放置上述3种过滤器,并使用Spekpy生成的80 kV无常规铝制过滤器X射线能谱作为源。剂量分析使用相对剂量,分别计算不同过滤器对应PDD以及90%、80%、20%和10%最大剂量深度位置,绘制中心剖面上的二维百分等高剂量图。横向剂量分析为1.5和5.5 mm深度的剖面中心轴横向剂量曲线。
圆柱形铝制薄片过滤器的建模与Spekpy中对过滤器描述一致。对比圆柱形铝制薄片过滤器的蒙特卡罗建模剂量与使用Spekpy经相同过滤器进行建模的剂量结果以验证过滤器建模的正确性。进一步基于圆柱形铝制薄片过滤器与其他个性化设计过滤器的剂量结果进行对比分析,以评估基于个性化过滤器的剂量优化方案的应用潜力。
蒙特卡罗模拟中,额外的过滤器建模会导致粒子的利用率降低,考虑到对比剂量分布模拟结果准确性的接受度和模拟时间,粒子数设置为1010,此时统计误差结果 < 5%。模拟在配备AMD EPYC 7763×2 CPU和1 024 GB内存的服务器上进行,利用256个线程进行运算。
结果1.不同能量下过滤器厚度对治疗深度的影响:图 3展示了源的能量为70 kV时,使用不同过滤器时水箱内的PDD分布图。图 4展示了过滤器厚度为2 mm时,使用不同能量源时水箱内的PDD分布图。
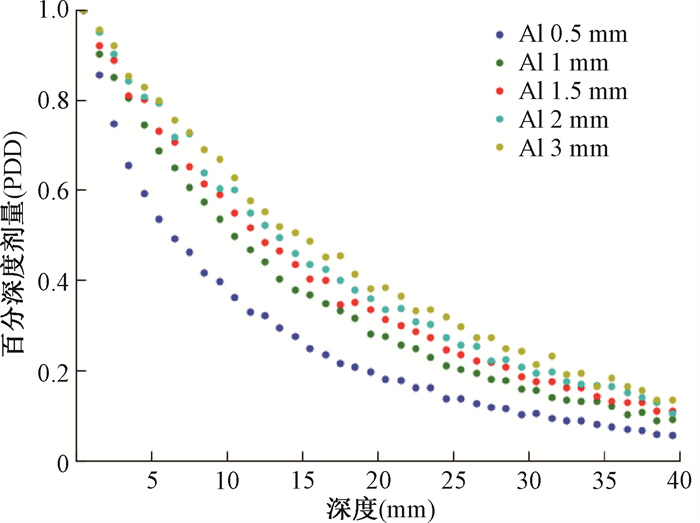
|
图 3 不同厚度的铝制过滤器在能量70 kV时的百分深度剂量分布 Figure 3 Percentage depth dose distribution of aluminum filters at different thicknesses for energy 70 kV |
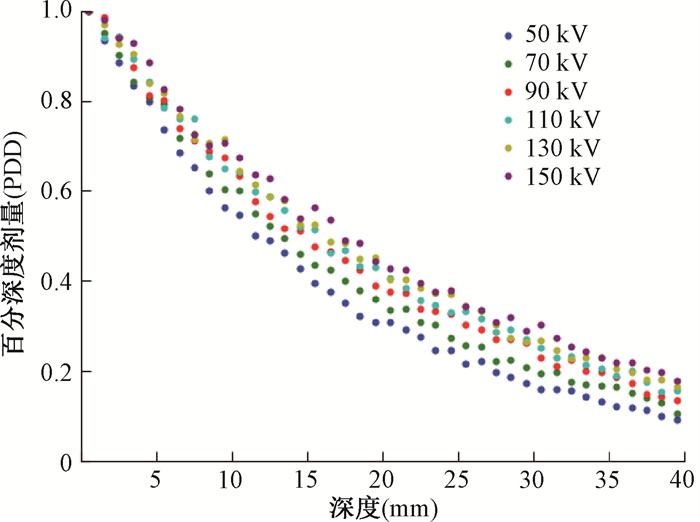
|
图 4 厚度为2 mm的铝制过滤器在不同能量的百分深度剂量分布 Figure 4 Percentage depth dose distribution of a 2 mm thick aluminum filter at different energies |
PDD曲线展示了剂量在深度上的相对分布,也可以在浅层放疗中为靶区剂量的均匀性提供参考。由3图可知,当能量为70 kV,过滤器厚度从0.5~3 mm的范围内逐渐增加时,百分剂量随深度下降梯度变缓,从而有效降低实际治疗中表层皮肤的剂量,对于深度>2 mm的靶区,剂量有一定的优化效果;深度5.5 mm处,剂量的均匀性优化效果最大能达到提高26%。这种影响在过滤器厚度从0.5到2 mm时较为显著,而超过2 mm的厚度变化对其影响相对较小。此外,过滤器厚度的增加在一定程度上会影响治疗时间和靶区后方正常组织接收的剂量。当过滤器的厚度为2 mm时,虽然能量的增加也可以降低表层皮肤的剂量,但同时也会使靶区后方正常组织接收的剂量提高。
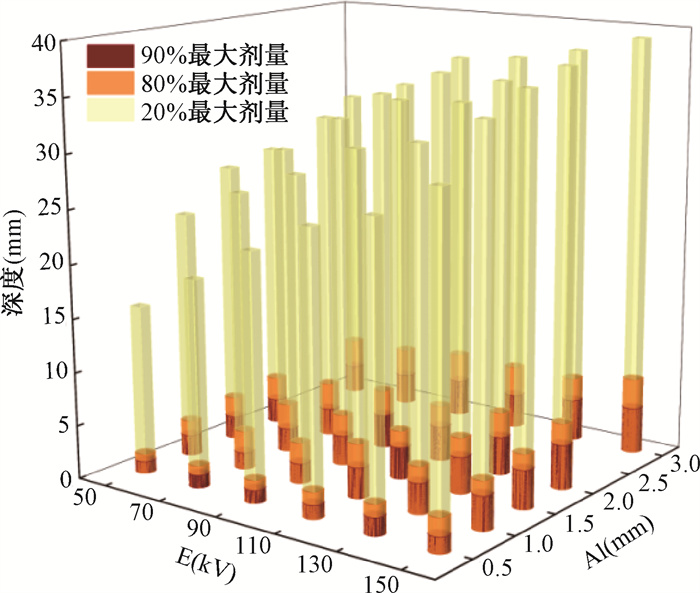
表 1展示了在不同源能量和不同过滤器厚度条件下的PDD数据,用于详细的剂量分布数据参考。图 5则用三维直方图的方式更加直观的展现了百分剂量在深度上的分布情况。
|
|
表 1 不同能量不同过滤器厚度下深度剂量百分比(%) Table 1 Percentage of depth dose at different energies and filter thicknesses(%) |
|
图 5 不同能量和过滤器的百分深度剂量分布的三维直方图 Figure 5 Three-dimensional histograms of percentage depth dose distribution for different energies and filters |
当源的能量为50 kV,铝制过滤器厚度为0.5 mm时,在5.5、10.5、20.5和30.5 mm处模拟得到的百分剂量结果分别为48%、31%、15%和8%,与Sheu等[11]在2015年对其两台Sensus SRT-100 50~100 kV X射线装置上使用50 kV源、0.52 mm铝的半值层厚度和4 cm直径施源器在5、10、20和30 mm处的测量百分剂量结果:47.7%、31.3%、15.8%和9%相符。
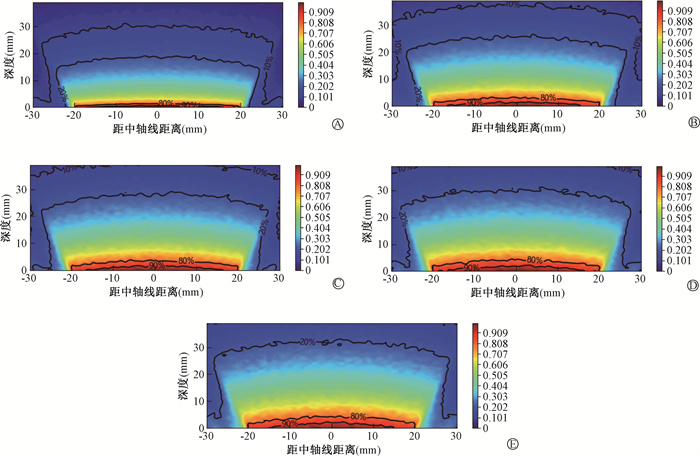
在实际治疗中,散射的影响也不容忽略。过滤器厚度的增加会使高能粒子占比变大,也会产生更大的散射,导致正常组织接收更多的剂量。图 6展示了在70 kV能量下,不同过滤器厚度对应的中心轴剖面二维等高百分剂量分布图。
|
图 6 不同厚度的铝制过滤器在能量70 kV时的二维等高百分剂量图 A. 0.5 mm;B. 1 mm;C. 1.5 mm;D. 2 mm;E. 3 mm Figure 6 Two-dimensional contour map of percentage dose for aluminum filters at different thicknesses at energy 70 kV A. 0.5 mm; B. 1 mm; C. 1.5 mm; D. 2 mm; E. 3 mm |
二维分布图在深度剂量上的规律与前面的数据一致。值得注意的是,在横向剂量分布上,本次模拟的结果在水箱中呈现出中间剂量高、两侧剂量低的分布特征。且随过滤器厚度增加,散射剂量的影响增加。在本次设备建模中,施源器的直径设定为4 cm。对于5种不同厚度的过滤器,模拟结果显示,在1.5 mm深度处对横向剂量均匀性的分析中,最大百分比剂量(中心剂量)与最小百分比剂量(边缘剂量)之间的差值均在12%~14%的范围内。对于某一深度横向分布较为平坦的靶区而言,这种剂量分布无疑会造成治疗中心剂量过高或边缘部分剂量不足的问题,而横向上深度更加复杂的靶区而言,则可能需要配合使用特殊形状的过滤器或分割治疗,这对于临床的治疗方案有更高的要求。
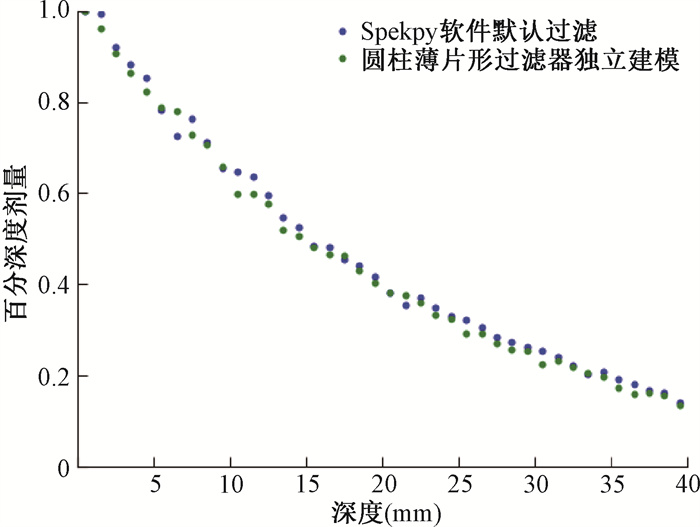
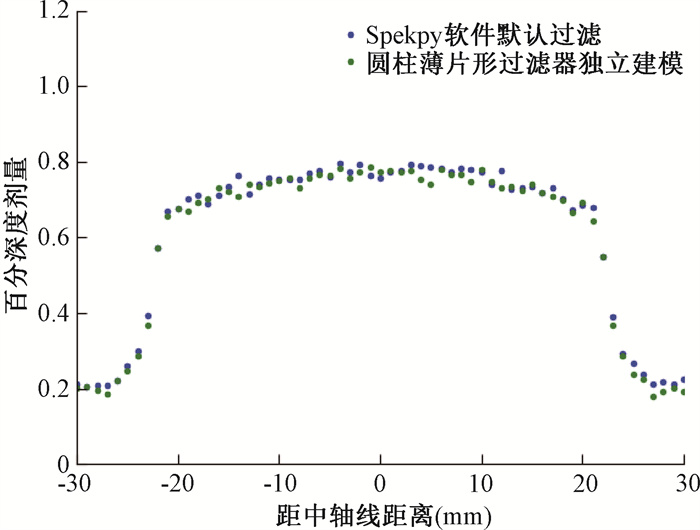
2.个性化过滤器剂量分布结果:图 7,8展示了软件生成的80 kV、3 mm铝制过滤器能谱模拟剂量分布与软件生成80 kV能量无过滤器能谱同时独立建模的3 mm铝制圆柱薄片状过滤器剂量分布的对比。由图可知,独立建模的圆柱薄片状常规过滤器的剂量结果与软件生成的过滤剂量结果是相符的,相对误差的存在可能是由于模拟时的统计误差等引起的。
|
图 7 软件默认过滤器与独立建模过滤器百分深度剂量分布曲线对比 Figure 7 Comparison of percentage depth dose distribution curves between software default filter and independent modeling filter |
|
图 8 软件默认过滤器与独立建模过滤器深度为5.5 mm时百分横向剂量分布曲线对比 Figure 8 Comparison of percentage lateral dose distribution curve between the software default filter and the independently modeled filter at depth of 5.5 mm |
图 9为3种不同设计的过滤器(圆柱形过滤器、圆锥形过滤器、斜柱形过滤器)的二维等高剂量图。

|
图 9 3种设计的过滤器的二维等高百分剂量图 A.圆柱薄片形过滤器;B.圆锥形过滤器;C.斜柱形过滤器 Figure 9 Two-dimensional contour maps of percentage dose for three designs of personalized filter A. Cylindrical thin film filter; B. Conical filter; C. Oblique columnar filter |
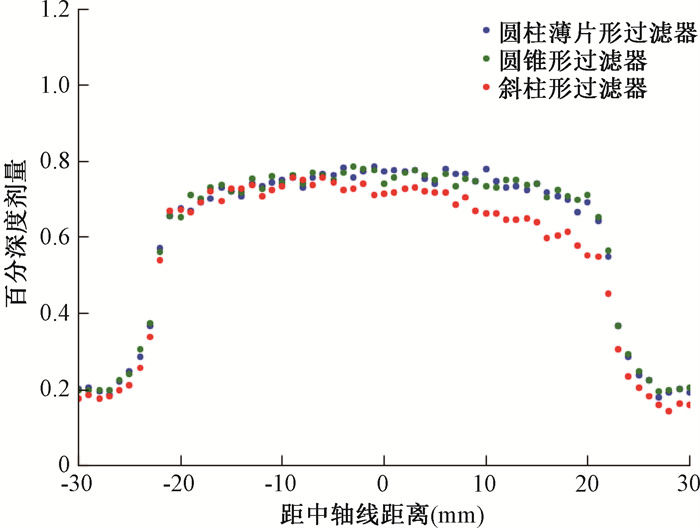
图 10为3种不同过滤器设计下,深度为1.5 mm时的横向百分比剂量分布图。图 11为3种不同过滤器设计下,深度为5.5 mm时的横向百分比剂量分布图。

|
图 10 深度为1.5 mm时的横向百分比剂量分布图 Figure 10 Transverse percentage dose distribution at a depth of 1.5 mm |
|
图 11 深度为5.5 mm时的横向百分比剂量分布图 Figure 11 Transverse percentage dose distribution at a depth of 5.5 mm |
在当前常见的低能X射线商用放疗系统中,常规过滤器设计为圆柱体薄片形状。从剂量分布上可以看出,横向剂量呈现中间高、两侧低的分布特征。而圆锥形过滤器,采用中间厚、两边薄的过滤器形状,可以使剂量分布更加平坦。对于深度分布较均匀的靶区,圆锥形过滤器的过滤器剂量分布显然更为适配。然而,在实际治疗中,靶区的深度分布往往更为复杂。斜柱形过滤器采用一侧厚度为1 mm,另一侧厚度为3 mm的过滤器,其剂量分布呈现出一侧高、一侧低的形状,对于深度分布不均的靶区适形效果更好。
在这3种设计的模拟中,源能量均为80 kV,过滤器的最大厚度均达到了3 mm。在深度1.5 mm处,3种设计的最大百分比剂量都超过了90%,常规的圆柱薄片状过滤器在施源器范围内百分剂量的差值达到了最大18%,而圆锥形设计的过滤器在施源器范围内百分剂量的差值为最大11%,斜柱状过滤器施源器范围内两端的百分剂量差值最大超过20%;而在深度5.5 mm处,最大百分比剂量都接近80%,常规的圆柱薄片状过滤器在施源器范围内百分剂量的差值达到了最大10%,而圆锥形设计的过滤器在施源器范围内百分剂量的差值为最大5%,斜柱状过滤器施源器范围内两端的百分剂量差值最大超过10%。这说明这3种设计下的过滤器可以在保持最大治疗深度的同时起到一定的适形效果,且对于浅层的病变效果更为明显。
讨论基于X射线管的浅层X射线放疗设备凭借其便携性、浅层剂量分布和成本等方面的优势,在美容医疗和皮肤癌治疗领域发挥着重要作用。本研究运用蒙特卡罗剂量计算方法,深入探讨了不同能量下过滤器厚度对治疗时剂量分布的影响,为改善治疗设备的参数提供参考价值。
从PDD的角度分析,增加过滤器的厚度可以在一定程度上增加治疗的深度。因此,在浅层治疗中,如果靶区深度较大,可以考虑在不改变能量的情况下增加过滤器的厚度。然而,需要注意的是,根据PDD和深度的关系,增加过滤器的厚度也会增加靶区后方正常组织接收的剂量比例。因此,如何选择源能量和过滤器厚度的设计成为一个不可忽视的问题。PDD剂量数据表格的建立,从剂量学的角度出发,为浅层X射线放疗系统设备源的能量和过滤器的选择提供了重要参考,对于临床实际治疗具有指导意义。浅层X射线放疗适用于治疗靶区深度在5 mm以下的病变。例如,由PDD表格可知,当深度为5.5 mm时,若为了保证靶区剂量的均匀性,使剂量达到最大剂量的80%左右,可以选择以下几种组合:50 kV能量搭配3 mm厚的铝制过滤器、70 kV能量搭配3 mm厚的铝制过滤器,以及90 kV能量搭配2 mm厚的铝制过滤器等。上述3种组合在30.5 mm处的百分剂量分别为21%、22%和23%。然而,需要注意的是,同样管电流下,过滤器的厚度增加会延长治疗时间。因此,在这3种组合中,90 kV能量搭配2 mm厚的铝制过滤器的组合应优先选择。
在实际治疗中,靶区的形状因人而异,且会随着治疗时间发生变化。在个性化过滤器的设计上,考虑到浅层X射线放疗主要治疗的靶区为5 mm以下的深度,因此剂量在表面的分布变化情况尤为重要,以80%等高百分剂量线为参考,本次研究的3种过滤器可以治疗中心凸起状,平坦状,一侧深一侧浅3种横向深度分布的肿瘤。当然,对于形状更复杂的靶区,也需要考虑靶区分割等治疗方案,但考虑到成本和复杂程度,很多情况下,这种简单的个性化过滤器定制可以解决很多临床问题。本次研究也对这几种可以预料到的可商业化的个性化过滤器进行了模拟,得到的剂量分布结果也可以作为浅层X射线放疗治疗机过滤器定做时的一种选择参考。
本研究从浅层放疗剂量学方面进行了详细模拟计算,但由于时间和条件因素,仍存在一些局限。首先,本研究使用均匀介质水箱模体,并未充分考虑皮肤、皮下组织、骨骼等组织的复杂性和不均匀性。其次,由于浅层放疗的剂量较为集中,且靶区深度一般在5 mm以下,因此本研究以1 mm × 1 mm × 1 mm为计算单位不可避免地会引入一定的误差。然而,降低分辨率以减少计算误差会导致统计误差的增加和模拟时间的延长,有必要考虑基于GPU加速的快速蒙特卡罗三维治疗计划系统[12]。在剂量学上,不仅希望靶区剂量分布集中且平坦,还希望最大限度地保护危及器官。因此,未来的产品技术会包括快速治疗计划系统和个性化患者设备定制。
利益冲突 所有研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 陶莉负责建模,剂量计算和撰写论文;张慧、刘君怡负责对结果分析和提供剂量学参考;吴翊凯、齐妙、高宁负责提供建模思路和建模数据;常艳奎负责指导论文设计和修改;裴曦、陈志、徐榭负责指导研究思路
| [1] |
Goldschmidt H. Ionizing radiation therapy in dermatology: current use in the United States and Canada[J]. Arch Dermatol, 1975, 111(11): 1511-1517. DOI:10.1001/archderm.1975.01630230113021 |
| [2] |
Krema H, Herrmann E, Albert-Green A, et al. Orthovoltage radiotherapy in the management of medial canthal basal cell carcinoma[J]. Br J Ophthalmol, 2013, 97(6): 730-734. DOI:10.1136/bjophthalmol-2012-302991 |
| [3] |
Medvedevas N, Adliene D, Laurikaitiene J, et al. The role of shielding in superficial X-ray therapy[J]. Radiat Prot Dosimetry, 2011, 147(1-2): 291-295. DOI:10.1093/rpd/ncr340 |
| [4] |
Soleymanifard S, Aledavood SA, Noghreiyan AV, et al. In vivo skin dose measurement in breast conformal radiotherapy[J]. Contemp Oncol (Pozn), 2016, 20(2): 137-140. DOI:10.5114/wo.2015.54396 |
| [5] |
Sarvari A. Monte Carlo simulations in skin radiotherapy[C]. Bled: International Conference " Nuclear Energy in Central Europe 2000", 2000.
|
| [6] |
Lee YC, Davis SD, Romaguera W, et al. Implementation of superficial radiation therapy (SRT) using SRT-100 VisionTM for non-melanoma skin cancer in a Radiation Oncology clinic[J]. J Appl Clin Med Phys, 2023, 24(6): e13926. DOI:10.1002/acm2.13926 |
| [7] |
Candela-Juan C, Niatsetski Y, Ouhib Z, et al. Commissioning and periodic tests of the Esteya(Ⓡ) electronic brachytherapy system[J]. J Contemp Brachytherapy, 2015, 7(2): 189-195. DOI:10.5114/jcb.2015.51523 |
| [8] |
Goubert M, Parent L. Dosimetric characterization of INTRABEAMⓇ miniature accelerator flat and surface applicators for dermatologic applications[J]. Phys Med, 2015, 31(3): 224-232. DOI:10.1016/j.ejmp.2015.01.009 |
| [9] |
Perl J, Shin J, Schumann J, et al. TOPAS: an innovative proton Monte Carlo platform for research and clinical applications[J]. Med Phys, 2012, 39(11): 6818-6837. DOI:10.1118/1.4758060 |
| [10] |
Poludniowski G, Omar A, Bujila R, et al. Technical Note: SpekPy v2.0-a software toolkit for modeling x-ray tube spectra[J]. Med Phys, 2021, 48(7): 3630-3637. DOI:10.1002/mp.14945 |
| [11] |
Sheu RD, Powers A, Lo YC. Commissioning a 50-100 kV X-ray unit for skin cancer treatment[J]. J Appl Clin Med Phys, 2015, 16(2): 5182. DOI:10.1120/jacmp.v16i2.5182 |
| [12] |
Peng Z, Fang X, Yan P, et al. A method of rapid quantification of patient-specific organ doses for CT using deep-learning-based multi-organ segmentation and GPU-accelerated Monte Carlo dose computing[J]. Med Phys, 2020, 47(6): 2526-2536. DOI:10.1002/mp.14131 |
 2025, Vol. 45
2025, Vol. 45


