2. 湖南省肿瘤医院 中南大学湘雅医学院附属肿瘤医院妇瘤科,长沙 410013;
3. 南华大学公共卫生学院典型环境污染与健康危害湖南省重点实验室,衡阳 421001;
4. 湖南省肿瘤医院 中南大学湘雅医学院附属肿瘤医院教学办,长沙 410013
2. Department of Gynecologic Oncology, Hunan Cancer Hospital, Affiliated Cancer Hospital of Xiangya School of Medicine, Central South University, Changsha 410013, China;
3. Hunan Province Key Laboratory of Typical Environmental Pollution and Health Hazards, School of Public Health, University of South China, Hengyang 421001, China;
4. Teaching Office, Hunan Cancer Hospital, Affiliated Cancer Hospital of Xiangya School of Medicine, Central South University, Changsha 410013, China
宫颈癌是我国女性最常见的恶性肿瘤之一,每年新发病例超10万例[1-2]。放射治疗可用于宫颈癌治疗的各个时期,近80%患者治疗过程中需接受放疗[3]。根据美国国立综合癌症网络(NCCN)发布的宫颈癌指南,对于中晚期患者,以单药顺铂为基础的同步放化疗已成为ⅡB期及以上的晚期宫颈癌的首选标准治疗方案[4],但射线对盆腔骨髓造血干细胞、骨髓间充质干细胞、骨髓内在的脉管系统与微环境等损伤,以及同期化疗造成的血液学不良反应降低了盆腔外骨髓的代偿反应,从而降低了放化疗耐受性,可能影响治疗进程和疗效[5-8]。据研究报道,盆腔外照射影响的骨骼含有超过一半的身体增殖活性骨髓体积,这对骨髓的造血功能产生重要的影响[9-10]。本研究回顾性分析了接受单药顺铂同步放疗的宫颈癌患者的病例资料,探索基于影像组学和剂量组学的机器学习模型来预测局部晚期不可手术的宫颈癌患者的血液学不良反应,通过及时了解高危患者的不良反应进展情况,帮助临床医生及时进行干预治疗。
资料与方法1. 临床资料:本研究纳入2022年1月至2023年6月在中南大学湘雅医学院附属肿瘤医院接受同步放化疗的局部晚期宫颈癌患者205例。纳入标准:①组织学证实(活检)宫颈癌和临床诊断为局部晚期宫颈癌,且国际妇产科联盟分期为ⅡB~ⅣA期。②首次接受放射治疗并完成了整个治疗过程。③患者在放疗前、治疗期间每周1次、治疗结束后90 d内进行血常规检查。④体力状况评分≤2分。⑤肝脏、肾脏功能正常。排除标准:合并严重血液系统疾病及其他系统疾病。
2. 图像获取及感兴趣区域(region of interest,ROI)定义:患者取仰卧位,使用盆腹部热塑网膜和一体化碳纤固定底座固定体位,双手上举抱肘置于前额,并标记患者信息。要求患者饮水使膀胱充盈,提前1.5~2 h口服稀释的复方泛影葡胺溶液(200~300 ml水中加入10 ml 60%的复方泛影葡胺溶液)使小肠显影。在荷兰Philips大孔径CT模拟定位机进行增强CT扫描,层厚5 mm,范围第10胸椎上缘至坐骨结节下5 cm,图像传至美国Varian Eclipse计划系统中。
靶体积及危及器官均由两位主任医师根据美国放射肿瘤协作组(RTOG)指南在Eclipse治疗计划系统中进行勾画。在本研究中,ROI被定义为包括髂骨、耻骨、坐骨、整个骶骨和尾骨、髋臼及股骨头在内的骨轮廓。所有ROI均由一位资深主任医师额外确认,如果在ROI分割上有分歧,则由3位医师讨论得出一致的ROI。
3. 治疗计划
(1) 外照射治疗:由两位医学物理师制定并审核,患者均采用容积调强放疗技术进行常规分割,并使用Eclipse计划系统中的光子剂量算法(acuros external beam,AXB)进行计算,放疗计划要求至少95%的处方剂量线包绕计划靶区,计划靶体积(PTV)的处方剂量方案为45~50.4 Gy。采取3个全弧和6 MV光子,1次/d,5次/周。治疗方案在Trillogy(美国Varian医疗系统)医用直线加速器上进行。治疗前3 d进行锥形束CT成像,之后1次/周。
(2) 后装治疗:后装治疗在外照射完成15次后开始,采用192Ir高剂量率后装治疗,A点剂量(阴道穹窿垂直向上2 cm,与子宫中轴线旁开2 cm交叉处)为600 cGy/次,30 Gy/5次,每周1~2次。放射治疗期间,每日行阴道冲洗。
(3) 同步化疗:放射治疗期间,采用顺铂每周治疗方案(40 mg/m2,静脉滴注,1次/周,共5次)进行同步化疗。本研究未考虑化疗方案对血液学不良反应(hematologic toxicity, HT)的影响。
4. HT评级:根据RTOG的急性放射损伤评分标准对HT进行分级。记录从放疗开始前1周至放疗结束后3个月的全血细胞计数。放疗前的白细胞计数、中性粒细胞绝对值、血红蛋白、血小板作为基线值。若4项中其中1项出现3级或4级不良反应记为重度HT事件,否则标记为轻度HT事件。发生时间定义为放疗开始至放疗中HT值最差时间之差(以天为单位,总时长90 d)。
5. 特征提取:使用3D Slicer 5.0.2导入每个样本的计划CT图像和剂量文件,以便使用Python 3.7进行放射组学特征的批量提取。影像组学特征定义为基于计划CT图像提取的放射组学特征,剂量组学特征定义为基于放疗计划的剂量分布提取的放射组学特征。在原始图像和小波变换图像中同时计算这些特征,总共提取特征851个,包括形状特征、一阶特征和纹理特征。其中纹理特征包含以下5个类别:灰度共生矩阵特征(gray level cooccurrence matrix,GLCM)、灰度级大小区域矩阵特征(gray level size zone matrix,GLSZM)、灰度游程矩阵特征(gray level run length matrix,GLRLM)、相邻灰度差矩阵特征(neighboring gray tone difference matrix,NGTDM)和灰度依赖矩阵特征(gray level dependence matrix,GLDM)。
6. 数据集划分:将整个数据集进行随机划分,80%的数据(164个)用作训练数据集,剩余的20%作为测试集,其中特征选择和模型训练均在训练集上进行,测试集仅用于模型性能评估。由于数据存在轻度不平衡情况,在数据集划分时使用了分层抽样技术,使得训练集和测试集中各类数据的比例与原始数据保持一致。使用公式(1)对数据进行标准化处理:
| $ x=\frac{(X-\mu)}{\sigma} $ | (1) |
式中,x为标准化后的数值;X为原始数值;μ为每个特征类的平均值;σ为每个特征类的标准差。先在训练集上做标准化处理,再将这种转换应用到测试集上,以防止测试数据信息的泄露。
7. 特征选择:本研究使用随机森林(random forest,RF)进行特征的选择,在训练集上计算每个特征的重要性并按降序排序,经选择后的特征序号默认是从数字0开始计算的。RF是一种特殊的Bagging方法,是多个决策树的组合,每棵树依赖于独立采样的随机向量的值且森林中的所有树具有相同的分布[11]。具体而言,使用RF算法分别对影像组学特征和剂量组学特征进行特征的重要性排序,在前50个特征集中选择不同的特征子集作为输入,分别构建不同的机器学习模型并评估其分类性能以确定最佳特征子集,其中不同特征子集数量的间隔为5。由这两种最佳特征子集组成的综合特征再进行进一步的特征选择过程,以确定综合特征集中的最佳子集。
8. 模型训练与评估:本研究中使用极端梯度提升树算法(extreme gradient boosting,XGBoost)进行数据的训练,XGBoost是一个可扩展的树提升系统,生成每棵决策树使用的整个数据集且在后一棵决策树生成时会考虑前一棵决策树模型的预测结果与真实结果之间的残差,具有较高的精度,能有效地缓解过拟合并支持并行化[12]。分别以影像组学特征、剂量组学特征以及综合特征作为输入,建立影像组学模型、剂量组学模型和混合模型。所有模型均在训练过程中使用网格搜索结合五折交叉验证,以获取具有最高性能参数的模型应用于测试数据集。
采用灵敏度、特异度及受试者工作特征曲线(receiver operating characteristic curve, ROC)下面积(area under the curve, AUC)来对二分类模型的性能进行评估。灵敏度公式为:灵敏度=TP/(TP+FN),特异度公式为:特异度=TN/(FP+TN)。其中,TP、FP、TN、FN分别代表预测为重度HT且实际也为重度HT的样本数、预测为重度HT但实际为轻度HT的样本数、预测为轻度HT且实际为轻度HT的样本数、预测为轻度HT但实际为重度HT的样本数。所有建模和分析过程均在Python 3.7上完成。
结果1. 一般资料统计结果:根据纳入和排除标准,本研究共纳入205例宫颈癌患者数据,8例(3.9%)患者未出现HT,剩余的197例患者出现1级及以上HT,无5级HT。其中轻度HT患者144例(70.24%),重度HT患者61例(29.76%),其他资料详见表 1。
|
|
表 1 所有入组宫颈癌患者的临床资料统计[例(%)] Table 1 Statistics of the clinical data of all enrolled patients with cervical cancer [n(%)] |
2. 特征选择结果:对于影像组学模型,作为输入的最佳特征子集数量为15,包括纹理特征11个、一阶特征1个、形状特征3个;对于剂量组学模型,作为输入的最佳特征子集数量为25,包括纹理特征13个、一阶特征10个、形状特征2个;对于混合模型,经特征选择的最佳子集数量为15,包括纹理特征9个、一阶特征5个、形状特征1个,详见表 2。
|
|
表 2 混合模型特征选择结果 Table 2 Selected features for the hybrid model |
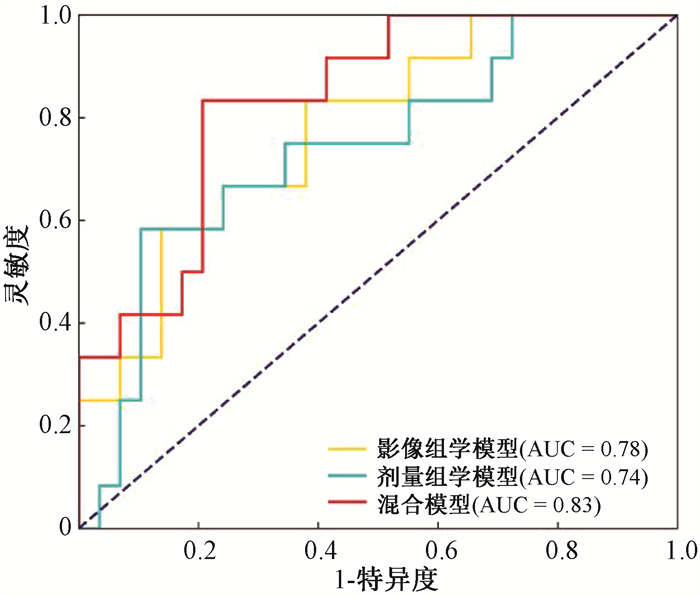
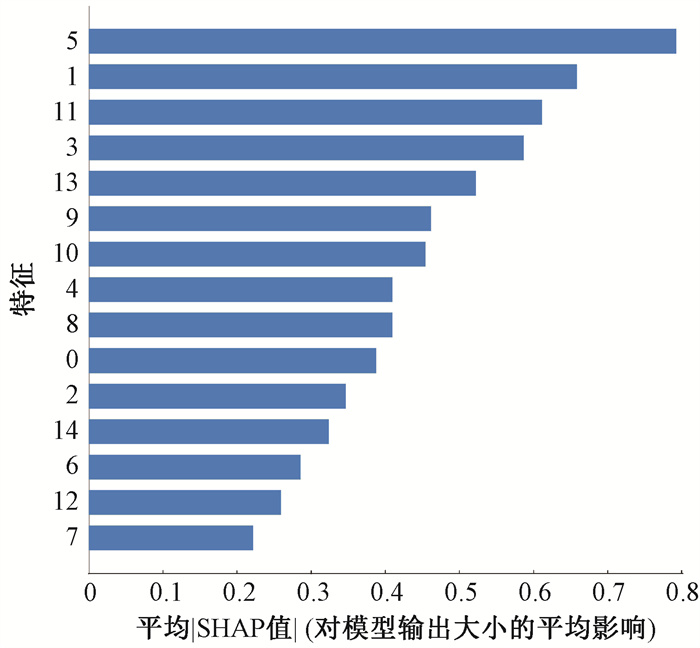
3. 模型性能比较:不同模型在测试集上的分类性能评估结果见图 1。影像组学模型的灵敏度、特异度和AUC值分别为0.42、0.86和0.78;剂量组学模型的灵敏度、特异度和AUC值分别为0.50、0.90和0.74;而混合模型的灵敏度、特异度和AUC值分别为0.50、0.83和0.83,与影像组学和剂量组学模型相比,混合模型表现出更好的分类能力。在测试集上采用SHAP值对特征的重要性进行评估[13],图 2展示了混合模型中输入特征的重要性排序,其中排在第一位和第二位的分别属于一阶特征和纹理特征。
|
图 1 不同模型的受试者工作特征曲线比较 Figure 1 Comparison of ROC curves of different models |
|
图 2 混合模型的特征重要性排序 Figure 2 Importance rankings of features for the hybrid model |
讨论
针对接受放化疗的晚期宫颈癌患者,重度HT可能会导致患者治疗的中断,进而影响整体的治疗效果[14]。基于机器学习的不良反应预测可为患者和临床医生提供重要的信息,Akcay等[15]使用机器学习方法研究了妇科肿瘤患者临床特征与急性HT之间的关系,并表明对急性HT患者进行预测是减少治疗副作用的重要手段。本研究使用影像组学特征和剂量组学特征作为输入,分别建立机器学习分类模型以评估晚期宫颈癌患者的血液学不良反应,并对多组学特征的综合应用进行初步探讨。结果显示,影像组学模型和剂量组学模型的AUC值分别为0.78和0.74,在保持相近的灵敏度和特异度的情况下均要优于Akcay等[15]的研究,表明使用影像组学或剂量组学特征在宫颈癌患者HT的分类预测中具有可行性,并且与使用临床特征相比,模型性能有较大的提高。而对于综合影像组学特征和剂量组学特征的混合模型,AUC值达到0.83,均要优于单独的影像组学模型或剂量组学模型,可见多组学特征的综合在一定程度上可提高分类预测模型的性能。
放射组学特征具有高维度特性,使用特征选择方法能够避免高维度数据灾难问题,减少训练时间,提高模型的可解释性和预测性能[16]。然而,对于影像组学特征和剂量组学特征的降维处理尚没有客观标准的特征选择方法[17]。本研究采用随机森林算法进行特征筛选,并参考了Zhou等[18]在研究中使用的特征综合的做法,即分别在影像组学特征和剂量组学特征中选出最佳子集组成综合特征集,并再进行一次特征选择过程。尽管本工作中使用的特征选择方法取得了一定的效果,但关于多组学特征的综合应用及筛选方法还有待进一步的深入探讨。在影像组学模型、剂量组学模型和混合模型的最佳特征子集中,一阶特征和纹理特征占主要部分,且性能表现最佳的混合模型在测试集上的特征重要性排序中,最重要的特征属于一阶特征,其次为纹理特征。相比于形状特征,一阶特征和纹理特征显得更加重要。此外,在混合模型的输入特征集中,大多数来自小波变换图像,可见小波变换图像比原始图像具有一定的优势,这与Yue等[19]的结果类似,不同的是,他们的研究表明纹理特征比形状特征和一阶特征更加敏感。
本研究收集的接受放化疗的晚期宫颈癌患者数量有限,导致模型训练的数据不够多,特别是重度HT病例,下一步将继续补充样本数量,从而进一步提高预测模型的分类性能。其次,深度学习技术在图像的处理和应用方面具有明显的优势,建立基于深度学习的HT分类模型将在未来的工作予以考虑。此外,本次数据来自于单一放疗机构,未来可依托多中心和大数据平台构建具有更好的稳健性和泛化性的机器学习预测模型,以推进HT分类模型的前瞻性临床验证。如果能够提前发现重度HT患者,就可以及时采取必要的预防措施来降低患者的不良反应发生率。
综上所述,针对接受放化疗的晚期宫颈癌患者,使用基于影像组学特征或剂量组学特征的机器学习方法在HT的分类预测中具有可行性,且与使用临床特征相比模型性能有较大的提高。对于综合影像组学特征和剂量组学特征的混合模型,在一定程度上可提高模型的分类预测性能,有望在临床工作中成为改善患者治疗策略的潜在工具。
利益冲突 无
作者贡献声明 周琼辉负责数据的收集、整理和论文撰写;陈路桥、张利负责数据的整理和分析;倪千喜、朱俊负责分析审阅结果并指导论文的撰写和修改;兰菁、隆曦孜参与论文修改
| [1] |
Zhang S, Xu H, Zhang L, et al. Cervical cancer: Epidemiology, risk factors and screening[J]. Chin J Cancer Res, 2020, 32(6): 720-728. DOI:10.21147/j.issn.10009604.2020.06.05 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
黄曼妮, 安菊生, 杜霄勐. 宫颈癌放射治疗的研究进展[J]. 中华妇幼临床医学杂志(电子版), 2016, 12(1): 7-15. Huang MN, An JS, Du XM. Research progress of radiotherapy for cervical cancer[J]. Chin J Obstet Gynecol Pediatr (Electronic Edition), 2016, 12(1): 7-15. DOI:10.3877/cma.j.issn.16735250.2016.01.002 |
| [4] |
Abu-Rustum NR, Yashar CM, Arend R, et al. NCCN GuidelinesⓇ insights: Cervical cancer, version 1.2024: Featured updates to the NCCN guidelines[J]. J Natl Compr Canc Netw, 2023, 21(12): 1224-1233. DOI:10.6004/jnccn.2023.0062 |
| [5] |
Meng X, Wang N, Yu M, et al. Development of a nomogram for predicting grade 2 or higher acute hematologic toxicity of cervical cancer after the pelvic bone marrow sparing radiotherapy[J]. Front Public Health, 2022, 10: 993443. DOI:10.3389/fpubh.2022.993443 |
| [6] |
Yang X, Li Z, Zhang L, et al. The effect of radiotherapy time and dose on acute hematologic toxicity during concurrent postoperative chemoradiotherapy for early high-risk cervical cancer[J]. J Cancer, 2023, 14(6): 895-902. DOI:10.7150/jca.82801 |
| [7] |
Vordermark D. Radiotherapy of cervical cancer[J]. Oncol Res Treat, 2016, 39(9): 516-520. DOI:10.1159/000448902 |
| [8] |
Güth U, Hadwin RJ, Schötzau A, et al. Clinical outcomes and patterns of severe late toxicity in the era of chemo-radiation for cervical cancer[J]. Arch Gynecol Obstet, 2012, 285(6): 1703-1711. DOI:10.1007/s0040401121932 |
| [9] |
Vande Berg BC, Malghem J, Lecouvet FE, et al. Magnetic resonance imaging of the normal bone marrow[J]. Skeletal Radiol, 1998, 27(9): 471-483. DOI:10.1007/s002560050423 |
| [10] |
Zhou P, Zhang Y, Luo S, et al. Pelvic bone marrow sparing radiotherapy for cervical cancer: A systematic review and meta-analysis[J]. Radiother Oncol, 2021, 165: 103-118. DOI:10.1016/j.radonc.2021.10.015 |
| [11] |
Breiman L. Random forests[J]. Mach Learn, 2001, 45(1): 5-32. DOI:10.1023/A:1010933404324 |
| [12] |
Chen T, Guestrin C. XGBoost: A scalable tree boosting system. Proceedings of the 22nd ACM SIGKDD International Conference on Knowledge Discovery and Data Mining[C]. San Francisco: KDD, 2016: 785-794. DOI: 10.1145/2939672.2939785.
|
| [13] |
Lundberg SM, Lee SI. A unified approach to interpreting model predictions. Proceedings of the 31st International Conference on Neural Information Processing Systems[C]. New York: Curran Associates Inc., 2017: 4768‐4777. DOI: 10.5555/3295222.3295230.
|
| [14] |
杨利, 王骞, 陈仙, 等. 宫颈癌同步放化疗期间骨髓抑制的特点及影响因素分析[J]. 现代肿瘤医学, 2019, 27(23): 4259-4263. Yang L, Wang Q, Chen X, et al. The characteristics and influencing factors of bone marrow suppression during concurrent chemoradiotherapy for patients with cervical carcinoma[J]. J Modern Oncol, 2019, 27(23): 4259-4263. DOI:10.3969/j.issn.16724992.2019.23.031 |
| [15] |
Akcay M, Etiz D, Celik O, et al. Evaluation of acute hematological toxicity by machine learning in gynecologic cancers using postoperative radiotherapy[J]. Indian J Cancer, 2022, 59(2): 178-186. DOI:10.4103/ijc.IJC_666_19 |
| [16] |
Chandrashekar G, Sahin F. A survey on feature selection methods[J]. Comput Electr Eng, 2014, 40(1): 16-28. |
| [17] |
闫萌, 张臻, 于佳琦, 等. 基于剂量组学预测肺癌患者放射性肺炎发生的研究[J]. 中华放射肿瘤学杂志, 2022, 31(8): 698-703. Yan M, Zhang Z, Yu JQ, et al. Dosiomics-based prediction of incidence of radiation pneumonitis in lung cancer patients[J]. Chin J Radiat Oncol, 2022, 31(8): 698-703. DOI:10.3760/cma.j.cn1130302021111500466 |
| [18] |
Zhou L, Zheng W, Huang S, et al. Integrated radiomics, dose-volume histogram criteria and clinical features for early prediction of saliva amount reduction after radiotherapy in nasopharyngeal cancer patients[J]. Discov Oncol, 2022, 13(1): 145. DOI:10.1007/s1267202200606x |
| [19] |
Yue H, Geng J, Gong L, et al. Radiation hematologic toxicity prediction for locally advanced rectal cancer using dosimetric and radiomics features[J]. Med Phys, 2023, 50(8): 4993-5001. DOI:10.1002/mp.16308 |
 2025, Vol. 45
2025, Vol. 45


