2. 蚌埠医科大学第一附属医院肿瘤内科,蚌埠 233000;
3. 安徽省呼吸系统肿瘤与感染性疾病重点实验室,蚌埠 233000
2. Department of Medical Oncology, First Affiliated Hospital of Bengbu Medical University, Bengbu 233000, China;
3. Anhui Province Key Laboratory of Respiratory Tumor and Infectious Disease, Bengbu Medical University, Bengbu 233000, China
作为女性发病率最高的癌种[1],乳腺癌每年新发的病例中,3%~10%的患者在确诊时即有远处转移,而30%~40%的早期人群亦可发展为晚期乳腺癌,其5年生存率仅20%。在晚期转移性乳腺癌中,人表皮生长因子受体2(human epidermal receptor growth factor 2,HER2)过表达患者约占20%,其侵袭性强,预后差[2]。进入本世纪,以曲妥珠单抗为代表的抗HER2靶向药物明显提高了晚期HER2过表达乳腺癌的生存率[3],而随着小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)的研发与应用,晚期患者的预后得到了进一步改善[4]。我国自主研发针对泛HER受体的不可逆的TKI吡咯替尼在晚期各线治疗中,也显示出改善生存的优势[5-7]。在系统治疗的基础上,局部治疗能否进一步提高晚期转移性乳腺癌的疗效,是临床关注的焦点之一。大样本真实世界研究显示,放射治疗的加入能够改善晚期乳腺癌总人群的生存预后[8]。在新一代小分子药物吡咯替尼靶向治疗背景下,放射治疗能否进一步提高转移性HER2过表达乳腺癌患者的疗效,有待进一步确认。本研究拟采用Kaplan-Meier法、Log-rank检验及Cox回归分析明确吡咯替尼治疗术后远处转移HER2过表达乳腺癌的预后因素,并探讨在吡咯替尼靶向治疗的背景下,放射治疗的作用及潜在获益的人群。
资料与方法1. 临床资料:回顾性收集2018年1月至2022年7月于蚌埠医科大学第一附属医院可手术乳腺癌术后发生远处转移并接受吡咯替尼治疗的187例HER2过表达乳腺癌患者的临床资料。排除其他肿瘤及其他严重疾病病史的患者。本研究对患者的一般状况、临床病理特征及治疗信息进行分析。其中,既往抗HER2治疗包含辅助治疗阶段、一线、二线及以上以曲妥珠单抗为基础的单靶或双靶治疗。曲妥珠单抗耐药定义为在曲妥珠单抗辅助治疗期间或治疗结束12个月内诊断为复发,或一线曲妥珠单抗治疗后8~12周或3个月内首次影像学评估时疾病进展。寡转移定义为转移器官≤3个,转移病灶≤5个。
2. 吡咯替尼治疗:所有患者均接受基于吡咯替尼联合卡培他滨的方案治疗。初始方案为:吡咯替尼(400 mg口服,1次/d)联合卡培他滨(1 000 mg/m2口服,2次/d,第1~14天,每3周1次),期间药物的剂量根据患者的身体状况和药物耐受性酌情调整。
3. 放射治疗:根据不同患者的转移灶特征,进行个体化放射治疗,具体部位包含肝、肺、骨、脑及远处淋巴结等转移病灶。等效生物剂量效应范围为45~112.5 Gy(α/β=4 Gy)。按照是否接受放疗,分为未放疗组111例,放疗组76例。
4. 统计学处理:用SPSS 25.0软件进行统计学分析,Graphpad prism 9.5软件绘制生存曲线。基线特征组间差异分析应用卡方检验;用Kaplan-Meier法进行生存分析,Log-rank法进行单因素分析比较组间生存率差异,将单因素分析中P < 0.1以及可能具有临床意义的变量纳入多因素Cox回归分析, 从而确定影响患者临床结局的独立预后因素。P < 0.05为差异有统计学意义。本研究临床结局的观察指标是总生存时间(overall survival, OS),OS被定义为服用吡咯替尼起至任何原因死亡时间。
结果1. 患者基线特征:患者的基线特征如表 1所示。中位年龄52岁(26~77岁),187例患者中,161例(86.0%)既往接受过以曲妥珠单抗为基础的抗HER2靶向治疗,118例(75.1%)接受了二线治疗,57.4%的激素受体阳性患者接受了内分泌治疗。全身器官发生转移的频率由高到低依次为远处淋巴结(49.7%)、脑(41.7%)、肺(40.6%)、骨(31.0%)和肝(25.1%),40%(26/65)的寡转移患者接受了放射治疗。放疗组76例患者中,47例(61.8%)采用了常规分割照射,29例(38.2%)接受了大分割照射。
|
|
表 1 187例术后转移性HER2过表达乳腺癌患者基线特征 Table 1 Baseline characteristics of 187 patients with postoperative metastatic HER2-overexpressing breast cancer |
2. 临床结局:患者的中位随访时间为16.9(3.1~37.9)个月,2年OS为75.0%。其中,放疗组的2年OS为83.0%,高于未放疗组的64.9%(χ2=6.17,P = 0.013,图 1)。
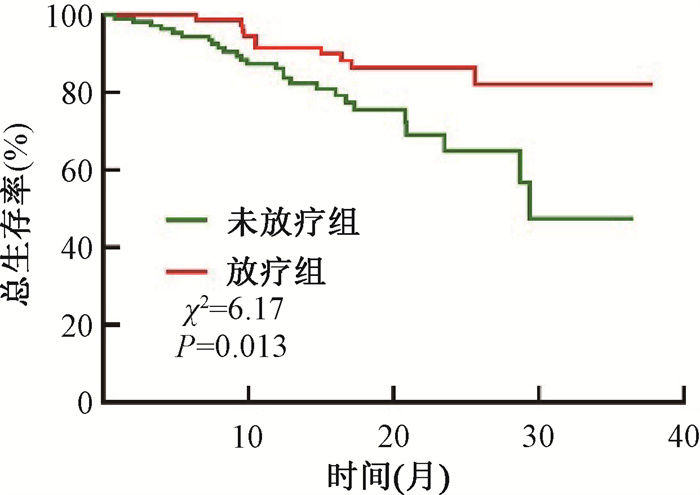
|
图 1 187例术后转移性HER2过表达乳腺癌患者生存结局 Figure 1 Survival outcomes of 187 patients with postoperative metastatic HER2-overexpressing breast cancer |
3. 预后因素分析:对患者的基线资料进行单因素和多因素的分析,结果显示,年龄、绝经状态、是否寡转移以及是否放射治疗是影响患者OS的独立因素(χ2=3.86~6.76,P < 0.05,表 2)。
|
|
表 2 187例术后转移性HER2阳性乳腺癌患者预后分析 Table 2 Prognostic analysis of 187 patients with postoperative metastatic HER2-overexpressing breast cancer |
4. 亚组分析:进一步亚组分析结果显示,在绝经患者(2年OS率:55.0% vs 73.3%,HR=0.385,P=0.020)中,放射治疗的加入改善了其生存结局。对于不同转移状态患者,放射治疗提高了骨转移(2年OS率:62.9% vs. 75.0%,HR=0.374,P=0.045)及寡转移(2年OS率:54.4% vs. 95.0%,HR=0.144,P=0.003)的生存率。此外,一、二线接受吡咯替尼治疗的患者,放射治疗的生存获益更明显(2年OS率:64.5% vs. 87.7%,HR=0.230,P=0.004)。在未接受内分泌治疗(2年OS率:63.1% vs. 84.9%,HR=0.320,P=0.014)及曲妥珠单抗耐药患者(2年OS率:63.0% vs. 85.4%,HR=0.357,P=0.012)中,放射治疗明显改善了其预后。
讨论随着抗HER2治疗的发展,晚期转移性HER2过表达乳腺癌患者的生存预后得到了明显提高,其中,小分子TKI药物显示了良好的疗效。EGF104900研究[9]结果显示,拉帕替尼一线治疗晚期HER2过表达乳腺癌的中位OS为9.5个月,Lin等[10]报道了二线图卡替尼治疗方案的中位OS为18.1个月,Saura等[11]研究提示,奈拉替尼作为三线及以上治疗方案,患者的中位OS为21个月。最新PRETTY研究结果显示,在吡咯替尼治疗的晚期HER2过表达乳腺癌中,一线、二线、三线及以上的1年OS率分别为92%、90.1%和81.4%[12]。而本研究的2年OS率约75.0%,提示真实世界中吡咯替尼能够明显提高晚期转移性HER2过表达乳腺癌的生存率。
放射治疗对晚期转移性患者生存预后的影响是临床关注的焦点之一。一项来自印度的研究[13]显示放射治疗的加入,未能改善转移性乳腺癌患者的OS。但也有研究显示,放射治疗可提高内脏转移和多发转移患者的3年OS [14]。上述研究结果存在争议,可能与人群特点、肿瘤特征以及治疗模式不同有关。本研究结果提示,在以吡咯替尼为基础的抗HER2治疗背景下,放射治疗的加入进一步改善了转移性HER2过表达患者的生存结局。
晚期乳腺癌患者生存率低,预后影响因素错综复杂,不同人群生存结局也存在明显的差异[15]。因此,在靶向治疗背景下,影响转移性HER2过表达乳腺癌生存的预后因素以及个体化治疗,值得探索与分析。有研究显示,初诊低肿瘤负荷、寡转移、非内脏转移和系统治疗后达到肿瘤完全缓解的转移性HER2过表达乳腺癌患者长期预后较好[16]。而对于这部分相对低危的人群,放射治疗可能进一步改善其生存预后[17-18]。本研究也得出相似的结果,在吡咯替尼治疗的术后转移性HER2过表达乳腺癌中,具有低瘤负荷等低危特征的患者可能从放射治疗中获益的程度更大。
脑转移是导致乳腺癌患者总生存率和生活质量下降的重要原因之一。研究证实,约20%的乳腺癌患者死于脑转移[19]。在依据分子分型个体化治疗的背景下,HER2过表达乳腺癌患者生存期不断延长,其发生脑转移的概率和风险不断增加。一项基于脑转移HER2过表达乳腺癌的回顾性分析显示,抗HER2治疗患者3年OS较未治者显著延长[20]。近期研究结果显示,图卡替尼联合曲妥珠单抗及卡培他滨显著降低了脑转移HER2过表达乳腺癌患者疾病进展和死亡风险[10]。此外,多项真实世界数据显示,吡咯替尼同样也改善了脑转移HER2过表达乳腺癌患者的结局[21-22]。在抗HER2治疗的前提下,颅内放射治疗的作用则需要重新被审视和评估。近期研究发现,在吡咯替尼治疗的基础上,颅内放射治疗的加入展现出良好的疗效和安全性[23]。本中心的数据虽然未观察到吡咯替尼联合颅内放射治疗对脑转移HER2过表达患者OS的改善,但两者联合明显提高了其颅内控制率[24]。
本研究存在一定的局限性:由于单中心回顾性资料的限制,在治疗方式特别是在放射治疗的选择上,可能存在一定的临床决策偏倚,此外,本组数据未对局部控制率、无进展生存率、患者生活质量以及放射治疗介入时机、放射治疗方式、不同放疗剂量进行分析,所得出的结论尚需在前瞻性研究、以及多中心真实世界数据中进一步验证。
综上所示,本研究提示在吡咯替尼治疗的基础上,放射治疗可进一步提高术后转移性HER2过表达乳腺癌的生存率;其中,在肿瘤负荷低、系统治疗不足和耐药人群中,放射治疗改善预后的作用可能更明显。
利益冲突 无
作者贡献声明 孙楠负责研究过程的实施、论文撰写及数据分析;孙祥露、刘静负责临床资料收集和随访;杨燕负责部分方案设计;周咏春负责研究总体设计、指导和审阅
| [1] |
Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024[J]. CA Cancer J Clin, 2024, 74(1): 12-49. DOI:10.3322/caac.21820 |
| [2] |
Hosonaga M, Arima Y, Sampetrean O, et al. HER2 heterogeneity is associated with poor survival in HER2-positive breast cancer[J]. Int J Mol Sci, 2018, 19(8): 2158. DOI:10.3390/ijms19082158 |
| [3] |
Slamon DJ, Leyland-Jones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2[J]. N Engl J Med, 2001, 344(11): 783-792. DOI:10.1056/NEJM200103153441101 |
| [4] |
Diéras V, Miles D, Verma S, et al. Trastuzumab emtansine versus capecitabine plus lapatinib in patients with previously treated HER2-positive advanced breast cancer (EMILIA): a descriptive analysis of final overall survival results from a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2017, 18(6): 732-742. DOI:10.1016/S1470-2045(17)30312-1 |
| [5] |
Yan M, Bian L, Hu X, et al. Pyrotinib plus capecitabine for human epidermal growth factor receptor 2-positive metastatic breast cancer after trastuzumab and taxanes (PHENIX): A randomized, double-blind, placebo-controlled phase 3 study[J]. Transl Breast Cancer Res, 2020, 1: 1-13. DOI:10.21037/tbcr-20-25 |
| [6] |
Xu B, Yan M, Ma F, et al. Pyrotinib plus capecitabine versus lapatinib plus capecitabine for the treatment of HER2-positive metastatic breast cancer (PHOEBE): a multicentre, open-label, randomised, controlled, phase 3 trial[J]. Lancet Oncol, 2021, 22(3): 351-360. DOI:10.1016/S1470-2045(20)30702-6 |
| [7] |
Ma F, Yan M, Li W, et al. Pyrotinib versus placebo in combination with trastuzumab and docetaxel as first line treatment in patients with HER2 positive metastatic breast cancer (PHILA): randomised, double blind, multicentre, phase 3 trial[J]. BMJ, 2023, 383: e076065. DOI:10.1136/bmj-2023-076065 |
| [8] |
Kim KN, Qureshi MM, Huang D, et al. The impact of locoregional treatment on survival in patients with metastatic breast cancer: A national cancer database analysis[J]. Clin Breast Cancer, 2020, 20(2): e200-e213. DOI:10.1016/j.clbc.2019.12.010 |
| [9] |
Blackwell KL, Burstein HJ, Storniolo AM, et al. Overall survival benefit with lapatinib in combination with trastuzumab for patients with human epidermal growth factor receptor 2-positive metastatic breast cancer: final results from the EGF104900 Study[J]. J Clin Oncol, 2012, 30(21): 2585-2592. DOI:10.1200/JCO.2011.35.6725 |
| [10] |
Lin NU, Borges V, Anders C, et al. Intracranial efficacy and survival with tucatinib plus trastuzumab and capecitabine for previously treated HER2-positive breast cancer with brain metastases in the HER2CLIMB trial[J]. J Clin Oncol, 2020, 38(23): 2610-2619. DOI:10.1200/JCO.20.00775 |
| [11] |
Saura C, Oliveira M, Feng YH, et al. Neratinib plus capecitabine versus lapatinib plus capecitabine in HER2-positive metastatic breast cancer previously treated with ≥ 2 HER2-directed regimens: Phase Ⅲ NALA trial[J]. J Clin Oncol, 2020, 38(27): 3138-3149. DOI:10.1200/JCO.20.00147 |
| [12] |
Li Y, Tong Z, Wu X, et al. Real-world treatment patterns and outcomes of pyrotinib-based therapy in patients with HER2-positive advanced breast cancer (PRETTY): A nationwide, prospective, observational study[J]. Int J Cancer, 2023, 153(10): 1809-1818. DOI:10.1002/ijc.34676 |
| [13] |
Badwe R, Hawaldar R, Nair N, et al. Locoregional treatment versus no treatment of the primary tumour in metastatic breast cancer: an open-label randomised controlled trial[J]. Lancet Oncol, 2015, 16(13): 1380-1388. DOI:10.1016/S1470-2045(15)00135-7 |
| [14] |
Andre F, Slimane K, Bachelot T, et al. Breast cancer with synchronous metastases: trends in survival during a 14-year period[J]. J Clin Oncol, 2004, 22(16): 3302-3308. DOI:10.1200/JCO.2004.08.095 |
| [15] |
Plichta JK, Thomas SM, Hayes DF, et al. Novel prognostic staging system for patients with de novo metastatic breast cancer[J]. J Clin Oncol, 2023, 41(14): 2546-2560. DOI:10.1200/JCO.22.02222 |
| [16] |
Tarantino P, Curigliano G, Parsons HA, et al. Aiming at a tailored cure for ERBB2-positive metastatic breast cancer: A review[J]. JAMA Oncol, 2022, 8(4): 629-635. DOI:10.1001/jamaoncol.2021.6597 |
| [17] |
Le Scodan R, Stevens D, Brain E, et al. Breast cancer with synchronous metastases: survival impact of exclusive locoregional radiotherapy[J]. J Clin Oncol, 2009, 27(9): 1375-1381. DOI:10.1200/JCO.2008.19.5396 |
| [18] |
Neuman HB, Morrogh M, Gonen M, et al. Stage Ⅳ breast cancer in the era of targeted therapy: does surgery of the primary tumor matter?[J]. Cancer, 2010, 116(5): 1226-1233. DOI:10.1002/cncr.24873 |
| [19] |
Zahid KF, Kumar S, Al-Bimani K, et al. Outcome of Omani women with breast cancer-associated brain metastases experience from a university hospital[J]. Oman Med J, 2019, 34(5): 412-419. DOI:10.5001/omj.2019.76 |
| [20] |
Pessina F, Navarria P, Cozzi L, et al. Outcome evaluation of HER2 breast cancer patients with limited brain metastasis[J]. Anticancer Res, 2017, 37(12): 7057-7062. DOI:10.21873/anticanres.12177 |
| [21] |
Anwar M, Chen Q, Ouyang D, et al. Pyrotinib treatment in patients with HER2-positive metastatic breast cancer and brain metastasis: Exploratory final analysis of real-world, multicenter data[J]. Clin Cancer Res, 2021, 27(16): 4634-4641. DOI:10.1158/1078-0432.CCR-21-0474 |
| [22] |
Li C, Bian X, Liu Z, et al. Effectiveness and safety of pyrotinib-based therapy in patients with HER2-positive metastatic breast cancer: A real-world retrospective study[J]. Cancer Med, 2021, 10(23): 8352-8364. DOI:10.1002/cam4.4335 |
| [23] |
Yang Z, Meng J, Mei X, et al. Brain radiotherapy with pyrotinib and capecitabine in patients with ERBB2-positive advanced breast cancer and brain metastases: A nonrandomized phase 2 trial[J]. JAMA Oncol, 2024, 10(3): 335-341. DOI:10.1001/jamaoncol.2023.5791 |
| [24] |
Huang J, Zhu W, Duan Q, et al. Efficacy and safety of radiotherapy combined with pyrotinib in the treatment of HER2-positive breast cancer with brain metastases[J]. Breast Cancer (Dove Med Press), 2023, 15: 841-853. DOI:10.2147/BCTT.S440427 |
 2025, Vol. 45
2025, Vol. 45


