DNA双链断裂(DSB)是细胞受到电离辐射后最严重的损伤,为了维持DNA分子结构的完整和稳定,真核生物进化了两种主要的DSB修复机制,分别是非同源末端连接(non-homologous end-joining, NHEJ)和同源重组(homologous recombination, HR)修复[1-2]。长链非编码RNA(long non-coding RNA, lncRNA)已被证明能够与DNA、RNA或蛋白质相互作用,在DNA损伤应答中发挥关键的调控作用[3-4],如长链非编码RNA(DNA damage-sensitive RNA1,DDSR1)通过特异性结合BRCA1和hnRNPUL1,调控DSB损伤位点对BRCA1和RAP80蛋白的招募,进而影响HR修复[5]。然而大部分lncRNA在辐射损伤修复中的作用及机制尚不明确。宫颈癌是最常见的女性恶性肿瘤之一,在全球女性癌症致死率中排第4位[6]。课题组前期基于CRISPR/Cas9系统建立了针对HR和NHEJ修复的检测体系,利用该模型高通量筛选发现下调lncRNA ANK3DT可以显著抑制HR修复。目前,关于lncRNA ANK3DT对放射敏感性的功能机制研究少见报道,本研究通过下调lncRNA ANK3DT表达后,分析其对X射线照射后人宫颈癌HeLa细胞存活能力、凋亡水平和G2/M期阻滞的影响,探索lncRNA ANK3DT对HeLa细胞放射敏感性的影响及其作用机制。
材料与方法1. 材料:HEK293T-spCas9细胞(上海和元生物技术公司)、人宫颈癌HeLa细胞(中国科学院上海生命科学研究院细胞资源中心)。DMEM和胎牛血清(美国GIBCO公司);基因组DNA提取试剂盒(日本TaKaRa公司);细胞质和细胞核RNA提取试剂盒(加拿大Norgen Biotek公司);Lipofectamine 2000转染试剂、总RNA提取试剂TRIzol(美国Invitrogen公司);RNA反转录试剂盒(长沙艾科瑞生物公司);青、链霉素混合液、细胞凋亡与周期检测试剂盒、电化学发光(ECL)试剂盒、抗体稀释液、牛血清白蛋白(BSA)、Alexa Fluor 555标记驴抗小鼠IgG(H+L)(上海碧云天生物公司);γ-H2AX、CtIP、β-肌动蛋白抗体(美国Cell Signaling公司);NU7441、放线菌素D(CHD,美国Sellcek公司)。siRNA干粉购自广州锐博生物公司,根据lncRNA序列设计合成3条靶向ANK3DT的siRNA,siRNA序列见表 1。
|
|
表 1 siRNA序列信息 Table 1 siRNA sequence information |
2. 细胞培养与处理:人宫颈癌HeLa细胞使用DMEM培养基培养,其中含有10%胎牛血清、青霉素(100 U/ml)、链霉素(100 U/ml)。实验分siNC转染组、siANK3DT转染组,将合适密度的细胞接种于6孔板,每孔加入2 ml完全培养基,继续培养24 h后密度达到60%~70%,用Lipofectamine 2000按照说明书转染siRNA,继续培养后根据不同功能实验进行不同处理。X射线照射:采用美国Faxitron辐照仪照射,剂量率为1 Gy/min,源靶距为20 cm,照射剂量为0、2、4、6、8 Gy。
3. HR和NHEJ活性的定量测定:实验分siNC转染组、siANK3DT转染组、siRad51转染组、siLigaseIV转染组和NU7441(1 μmol/ml)处理组,使用Lipofectamine 2000 Reagent将siRNA转染入HEK293T-spCas9细胞48 h后,再转染靶向AAVS1和dsDNA(HR)或dsODN(NHEJ)的sgRNA。诱导位点特异性DSB后,外源引入的含有独特标记序列的dsDNA或dsODN通过HR或NHEJ途径嵌入DSB位点。然后,使用标记序列的特异引物(M:GAGTTGTCATATGTTAATAACGGTAT)和DSB位点外侧的引物(F:ACCTTATATTCCCAGGGCCG,R:ATGGGGTGTGTCACCAGAT)进行PCR分析,通过检测基因组DNA中整合标记序列的相对数量,定量测定HR/NHEJ修复的活性。
4. 实时定量PCR(RT-qPCR)检测X射线照射后lncRNA ANK3DT的表达:HeLa细胞给予4 Gy X射线照射,继续培养后按照说明书提取总RNA并反转录成cDNA,然后进行qPCR扩增反应,条件为95℃ 10 min;95℃ 10 s,60℃ 20 s,40个循环。qPCR引物序列见表 1,β-肌动蛋白作为内参照基因,采用2-ΔΔCt方法计算相对基因表达。
|
|
表 2 qPCR引物序列 Table 2 Sequences of qPCR primers |
5. 细胞质和细胞核RNA提取:HeLa细胞给予4 Gy X射线照射后2 h按照说明书提取细胞质和细胞核RNA,将细胞于200 μl细胞裂解液在冰上孵育5 min,然后将裂解液在14 000 × g、4℃下离心10 min。细胞质RNA在上清液中,而胞核RNA在沉淀中。通过RT-qPCR分析细胞核和细胞质部分的RNA水平。
6. 克隆形成实验:细胞分别转染siNC、siANK3DT继续培养24 h后,使用0.25%胰酶消化,完全培养基终止消化后,以1 000 r/min,离心半径10 cm,离心5 min重悬后进行计数,按照辐射剂量在6孔板中种入细胞(0 Gy/500个、2 Gy/1 000个、4 Gy/2 000个、6 Gy/4 000个、8 Gy/8 000个),每个处理组设置3个平行样。培养24 h后给予X射线照射,继续培养14 d后用4%多聚甲醛在室温下固定30 min,磷酸盐缓冲液(PBS)洗3次;用结晶紫染色液染色20 min,PBS洗3次;记录细胞数量>50的集落数量。
7. 细胞凋亡实验:细胞分别转染siNC、siANK3DT继续培养24 h后给予4 Gy X射线照射,照射后48 h收集细胞,用195 μl Annexin V-FITC结合液重悬细胞,避光下与5 μl Annexin V-FITC和10 μl碘化丙啶(PI)溶液室温孵育15 min,使用流式细胞术分析样品。
8. 细胞周期实验:细胞分别转染siNC、siANK3DT继续培养24 h后给予4 Gy X射线照射,照射后24 h收集细胞,将细胞在4℃下用70%乙醇固定过夜,预冷的PBS洗涤后使用含有RNase的PI染色溶液在37℃条件下避光孵育30 min,使用流式细胞术分析样品。
9. 免疫荧光实验:细胞分别转染siNC、siANK3DT继续培养24 h后给予4 Gy X射线照射,在照射后0、1、6、24 h用含有0.2%Triton X-100的4%多聚甲醛固定20 min,然后在室温下用牛血清白蛋白封闭60 min。随后加入1∶500稀释的γ-H2AX抗体在4℃下过夜。洗涤后,与Alexa Fluor 555山羊抗小鼠二抗(1∶500)室温孵育1 h。最后,使用封片剂(含DAPI)封片,并且用FV3000共聚焦显微镜获取细胞图像。
10. Western blot实验:使用含有蛋白酶抑制剂的裂解缓冲液对样品进行裂解,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量的总蛋白,然后将其转移到聚偏二氟乙烯(PVDF)膜上,用含8%脱脂奶粉的Tris缓冲盐溶液(TBST)封闭1 h,使用CtIP抗体与β-肌动蛋白抗体(稀释比例为1∶1 000)4℃孵育过夜。再用TBST洗膜4次,每次8 min,二抗(1∶1 000)室温孵育1 h,同样方法洗膜4次,进行发光反应显影。
11. RNA稳定性检测:细胞分别转染siNC、siANK3DT继续培养24 h后,使用5 μg/ml的CHD处理,分别于0、1、2、4、8 h后收取RNA,进行实时定量PCR检测CtIP的表达含量。
12. 双荧光素酶报告质粒实验:将CtIP的野生型启动子克隆到荧光素酶报告质粒pPRO RB Report中。接种细胞后次日使用Lipofectamine 2000将荧光素酶报告质粒和siNC/siANK3DT共转染。转染后48 h充分裂解细胞,以15 000 × g在室温下离心5 min,取出上清使用双荧光素酶报告基因测定系统测量萤火虫和海肾荧光素酶活性。
13. 统计学处理:使用SPSS 26.0软件进行统计学处理,计量资料符合正态分布,以x ±s表示。两组间比较使用独立样本t检验,P < 0.05为差异有统计学意义。
结果1. 下调lncRNA ANK3DT表达抑制HR修复效率:为进一步明确lncRNA ANK3DT对HR修复的调控功能,首先验证了siRNA对lncRNA ANK3DT表达水平的抑制效果,结果表明3条siRNA均能有效下调lncRNA ANK3DT的表达,分别为(10.00±1.47)%、(7.86±2.20)%、(4.39±0.10)% (t=6.27、6.39、6.73, P < 0.05)。其中,siANK3DT-3的效果最为显著,故选择其用于后续细胞功能实验。课题组前期基于CRISPR/Cas9系统建立了针对HR和NHEJ修复的检测体系[7],利用该模型进一步研究lncRNA ANK3DT对HR和NHEJ修复的调节作用,结果显示,下调lncRNA ANK3DT能显著地抑制HR修复活性(42.73±0.59)%(t=6.40, P < 0.05)(图 1A),对NHEJ修复无影响(图 1B)。
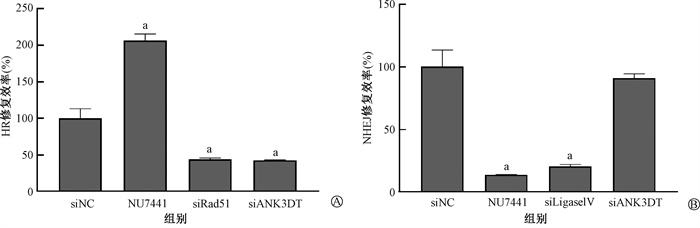
|
注:a与siNC组相比,t=-2.17、6.20、6.40、9.26、8.47, P < 0.05;siNC为阴性对照,图A中NU7441、siRad51为测定HR修复效率的阳性对照,图B中NU7441、siLigaseIV为测定NHEJ修复效率的阳性对照 图 1 下调lncRNA ANK3DT对DSB修复效率的影响 A. HR修复效率;B. NHEJ修复效率 Figure 1 Effect of down-regulation of lncRNA ANK3DT on DSB repair efficiency A. HR repair efficiency; B. NHEJ repair efficiency |
2. 电离辐射诱导HeLa细胞中lncRNA ANK3DT表达上调:利用RT-qPCR检测电离辐射对lncRNA ANK3DT表达的影响,结果显示,与0 Gy相比,4 Gy X射线照射后,lncRNA ANK3DT表达呈上升趋势,照射后24 h升高至(201.07±7.51)%,48 h达到最高(299.42±3.62)%,而72 h后表达略有降低(246.14±4.66)%(t=-23.39、-88.83、-52.42,P < 0.05)。lncRNA的作用机制与其所在的亚细胞位置密切相关,核质分离RNA实验表明0、4 Gy照射后lncRNA ANK3DT均主要定位于细胞核内(图 2)。
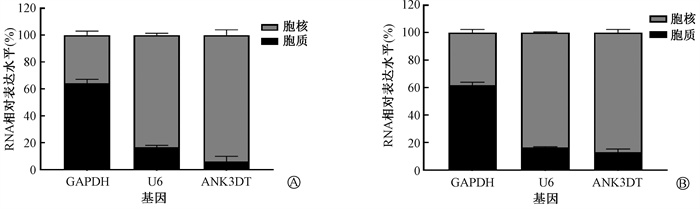
|
图 2 核质分离RNA实验检测不同剂量照射后lncRNA ANK3DT的亚细胞定位 A. 0 Gy; B. 4 Gy Figure 2 Nucleoplasmic isolation RNA assay was used to detect the subcellular localization of lncRNA ANK3DT after different dose X-ray irradiation A. 0 Gy; B. 4 Gy |
3. 下调lncRNA ANK3DT表达增强HeLa细胞放射敏感性:通过克隆形成实验分析下调lncRNA ANK3DT表达对电离辐射后细胞存活能力的影响,结果显示,siANK3DT组细胞经4、6、8 Gy X射线照射后存活分数低于siNC组,差异具有统计学意义(t=3.89、2.87、3.10,P < 0.05),放射增敏比(SER)为1.21。同时,与siNC组相比,下调lncRNA ANK3DT表达显著提高电离辐射诱导的细胞凋亡水平,差异具有统计学意义(t=-14.63, P < 0.05),见图 3。
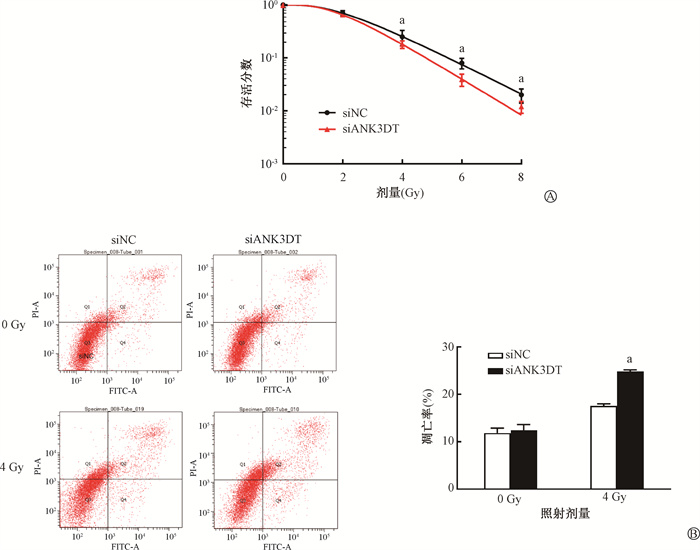
|
注:a与siNC组相比,t=3.89、2.87、3.10、-14.63,P < 0.05 图 3 下调lncRNA ANK3DT表达对HeLa细胞放射敏感性的影响 A.对电离辐射后细胞存活能力的影响;B.对电离辐射后细胞凋亡水平的影响 Figure 3 Effect of down-regulation of lncRNA ANK3DT on radiosensitivity of HeLa cells A. The effect on the cell viability after ionizing radiation; B. The effect on the apoptosis level after ionizing radiation |
4. 下调lncRNA ANK3DT表达对电离辐射后HeLa细胞G2/M期的影响:通过检测lncRNA ANK3DT对电离辐射后HeLa细胞周期的影响,实验结果如图 4所示,在未照射时,siNC组和siANK3DT组的细胞周期分布相似,G2/M期的细胞百分比分别为(29.96± 2.44)%、(20.30±0.89)%,差异无统计学意义(P>0.05);4 Gy X射线照射后24 h,siANK3DT组G2/M期细胞百分比显著高于siNC组,差异具有统计学意义(siNC组:48.05%±0.46%,siANK3DT组:56.11%±0.38%,t=-19.50,P < 0.05)。
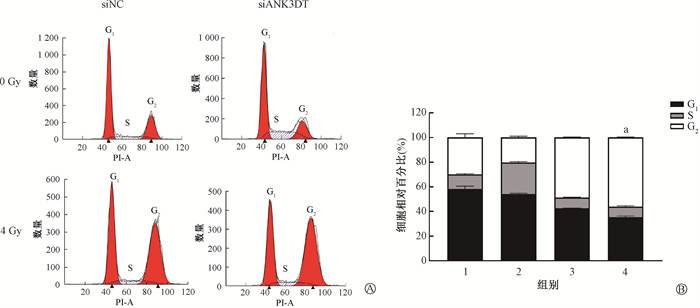
|
注:1. siNC+0 Gy组;2. siANK3DT+0 Gy组;3. siNC+4 Gy组;4. siANK3DT+4 Gy组;a与siNC+4 Gy组相比,t=-19.50,P < 0.05 图 4 下调lncRNA ANK3DT表达对电离辐射后G2/M期阻滞的影响 A.流式分析图;B.统计分析图 Figure 4 Effect of down-regulation of lncRNA ANK3DT on G2/M phase block after ionizing radiation A.Flow charts; B.Statistical analysis chart |
5. 下调lncRNA ANK3DT表达抑制电离辐射后DSB的修复进程:如图 5所示,在未照射时,两组均未检测到γ-H2AX焦点的形成;在4 Gy X射线照射后1 h,两组细胞核中均出现了大量γ-H2AX焦点,数量基本一致,差异无统计学意义(P>0.05);在照射后6 h,siANK3DT组γ-H2AX foci数量显著高于siNC组(34.80%±4.05% vs. 17.60%±1.71%,t=-3.92, P < 0.05),辐射后24 h,焦点数量仍显著高于siNC组(15.8%±5.63% vs. 5.50%±2.59%,t=-5.26, P < 0.05)。
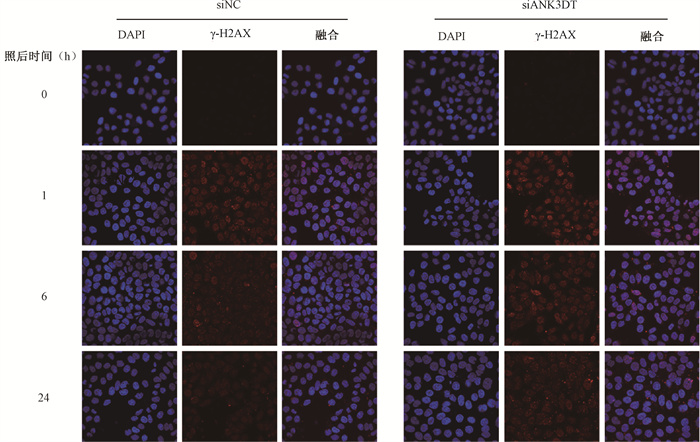
|
图 5 下调lncRNA ANK3DT表达对电离辐射后γ-H2AX foci的影响免疫荧光染色×60 Figure 5 The effect of down-regulation of lncRNA ANK3DT on changes in γ-H2AX foci after ionizing radiation Immunofluorescence staining ×60 |
6. lncRNA ANK3DT通过影响CtIP的转录进而调控CtIP的表达:通过siRNA干扰技术下调lncRNA ANK3DT 24或48 h后,HR修复关键蛋白CtIP在蛋白(图 6A)和mRNA(图 6B)水平上均表达降低(t=7.97、10.49, P > 0.05)。用放线菌素D(CHD)阻断RNA转录,结果显示,下调lncRNA ANK3DT表达对CtIP mRNA的降解速率没有影响(P >0.05)。将CtIP的野生型启动子克隆到荧光素酶报告质粒pPRO RB Report中,通过双荧光素酶报告质粒系统发现下调lncRNA ANK3DT表达能够显著降低CtIP启动子的活性,差异具有统计学意义(siNC组:96.67%±4.54%,siANK3DT组:55.76%±5.15%,t=10.31, P < 0.05)。

|
注:1. siNC组;2. siANK3DT组;a与siNC组相比,t=10.31,P < 0.05 图 6 在照后不同时间lncRNA ANK3DT通过抑制CtIP的转录进而下调CtIP的表达 A. Western blot检测下调lncRNA ANK3DT对CtIP表达水平的影响;B. q-PCR检测下调lncRNA ANK3DT对CtIP表达水平的影响 Figure 6 The lncRNA ANK3DT down-regulates CtIP by repressing CtIP transcription at different time after irradiation A. Western blot assay was used to detect the effect of down-regulation of lncRNA ANK3DT on CtIP expression levels; B. q-PCR assay was used to detect the effect of down-regulation of lncRNA ANK3DT on CtIP expression levels |
讨论
同源重组修复是一种高度保守的无差错途径,主要发生在细胞周期的S期和G2期,需要同源DNA链作为模板进行修复[8]。研究显示,肿瘤细胞的HR修复能力与放射敏感性密切相关。例如,过表达ATM激酶的结直肠癌细胞表现出更强的放射抗性[9];过表达RAD51蛋白可通过促进HR修复,增强哺乳动物细胞对电离辐射的抵抗力[10]。因此,靶向HR修复机制提高肿瘤细胞的放射敏感性的策略为肿瘤治疗提供了新的方向。
随着转录组学的兴起和发展,发现lncRNA能够通过不同的作用机制在转录、转录后及表观遗传学等多个水平调控基因表达[11]。课题组前期成功构建了针对HR和NHEJ修复的筛选体系,发现PI3K/mTOR抑制剂Ompalisib可抑制NHEJ修复并使癌细胞对射线和化疗药物敏感[12]。利用该模型进行高通量筛选,发现下调lncRNA ANK3DT表达可以显著抑制HR修复。本研究进一步明确了lncRNA ANK3DT对电离辐射诱导细胞DSB修复和放射敏感性的调控作用。本研究结果显示,下调lncRNA ANK3DT表达显著降低电离辐射后HeLa细胞存活分数,提高细胞凋亡水平,提示lncRNA ANK3DT与HeLa细胞的放射敏感性密切相关。G2/M期阻滞是细胞应对电离辐射所致DNA损伤的重要反应机制,以确保DNA损伤得到修复,从而维持基因组稳定性[13]。在本研究中,下调lncRNA ANK3DT表达后,电离辐射诱导的G2/M期细胞比例显著上升。同时4 Gy X射线照射后,lncRNA ANK3DT敲低组γ-H2AX foci数目显著高于siNC组。以上结果表明,下调lncRNA ANK3DT通过抑制电离辐射诱导的DSB修复进程,延长G2/M期阻滞,提高细胞凋亡水平,进而增强HeLa细胞的放射敏感性。
目前,已有相关证据表明lncRNA在HR修复中起着重要作用,如lncRNA PCAT-1能够靶向结合HR修复核心分子BRCA2的3 ’ UTR区,促进BRCA2 mRNA降解,导致电离辐射诱导的DSB损伤修复延迟[14]。lnc-RI (lncRNA radiation induced)可作为内源竞争性RNA结合miR-193a-3p,阻止HR修复蛋白RAD51 mRNA的降解,从而维持基因组的稳定[15]。CtIP是HR修复途径的关键分子,通过与MRE11-RAD50-NBS1(MRN)复合物的结合共同启动DNA末端切除[16],且在DNA损伤诱导G2/M细胞周期检查点中起控制作用[17]。有研究发现,抑制辐射诱导的LINC00261和LINC00665上调后,可降低CtIP和XPC基因的表达,且敲除LINC00261和LINC00665可影响DNA双链断裂的修复[18]。与此相似,本研究发现,下调lncRNA ANK3DT表达后,CtIP的mRNA及蛋白表达量均显著降低,且CtIP mRNA的降解速率没有显著变化。核质分离RNA实验表明lncRNA ANK3DT主要定位于细胞核,因此,通过双荧光素酶报告质粒系统检测lncRNA ANK3DT对CtIP启动子活性的影响,结果发现,下调lncRNA ANK3DT表达后,CtIP启动子的活性显著降低,表明lncRNA ANK3DT通过调控CtIP的转录,参与HR修复进程。
综上所述,lncRNA ANK3DT主要定位于细胞核内,且在X射线照射后表达显著升高。下调lncRNA ANK3DT表达显著降低HR修复而不影响NHEJ修复。下调lncRNA ANK3DT表达通过抑制电离辐射后DSB修复进程,进而提高HeLa细胞放射敏感性。在调控机制方面,lncRNA ANK3DT通过在转录水平上调控CtIP的表达,影响HR修复途径。本研究初步探讨了lncRNA ANK3DT对宫颈癌细胞放射敏感性的影响及其调控机制,为宫颈癌的放射增敏研究提供新的思路和分子靶点。
利益冲突 无
作者贡献声明 赵文娜负责实验操作、分析数据、论文撰写;陈子晗、陈富强负责分析数据、参与实验研究;杜杰、周美娟在实验方案设计、结果分析及论文修改过程中予以指导
| [1] |
Ciccia A, Elledge SJ. The DNA damage response: making it safe to play with knives[J]. Mol Cell, 2010, 40(2): 179-204. DOI:10.1016/j.molcel.2010.09.019 |
| [2] |
Chien TM, Yang CW, Yen CH, et al. Excavatolide C/cisplatin combination induces antiproliferation and drives apoptosis and DNA damage in bladder cancer cells[J]. Arch Toxicol, 2024, 98(5): 1543-1560. DOI:10.1007/s00204-024-03699-1 |
| [3] |
Lee JT. Epigenetic regulation by long noncoding RNAs[J]. Science, 2012, 338(6113): 1435-1439. DOI:10.1126/science.1231776 |
| [4] |
Liu L, Chen Y, Huang Y, et al. Long non-coding RNA ANRIL promotes homologous recombination-mediated DNA repair by maintaining ATR protein stability to enhance cancer resistance[J]. Mol Cancer, 2021, 20(1): 94. DOI:10.1186/s12943-021-01382-y |
| [5] |
Sharma V, Khurana S, Kubben N, et al. A BRCA1-interacting lncRNA regulates homologous recombination[J]. EMBO Rep, 2015, 16(11): 1520-1534. DOI:10.15252/embr.201540437 |
| [6] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [7] |
Du J, Yin N, Xie T, et al. Quantitative assessment of HR and NHEJ activities via CRISPR/Cas9-induced oligodeoxynucleotide-mediated DSB repair[J]. DNA Repair (Amst), 2018, 70: 67-71. DOI:10.1016/j.dnarep.2018.09.002 |
| [8] |
Brandsma I, Gent DC. Pathway choice in DNA double strand break repair: observations of a balancing act[J]. Genome Integr, 2012, 3(1): 9. DOI:10.1186/2041-9414-3-9 |
| [9] |
Choi EK, Ji IM, Lee SR, et al. Radiosensitization of tumor cells by modulation of ATM kinase[J]. Int J Radiat Biol, 2006, 82(4): 277-283. DOI:10.1080/09553000600702346 |
| [10] |
Vispé S, Cazaux C, Lesca C, et al. Overexpression of Rad51 protein stimulates homologous recombination and increases resistance of mammalian cells to ionizing radiation[J]. Nucleic Acids Res, 1998, 26(12): 2859-2864. DOI:10.1093/nar/26.12.2859 |
| [11] |
Kopp F, Mendell JT. Functional classification and experimental dissection of long noncoding RNAs[J]. Cell, 2018, 172(3): 393-407. DOI:10.1016/j.cell.2018.01.011 |
| [12] |
Du J, Chen F, Yu J, et al. The PI3K/mTOR inhibitor ompalisib suppresses nonhomologous end joining and sensitizes cancer cells to radio- and chemotherapy[J]. Mol Cancer Res, 2021, 19(11): 1889-1899. DOI:10.1158/1541-7786.MCR-21-0301 |
| [13] |
Lang F, Cornwell JA, Kaur K, et al. Abrogation of the G2/M checkpoint as a chemosensitization approach for alkylating agents[J]. Neuro Oncol, 2024, 26(6): 1083-1096. DOI:10.1093/neuonc/noad252 |
| [14] |
Prensner JR, Chen W, Iyer MK, et al. PCAT-1, a long noncoding RNA, regulates BRCA2 and controls homologous recombination in cancer[J]. Cancer Res, 2014, 74(6): 1651-1660. DOI:10.1158/0008-5472.CAN-13-3159 |
| [15] |
Shen L, Wang Q, Liu R, et al. LncRNA lnc-RI regulates homologous recombination repair of DNA double-strand breaks by stabilizing RAD51 mRNA as a competitive endogenous RNA[J]. Nucleic Acids Res, 2018, 46(2): 717-729. DOI:10.1093/nar/gkx1224 |
| [16] |
Zhang Z, Samsa WE, Gong Z. NUDT16 regulates CtIP PARylation to dictate homologous recombination repair[J]. Nucleic Acids Res, 2024, 52(7): 3761-3777. DOI:10.1093/nar/gkae064 |
| [17] |
Li S, Ting NS, Zheng L, et al. Functional link of BRCA1 and ataxia telangiectasia gene product in DNA damage response[J]. Nature, 2000, 406(6792): 210-215. DOI:10.1038/35018134 |
| [18] |
Eke I, Bylicky MA, Sandfort V, et al. The lncRNAs LINC00261 and LINC00665 are upregulated in long-term prostate cancer adaptation after radiotherapy[J]. Mol Ther Nucleic Acids, 2021, 24: 175-187. DOI:10.1016/j.omtn.2021.02.024 |
 2025, Vol. 45
2025, Vol. 45


