胸部放疗使心脏和脉管系统暴露于电离辐射,可能引发心血管疾病(cardiovascular diseases,CVDs)[1-3]。电离辐射对循环系统的影响主要通过血管内皮细胞发挥作用。研究表明,电离辐射可通过氧化应激和炎症反应等途径损伤内皮细胞,诱导其早衰,进而促进动脉粥样硬化的发生[4-6]。
细胞早衰(cell senescence)是指细胞在生长发育过程中,在非端粒信号刺激端粒脱帽的情况下,形态功能发生变化,提前出现退行性改变[7]。目前,辐射触发的内皮细胞衰老表型主要有细胞形态变大,永久性细胞周期阻滞,衰老相关β-半乳糖苷酶染色增加,溶酶体数目增加,脂褐素积累,衰老相关蛋白表达增加,以及衰老相关分泌表型(SASP)分子表达变化等。研究发现,多种细胞早衰的发生与Caveolin-1(CAV-1)蛋白的表达密切相关[8]。
CAV-1是一种功能广泛的膜脂筏(membrane lipid raft,MLR)支架蛋白,参与多种细胞过程。CAV-1对物质转运、内皮渗透和肿瘤发生起重要的调节作用,并与衰老相关疾病密切相关,通过维持膜脂筏结构与功能、参与p53-p21及p16-Rb等信号通路调控等方面影响细胞的衰老进程[8]。然而,目前尚不明确CAV-1在电离辐射导致血管内皮细胞早衰过程中的具体作用机制。
因此,本研究利用人微血管内皮细胞(HMEC-1)探讨CAV-1在电离辐射诱导血管内皮细胞早衰中的作用,为预防电离辐射导致的心血管疾病提供新的理论依据。
材料与方法1. 主要材料与仪器:人微血管内皮细胞HMEC-1及其专用培养基购自于中国科学院上海细胞库;胰酶购自于美国HyClone公司;CCK-8试剂盒购自于日本同仁化学研究所;细胞衰老β-半乳糖苷酶试剂盒购自于上海碧云天生物技术有限公司;细胞蛋白提取液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒和化学发光底物购自美国ThermoFisher公司;磷酸酶抑制剂和蛋白酶抑制剂购自瑞士Roche公司;5×蛋白上样缓冲液购自北京鼎国生物公司。p53抗体购自武汉proteintech公司;P21抗体购自美国Milipore公司;GAPDH抗体、山羊抗兔抗体和山羊抗鼠抗体均购自北京中衫金桥公司。磷酸盐缓冲液(PBS)、Tris-HCl缓冲盐溶液均为本实验室配制。多功能酶标仪VARIOSKAN LUX购自美国ThermoFisher公司;倒置显微镜CKX53购自日本OLYMPUS公司;Tanon 5200全自动化学发光图像系统购自上海天能科技有限公司。
2. 细胞培养与照射:HMEC-1细胞培养于专用培养基中,培养条件为37℃、CO2体积分数5%。当细胞生长至80%汇合度以上进行传代,按是否感染慢病毒shRNA-CAV-1,分为sh-CAV-1组和对照(NC)组。后续实验均取自对数生长期细胞。使用美国KUBTEC公司XCELL 225型X射线辐照仪对处于对数生长期细胞进行照射。剂量率为11.79 mGy/s,照射剂量分别为0、2、4 Gy。照射后将细胞置于37℃、5%CO2培养箱分别培养24、48及72 h。
3. shRNA细胞转染:将HMEC-1细胞按照5×104/孔的密度接种于6孔板中,将25×感染增强液(HitransG P,上海吉凯基因公司)使用培养基稀释至1×。更换含HitransG P的培养基,每孔1 ml。将NC组细胞感染慢病毒shRNA-NC,sh-CAV-1组感染慢病毒shRNA-CAV-1,混匀。感染24 h后,更换正常培养基,换液后24 h加入2 μg/μl的嘌呤霉素(上海碧云天公司)进行筛选,每2天换液加药,处理1周后,将稳定细胞系传代进行后续实验。
4. 蛋白提取及免疫印迹实验:HMEC-1细胞接受0、2、4 Gy X射线照射后,继续培养24、48、72 h收集细胞。加入细胞蛋白裂解液(含磷酸酶抑制剂和蛋白酶抑制剂),冰浴裂解40 min,在4℃,12 000 r/min,离心半径6.5 cm,离心15 min,取细胞上清。取2 μl细胞上清利用BCA法测定蛋白浓度,同时将剩余细胞上清按体积加入适量5×蛋白上样缓冲液混匀,于100℃金属浴中加热10 min,将蛋白变性。配置10%的聚丙烯酰胺凝胶,各实验组取30 μg蛋白进行电泳,将蛋白转至硝酸纤维素(nitrocellulose,NC)膜后,用5%脱脂奶粉封闭1 h,一抗4℃孵育过夜,二抗室温孵育1 h后,采用增强化学发光法于全自动化学发光图像分系统显影并拍照。
5. β-半乳糖苷酶染色:将HMEC-1细胞按照2×104/孔的密度接种于6孔板中,每组设4个复孔,待细胞贴壁后接受0、2、4 Gy X射线照射,继续培养72 h。弃培基,用PBS清洗。按照β-半乳糖苷酶染色试剂盒说明书,在每孔细胞中加入1 ml固定液,室温下固定15 min。倒掉固定液,用PBS清洗3次。在每孔中加入1 ml染色工作液,用保鲜膜包好置于无CO2的37℃培养箱,孵育过夜。24 h后在显微镜下观察染色情况并拍照。
6. 细胞活力检测:将HMEC-1细胞制成100 μl细胞悬液,按照1×105/孔的密度接种于6孔板中,每组设5个复孔,待细胞贴壁后接受0、2、4 Gy X射线照射。分别在照射后0、24、48、72 h,在每孔细胞中加入10 μl的CCK-8溶液,继续培养4 h,用酶标仪在450 nm波长下测量吸光度(A)值。
7. 血管生成实验:HMEC-1细胞接受0、2、4 Gy X射线照射后,继续培养24 h。在事先预冷的24孔板中,每孔加入100 μl基质胶,将铺有基质胶的24孔板放入细胞培养箱1 h。将细胞制成细胞悬液,细胞浓度为1×105/ml,在已凝固的基质胶中每孔加入100 μl细胞悬液,混匀,继续培养24 h,在显微镜下观察染色情况,并拍照。
8. 统计学处理:采用SPSS 25.0软件进行统计分析,用Graphpad Prism 8.0软件作图。对数据进行描述性分析,符合正态分布,方差齐,采用x ± s表示,组间比较采用两独立样本t检验。P<0.05为差异具有统计学意义。
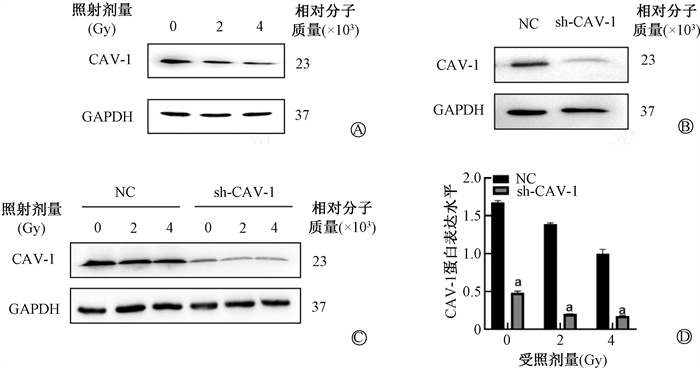
结果1. 电离辐射对CAV-1蛋白表达的影响:0、2、4 Gy X射线照射后48 h,Western blot结果如图 1所示,CAV-1蛋白表达水平分别为1.17±0.14、0.85±0.08、0.69±0.16,与0 Gy相比,随着照射剂量增加,2、4 Gy照射时,CAV-1蛋白表达水平显著降低(t=3.50、3.89,P < 0.05),提示电离辐射抑制CAV-1表达。在HMEC-1细胞中敲低CAV-1,sh-CAV-1组和NC组CAV-1相对表达分别为(19.00±1.00)% 和(68.67±1.15)%,效率>50%(t=56.32,P < 0.05),可用于后续实验。0、2、4 Gy照射后,敲低CAV-1的血管内皮细胞中CAV-1蛋白的表达情况与NC组相比显著降低(t=30.53、64.99、13.33,P < 0.05),提示电离辐射使得CAV-1蛋白表达进一步降低。
|
注:a与NC组相比,t=30.53、64.99、13.33,P < 0.05 图 1 Western blot检测不同剂量X射线照射后CAV-1蛋白的表达A.电离辐射后CAV-1蛋白表达;B.慢病毒转染后CAV-1蛋白表达;C~D.电离辐射后NC组与sh-CAV-1组CAV-1蛋白表达及分析 Figure 1 Detection of CAV-1 protein expression of the different doses of X-ray irradiation by Western blot A. The expression of CAV-1 protein after irradiation; B. The expression of CAV-1 protein after lentiviral transfection; C-D. The expressions of CAV-1 protein in the NC group and shCAV-1 group after irradiation |
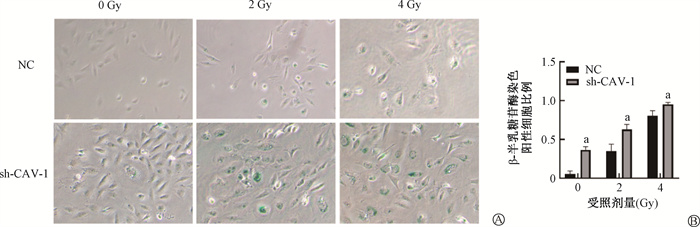
2. 敲低CAV-1对血管内皮细胞早衰的影响:敲低CAV-1的细胞进行0、2、4 Gy X射线照射后72 h,NC组细胞染成蓝色的阳性细胞较少,且颜色较浅。分别与NC组相比,sh-CAV-1组细胞β-半乳糖苷酶染色阳性比例显著增加(t=12.91、11.54、6.04,P < 0.05,图 2),说明细胞发生早衰比例显著增加。提示抑制CAV-1表达会促进血管内皮细胞早衰发生。
|
注:a与NC组相比,t=12.91、11.54、6.04,P < 0.05 图 2 不同剂量X射线照射sh-CAV-1 HMEC-1细胞后72 h镜下观察β-半乳糖苷酶染色×100(A)及定量分析(B) Figure 2 β-galactosidase staining (×100) of sh-CAV-1 HMEC-1 cells at 72 h after different doses of X-ray irradiation (A) and quantitative analysis (B) |
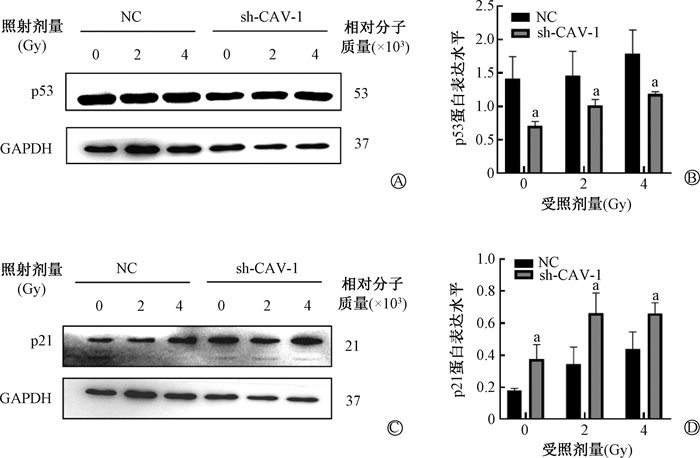
3. CAV-1敲低对p53、p21蛋白表达影响:0、2、4 Gy照射后,与NC组相比,sh-CAV-1组的p53蛋白表达水平显著降低(t=4.09、3.13、3.43,P < 0.05),提示抑制CAV-1蛋白表达会抑制p53蛋白表达,见图 3A,B。与NC组相比,sh-CAV-1组的p21蛋白表达水平显著升高(t=-3.63、-3.33、-3.06,P < 0.05),提示抑制CAV-1蛋白表达会促进p21蛋白表达,见图 3C,D。综上,敲低CAV-1可以促进血管内皮细胞发生早衰,CAV-1通过正调控p53蛋白表达,负调控p21蛋白表达,从而参与电离辐射诱导的血管内皮细胞早衰。
|
注:a与NC组相比, t=4.09、3.13、3.43、-3.63、-3.33、-3.06,P < 0.05 图 3 Western blot检测不同剂量X射线照射sh-CAV-1 HMEC-1细胞后72 h p53蛋白和p21蛋白表达的变化A~B.p53蛋白表达及定量分析;C~D.p21蛋白表达及定量分析 Figure 3 Changes of expressions of p53 and p21 protein in sh-CAV-1 HMEC-1 cells at 72 h after different doses of X-ray irradiation by Western blot A-B. Expression of p53 protein detected and quantitative analysis; C-D. Expression of p21 protein detected and quantitative analysis |
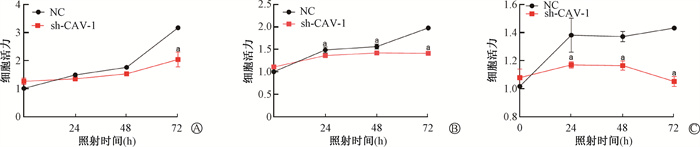
4. 敲低CAV-1对血管内皮细胞活力的影响:如图 4所示,与NC组相比,sh-CAV-1组细胞活力在72 h显著降低(t=7.42,P < 0.05);在电离辐射作用下,sh-CAV-1组细胞活力降低更明显,细胞存活率随着照射剂量增加而下降(t=3.26、3.79、25.89、2.97、7.31、18.33,P < 0.05)。提示抑制CAV-1表达会降低血管内皮细胞活力,使血管内皮细胞增殖能力减弱。
|
注:a与NC组比较,t=7.42、3.26、3.79、25.89、2.97、7.31、18.33,P < 0.05 图 4 CCK-8检测不同剂量X射线照射后HMEC-1细胞活力A. 0 Gy;B. 2 Gy;C. 4 Gy Figure 4 Viability of HMEC-1 cell detected by CCK-8 after X-ray irradiation at different doses A. 0 Gy; B. 2 Gy; C. 4 Gy |
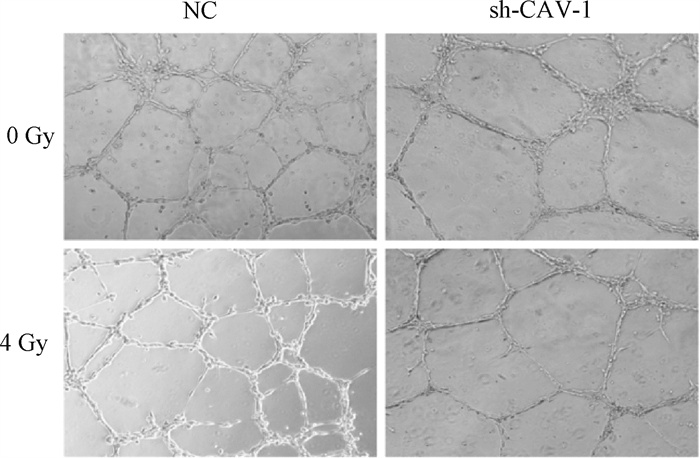
5. CAV-1敲低对血管内皮细胞功能的影响:为探讨CAV-1对血管内皮细胞HMEC-1功能的影响,对敲低CAV-1的细胞进行4 Gy X射线照射,72 h后检测细胞成管能力。结果如图 5和表 1所示,与NC组相比,抑制CAV-1表达后,HMEC-1细胞的节点数、主干数、成管总长度均显著下降(t=5.27、3.39、15.73,P < 0.05)。4 Gy X射线照射后使成管能力、主干数、成管总长度进一步下降(t=5.49、3.70、39.68,P < 0.05)。提示抑制CAV-1表达后,血管内皮细胞功能显著降低。
|
图 5 X射线照射HMEC-1 sh-CAV-1细胞成管能力×100 Figure 5 Angiogenesis ability of HMEC-1 sh-CAV-1 cells in vitro after X-ray irradiation ×100 |
|
|
表 1 X射线照射HMEC-1 sh-CAV-1细胞体外成管参数(X±s) Table 1 The parameters of angiogenesis ability of HMEC-1 sh-CAV-1 cells in vitro after X-ray irradiation (X±s) |
讨论
一般认为,细胞衰老主要有两种类型:复制性衰老(replicative senescence)和应激诱导的过早衰老(stress-induced premature senescence, SIPS)[9]。复制性衰老是一种经典的细胞衰老现象,其发生是由于细胞在不断分裂和复制过程中导致端粒逐渐缩短,以及端粒酶活性的下降,从而触发了细胞的衰老机制。此外,细胞衰老还可以独立于端粒缩短之外发生,它可能由多种应激因素(包括氧化损伤、电离辐射、化疗药物等)引发,这种现象被称为SIPS[10-12]。放疗通过诱导癌细胞DNA损伤导致细胞衰老和细胞死亡[11]。然而,同时也可引起血管内皮细胞的早衰,这增加了心血管疾病的风险[13-14],如治疗乳腺癌、肺癌可伴随限制性心肌炎等[13]。因此,探索电离辐射诱导血管内皮细胞早衰对减弱或消除放疗风险具有重要意义。本研究利用HMEC-1细胞,通过探讨CAV-1在电离辐射诱导血管内皮细胞早衰中的作用机制,为进一步研究辐射诱导血管内皮细胞机制探索提供理论依据。
现有研究表明,电离辐射主要通过细胞周期阻滞从而导致细胞早衰,目前涉及到的主要通路包括p53-p21通路以及p16-RB通路[15-16]。这些通路在细胞周期调控中扮演关键角色,p53-p21通路通过激活p53蛋白,进而上调p21的表达,导致细胞周期停滞在G2期,从而引发细胞衰老。而p16-RB通路则通过增加p16蛋白的表达,抑制RB蛋白的磷酸化,阻止细胞进入S期,最终导致细胞早衰[15-16]。电离辐射引起的DNA损伤激活了这些通路,加速了细胞衰老过程。进一步的研究发现,CAV-1蛋白在这一过程中可能起到重要的调控作用,它不仅参与细胞内信号传导,还影响细胞周期的进程。通过深入探讨CAV-1在电离辐射诱导的细胞早衰中的具体机制,有望为放疗副作用的预防和治疗提供新的靶点。
CAV-1是一种关键的膜蛋白,主要存在于细胞表面的微囊(caveolae)中,对于维护微囊的结构完整性、调控小泡运输以及信号传导过程发挥着重要作用。作为支架蛋白,CAV-1调节多种信号转导途径,并与多种分子相互作用,包括胆固醇、表皮生长因子受体(EGFR)、异源三聚体G蛋白和内皮一氧化氮合酶(endothel nitric oxide synthase, eNOS)等[13]。当前的研究表明,CAV-1可能与多种细胞的早衰发生有关[8, 17-19],它能在小鼠成纤维细胞和人类关节软骨细胞中介导应激诱导的早衰(SIPS)[8]。而Head等[19]的研究表明,Cav-1的缺失会导致神经衰老的加速。在本项研究中,通过对人微血管内皮细胞进行CAV-1基因敲低处理,与未处理的NC组相比,观察到CAV-1敲低细胞的活力明显降低,且细胞早衰的比例有所上升,这一发现与先前的研究结论相符。然而现有文献报道CAV-1与辐射抗性密切相关,本研究中对敲低CAV-1的细胞再施加不同剂量的电离辐射,其细胞衰老比例显著高于对照组,可能与照射剂量有关。研究表明,在0.5~10 Gy剂量下X射线主要导致细胞衰老,而细胞凋亡水平有限[20]。
本研究旨在深入探讨CAV-1在电离辐射引发血管内皮细胞早衰中的作用机制。为此,检测了在CAV-1被敲低的血管内皮细胞中,与衰老相关的蛋白p53的表达水平。研究结果显示,CAV-1的敲低导致p53蛋白表达量减少,这表明抑制CAV-1蛋白的表达会降低p53蛋白的表达。此外,研究结果表明CAV-1的敲低导致p21蛋白表达量增加,这表明抑制CAV-1蛋白的表达会促进p21蛋白的表达。因此,CAV-1通过正调控p53蛋白的表达,负调控p21蛋白表达,参与了电离辐射诱导的血管内皮细胞早衰过程。
综上所述,本研究表明CAV-1的表达降低与电离辐射诱导的血管内皮细胞早衰有关,且CAV-1的敲低会通过正调控p53蛋白的表达以及负调控p21蛋白表达,促进早衰的发生并抑制血管成管能力。这一发现丰富了CAV-1在电离辐射引发细胞早衰的理论框架,为探索CAV-1在电离辐射导致的细胞早衰机制提供了新的视角。尽管如此,本研究仍有一些局限性。为了验证这些发现的实际应用性,需要在动物模型中进一步进行验证。此外,一般研究认为CAV-1可以通过调节p53-p21通路促进细胞衰老,p53蛋白表达升高伴随p21蛋白表达升高,但本研究结果表明可能存在非p53依赖性p21通路调控细胞早衰。CAV-1如何具体调节p53和p21的分子机制,还需要进行更深入的研究。
利益冲突 无
作者贡献声明 伊如罕负责实验设计、实验操作、数据整理、起草论文;陆雪、蔡恬静负责论文修改;高玲指导实验设计和论文修改
| [1] |
Wang KX, Ye C, Yang X, et al. New insights into the understanding of mechanisms of radiation-induced heart disease[J]. Curr Treat Options Oncol, 2023, 24(1): 12-29. DOI:10.1007/s11864-022-01041-4 |
| [2] |
Uehara M, Bekki N, Shiga T. Radiation-associated cardiovascular disease in patients with cancer: current insights from a cardio-oncologist[J]. J Radiat Res, 2024, 65(5): 575-590. DOI:10.1093/jrr/rrae068 |
| [3] |
Bedi R, Ahmad A, Horbal P, et al. Radiation-associated arrhythmias: Putative pathophysiological mechanisms, prevalence, screening and management strategies[J]. Arrhythm Electrophysiol Rev, 2023, 12: e24. DOI:10.15420/aer.2022.44 |
| [4] |
Baselet B, Sonveaux P, Baatout S, et al. Pathological effects of ionizing radiation: endothelial activation and dysfunction[J]. Cell Mol Life Sci, 2019, 76(4): 699-728. DOI:10.1007/s00018-018-2956-z |
| [5] |
Dymkowska D. The involvement of autophagy in the maintenance of endothelial homeostasis: The role of mitochondria[J]. Mitochondrion, 2021, 57: 131-147. DOI:10.1016/j.mito.2020.12.013 |
| [6] |
Larionov A, Hammer CM, Fiedler K, et al. Dynamics of endothelial cell diversity and plasticity in health and disease[J]. Cells, 2024, 13(15): 1276. DOI:10.3390/cells13151276 |
| [7] |
Schmitt CA, Wang B, Demaria M. Senescence and cancer - role and therapeutic opportunities[J]. Nat Rev Clin Oncol, 2022, 19(10): 619-636. DOI:10.1038/s41571-022-00668-4 |
| [8] |
Volonte D, Galbiati F. Caveolin-1, a master regulator of cellular senescence[J]. Cancer Metastasis Rev, 2020, 39(2): 397-414. DOI:10.1007/s10555-020-09875-w |
| [9] |
Mikuła-Pietrasik J, Niklas A, Uruski P, et al. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells[J]. Cell Mol Life Sci, 2020, 77(2): 213-229. DOI:10.1007/s00018-019-03261-8 |
| [10] |
Calcinotto A, Kohli J, Zagato E, et al. Cellular senescence: Aging, cancer, and injury[J]. Physiol Rev, 2019, 99(2): 1047-1078. DOI:10.1152/physrev.00020.2018 |
| [11] |
Wanner E, Thoppil H, Riabowol K. Senescence and apoptosis: Architects of mammalian development[J]. Front Cell Dev Biol, 2020, 8: 620089. DOI:10.3389/fcell.2020.620089 |
| [12] |
Herrmann J. Adverse cardiac effects of cancer therapies: cardiotoxicity and arrhythmia[J]. Nat Rev Cardiol, 2020, 17(8): 474-502. DOI:10.1038/s41569-020-0348-1 |
| [13] |
Herdy JR, Mertens J, Gage FH. Neuronal senescence may drive brain aging[J]. Science, 2024, 384(6703): 1404-1406. DOI:10.1126/science.adi3450 |
| [14] |
Banfill K, Giuliani M, Aznar M, et al. Cardiac toxicity of thoracic radiotherapy: Existing evidence and future directions[J]. J Thorac Oncol, 2021, 16(2): 216-227. DOI:10.1016/j.jtho.2020.11.002 |
| [15] |
Wu Z, Qu J, Liu GH. Roles of chromatin and genome instability in cellular senescence and their relevance to ageing and related diseases[J]. Nat Rev Mol Cell Biol, 2024, 25(12): 979-1000. DOI:10.1038/s41580-024-00775-3 |
| [16] |
de Magalhães JP. Cellular senescence in normal physiology[J]. Science, 2024, 384(6702): 1300-1301. DOI:10.1126/science.adj7050 |
| [17] |
Zou H, Stoppani E, Volonte D, et al. Caveolin-1, cellular senescence and age-related diseases[J]. Mech Ageing Dev, 2011, 132(11-12): 533-542. DOI:10.1016/j.mad.2011.11.001 |
| [18] |
Yu DM, Jung SH, An HT, et al. Caveolin-1 deficiency induces premature senescence with mitochondrial dysfunction[J]. Aging Cell, 2017, 16(4): 773-784. DOI:10.1111/acel.12606 |
| [19] |
Head BP, Peart JN, Panneerselvam M, et al. Loss of caveolin-1 accelerates neurodegeneration and aging[J]. PLoS One, 2010, 5(12): e15697. DOI:10.1371/journal.pone.0015697 |
| [20] |
Panganiban RA, Mungunsukh O, Day RM. X-irradiation induces ER stress, apoptosis, and senescence in pulmonary artery endothelial cells[J]. Int J Radiat Biol, 2013, 89(8): 656-667. DOI:10.3109/09553002.2012.711502 |
 2025, Vol. 45
2025, Vol. 45


