Clinical trial registration: China Clinical Trial Registry, ChiCTR2300069881
放射治疗作为重要的宫颈癌根治性治疗手段,在治疗的同时也会造成周围正常组织的损伤[1]。放射性腹泻(radiation-induced diarrhea,RID)是肠道放射性损伤的重要表现,在宫颈癌患者放疗过程中尤为常见,其发生率可达80%。不仅会影响患者的生活质量,还可能导致放疗中断进而降低疗效[2]。然而,目前临床上应对RID的主要方式为对症支持治疗,缺乏特异性的防治手段。近年来,肠道菌群紊乱与肠道放射性损伤之间的关系成为研究热点,通过补充益生菌调节肠道菌群来预防肠道放射性损伤被认为是一个具有前景的研究方向[3-5]。本课题组的前期研究发现补充益生菌长双歧杆菌BL21(BL21)可以保护肠隐窝干细胞、维持肠道屏障完整性来预防小鼠模型中肠道的放射性损伤[6]。为了进一步验证BL21在临床中的应用前景,设计了本项Ⅱ期临床研究。本研究重点评估了临床中使用BL21预防RID的安全性及有效性,并探索了肠道菌群的改变情况,旨在为临床中应对RID提供参考,并为后续开展Ⅲ期临床研究提供依据。
资料与方法1. 入组对象选择:纳入标准:年龄18~75岁;在苏州大学附属第二医院放疗科经病理学确诊、行根治性或术后辅助性放疗的宫颈癌患者;卡氏(KPS)评分≥70,预期寿命评估>12个月。排除标准:既往有恶性肿瘤病史;合并其他严重消化系统疾病,如炎症性肠病;已知重大的活动性感染,或研究者判断存在重大的血液、肾脏、代谢、胃肠、内分泌功能或代谢紊乱;受试者基线血常规和生化指标不符合抗肿瘤指标标准。
2. 研究对象:本研究是一项前瞻性单臂Ⅱ期临床研究,自2023年4月至2023年11月,共入组了35例接受根治性或辅助性放疗的宫颈癌患者。其中,2例患者因发生严重粒细胞缺乏伴发热而退出研究,4例患者没有按照规定方案服用BL21,故29例纳入分析。入组患者中位年龄55(35~74)岁;KPS 70和80分别为12和17例;鳞癌24例;国际妇产科联盟(FIGO)分期Ⅰ、Ⅱ、Ⅲ期分别为12、12、5例;22例患者接受同步放化疗;处方剂量50(46.8~50.4)Gy/36(33~44)d。放疗期间第一天起每日口服1包含有200亿菌落形成单位(CFU)的长双歧杆菌BL21菌粉(苏州微康益生菌公司)至放疗结束。本研究获得了本院伦理审查委员会批准(伦理审批号:2022-137)。所有患者签署书面知情同意书。
3. 放射治疗及化疗方案:入组患者的放化疗适应症、放化疗方案的制定等遵循美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group, RTOG)和美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)发布的指南。放射治疗使用6 MV X射线(美国Varian Vitalbeam医用直线电子加速器)调强放疗技术,靶区通过Eclipse放疗计划系统进行勾画。根治性放疗采用外照射联合后装的治疗模式,其中外照射临床靶体积(CTV)包括子宫体、宫颈、宫旁组织、阴道及盆腔淋巴引流区(髂总、髂内、髂外、骶前和闭孔淋巴引流区)。术后辅助放疗CTV包括宫旁组织、阴道残端、阴道及盆腔淋巴引流区(髂总、髂内、髂外、骶前和闭孔淋巴引流区)。计划靶体积(PTV)为CTV各方向外扩5~7 mm,处方剂量为45~50.4 Gy。同步化疗主要采用以顺铂为基础的方案,以75~80 mg/m2的剂量每3周给药。
4. 随访指标:本研究随访频率为每周1次,主要研究终点为放疗外照射期间RID的发生率及严重程度,按照不良事件的通用术语标准5.0版本(common terminology criteria for adverse events, CTCAE v5.0)[7]中腹泻的分级标准进行记录与分级。同时记录患者使用抗腹泻药物的起始时间,作为评估RID严重程度的补充。在外照射过程中出现的不良反应均按照CTCAE v5.0进行记录和分级,作为BL21安全性的评定依据,主要包括体重变化、肝肾功能异常以及消化道反应等。这些不良反应需与放化疗本身导致的不良反应进行区分,由3名高级职称的放疗科医师共同判定。此外,在放疗前后分别留取两次患者粪便样本置于离心管中,并存储于-80℃冰箱,以供后续的16SrRNA分析。
5. 肠道勾画与剂量体积的评估:主要的危及器官包括小肠、结肠、直肠和膀胱,剂量限定参考NCCN指南中的原则。采用肠管勾画法勾画肠道,在勾画小肠时,根据小肠造影剂的对比效果,沿小肠肠管勾画其外表面,以便将小肠与结肠区分开;在勾画结肠时,从乙状结肠末端一直延伸到升结肠进行勾画;直肠的勾画从坐骨结节延伸到直肠与乙状结肠的交界处。所有肠道的上界设定在PTV上方2 cm,下界设定在PTV下方2 cm。小肠与结肠的受照体积通过D45 Gy的绝对体积和V40 Gy的相对体积来描述。直肠的受照体积通过V40 Gy和V45 Gy的相对体积来描述。
6. 肠道菌群16SrRNA分析:粪便样本的16SrRNA测序分析由上海Metabo-Profile Biotechnology有限公司进行。提取DNA并使用Nanodrop对其进行定量,通过1.2%琼脂糖凝胶电泳检测DNA的提取质量。添加样本特异性Barcode序列,对rRNA基因的可变区或特定基因片段进行聚合酶链式反应(PCR)扩增。扩增产物经过磁珠纯化回收和荧光定量后,采用美国Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,并进行高通量测序。在使用DADA2进行质量控制后(包括序列质量控制、去噪、连接和去除嵌合体等步骤),生成的每个去重序列被称为ASVs。
7. 统计学处理:采用SPSS 25.0软件进行统计学分析,连续型变量如符合正态分布则以x±s表示,不符合正态分布则以中位数(范围)表示。使用独立样本t检验(正态分布)和Wilxcon秩和检验(非正态分布)比较两组患者间肠道的受照剂量体积。对α多样性的评估采用Chao1指数表征丰富度,Shannon指数表征多样性。对β多样性的评估,采用非加权UniFrac距离进行非度量多维标度(nonmetric multidimensional scaling, NMDS)分析,stress<0.2表明两组差异分析的可靠性高。物种差异分析采用线性判别(LEfSe)分析。P<0.05为差异有统计学意义。
结果1. RID评估:RID总体发生率为21/29。1、2、3级RID分别为14、3、4例,8例患者未发生RID,总体严重程度呈较低水平。除这29例外,4例未按照规定每天服用BL21的患者发生RID的情况如下:1例未发生RID,2例发生1级RID,1例发生2级RID,未服用BL21的天数为4~5 d。6例患者在放疗期间使用了抗腹泻药物,开始使用抗腹泻药物的平均时间约为放疗开始后20 d,其中4例患者仅在1周内使用了抗腹泻药物,另外2例患者使用抗腹泻药物的时间分别为2和3周。
2. 安全性评价:入组患者在放疗前后的体重保持稳定,25例未出现体重减轻,仅1例出现2级体重减轻。放疗过程中所有患者均未出现明显肝肾功能的异常。非血液学不良反应较常见的包括食欲不振(13例)、恶心(15例)和胃肠道胀气(3例),但均为1~2级。其中胃肠道胀气考虑与BL21有关,因为其常出现在服用BL21之后。这些患者症状轻微,无需治疗,并且仅在服用BL21的前几日出现,可自行缓解。
3. 肠道剂量-体积参数评估:参考2024版NCCN宫颈癌诊疗指南中的对肠道剂量的限制要求,本组患者中肠道的受照剂量整体保持在可接受的安全范围内,符合国际标准[8]。将未发生和发生1级RID的患者归为低症状级别组,发生2级和3级RID的患者归为高症状级别组,进一步比较两组间患者的肠道受照剂量情况。结果显示,高症状级别组的结肠受照剂量略高于低症状级别组,但差异无统计学意义(P>0.05),小肠和直肠的受照剂量在两组间相仿(P>0.05)。这说明本组患者RID严重程度差异并非由肠道受照剂量差异主导。
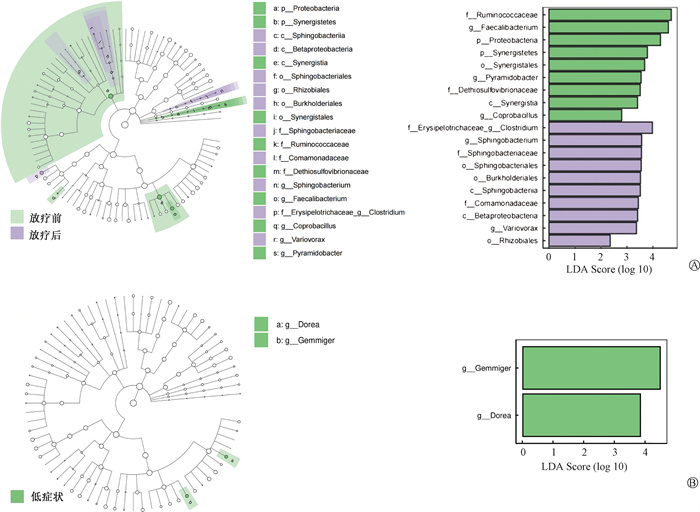
4. 肠道菌群分析:对放疗前后肠道菌群多样性和菌种组成进行比较。放疗前的α多样性高于放疗后(Chao1:P = 0.002,Shannon:P = 0.005,图 1A),β多样性也存在差异(stress = 0.198,图 1B)。通过LEfSe分析发现,放疗前样本中Ruminococcaceae科(LDA score=4.70)、Faecalibacterium属(LDA score=4.59)和Proteobacteria门(LDA score=4.29)的丰度较高。经过放疗,肠道菌群的组成发生了改变,在放疗后样本中,Clostridium属(LDA score=3.98)的丰度较高(图 2A)。进一步比较放疗后样本中低症状级别患者与高症状级别患者菌群多样性和物种组成。前者的α多样性高于后者,但差异无统计学意义(Chao1: P = 0.07,Shannon: P = 0.28,图 1C)。两组间β多样性存在差异(stress = 0.194,图 1D)。通过LEfSe分析发现,低症状级别患者中Gemmiger属(LDA score=4.48)和Dorea属(LDA score=3.83)的丰度较高(图 2B)。

|
注:BL. 低症状级别;BH. 高症状级别 图 1 放疗前、后肠道菌群多样性分析 A. 放疗前、后α多样性对比箱线图;B. 放疗前、后基于Unweighted-UniFrac的NMDS分析;C. 低症状级别与高症状级别患者α多样性对比箱线图;D. 低症状级别与高症状级别患者基于Unweighted-UniFrac的NMDS分析 Figure 1 Analyses of alpha diversity of intestinal microbiota before and after radiotherapy A. Box plot showing the comparison of alpha diversity before and after radiotherapy; B. NMDS analysis based on Unweighted UniFrac before and after radiotherapy; C. Box plot showing the comparison of alpha diversity in patients with low- and high-grade symptoms; D. NMDS analysis based on Unweighted UniFrac of patients with low- and high-grade symptoms |
|
注:LDA score阈值为2,P<0.05,LDA score>4认为对差异贡献显著 图 2 放疗前、后(A)及低、高症状级别(B)患者肠道菌群差异LEfSe分析 Figure 2 LEfSe analyses of differences in intestinal microbiota in patients before and after radiotherapy (A) and in patients with low- and high-grade symptoms (B) |
讨论
益生菌被定义为“活的微生物,当给予足够的量时,对宿主的健康有益”[9]。补充益生菌的安全性和有效性已在一些消化系统疾病中得到证明,如炎症性肠病[10]。长双歧杆菌BL21菌株分离自健康婴儿的粪便,是目前一种上市商品。Dong等[11]在其研究中证明了BL21的低毒性,连续给药14 d后,BL21没有导致小鼠出现任何不良反应或死亡,小鼠的体重均正常增加,对小鼠进行病理解剖也没有发现明显的异常,半数致死剂量超过2×1010 CFU/kg。然而,目前BL21应用于临床中的安全性尚未得到评估和证明。本研究首先在临床中评估了使用BL21预防RID的安全性,研究过程中未观察到与BL21相关的严重不良事件(AE),仅短暂出现3例可能与BL21相关的胃肠道胀气。因此,BL21安全性可靠。
多种益生菌在防治辐射诱导的肠道损伤中可能发挥着作用,这些结果已在小鼠模型中得到验证,如乳酸杆菌属等,而目前相关临床研究的结果却不一致[12]。本研究中RID的总体发生率为72.4%,与既往临床研究报道的数据略低或相当,如Demers等[13]的研究显示,接受盆腔放疗的患者RID发生率为86%,在Chitapanarux等[14]的研究中这一比例达到了100%。Linn等[15]开展的研究使用嗜酸性乳杆菌LA-5与双歧杆菌BB-12的混合菌作为干预手段,结果显示,益生菌组发生1~2级RID的概率较安慰剂组显著降低(安慰剂组:82.1%,益生菌组:52.8%),在本研究中发生1~2级RID的概率为58.6%,与该研究中实验组的数据相当。值得指出的是,在本研究发生1~2级RID的17例患者中,1级的患者占绝大多数(14例),这些患者的腹泻症状较轻微,而在Linn等[15]的研究中并未对1级和2级RID的具体人数进行说明。抗腹泻药物的使用率方面,6例(20.7%)患者在放疗期间使用了抗腹泻药物,低于既往研究中报道的数据。既往研究中报道的益生菌组的抗腹泻药物使用率为9.0%~50.0%,而安慰剂组为29.3%~85.7%[13-16]。抗腹泻药物的使用时间方面,本研究中患者开始使用抗腹泻药物的平均时间约为放疗开始后的20 d。与既往研究中的结果相似,无论益生菌组还是对照组均在20 d左右[13, 15]。
放疗会影响腹盆部肿瘤患者的肠道菌群的多样性及组成,如美国德州大学MD安德森肿瘤中心开展的一项临床研究显示,肠道菌群多样性在宫颈癌放疗过程中持续下降,较高的肠道菌群多样性与更好的胃肠道功能呈线性相关[3]。本研究通过分析放疗前后的粪便样本发现放疗后α多样性相较于放疗前下降,并且在放疗后样本中高症状组α多样性更低。一方面证明了放疗会引起肠道菌群的失调,表现为α多样性和β多样性的改变;另一方面,RID严重程度更高的患者α多样性更低不仅说明了α多样性的降低与RID严重程度相关,也反映了通过腹泻次数评估辐射诱导肠道损伤的合理性。LEfSe分析结果显示,放疗后Clostridium属的丰度较高,提示Clostridium属可能是放疗后引起肠道菌群紊乱的一种特征菌,其已被证明与炎症相关的胃肠道疾病相关[17]。而在放疗后的样本中,发现在低症状组中Gemmiger属和Dorea属的丰度较高,其中Gemmiger属属于Ruminococcaceae科,而Dorea属属于Lachnospiraceae科。Lachnospiraceae科与人体的健康密切相关,其核心成员是短链脂肪酸的主要产生菌[18]。Dorea属的作用尚不完全明确,Shahi等[19]的研究提示Dorea属可能与某种抗炎功能相关。Gemmiger属的丰度往往在某些炎症性疾病中增加[20]。
本研究也存在一些局限性。一方面,本研究是一项单臂Ⅱ期临床研究,旨在初步评估BL21预防RID的安全性和有效性,而BL21预防RID的确切疗效仍需在未来进一步证明。另一方面,尽管本研究对入组患者放疗前后的肠道菌群进行了检测,并对这些菌群特征进行了分析和说明,但BL21发挥作用涉及的具体机制仍需进一步探索。在未来,本中心将扩大样本量开展随机、双盲、安慰剂对照的Ⅲ期临床研究,明确BL21预防RID的具体疗效。此外,还将对采集到的粪便样本进行代谢组学分析以探究BL21在减轻RID中可能涉及的机制。
宫颈癌患者在放疗期间口服补充BL21安全性良好,没有观察到与BL21相关的严重AE。RID总体发生率为21/29,但RID严重程度呈现较低水平,没有发生或发生轻度RID的比例为22/29。本研究中患者对抗腹泻药物的需求也有所减低,仅6/29的患者在放疗期间接受了抗腹泻药物的干预。肠道菌群方面,本研究观察到粪便样本的α多样性和肠道菌群组成与RID的严重程度相关,提示BL21可能通过调节肠道菌群发挥预防RID的作用。本项Ⅱ期研究的结果初步展示了BL21在临床中预防RID的安全性以及有效性,值得进一步研究。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 杨寅寅、胡宜佳负责设计研究方案,研究实施及论文撰写;顾栩滈、夏彤负责收集临床数据;徐睿哲、刘畅负责文献查找及数据分析;邹莉、田野提出研究思路,技术指导及论文修改
| [1] |
Wang K, Tepper JE. Radiation therapy-associated toxicity: Etiology, management, and prevention[J]. CA Cancer J Clin, 2021, 71(5): 437-454. DOI:10.3322/caac.21689 |
| [2] |
Hauer-Jensen M, Denham JW, Andreyev HJ. Radiation enteropathy-pathogenesis, treatment and prevention[J]. Nat Rev Gastroenterol Hepatol, 2014, 11(8): 470-479. DOI:10.1038/nrgastro.2014.46 |
| [3] |
Mitra A, Grossman Biegert GW, Delgado AY, et al. Microbial diversity and composition is associated with patient-reported toxicity during chemoradiation therapy for cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2020, 107(1): 163-171. DOI:10.1016/j.ijrobp.2019.12.040 |
| [4] |
Moraitis I, Guiu J, Rubert J. Gut microbiota controlling radiation-induced enteritis and intestinal regeneration[J]. Trends Endocrinol Metab, 2023, 34(8): 489-501. DOI:10.1016/j.tem.2023.05.006 |
| [5] |
Tonneau M, Elkrief A, Pasquier D, et al. The role of the gut microbiome on radiation therapy efficacy and gastrointestinal complications: A systematic review[J]. Radiother Oncol, 2021, 156: 1-9. DOI:10.1016/j.radonc.2020.10.033 |
| [6] |
Xie LW, Lu HY, Tang LF, et al. Probiotic consortia protect the intestine against radiation injury by improving intestinal epithelial homeostasis[J]. Int J Radiat Oncol Biol Phys, 2024, 120(1): 189-204. DOI:10.1016/j.ijrobp.2024.03.003 |
| [7] |
National Cancer Institute, USA. Common Terminology Criteria for Adverse Events (CTCAE), v5.0[OL]. (2018-03-01). [2023-10-20]. https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.
|
| [8] |
Abu-Rustum NR, Yashar CM, Arend R, et al. NCCN GuidelinesⓇ Insights: Cervical Cancer, Version 1.2024[J]. J Natl Compr Canc Netw, 2023, 21(12): 1224-1233. DOI:10.6004/jnccn.2023.0062 |
| [9] |
Hill C, Guarner F, Reid G, et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic[J]. Nat Rev Gastroenterol Hepatol, 2014, 11(8): 506-514. DOI:10.1038/nrgastro.2014.66 |
| [10] |
Ganji-Arjenaki M, Rafieian-Kopaei M. Probiotics are a good choice in remission of inflammatory bowel diseases: A meta analysis and systematic review[J]. J Cell Physiol, 2018, 233(3): 2091-2103. DOI:10.1002/jcp.25911 |
| [11] |
Dong Y, Zhang Y, Xu F, et al. Extensive genomic characterization, pre-clinical probiotic evaluation, and safety analysis of Bifidobacterium longum subsp. longum BL21 isolated from infant feces[J]. Microb Pathog, 2024, 197: 107100. DOI:10.1016/j.micpath.2024.107100 |
| [12] |
赵天舒, 杨咏强, 蔡尚, 等. 乳杆菌属防治急性放射性肠损伤的研究进展[J]. 中华放射肿瘤学杂志, 2020, 29(4): 313-316. Zhao TS, Yang YQ, Cai S, et al. Research progress on the prevention and treatment of radiation-induced intestinal injury by the genus Lactobacillus[J]. Chin J Radiat Oncol, 2020, 29(4): 313-316. DOI:10.3760/cma.j.cn113030-20191108-00013 |
| [13] |
Demers M, Dagnault A, Desjardins J. A randomized double-blind controlled trial: Impact of probiotics on diarrhea in patients treated with pelvic radiation[J]. Clin Nutr, 2014, 33(5): 761-767. DOI:10.1016/j.clnu.2013.10.015 |
| [14] |
Chitapanarux I, Chitapanarux T, Traisathit P, et al. Randomized controlled trial of live Lactobacillus acidophilus plus bifidobacterium bifidum in prophylaxis of diarrhea during radiotherapy in cervical cancer patients[J]. Radiat Oncol, 2010, 5: 31. DOI:10.1186/1748-717X-5-31 |
| [15] |
Linn YH, Thu KK, Win N. Effect of probiotics for the prevention of acute radiation-induced diarrhoea among cervical cancer patients: a randomized double-blind placebo-controlled study[J]. Probiotics Antimicrob Proteins, 2019, 11(2): 638-647. DOI:10.1007/s12602-018-9408-9 |
| [16] |
Giralt J, Regadera JP, Verges R, et al. Effects of probiotic Lactobacillus casei DN-114 001 in prevention of radiation-induced diarrhea: results from multicenter, randomized, placebo-controlled nutritional trial[J]. Int J Radiat Oncol Biol Phys, 2008, 71(4): 1213-1219. DOI:10.1016/j.ijrobp.2007.11.009 |
| [17] |
Kaakoush NO. Insights into the role of erysipelotrichaceae in the human host[J]. Front Cell Infect Microbiol, 2015, 5: 84. DOI:10.3389/fcimb.2015.00084 |
| [18] |
Vacca M, Celano G, Calabrese FM, et al. The controversial role of human gut lachnospiraceae[J]. Microorganisms, 2020, 8(4): 573. DOI:10.3390/microorganisms8040573 |
| [19] |
Shahi SK, Freedman SN, Mangalam AK. Gut microbiome in multiple sclerosis: The players involved and the roles they play[J]. Gut Microbes, 2017, 8(6): 607-615. DOI:10.1080/19490976.2017.1349041 |
| [20] |
Mondot S, Lepage P, Seksik P, et al. Structural robustness of the gut mucosal microbiota is associated with Crohn's disease remission after surgery[J]. Gut, 2016, 65(6): 954-962. DOI:10.1136/gutjnl-2015-309184 |
 2025, Vol. 45
2025, Vol. 45


