2. 河北医科大学第四医院放疗科,石家庄 050011
2. Department of Radiation Oncology, Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
肺癌是全球发病率和死亡率最高的恶性肿瘤,其中约85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。NSCLC具有早期转移的特点,临床就诊时多数患者已为晚期[2]。在晚期NSCLC患者中,20%~50%的患者为寡转移[3]。全身治疗是NSCLC寡转移患者不可或缺的重要治疗模式,尽管综合治疗在晚期NSCLC患者中取得了一定疗效,但结果仍不令人满意[4]。近年来,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs) 的临床应用从一定程度上改变了驱动基因阴性转移性NSCLC患者的治疗方式,无论是二线或一线应用,均取得了较好的临床效果[5-7],但ICIs单药的治疗应答率仅为19%~47%[8],因此,迫切需要一种新的治疗模式来改变这一现状。在过去几十年的时间里,临床实践表明,对于NSCLC寡转移患者进行选择性的局部治疗有利于提高患者的长期生存率[9-10]。在ICIs治疗时代,对于NSCLC寡转移患者,免疫联合放疗或免疫联合化疗已越来越被临床医师所接受,且显示出疗效[11-12]。然而,在免疫联合化疗一线治疗的基础上加用放疗治疗NSCLC寡转移还较为少见。本研究通过回顾性分析195例NSCLC寡转移患者的临床病理资料和治疗效果,以明确放疗在免疫联合化疗一线治疗NSCLC寡转移患者中的作用,现将结果报告如下。
资料与方法1. 研究对象:2019年1月至2021年12月安阳市肿瘤医院和河北医科大学第四医院符合入组条件的195例NSCLC寡转移患者进入本研究。纳入标准:①年龄≥18岁。②病理组织学诊断为NSCLC,腺癌患者接受基因检测,且表皮生长因子受体(epidermal growth factor receptor, EGFR)或间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)基因无异常。③依据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版NSCLC的TNM分期标准[13],患者均为Ⅳ期,且为寡转移(≤3个转移器官,且≤5个转移病灶)。④既往未接受过抗肿瘤治疗。⑤接受≥2个周期的化疗及≥3个周期的ICIs治疗,联合或不联合放疗。⑥美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2分。⑦根据实体瘤的疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版[14],治疗前至少存在1个可测量的病灶。⑧治疗前后影像学和临床病理资料完整。排除标准:①合并除外皮肤癌的第二原发癌。②治疗前存在骨髓储备不足,心脏、肝脏、肾脏等重要脏器功能不全。③需要治疗的活动性感染、艾滋病毒感染和活动性病毒性肝炎等疾病。④自身免疫性疾病和其他严重的全身性疾病,且需要药物干预。
本研究遵循《赫尔辛基宣言》,所有患者治疗前均签署知情同意书。195例患者中,男166例,女29例;年龄28~85(61.4±9.3)岁;ECOG评分为0分47例,1分148例;鳞癌106例,腺癌86例,其他3例;Ⅳa期131例,Ⅳb期64例。胸腔内转移31例,胸腔外单个器官单发转移100例,胸腔外单个器官多发转移39例,2个器官转移25例。放疗联合免疫和化疗组60例,免疫联合化疗组135例。
2. 治疗方法
(1) 免疫治疗:195例患者中,帕博利珠单抗治疗87例,替雷利珠单抗治疗52例,卡瑞利珠单抗治疗34例,度伐利尤单抗治疗22例。同步治疗期间每隔3周输注1次,巩固治疗期间每隔3~4周输注1次。195例患者接受ICIs治疗的周期数为3~35个,中位数为6个。
(2) 化疗:195例患者均使用含铂双药化疗方案,主要包括白蛋白紫杉醇+顺铂或卡铂、紫杉醇+顺铂或卡铂和培美曲塞+顺铂等方案。化疗周期数为2~8个,中位数为4个。
(3) 放疗:60例患者接受放疗(放疗前均接受1~4个周期免疫联合化疗),其中单器官转移46例,2个器官转移14例。单器官转移患者中,包括脑转移16例,肺转移13例,骨转移8例,肝转移6例,肾上腺转移3例;2个器官转移患者中,脑和骨转移5例,肺和肾上腺转移4例,肺和脑转移3例,肝和骨转移2例。有38例患者接受原发灶和转移灶放疗,9例仅接受原发灶放疗,13例仅接受转移灶放疗。原发灶放疗均采用同步整合加量调强放疗(simultaneous integrated boost intensity-modulated radiation therapy,SIB-IMRT),肿瘤靶区(gross tumor volume,GTV)包括肺部原发肿瘤病灶,临床靶区(clinical target volume,CTV)为GTV外扩0.6~0.8 cm,计划靶区(planning target volume,PTV)为CTV外扩0.5 cm。勾画转移性淋巴结(GTVnd),GTVnd基础上外扩0.5 cm为PTVnd。处方剂量要求95%的PTV和PTVnd接受总量为54 Gy的照射(1.8 Gy/次,分30次完成),GTV和GTVnd接受总量为60~63 Gy的照射(2.0~ 2.1 Gy/次,分30次完成)。脑转移患者的转移瘤个数为1~4个,均接受立体定向放射治疗(stereotactic body radiationtherapy,SBRT),处方剂量为30~40 Gy,分5次完成。骨转移患者中,椎体骨转移7例,盆腔骨转移5例,肋骨转移3例,均采用调强放疗(intensity-modulated radiationtherapy,IMRT),处方剂量为30 Gy,分10次完成。其他肺、肾上腺和肝脏转移灶均接受IMRT,处方剂量为30~56 Gy,分10~28次完成。
3. 基线检查、疗效评估和随访
(1) 基线检查:影像学检查主要包括浅表部位超声、胸部和腹部CT、脑部MRI、放射性核素骨扫描或正电子发射体层摄影(positron emission tomography,PET-CT)。血液学检查主要包括血常规、肝肾功能、肿瘤标志物、甲状腺功能及心肌酶等免疫治疗相关化验。病理学检查主要包括电子支气管镜检查或浅表肿大淋巴结穿刺活检等。
(2) 疗效评价:依据RECIST 1.1版进行治疗反应评估,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)[14]。治疗相关不良反应根据常见不良反应通用术语标准(common terminology criteria for adverse events,CTCAE)5.0版[15]进行分级。
(3) 随访:主要包括常规体格检查、影像学检查(胸部和腹部CT检查、脑部MRI、浅表淋巴结超声等)和血液学检查(肿瘤标志物等)。第1年每2个月进行一次,之后每3个月进行一次;必要时进行PET-CT检查或细胞学穿刺活检。无进展生存时间(progression free survival,PFS)的定义为从治疗开始到肿瘤进展或任何原因引起死亡的时间。生存时间(overall survival,OS)的定义为从治疗日期到任何原因引起死亡的时间。随访截至2023年12月31日,随访率为100%。
4. 倾向评分匹配(propensity score matching,PSM):为明确不同治疗模式对患者预后的影响,进行1∶1 PSM,以减少临床混杂因素的影响。定义两组患者临床、病理指标构成比中P≤0.2的因素为协变量,以免疫联合化疗组为对照组,放疗联合免疫和化疗组为治疗组进行重新匹配。
5. 统计学处理:应用SPSS 26.0软件进行分析。分类变量以例数和百分数(%)表示,组间比较采用χ2检验。生存曲线采用Kaplan-Meier法绘制,组间比较使用log rank检验。将可能影响患者预后的因素纳入Cox多因素回归模型,以分析患者预后的独立影响因素。P < 0.05为差异有统计学意义。
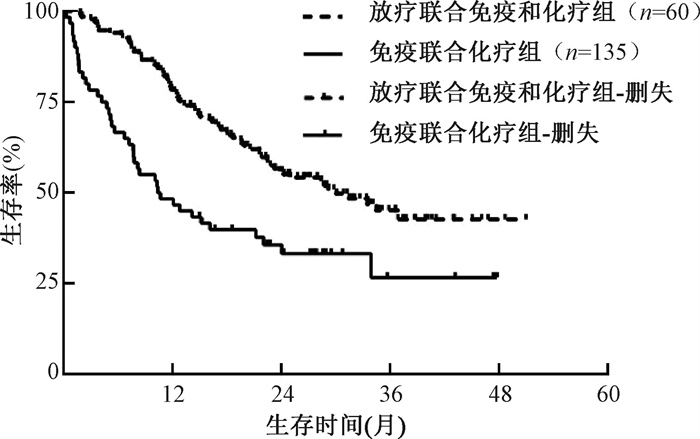
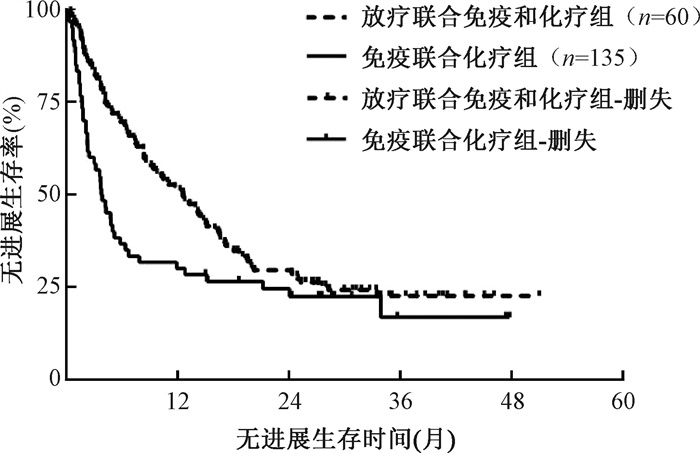
结果1. PSM前患者的预后:PSM前,全组195例患者的中位随访时间为31.8个月(95%CI:28.8~ 34.8个月),1、2、3年生存率分别为69.2%、49.5%和39.5%,1、2、3年无进展生存率分别为45.1%、27.8%和21.0%,中位OS和中位PFS分别为23.8(95%CI:17.5~30.1个月)和9.2(95%CI:5.9~12.4个月)。放疗联合免疫和化疗组患者的1、2、3年生存率分别为78.5%、55.9%和45.1%,免疫联合化疗组患者的1、2、3年生存率分别为48.3%、35.6%和26.6%,放疗联合免疫和化疗组患者的1、2、3年生存率明显优于免疫联合化疗组(χ2=14.65,P<0.001,图 1)。放疗联合免疫和化疗组患者的1、2、3年无进展生存率分别为51.9%、29.5%和22.7%,免疫联合化疗组患者的1、2、3年无进展生存率分别为30.0%、24.5%和16.9%,放疗联合免疫和化疗组患者的1、2、3年无进展生存率明显优于免疫联合化疗组(χ2=6.09,P=0.014,图 2)。
|
图 1 倾向评分匹配前放疗联合免疫和化疗组以及免疫联合化疗组非小细胞肺癌寡转移患者的生存曲线比较 Figure 1 Comparison of survival curves for oligometastatic NSCLC patients in both groups before PSM |
|
图 2 倾向评分匹配前放疗联合免疫和化疗组以及免疫联合化疗组非小细胞肺癌寡转移患者的无进展生存曲线比较 Figure 2 Comparison of PSF curves for oligometastatic NSCLC patients in both groups before PSM |
2. PSM后患者的临床病理特征:PSM后,放疗联合免疫和化疗组以及免疫联合化疗组各55例,放疗联合免疫和化疗组与免疫联合化疗组患者临床病理特征的差异均无统计学意义(P>0.05,表 1)。
|
|
表 1 PSM前后不同治疗模式组NSCLC寡转移患者的临床病理特征比较 [例(%)] Table 1 Comparison of clinical and pathological characteristics of oligometastatic NSCLC patients in both groups before and after PSM [n (%)] |
3. PSM后患者的近期疗效和预后
(1) 近期疗效:全组110例患者治疗结束后,疗效评价为CR 6例,PR 36例,SD 38例,PD 30例,客观缓解率(objective response rate,ORR)为38.2%(42/110),疾病控制率(disease control rate,DCR)为72.7%(80/110)。55例放疗联合免疫和化疗组患者中,CR 6例,PR 27例,SD 16例,PD 6例,ORR为60.0%(33/55),DCR为89.1%(49/55)。55例免疫联合化疗组患者中,PR 9例,SD 22例,PD 24例,ORR为16.4%(9/55),DCR为56.4%(31/55)。放疗联合免疫和化疗组患者的ORR和DCR均明显优于免疫联合化疗组,差异有统计学意义(χ2=22.18、14.85,P<0.001)。
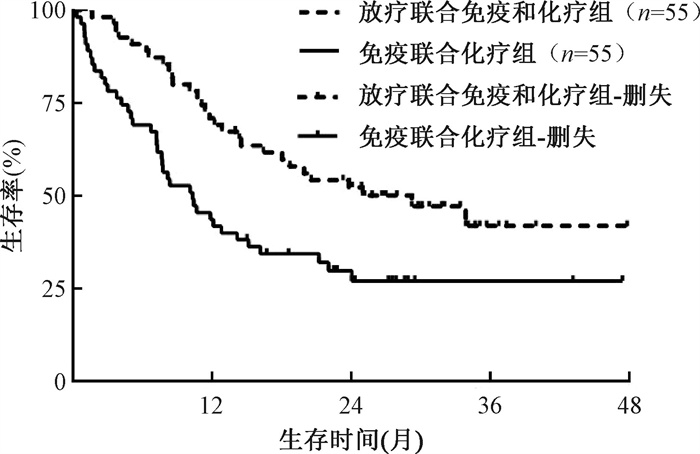
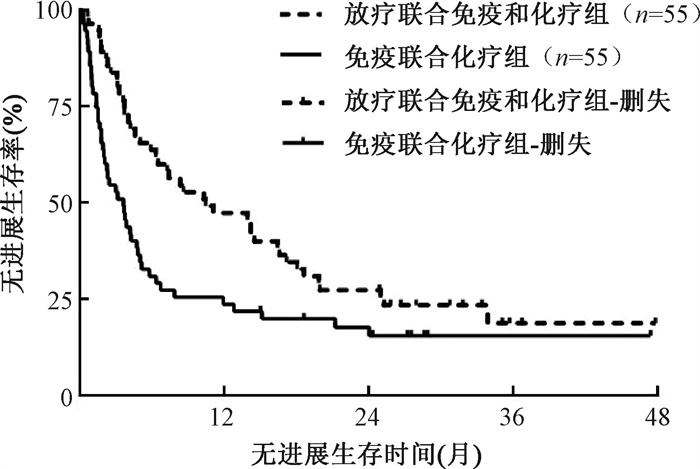
(2) 预后:全组110例患者的1、2、3年生存率分别为57.3%、41.8%和33.4%,1、2、3年无进展生存率分别为35.5%、22.4%和27.1%,中位OS和中位PFS分别为15.2(95%CI:8.3~22.0个月)和5.0(95%CI:3.1~7.0个月)。放疗联合免疫和化疗组患者的1、2、3年生存率分别为70.9%、52.3%和41.9%,免疫联合化疗组患者的1、2、3年生存率分别为43.6%、29.8%和27.1%,放疗联合免疫和化疗组患者的1、2、3年生存率明显优于免疫联合化疗组(χ2=8.95,P=0.003,图 3)。放疗联合免疫和化疗组患者的1、2、3年无进展生存率分别为47.3%、27.3%和18.7%,免疫联合化疗组患者的1、2、3年无进展生存率分别为23.6%、17.6%和15.4%,放疗联合免疫和化疗组患者的1、2、3年无进展生存率明显优于免疫联合化疗组(χ2=6.71,P=0.010,图 4)。
|
图 3 倾向评分匹配后放疗联合免疫和化疗组以及免疫联合化疗组非小细胞肺癌寡转移患者的生存曲线比较 Figure 3 Comparison of survival curves for oligometastatic NSCLC patients in both groups after PSM |
|
图 4 倾向评分匹配后放疗联合免疫和化疗组以及免疫联合化疗组非小细胞肺癌寡转移患者的无进展生存曲线比较 Figure 4 Comparison of PSF curves for oligometastatic NSCLC patients in both groups after PSM |
(3) 预后影响因素分析:将可能影响患者预后的因素如性别、年龄、ECOG评分、临床分期、BMI、病理类型、既往病史、治疗模式、免疫治疗周期数、化疗周期数以及治疗疗效等纳入Cox多因素回归模型进行分析,结果显示,临床分期、治疗模式、免疫治疗周期数和治疗疗效为影响患者OS的独立因素(P<0.05);治疗模式、免疫治疗周期数和治疗疗效为影响患者PFS的独立因素(P<0.05,表 2)。
|
|
表 2 PSM后影响NSCLC寡转移患者OS和PFS的Cox多因素回归分析 Table 2 Multivariate Cox regression analysis of factors affecting OS and PFS of oligometastatic NSCLC patients after PSM |
4. PSM后患者的治疗相关不良反应:由表 3可见,放疗联合免疫和化疗组以及免疫联合化疗组患者3级及以上肺炎的发生率分别为5.5%(3/55)和3.6%(2/55),3级及以上骨髓抑制的发生率分别为14.5%(8/55)和9.1%(5/55)。放疗联合免疫和化疗组与免疫联合化疗组≥2级骨髓抑制的发生率(分别为18.2%和12.7%)和≥2级肺炎的发生率(分别为21.8%和14.5%)的差异均无统计学意义(P>0.05)。全组患者4级不良反应为甲状腺功能减低和骨髓抑制,无5级不良反应出现。
|
|
表 3 PSM后不同治疗模式非小细胞肺癌寡转移患者治疗相关不良反应比较 [例(%)] Table 3 Comparison of treatment-related adverse reactions in oligometastatic NSCLC patients in both groups after PSM [n(%)] |
5. PSM后患者的治疗失败模式及后续治疗情况:截至末次随访日期,全组有63例(57.3%)患者出现PD,其中出现新病灶者18例(16.4%),原发部位进展者35例(31.8%),新病灶+原发部位进展者11例(10.0%)。放疗联合免疫和化疗组以及免疫联合化疗组患者出现PD者分别为29例(52.7%)和34例(61.8%),放疗联合免疫和化疗组患者PD后再次接受治疗者占82.8%(24/29),其中接受单纯ICIs治疗5例,单纯化疗4例,单纯放疗3例,接受免疫联合化疗6例,联合靶向药物治疗6例。免疫联合化疗组PD后再次接受治疗者占76.5%(26/34),其中接受单纯ICIs治疗5例,单纯化疗2例,单纯放疗2例,接受免疫联合化疗3例,放疗联合免疫和化疗3例,联合靶向药物治疗11例。
讨论近年研究显示,对于NSCLC寡转移患者,在积极的全身治疗基础上联合适当的局部治疗,能够显著改善患者的预后[9, 16]。局部治疗可有效降低肿瘤负荷、加速肿瘤细胞破坏、增加肿瘤免疫原性,提升免疫治疗效果,改善患者预后[17-18]。因此,放疗、手术或射频消融等局部治疗手段针对原发肿瘤或转移灶的干预,有助于提高患者的生存率。一项针对74例NSCLC寡转移患者的前瞻性随机对照研究结果显示,接受局部巩固性治疗(放疗或手术)的患者与观察组相比,PFS明显延长(分别为11.9和3.9个月),且未增加不良反应发生率,强调了局部治疗对NSCLC寡转移患者的重要性[10]。另一项基于34 887例Ⅳ期NSCLC患者的研究表明,联合放疗或射频消融者的OS优于单纯全身治疗(HR=0.95,P=0.002),且在低T分期和N分期的寡转移患者中,局部治疗的生存获益更加明显(HR=0.68,P<0.001)[9]。然而,对于非寡转移的NSCLC患者,局部治疗的临床证据仍较为有限,主要应用姑息治疗,改善生活质量。
ICIs已广泛应用于转移性NSCLC的一线治疗[19-20]。与单纯化疗相比,对于驱动基因阴性、转移性NSCLC患者,ICIs联合治疗在理论和临床实践上更具优势,这也促进了ICIs同步或序贯放疗在转移性NSCLC患者中的临床应用[21-22]。目前,免疫联合放疗一线治疗NSCLC寡转移的相关研究较为多见,且放疗技术多数为立体定向放疗(stereotactic radiotherapy,SRT)。Foster等[23]进行了一项基于国家癌症数据库的病例分析,共纳入了44 498例转移性NSCLC患者,其中13%接受了ICIs,46.8%接受了外照射(external beam radiotherapy,EBRT),4.7%接受了SRT。在接受ICIs的患者中,无放疗、EBRT和SRT患者的中位OS分别为14.5、10.9和18.2个月(P<0.001)。在SRT亚组中,ICIs患者的中位OS为18.2个月,高于化疗患者(14.3个月,P=0.004),且ICIs是影响OS的独立因素。此外,等效生物剂量>60 Gy的SRT更可能改善患者的OS(HR=0.79,P<0.001)。放疗联合免疫和化疗一线治疗NSCLC寡转移的相关研究较为少见。Ding等[24]报道了一项针对NSCLC寡转移的回顾性研究,放疗联合免疫和化疗组(65例)以及免疫联合化疗组(70例)患者的ORR分别为50.8%和40.0%,中位PFS分别为16.5和10.4个月(P=0.043),中位OS分别为未达到和21.0个月(P=0.030);且放疗是影响患者PFS和OS的预后因素,放疗并未显著增加患者不良反应的发生率。NRG-LU002研究[25]结果同样显示,局部治疗(放疗或手术)可以显著提高NSCLC寡转移患者的1、2年生存率和无进展生存率。Chen等[26]对231例NSCLC寡转移患者的回顾性分析显示,接受局部治疗联合帕博利珠单抗±化疗患者的中位PFS为14.0个月,中位OS为30.7个月;而非局部治疗组患者的中位PFS为10.1个月,中位OS为22.0个月,差异均有统计学意义(P=0.016和P=0.011)。本研究结果也显示,无论PSM前还是PSM后,放疗联合免疫和化疗组患者的中位OS和PFS均显示出延长优势,放疗并未显著增加不良反应,且治疗方式为影响患者PFS和OS的独立因素。
免疫联合治疗仍面临许多挑战,其中最佳免疫治疗周期数尚需进一步临床验证。ICIs通过激活免疫系统对肿瘤细胞产生作用[27],因此起效需要一定时间。ICIs具有拖尾效应,患者可能在治疗后持续获得稳定效果[28-29]。KEYNOTE-189和KEYNOTE-407研究表明,完成35个周期帕博利珠单抗治疗的患者,其ORR和3年生存率均显著提高[30-31]。CheckMate-017和CheckMate-057研究表明,接受纳武利尤单抗治疗患者的5年生存率持续获益,且大部分接受ICIs治疗的患者在第2年和第3年未出现PD,其5年生存率分别为12.3%和14.0%。第4年未发生PD患者的5年无进展生存率和5年生存率分别为87.5%和100%[32],本研究与之相似。本研究结果显示,免疫治疗周期数为PFS和OS的独立影响因素,且周期数≥5患者的预后较好。基于当前数据,ICIs的起效时间为2~4个周期,且多数患者在3个月(4个周期)后可通过影像学检查评估治疗效果[33-35]。因此,在临床真实世界中,建议患者的免疫治疗周期数≥5个。
在本研究中,放疗的加入并未显著增加≥2级骨髓抑制和≥2级肺炎的发生率,表明放疗联合免疫和化疗在NSCLC寡转移患者中是安全、可耐受的。
本研究存在局限性:首先为回顾性研究,尽管采用PSM分析,但选择偏倚不可避免;其次,因样本量限制,在PSM过程中未精细匹配转移部位和转移个数,可能会降低组间平衡性;再次,患者放疗方式不统一,可能影响结果的可靠性。同时,本研究未对化疗方案和ICIs使用进行统一要求,可能存在潜在偏倚。因此,未来需要进一步开展前瞻性、随机对照研究来验证本研究结果。
综上所述,放疗在免疫联合化疗一线治疗NSCLC寡转移患者中可有效优化局部和全身疾病控制,显著改善PFS和OS,且不增加治疗相关不良反应。未来临床试验应聚焦于识别最能从这一治疗模式中获益的患者特征,并进一步优化治疗时机和策略。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 张耀文、温晶媛负责研究设计、研究实施、论文撰写;汪晨宇、程欣宇、赵小涵负责数据收集、文献检索、数据分析;张贺铭、金琳芝、任润川负责数据收集;沈文斌负责论文修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Woodard GA, Jones KD, Jablons DM. Lung cancer staging and prognosis[J]. Cancer Treat Res, 2016, 170: 47-75. DOI:10.1007/978-3-319-40389-2_3 |
| [3] |
Román-Jobacho A, Hernández-Miguel M, García-Anaya MJ, et al. Oligometastatic non-small cell lung cancer: current management[J]. J Clin Transl Res, 2021, 7(3): 311-319. |
| [4] |
Shah M, Parmar A, Chan KKW. Socioeconomic disparity trends in diagnostic imaging, treatments, and survival for non-small cell lung cancer 2007-2016[J]. Cancer Med, 2020, 9(10): 3407-3416. DOI:10.1002/cam4.2978 |
| [5] |
Shiraishi Y, Kishimoto J, Sugawara S, et al. Atezolizumab and platinum plus pemetrexed with or without bevacizumab for metastatic nonsquamous non-small cell lung cancer: a phase 3 randomized clinical trial[J]. JAMA Oncol, 2024, 10(3): 315-324. DOI:10.1001/jamaoncol.2023.5258 |
| [6] |
Gadgeel S, Rodríguez-Abreu D, Speranza G, et al. Updated analysis from KEYNOTE-189: pembrolizumab or placebo plus pemetrexed and platinum for previously untreated metastatic nonsquamous non-small-cell lung cancer[J]. J Clin Oncol, 2020, 38(14): 1505-1517. DOI:10.1200/JCO.19.03136 |
| [7] |
Leonetti A, Perrone F, Puntoni M, et al. Real-world outcomes of Italian patients with advanced non-squamous lung cancer treated with first-line pembrolizumab plus platinum-pemetrexed[J]. Eur J Cancer, 2024, 202: 114006. DOI:10.1016/j.ejca.2024.114006 |
| [8] |
Ruiz-Bañobre J, Areses-Manrique MC, Mosquera-Martínez J, et al. Evaluation of the lung immune prognostic index in advanced non-small cell lung cancer patients under nivolumab monotherapy[J]. Transl Lung Cancer Res, 2019, 8(6): 1078-1085. DOI:10.21037/tlcr.2019.11.07 |
| [9] |
Uhlig J, Case MD, Blasberg JD, et al. Comparison of survival rates after a combination of local treatment and systemic therapy vs systemic therapy alone for treatment of stage Ⅳ non-small cell lung cancer[J]. JAMA Netw Open, 2019, 2(8): e199702. DOI:10.1001/jamanetworkopen.2019.9702 |
| [10] |
Gomez DR, Blumenschein GR Jr, Lee JJ, et al. Local consolidative therapy versus maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer without progression after first-line systemic therapy: a multicentre, randomised, controlled, phase 2 study[J]. Lancet Oncol, 2016, 17(12): 1672-1682. DOI:10.1016/S1470-2045(16)30532-0 |
| [11] |
Wang P, Yin T, Zhao K, et al. Efficacy of single-site radiotherapy plus PD-1 inhibitors vs PD-1 inhibitors for oligometastatic non-small cell lung cancer[J]. J Cancer Res Clin Oncol, 2022, 148(5): 1253-1261. DOI:10.1007/s00432-021-03849-3 |
| [12] |
Bauml JM, Mick R, Ciunci C, et al. Pembrolizumab after completion of locally ablative therapy for oligometastatic non-small cell lung cancer: a phase 2 trial[J]. JAMA Oncol, 2019, 5(9): 1283-1290. DOI:10.1001/jamaoncol.2019.1449 |
| [13] |
Amin MB, Greene FL, Edge SB, et al. The eighth edition AJCC cancer staging manual: continuing to build a bridge from a population-based to a more " personalized" approach to cancer staging[J]. CA Cancer J Clin, 2017, 67(2): 93-99. DOI:10.3322/caac.21388 |
| [14] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [15] |
National Cancer Institute, USA. Common terminology criteria for adverse events (CTCAE) version 5.0[EB/OL].[2017-11-27]. http://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm.
|
| [16] |
De Ruysscher D, Wanders R, Hendriks LE, et al. Progression-free survival and overall survival beyond 5 years of NSCLC patients with synchronous oligometastases treated in a prospective phase Ⅱ trial (NCT 01282450)[J]. J Thorac Oncol, 2018, 13(12): 1958-1961. DOI:10.1016/j.jtho.2018.07.098 |
| [17] |
Goldie JH, Coldman AJ. A mathematic model for relating the drug sensitivity of tumors to their spontaneous mutation rate[J]. Cancer Treat Rep, 1979, 63(11-12): 1727-1733. |
| [18] |
Meermeier EW, Welsh SJ, Sharik ME, et al. Tumor burden limits bispecific antibody efficacy through T cell exhaustion averted by concurrent cytotoxic therapy[J]. Blood Cancer Discov, 2021, 2(4): 354-369. DOI:10.1158/2643-3230.BCD-21-0038 |
| [19] |
Borghaei H, Gettinger S, Vokes EE, et al. Five-year outcomes from the randomized, phase Ⅲ trials CheckMate 017 and 057: nivolumab versus docetaxel in previously treated non-small-cell lung cancer[J]. J Clin Oncol, 2021, 39(7): 723-733. DOI:10.1200/JCO.20.01605 |
| [20] |
Shaverdian N, Lisberg AE, Bornazyan K, et al. Previous radiotherapy and the clinical activity and toxicity of pembrolizumab in the treatment of non-small-cell lung cancer: a secondary analysis of the KEYNOTE-001 phase 1 trial[J]. Lancet Oncol, 2017, 18(7): 895-903. DOI:10.1016/S1470-2045(17)30380-7 |
| [21] |
Dagar G, Gupta A, Shankar A, et al. The future of cancer treatment: combining radiotherapy with immunotherapy[J]. Front Mol Biosci, 2024, 11: 1409300. DOI:10.3389/fmolb.2024.1409300 |
| [22] |
Wu Y, Yi M, Niu M, et al. Beyond success: unveiling the hidden potential of radiotherapy and immunotherapy in solid tumors[J]. Cancer Commun (Lond), 2024, 44(7): 739-760. DOI:10.1002/cac2.12576 |
| [23] |
Foster CC, Sher DJ, Rusthoven CG, et al. Overall survival according to immunotherapy and radiation treatment for metastatic non-small-cell lung cancer: a National Cancer Database analysis[J]. Radiat Oncol, 2019, 14(1): 18. DOI:10.1186/s13014-019-1222-3 |
| [24] |
Ding P, Huang Y, Tong F, et al. First-line PD-1 inhibitors immunotherapy and chemotherapy combined with or without radiotherapy for patients with advanced non-small cell lung cancer[J]. J Clin Oncol, 2022, 40(16_suppl): 2606. DOI:10.1200/JCO.2022.40.16_suppl.2606 |
| [25] |
Puneeth I, Chen H, Daniel RG, et al. NRG-LU002: randomized phase Ⅱ/Ⅲ trial of maintenance systemic therapy versus local consolidative therapy (LCT) plus maintenance systemic therapy for limited metastatic non-small cell lung cancer (NSCLC)[J]. J Clin Oncol, 2024, 42(16_suppl): 8506. DOI:10.1200/JCO.2024.42.16_suppl.8506 |
| [26] |
Chen Y, Wang Y, Yang Z, et al. Local consolidative therapy for synchronous oligometastatic non-small cell lung cancer treated with first-line pembrolizumab: a retrospective observational study[J]. Thorac Cancer, 2022, 13(5): 732-741. DOI:10.1111/1759-7714.14312 |
| [27] |
Ghahremanloo A, Soltani A, Modaresi S, et al. Recent advances in the clinical development of immune checkpoint blockade therapy[J]. Cell Oncol (Dordr), 2019, 42(5): 609-626. DOI:10.1007/s13402-019-00456-w |
| [28] |
Gray JE, Villegas A, Daniel D, et al. Three-year overall survival with durvalumab after chemoradiotherapy in stage Ⅲ NSCLC-update from PACIFIC[J]. J Thorac Oncol, 2020, 15(2): 288-293. DOI:10.1016/j.jtho.2019.10.002 |
| [29] |
Waterhouse DM, Garon EB, Chandler J, et al. Continuous versus 1-year fixed-duration nivolumab in previously treated advanced non-small-cell lung cancer: CheckMate 153[J]. J Clin Oncol, 2020, 38(33): 3863-3873. DOI:10.1200/JCO.20.00131 |
| [30] |
Novello S, Kowalski DM, Luft A, et al. Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer: 5-year update of the phase Ⅲ KEYNOTE-407 study[J]. J Clin Oncol, 2023, 41(11): 1999-2006. DOI:10.1200/JCO.22.01990 |
| [31] |
Garassino MC, Gadgeel S, Speranza G, et al. Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the phase 3 KEYNOTE-189 study[J]. J Clin Oncol, 2023, 41(11): 1992-1998. DOI:10.1200/JCO.22.01989 |
| [32] |
Borghaei H, Gettinger S, Vokes EE, et al. Five-year outcomes from the randomized, phase Ⅲtrials CheckMate 017 and 057: nivolumab versus docetaxel in previously treated non-small-cell lung cancer[J]. J Clin Oncol, 2021, 39(7): 723-733. DOI:10.1200/JCO.20.01605 |
| [33] |
Wang DR, Wu XL, Sun YL. Therapeutic targets and biomarkers of tumor immunotherapy: response versus non-response[J]. Signal Transduct Target Ther, 2022, 7(1): 331. DOI:10.1038/s41392-022-01136-2 |
| [34] |
Spigel DR, Faivre-Finn C, Gray JE, et al. Five-year survival outcomes from the PACIFIC trial: durvalumab after chemoradiotherapy in stage Ⅲ non-small-cell lung cancer[J]. J Clin Oncol, 2022, 40(12): 1301-1311. DOI:10.1200/JCO.21.01308 |
| [35] |
Pichert MD, Canavan ME, Maduka RC, et al. Immunotherapy after chemotherapy and radiation for clinical stage Ⅲ lung cancer[J]. JAMA Netw Open, 2022, 5(8): e2224478. DOI:10.1001/jamanetworkopen.2022.24478 |
 2025, Vol. 45
2025, Vol. 45


