颅内多发转移瘤是最常见的颅内恶性肿瘤,原发肿瘤多为肺癌、乳腺癌或黑色素瘤等[1]。越来越多的文献证实,放疗是颅内多发转移瘤患者的标准治疗方案之一[2-4]。由于颅内多发转移瘤的数量、大小、位置等因素造成计划设计方法、投照技术、评估标准均有所不同,每个环节中微小的偏差都有可能导致疗效欠佳或不良反应增加等风险。即便在美国医学物理师协会(American Association of Physicists in Medicine,AAPM)发布的MPPG9.a号报告[5]中阐述了关于立体定向放射治疗(stereotactic radiotherapy, SRT)实施的建议,但也仅是较为一般性的讨论,如果能够采取一套标准化的测试例来检验和评估该技术的实施能力,那对于这项技术在各个单位的落地将大有裨益。Culcasi等[6]首先提出SRT专用测试例的概念,但其所使用的多发转移瘤的测试例只有一个包含5个病灶的病例,而临床患者的肿瘤通常为2~10个不等,且位置、大小、形状、与周围危及器官的距离各异,难以尽可能多地模拟临床场景。因此,本研究参考脑转移瘤SRT临床指南[7],根据脑转移瘤常发生的位置、大小和形态,拟提出一组更具临床特点的颅内多发转移瘤SRT计划测试例,用于评估SRT计划质量、机器执行能力,辅助各中心进行临床应用。
资料与方法 1、设备与软件治疗机器为美国瓦里安TrueBeam医用电子直线加速器,射线为6 MV无均整(flattening filter free, FFF)光子束,剂量率为1 400 MU/min。本研究采用Varian Eclipse 15.6治疗计划系统(treatment planning system, TPS)设计所有患者的SRT计划与验证计划。
用于SRT计划的是由美国SunNuclear公司生产的STEEV模体[8-9],其尺寸和结构均接近普通男性的头部,内部具有完整的三维仿真解剖结构,如:头骨、大脑、椎体、喉部、气管、鼻窦、鼻腔和口腔等。设计SRT计划前,需要使用美国通用公司的Revolution CT模拟机扫描STEEV模体,扫描管电压为120 kVp,层厚1 mm,之后将CT图像传输至TPS。
验证计划分为点剂量验证计划与平面剂量验证计划。用于点剂量验证的是由美国SunNuclear公司生产的StereoPhan(SP)模体和德国PTW公司生产的31010电离室(灵敏体积为0.125 cm3)。用于平面剂量(portal dosimetry, PD)验证[10]的是美国瓦里安公司的电子射野影像系统(electronic portal imaging device, EPID)和TPS中的Portal Dosimetry模块;用于半导体矩阵(SRS MapCHECK, SMC)验证[11-12]的是美国SunNuclear公司的SMC半导体矩阵和SNC Patient软件。
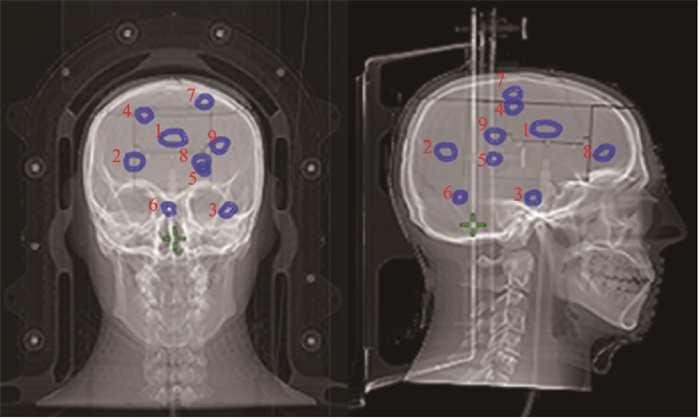
2、测试例数据(1) 3靶区测试例:该测试例中的靶区共3个,分别位于离轴0.05、3.30和4.52 cm处,体积分别为3.98、2.15和0.97 cm3(图 1,表 1)。
|
注:蓝色部分为脑转移瘤;红色数字为对应靶区标号 图 1 靶区测试例脑转移瘤分布示意图 Figure 1 Schematic diagram showing brain metastasis distribution in the target volumes in the test cases |
|
|
表 1 脑转移瘤位置与尺寸信息 Table 1 Information about brain metastasis locations and sizes |
(2) 6靶区测试例:该测试例中的靶区共6个,1~3与3靶区测试例中的完全一致,4~6分别位于离轴2.46、2.45和0.39 cm处,体积分别为1.1、0.65和0.62 cm3(图 1,表 1)。
(3) 9靶区测试例:该测试例中的靶区共9个,其中靶区1~6与6靶区测试例中的完全一致,靶区7~9分别位于离轴2.56、2.30和3.82 cm处,体积分别为1.15、1.51和1.48 cm3(图 1,表 1)。
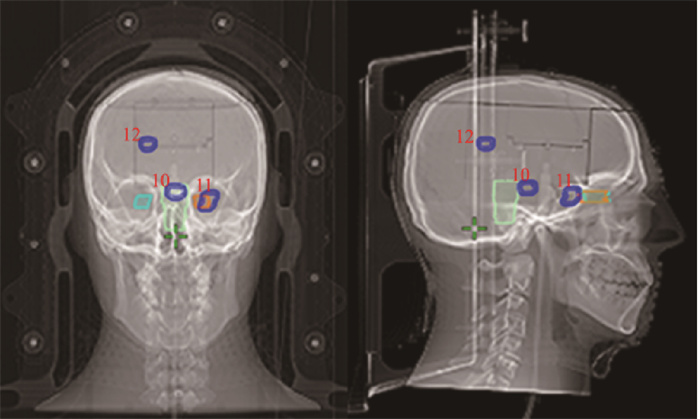
(4) 危及器官(organ at risk, OAR)测试例:该测试例中的靶区共3个,靶区10紧邻脑干,离轴距离为0.03 cm,体积为1.77 cm3;靶区11紧邻左侧视神经,离轴距离2.72 cm,体积1.88 cm3;靶区12离轴2.25 cm,体积1.17 cm3(图 2,表 1)。
|
注:蓝色部分为脑转移瘤; 红色数字为对应靶区标号; 浅绿色部分为脑干; 黄色和青色均为视神经;OAR. 危及器官 图 2 OAR测试例脑转移瘤分布示意图 Figure 2 Schematic diagram showing the brain metastasis distribution in OARs in the test cases |
3、计划设计及优化
所有测试例的SRT计划的处方剂量为30 Gy,要求至少包绕98%的靶区体积,分割次数为5次。计划设计方法采用美国瓦里安公司的超弧刀HyperArc技术。该技术为单中心非共面的容积旋转调强(volumetric modulated arc therapy,VMAT)技术,可以依照TPS向导根据脑转移瘤的分布选择射野,并调整治疗中心,自动优化准直器角度[13]。由于SRT计划剂量跌落快且脑转移瘤体积一般较小,需要将靶区转化为高精度结构,并将光子优化算法和AAA外照射剂量算法的网格设为1.25 mm。计划优化时,所有靶区同步优化,正常组织目标(normal tissue objective,NTO)采用SRS-NTO,同时设置3个剂量限值环,由靶区外扩2、5和8 mm形成,优化限值分别处方剂量的90%、70%和50%。SRT计划的评估参数有适形度指数(conformity index, CI)、梯度指数(gradient index, GI)、均匀性指数(homogeneityindex, HI)以及正常脑组织受量即脑PTV被24 Gy的剂量线包裹的体积(V24 Gy)[14]。
(1) 验证计划的设计与实施:在TPS中,为所有测试例的SRT计划建立PD验证计划,采取实际机架、准直器和床的旋转角度,在TrueBeam医用电子直线加速器上执行时,使用EPID收集测量数据,之后在TPS中的Potal Dosimetry模块进行γ分析。使用SP模体与SMC半导体矩阵建立点剂量与平面剂量验证模型的过程与孟祥银等[15]研究中的过程相同。
(2)点剂量和平面剂量偏差的分析方法:点剂量偏差EPoint的计算公式如下:
| $ E_{\text {Point }}=\left|\frac{D_{\text {Mea }}}{D_{T P S}}-1\right| \times 100 $ | (1) |
式中,DMea为使用SP模体与电离室实际测量得到的点剂量;DTPS为TPS计算给出的理论点剂量。
平面剂量的偏差采用γ分析方法[16],在通用剂量阈值10%的条件下,使用2 mm/2%和1 mm/2%的评价标准,计算基于绝对剂量模式下的全局剂量归一的γ通过率,计算公式如下:
| $ \begin{gathered} \Gamma\left(r_M, r_R\right)= \\ \sqrt{\frac{\left(r_M-r_R\right)^2}{\Delta r^2}+\frac{\left[D_M\left(r_M\right)-D_R\left(r_R\right)\right]^2}{\Delta D^2}} \end{gathered} $ | (2) |
式中,DM(rM)和DR(rR)分别为测量点rM和参考点rR处的剂量相对参考分布最大剂量的归一值;Δr和ΔD分别是γ分析的距离和剂量标准。每个测量点rM对应参考分布上符合要求的所有rR,都存在一个γ值,其中最小的为该测量点rM的γ指数,γ指数≤1代表通过,γ指数通过的测量点数目与总测量点数目的百分比值即为γ通过率。
结果 1、计划设计结果不同SRT测试例计划的剂量学评估数据如表 2所示,平均CI、GI、HI与脑-PTV的V24 Gy分别为(1.04±0.03)、(3.79±0.40)、(0.73±0.01)和(7.46±3.80)cm3。
|
|
表 2 不同SRT测试例计划剂量学评估参数 Table 2 Dosimetric assessment parameters for the four groups of test cases for SRT plans |
2、点剂量偏差
所有SRT测试例计划中靶区的点剂量偏差详细数据如表 3所示,其中3靶区测试例的平均点剂量偏差为0.88%±0.98%,6靶区测试例的平均偏差为1.47%±0.79%,9靶区测试例的平均偏差为1.52%±0.76%,邻近危及器官测试例的平均偏差为1.17%±0.38%,所有靶区的点剂量偏差都 < 3%。
|
|
表 3 不同SRT计划测试例点剂量偏差 Table 3 Deviations of point doses of the four groups of test cases for SRT plans |
3、PD γ通过率
不同SRT测试例计划的PD γ分析结果如表 4所示,包括4个单野。基于单个测试例的维度评估,在2 mm/2%的标准下,PD单野通过率平均值均>98%;在1 mm/2%的标准下,PD单野通过率均>96%。
|
|
表 4 不同SRT测试例计划的PD γ通过率(%) Table 4 γ passing rates of PDs for the four groups of test cases for SRT plans (%) |
4、SMC γ通过率
不同SRT测试例计划的SMC γ分析结果列于表 5。在2 mm/2%的标准下的平均值为99.33%±0.62%,在1 mm/2%的标准下为97.75%±2.31%。SNC Patient也会给出中心点以及归一点等绝对剂量结果。
|
|
表 5 不同SRT测试例计划的SMC半导体矩阵平面剂量γ通过率 Table 5 γ pass rate of SMC semiconductor matrix planar doses for the four groups of test cases for SRT |
讨论
颅内多发转移瘤的立体定向放射治疗技术能够兼顾肿瘤局部控制率与有效的认知功能保护,但该技术包含患者定位、计划设计与计划验证等众多复杂环节,需要有专用的测试例和标准的测试方法评估计划能力与机器执行能力。因此,本研究首先根据颅内多发转移瘤的临床特点与治疗经验设计了4个测试例,分别是3、6、9靶区和OAR靶区的测试例,并分别设计了SRT计划、点剂量与平面剂量验证计划,最后实际测量得到剂量偏差,并最终以此评估本中心开展该技术的计划能力与机器执行能力。
SRT计划方面,4个测试例的RTOG CI的平均值为1.04±0.03,表明处方剂量能完全覆盖靶区,但唯独邻近OAR测试例的CI为1.00,这是因为靶区紧邻脑干和视神经,剂量限值严格,处方量不能溢出PTV外,否则将导致OAR剂量超出限值。GI指数代表剂量的跌落速度,一般>2,数值越小代表靶区外的剂量跌落越快[17]。尽管Aiyama等[18]在单发脑转移的回顾性研究中提到GI值并不影响发生并发症的概率,但从物理的角度出发,靶区外剂量跌落速度越快,正常组织的受量越少,因此仍然推荐通过计划优化尽可能降低GI指数。由于4个测试例中脑转移瘤靶区体积均较小,平均体积仅有(1.53±0.86)cm3,且计划采用非共面照射的方式,很容易达到高剂量梯度的要求。HI指数能够表征剂量分布的均匀程度,但SRT计划的剂量分布高度不均匀,因此在计划评估中并无显著贡献,本研究仅用该指数评估计划内的最大剂量。国家癌症中心在指南中提到SRT计划的最大剂量可以>120%,且当最大剂量达到140%~160%时,剂量梯度最优[19]。为兼顾安全性,本研究中4个测试例的最大剂量均处于140%左右。正常脑组织的受量通过脑-PTV的V24 Gy评估。Minniti等[20]与Reynolds等[21]指出V24 Gy与放射性脑坏死的发生有关,并推荐 < 16.8 cm3,4个测试例计划均符合要求,随着靶区总体积的增大,脑-PTV的V24 Gy也在增大。
关于点剂量验证,所有靶区的点剂量偏差都在3%以内,符合TG\|218号报告[22]对于SRT计划验证的要求。随着靶区的体积变大,点剂量偏差有减小的趋势,认为这与建立验证计划时的电离室位置和被测量靶区体积有关,由于SRT的剂量跌落极快,要在靶区内找到剂量梯度相对平坦的区域较困难,靶区体积越小,电离室内的剂量梯度越大,受到体积平均效应的影响越显著。因此,本研究推荐在建立验证计划时尽可能地将电离室剂量浮动范围控制在10%以内,否则点剂量偏差结果有可能会超出3%的阈值。由于每个靶区的点剂量验证时长都在20 min左右,本研究并未进行重复测试,无法进行更深入的不确定度分析。
平面剂量验证方面,本研究的PD和SMC半导体矩阵平面剂量验证,均采用了1 mm/2%和2 mm/2%的γ分析标准,通过率均>95%。PD验证包含单野与合成野的数据,但由TG\|218号报告中对于合成野的描述可知,对于VMAT计划而言,合成野可能会忽略投照过程中剂量率变化和机架转速变化等因素,并且其验证结果还受到不同单野的剂量叠加和模糊效应的影响,因此在PD验证中,仅记录了单野的验证结果,并未使用合成野的结果。关于SMC半导体矩阵验证,其结果不仅有γ通过率,还有平面中心点和归一点的绝对剂量。本研究认为该绝对剂量结果可以用于参考,并不能代替电离室进行点剂量测量。结合以上两种平面剂量验证方式的结果,并参考Xia等[23]的研究,推荐在进行SRT的平面剂量验证时,γ分析使用1 mm/2%的标准。
综上所述,本研究提出的颅内多发转移瘤立体定向放疗计划质保测试例可以有效地评估该技术的计划质量与机器执行能力,辅助各中心进行临床应用,以促进产出最佳的实践方案。
利益冲突 无
作者贡献声明 孟祥银撰写论文;于浪、李文博、汪之群、连欣参与实验设计;王嘉欣、孙显松、冷凌萱参与数据采集与分析;杨波、邱杰修改论文
| [1] |
Vogelbaum MA, Brown PD, Messersmith H, et al. Treatment for brain metastases: ASCO-SNO-ASTRO Guideline[J]. J Clin Oncol, 2022, 40(5): 492-516. DOI:10.1200/JCO.21.02314 |
| [2] |
Benedict SH, Yenice KM, Followill D, et al. Stereotactic body radiation therapy: the report of AAPM Task Group 101[J]. Med Phys, 2010, 37(8): 4078-4101. DOI:10.1118/1.3438081 |
| [3] |
Niranjan A, Monaco E, Flickinger J, et al. Guidelines for multiple brain metastases radiosurgery[J]. Prog Neurol Surg, 2019, 34: 100-109. DOI:10.1159/000493055 |
| [4] |
Hartgerink D, Swinnen A, Roberge D, et al. LINAC based stereotactic radiosurgery for multiple brain metastases: guidance for clinical implementation[J]. Acta Oncol, 2019, 58(9): 1275-1282. DOI:10.1080/0284186X.2019.1633016 |
| [5] |
Halvorsen PH, Cirino E, Das IJ, et al. AAPM-RSS medical physics practice guideline 9.a. for SRS-SBRT[J]. J Appl Clin Med Phys, 2017, 18(5): 10-21. DOI:10.1002/acm2.12146 |
| [6] |
Culcasi R, Baran G, Dominello M, et al. Stereotactic radiosurgery commissioning and QA test cases-A TG-119 approach for stereotactic radiosurgery[J]. Med Phys, 2021, 48(12): 7568-7579. DOI:10.1002/mp.15087 |
| [7] |
中国医师协会放射肿瘤治疗医师分会. 脑转移瘤立体定向放射治疗临床指南[J]. 国际肿瘤学杂志, 2021, 48(8): 456-462. Radiation Oncology Physicians Branch of the Chinese Medical Doctors'Association. Clinical guidelines for stereotactic radiotherapy of brain metastases[J]. J Int Oncol, 2021, 48(8): 456-462. DOI:10.3760/cma.j.cn371439-20210520-00088.cma.j.cn371439-20210520-00088 |
| [8] |
Dimitriadis A, Palmer AL, Thomas R, et al. Adaptation and validation of a commercial head phantom for cranial radiosurgery dosimetry end-to-end audit[J]. Br J Radiol, 2017, 90(1074): 20170053. DOI:10.1259/bjr.20170053 |
| [9] |
Dimitriadis A, Tsang Y, Thomas R, et al. Multi-institutional dosimetric delivery assessment of intracranial stereotactic radiosurgery on different treatment platforms[J]. Radiother Oncol, 2020, 147: 153-161. DOI:10.1016/j.radonc.2020.05.024 |
| [10] |
魏夏平, 董彦鑫, 苏洁洪, 等. 脑转移瘤HyperArc放射治疗技术的两种计划验证方法比较[J]. 医疗装备, 2022, 35(18): 1-5. Wei XP, Dong YX, Su JH, et al. Comparison of two plan verification methods of brain metastases HyperArc radiotherapy technology[J]. Med Equip, 2022, 35(18): 1-5. DOI:10.3969/j.issn.1002-2376.2022.18.001 |
| [11] |
Popple RA, Sullivan RJ, Yuan Y, et al. Evaluation of a two-dimensional diode array for patient-specific quality assurance of HyperArc[J]. J Appl Clin Med Phys, 2021, 22(12): 203-210. DOI:10.1002/acm2.13438 |
| [12] |
Ahmed S, Zhang G, Moros EG, et al. Comprehensive evaluation of the high-resolution diode array for SRS dosimetry[J]. J Appl Clin Med Phys, 2019, 20(10): 13-23. DOI:10.1002/acm2.12696 |
| [13] |
Ohira S, Sagawa T, Ueda Y, et al. Effect of collimator angle on HyperArc stereotactic radiosurgery planning for single and multiple brain metastases[J]. Med Dosim, 2020, 45(1): 85-91. DOI:10.1016/j.meddos.2019.07.004 |
| [14] |
杨波, 于浪, 汪之群, 等. HyperArc与VMAT技术脑转移瘤应用比较[J]. 中华放射肿瘤学杂志, 2021, 30(9): 876-881. Yang B, Yu L, Wang ZQ, et al. Comparison between HyperArc and conventional VMAT approach for brain metastases[J]. Chin J Radiat Oncol, 2021, 30(9): 876-881. DOI:10.3760/cma.j.cn113030-20201031-00523 |
| [15] |
孟祥银, 杨波, 祝起禛, 等. 立体定向放疗计划验证模体在脑转移瘤HyperArc技术中的应用研究[J]. 中华放射医学与防护杂志, 2023, 43(12): 991-996. Meng XY, Yang B, Zhu QZ, et al. Application of stereotactic body radiotherapy planning verification phantom in HyperArc technique for brain metastases[J]. Chin J Radiol Med Prot, 2023, 43(12): 991-996. DOI:10.3760/cma.j.cn112271-20230317-00082 |
| [16] |
杨晶, 梁志文, 刘洪源, 等. SRS MapCHECK半导体矩阵探测器的校准及临床计划质量保证应用估[J]. 中国医学装备, 2020, 17(6): 29-33. Yang J, Liang ZW, Liu HY, et al. Calibration and assessment of the SRS MapCHECK diode matrix detector and the application of clinical treatment plan QA[J]. China Med Equip, 2020, 17(6): 29-33. DOI:10.3969/ISSN.1672-8270.2020.06.009 |
| [17] |
Muhammad A, Khan H, Furqan S, et al. Stereotactic radiotherapy: an educational narrative review[J]. Pre Radiat Oncol, 2024, 8(1): 47-58. DOI:10.1002/pro6.1222 |
| [18] |
Aiyama H, Yamamoto M, Kawabe T, et al. Clinical significance of conformity index and gradient index in patients undergoing stereotactic radiosurgery for a single metastatic tumor[J]. J Neurosurg, 2018, 129(Suppl 1): 103-110. DOI:10.3171/2018.6.GKS181314 |
| [19] |
国家癌症中心/国家肿瘤质控中心. 基于电子直线加速器的肿瘤立体定向放射治疗物理实践指南[J]. 中华放射肿瘤学杂志, 2022, 31(6): 493-512. National Cancer Center/National Cancer Quality Control Center. Medical physics practice guidelines for Linac-based stereotactic radiotherapy[J]. Chin J Radiat Oncol, 2022, 31(6): 493-512. DOI:10.3760/cma.j.cn113030-20220107-00010 |
| [20] |
Minniti G, Esposito V, Clarke E, et al. Multidose stereotactic radiosurgery (9 Gy×3) of the postoperative resection cavity for treatment of large brain metastases[J]. Int J Radiat Oncol Biol Phys, 2013, 86(4): 623-629. DOI:10.1016/j.ijrobp.2013.03.037 |
| [21] |
Reynolds TA, Jensen AR, Bellairs EE, et al. Dose gradient index for stereotactic radiosurgery/radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2020, 106(3): 604-611. DOI:10.1016/j.ijrobp.2019.11.408 |
| [22] |
Miften M, Olch A, Mihailidis D, et al. Tolerance limits and methodologies for IMRT measurement-based verification QA: recommendations of AAPM Task Group No. 218[J]. Med Phys, 2018, 45(4): e53-e83. DOI:10.1002/mp.12810 |
| [23] |
Xia Y, Adamson J, Zlateva Y, et al. Application of TG-218 action limits to SRS and SBRT pre-treatment patient specific QA[J]. J Radiosurg SBRT, 2020, 7(2): 135-147. |
 2025, Vol. 45
2025, Vol. 45


