2. 安徽省肿瘤医院放疗科, 合肥 230031
2. Department of Radiation Oncology, Anhui Provincial Cancer Hospital, Hefei 230031, China
我国乳腺癌发病率居女性恶性肿瘤发病谱首位,其新发病例数占全球该癌种发病总数的18.4%[1-2]。随着民众健康意识提升及乳腺癌筛查工作普及,早期乳腺癌诊断率明显提高[3]。保乳手术联合全乳及瘤床加量放疗被认为是早期乳腺癌的标准治疗方案[4-6],放疗作为保乳治疗中不可或缺的重要环节,能降低保乳术后患者75%的局部复发[7-9]。精准放疗的前提是患者精确摆位,而保乳患者在传统的定摆位方式下,其摆位易受乳腺特殊形态、呼吸运动、手臂姿态、体重变化等多种因素影响,使得临床保乳患者放疗摆位效率低、摆位精度不足等问题凸显。
光学体表监测系统(optical surface monitoring system, OSMS)是近年来临床快速推广的3D光学表面定位及追踪技术,具有无创、零辐射且实时反馈的技术优势,可连续获取患者体表信息以辅助分次间6个自由度、亚毫米级放疗摆位及分次内运动的实时监督。现有临床研究多关注OSMS在不同部位肿瘤的放疗摆位的可行性,患者体表状态(颜色、弹性等)、软件设置参数等因素对其监测精度的影响[10-11],而鲜有研究分析光学表面图像引导放疗技术(surface-guided radiation therapy, SGRT)下,患者个体化胸廓特征对其摆位精度的影响。因此,本研究拟基于SGRT技术,探索乳腺癌保乳术后放疗患者摆位新策略,并与传统标记线摆位方式对比,分析其对摆位精度及靶区外扩的改进效果,给出患者个体化胸廓特征参数定义,分析其与SGRT摆位偏差的相关性,进而为保乳术后放疗患者精确摆位提供参考依据。
资料与方法 1、临床资料回顾性选取2022年7月至2023年9月在中国科学技术大学附属第一医院放射治疗室接受放疗的60例保乳术后的女性乳腺癌患者病例资料,中位年龄46岁(22~69岁),体质量指数(body mass index, BMI)中位值为23.83(16.63~33.06)kg/m2,其中左侧乳腺患者34例,右侧乳腺患者26例。根据定位方式,将患者均分为传统十字线摆位组(标记线组)和体表光学引导摆位组(SGRT组),每组30例,两组患者年龄、BMI及肿瘤位置差异均无统计学意义(P>0.05)。
2、体位固定与模拟定位患者仰卧平躺于R612型多功能体位固定板(广州科莱瑞迪公司),上肢外展上举置于肘托、臂托上,在患者舒适状态下调整乳腺托架参数并记录。①标记线组:将加热后的热塑颈胸定位膜均匀覆盖在患者体表后两侧予以固定;CT定位标记点的头脚方向置于乳头平均处,水平方向以腋前线为准,左右方向定于锁骨中线,在定位膜上标记“十字”线。②SGRT组:患者头部枕于头枕上,双眼正视天花板,下颌上抬,暴露颈部区域,将加热后的U型面罩覆盖患者面部并固定在多功能体架上;让患者平静呼吸,CT定位标记点的头脚方向置于乳头平均处,水平方向以腋前线为准,左右方向定于锁骨中线,在患者上标记“十字”线。
患者均在自由呼吸状态下行CT定位扫描(Discovery CT 590,美国GE公司),扫描选用参数及重建层厚一致(120 kV,150 mAs,2.5 mm)。将扫描后的图像传至计划系统(Pinnacle,荷兰飞利浦公司)进行靶区勾画和计划设计,计划通过后传至应用直线加速器(Versa HD,瑞典Elekta公司),将RT plan和患者体表轮廓传至OSMS系统(Align RT, Version RT Ltd,英国)。
3、放疗前摆位及位置验证标记线组和SGRT组患者的摆位及靶区位置验证流程如下。①标记线组:患者平躺在定位一体架,双臂对称外展上举置于手臂托架后,调整体位限度辅助装置至指定位置;将颈胸定位膜覆盖患者体表进行体位固定,使定位膜上标注的标记线与激光灯一致。②SGRT组:患者摆位前,将放疗计划RT plan和患者体表轮廓导入OSMS系统,并在系统中勾画图像配准的感兴趣区(region of interest, ROI),ROI为厂家推荐的倒T形加部分患侧乳腺,见图 1;患者平静呼吸平躺于定位一体架,利用U型面罩固定患者头颈部位置,使患者体表标记线与激光线一致完成预摆位;再通过AlignRT软件提示的旋转和平移误差调整患者体位,修正阈值为3°/3 mm。
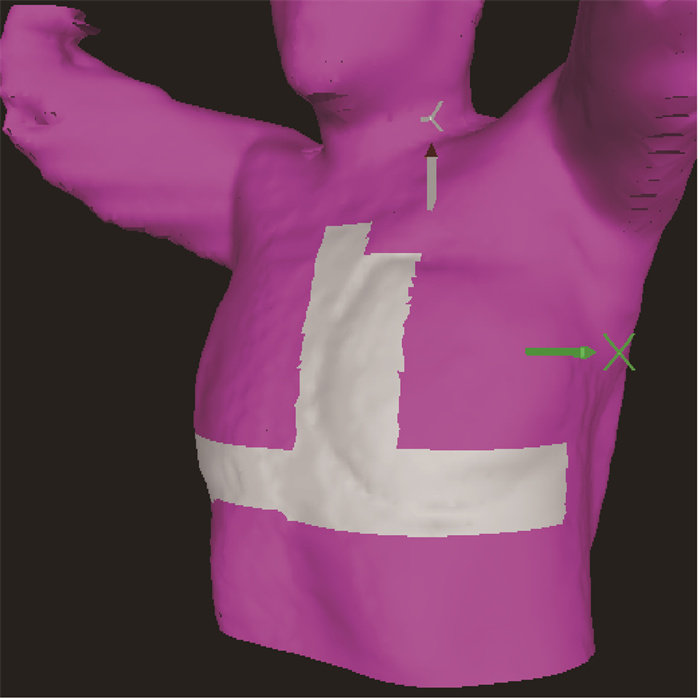
|
图 1 SGRT组保乳术后患者感兴趣区勾画示意 Figure 1 Region of interest of breast-conserving radiotherapy patients in SGRT group |
两组患者均使用加速器自带XVI成像系统(Versa HD)进行锥形束CT(cone beam computed tomography, CBCT)扫描,扫描参数设置为管电压120 kV,管电流600 mA,扫描角度360°,准直器M20,滤线器F1,重建层厚3 mm,视场角(field of view, FOV)42.6 cm。配准范围包括患侧胸壁区域及锁骨上下淋巴结区域以内的PTV靶区。考虑到乳腺是软组织,将扫描图像与定位图像首先按灰度值进行自动配准,再以匹配区域内乳腺靶区轮廓重合度为标准进行手动微调。医生、物理师确认后记录三维方向摆位误差,所有患者CBCT频次为第1周前3次和后期治疗每周1次。
4、外扩边界及患者胸廓参数根据van Herk等[12]外放边界公式MPTV=2.5Σ+0.7σ,计算保乳术后乳腺癌放疗靶区PTV外扩边界。式中,Σ为系统误差标准差,σ为随机误差标准差,系统误差为每个患者在整个治疗过程中摆位误差的均值,随机误差为每个患者每次摆位误差减去该患者系统误差。本研究选择在保乳放疗患者的支气管分叉层面,定义了多组患者胸廓特征参数[13-14],如图 2所示,其中,W和H分别为胸廓横轴和纵轴长度,患侧及健侧切线长度、夹角、乳腺高度分别为WH1、WH2;α1、α2;D1、D2。
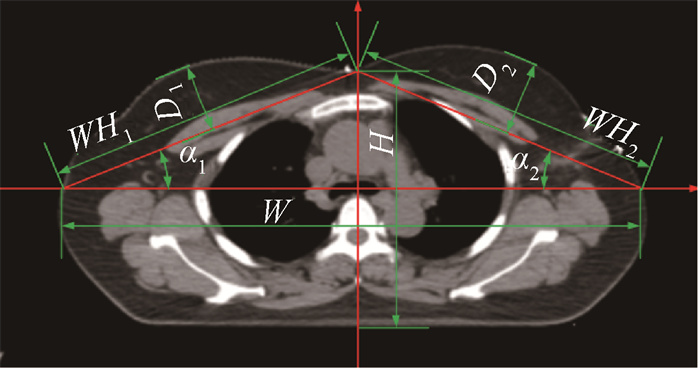
|
图 2 右侧保乳放疗患者胸廓特征参数定义 Figure 2 Definition of right-sided breast-conserving radiotherapy patient′s thoracic characteristic parameters |
5、统计学处理
使用SPSS 26.0进行数据统计分析。对于两种摆位方式下患者三维方向摆位误差(左右方向Δx、头脚方向Δy、前后方向Δz)及空间总位移(
图 3展示了标记线组和SGRT组各30例患者在三维方向摆位误差和总位移分布情况。每个箱式图中心线代表中位数误差,这表明SGRT组的中位数摆位误差低于标记线组。箱式图箱体所示的四分位数范围对于SGRT组更窄,同时异常值较少,这说明SGRT组具有更好的摆位稳定性和准确性。在首次放疗前CBCT影像验证中,标记线组和SGRT组的三维摆位误差均值分别在0.5和0.2 cm以内,两组Δx、Δy、Δz及总位移D差异具有统计学意义(z=-2.93、-3.21、-2.59、-4.76,P < 0.05),见表 1。
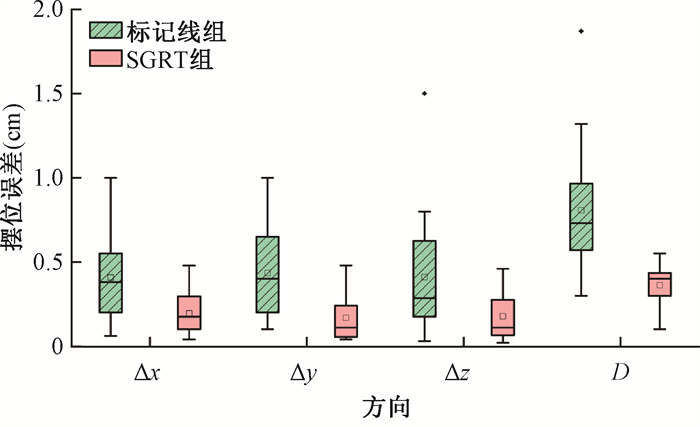
|
注:SGRT组为体表光学引导放疗摆位组;Δx、Δy、Δz、D为左右、头脚、前后方向误差及空间总位移 图 3 两组保乳放疗患者的摆位误差箱式图 Figure 3 Box plot of setup errors for two groups of breast-conserving radiotherapy patients |
|
|
表 1 两组保乳放疗患者的摆位误差对比(cm) Table 1 Comparison of set-up errors between marker line and SGRT groups in two groups of breast-conserving radiotherapy patients(cm) |
2、靶区外扩范围
结合CBCT扫描数据,根据靶区外放边界公式,表 2给出了标记线组和SGRT组三维方向上的靶区外扩边界。标记线组、SGRT组在三维方向上靶区外扩边界分别为0.47、0.47、0.49 cm和0.21、0.24、0.27 cm。这一结果说明采用SGRT摆位后,临床靶体积-计划靶体积(CTV-PTV)三维靶区外扩范围分别降低了54.6%、54.7%和44.1%,平均降幅51.1%。
|
|
表 2 三维方向上两组保乳放疗患者CTV-PTV靶区外扩边界(cm) Table 2 Expanded boundary of CTV-PTV in two groups of breast\|conserving radiotherapy patients in three-dimensions(cm) |
3、胸廓特征参数与SGRT摆位误差相关性分析
如表 3所示,保乳患者胸廓特征参数W、H、WH1、WH2与三维方向摆位误差未显示相关性(P>0.05)。胸廓纵横比H/W、患侧夹角α1、健侧夹角α2与x向摆位误差呈正相关(r=0.49、0.59、0.71,P < 0.05);胸廓特征参数与y方向摆位误差无相关关系(P>0.05);患侧乳腺高度D1及健侧乳腺高度D2与z向摆位误差呈负相关(r=-0.46、-0.49,P < 0.05)。
|
|
表 3 保乳放疗患者胸廓特征参数与SGRT摆位误差的相关分析结果 Table 3 Results of correlation analysis between thoracic characteristic parameters and SGRT set-up errors in breast-conserving radiotherapy patients |
讨论
鉴于提高早期乳腺癌检出率并进行有效治疗是降低乳腺癌死亡率的有效措施,我国开展了多项国家重大卫生服务项目,有效提升了民众乳腺癌筛查意识,使得早期乳腺癌(Ⅰ~Ⅱ期)占总体乳腺癌比例越来越高[15]。有研究表明,保乳手术联合放疗的预后,甚至优于全乳切除,其能在保留乳房功能的同时,大幅提高患者生活质量。不难得出,放疗在降低乳腺癌局部复发率方面有突出优势,是保乳治疗不可或缺的重要环节[16]。考虑到44%~86%的肿瘤局部复发多数发生在原发瘤床周围,如何实现放疗剂量充分、精准地投照,是目前临床放疗实践的重点[17]。精准放疗的前提是患者精确摆位,然而颈部及手臂姿态、乳腺组织移位、呼吸动度等诸多因素均增加了保乳患者精确摆位难度。
SGRT能连续获取患者体表信息,相对更适用与体表关系密切的乳腺肿瘤[18]。本研究针对临床定摆位难度较大的保乳放疗患者,首先对比分析了传统标记线和SGRT这两种方式的摆位精度。以CBCT扫描结果为金标准,SGRT引导下保乳摆位优于传统标记线摆位,且三维方向摆位误差差异显著,这与Kügele等[19]、Walter等[20]和李俊禹等[21]的研究结果吻合。分析原因主要有:传统标记线方法中标记线勾画方式不一,长期稳定性不足,且人为勾画偏差难以避免;考虑到呼吸动度和乳腺形态,保乳放疗患者标记线通常在靶区外以实现标记线位置稳定,但在激光灯“十”字摆位时仅关注标记点附近位置,对于患者体态,尤其是病灶处的旋转和/或变形没有任何直观显示。同时,模具在保存过程中存在变形可能,从而进一步影响标记精度。由于乳腺癌照射区域与皮肤表面接近,对患者体表实时探测是对乳腺癌靶区监测的适当替代,因此SGRT对于乳腺癌患者精确摆位具有突出优势。SGRT系统基于投影仪和多个摄像机单元组合记录患者实时捕捉三维表面数据,在提供患者姿势3D可视化的同时,对感兴趣区进行6维匹配,主动引导摆位技师纠正患者姿势,精确定位照射部位。在本研究中,SGRT组患者均采用小面罩固定,使用锁骨ROI和绿体表轮廓调整患者锁骨及手臂位置;而标记线组的颈胸面罩未覆盖患者手臂,无法明确患者手臂位置的准确性和重复性。最后,SGRT通过设置倒T形加部分患侧乳房的ROI设置,不仅能有效避免患者旋转,还有助于降低患侧乳腺区域,即扫描配准范围的摆位误差,如González-Sanchis等[22]研究了252名早期乳腺患者共计1 170次摆位测定,发现SGRT的表面匹配度平均为98%,比传统标记线摆位提高了5.3%。
其次,本研究进一步分析摆位精度的提升对放疗靶区外扩边界的影响。结果显示,采用标记线组和SGRT摆位时,CTV靶区分别外扩0.5和0.3 cm构建PTV可行,SGRT摆位方法能有效降低靶区三维方向上的外扩边界,该结果与Mouawad等[23]和Lastrucci等[24]研究结果一致。由于乳腺靶区临近心脏及肺组织,靶区范围的缩小使得正常组织放疗受量降低,进而避免造成乳腺癌患者长期健康隐患。此外,研究显示通过合理设置CBCT与SGRT频次[13, 25],SGRT摆位能实现在保证治疗安全精确的前提下,克服放疗期间乳房形态变化等造成的摆位误差,从而进一步减少因CBCT扫描造成的患者辐射损伤。
为更好地发挥SGRT个体化精确引导优势,本研究给出了不同胸廓特征参数定义,并对个体化胸廓特征参数与保乳患者SGRT摆位精度的相关性进行分析。结果表明,SGRT左右x方向移位误差与H/W、α1、α2均呈正相关;头脚y方向移位误差与胸廓特征参数无相关关系;前后z方向移位误差与D1、D2均呈负相关。这说明对于体型偏厚、体宽偏窄的保乳患者,SGRT引导下左右x方向摆位误差可能较大;对于乳腺腺体较小,胸部位置扁平的保乳患者,其前后z方向的SGRT引导精度存在不足。根据深度测量的立体视觉光学成像原理,两侧深度相机识别效果直接影响患者x方向测量精度[26-27]。对于体型偏厚、体宽偏窄的保乳患者,其x方向表面标志较少,同时体表切线方向与左右相机光轴夹角偏离最优角度,使得系统空间分辨率较差,对立体视觉系统在识别和匹配x方向表面标志的准确性造成影响。此外,对于胸部扁平的保乳患者,z方向表面特征不明显,且更易受呼吸运动影响,进而增加z方向测量误差。有研究提示,SGRT对于体表轮廓变化较大位置监测精度较好,因此对于上述特征的保乳患者,在临床勾画监测感兴趣区ROI时需要尽量覆盖弧度明显的体表范围,并调整合适SGRT设置参数以加强患者摆位的准确性[28-30]。
本研究存在一定局限性:如未纳入三维旋转方向摆位误差的分析讨论;因样本量有限,尚未给出胸廓特征参数与摆位误差的线性关系等。同时,尽管SGRT技术具有诸多优势,其在临床中仍存在一些潜在的误差来源,如患者呼吸模式变化影响体表运动;放疗期间乳房水肿或皮肤变色影响引导精度;设备校准和维护状态影响系统稳定性等,上述问题后续均可开展进一步研究。
综上所述,对于保乳术后放疗患者,SGRT能获得比传统标记线方法更高精确的三维方向摆位,有效缩小靶区外扩边界。同时,SGRT引导精度受患者个体化胸廓特征参数影响,实际临床中需要关注体型偏厚、体宽偏窄以及乳腺腺体偏小的保乳术后患者,在调整合适的ROI勾画范围、空间分辨率和阈值等监测参数设置之外,需要在放疗期间适当增加CBCT扫描频次,弥补SGRT引导精度不足、放疗中患者体型改变造成的位置偏差,有效保证摆位误差得到及时纠正,实现保乳术后患者靶区的精准放疗。
利益冲突 所有署名作者按以下贡献声明独立开展,未接受有关公司的任何赞助,不涉及各相关方的利益冲突
作者贡献声明 吴爱林负责构思、模拟计算、论文撰写;颜琳、武星蕾协助论文修改;张朋、程菁菁、臧春宝、张洪波负责病例选择和论文撰写;吴爱东指导论文修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9. DOI:10.1016/j.jncc.2022.02.002 |
| [3] |
Helvie MA, Chang JT, Hendrick RE, et al. Reduction in late-stage breast cancer incidence in the mammography era: implications for overdiagnosis of invasive cancer[J]. Cancer, 2014, 120(17): 2649-2656. DOI:10.1002/cncr.28784 |
| [4] |
Telli ML, Gradishar WJ, Ward JH. NCCN guidelines updates: breast cancer[J]. J Natl Compr Canc Netw, 2019, 17(5.5): 552-555. DOI:10.6004/jnccn.2019.5006 |
| [5] |
中国医师协会放射肿瘤治疗医师分会. 乳腺癌放射治疗指南(中国医师协会2020版)[J]. 中华放射肿瘤学杂志, 2021, 30(4): 321-342. Radiation Oncology Physicians Branch of Chinese Medical Doctor Association. Guidelines for radiotherapy of breast cancer (Chinese Medical Doctor Association 2020 edition)[J]. Chin J Radiat Oncol, 2021, 30(4): 321-342. DOI:10.3760/cma.j.cn113030-20210107-00010 |
| [6] |
辛灵, 向泓雨, 叶京明, 等. 《肿瘤专业医疗质量控制指标(2023年版)》与乳腺外科热点问题[J]. 中华外科杂志, 2024, 62(2): 93-98. Xin L, Xiang HY, Ye JM, et al. Quality control indexes for oncology (2023 edition) and hot topics in breast surgery[J]. Chin J Surg, 2024, 62(2): 93-98. DOI:10.3760/cma.j.cn112139-20230829-00071 |
| [7] |
Offersen BV, Overgaard M, Kroman N, et al. Accelerated partial breast irradiation as part of breast conserving therapy of early breast carcinoma: a systematic review[J]. Radiother Oncol, 2009, 90(1): 1-13. DOI:10.1016/j.radonc.2008.08.005 |
| [8] |
Boyages J. Radiation therapy and early breast cancer: current controversies[J]. Med J Aust, 2017, 207(5): 216-222. DOI:10.5694/mja16.01020 |
| [9] |
Corradini S, Ballhausen H, Weingandt H, et al. Left-sided breast cancer and risks of secondary lung cancer and ischemic heart disease: Effects of modern radiotherapy techniques[J]. Strahlenther Onkol, 2018, 194(3): 196-205. DOI:10.1007/s00066-017-1213-y |
| [10] |
Luo J, Peng H, Luo H, et al. The factors of fiducial marker motions and individual margin assessment in postoperative breast cancer radiotherapy[J]. Ann Transl Med, 2022, 10(24): 1359. DOI:10.21037/atm-22-6026 |
| [11] |
Peng H, Li C, Luo H, et al. The impacts of colors on the catalyst HD system: gains, integral times, and setups in radiotherapy[J]. J Radiat Res Appl Sc, 2022, 15(4): 1-7. DOI:10.1016/j.jrras.2022.100485 |
| [12] |
van Herk M. Errors and margins in radiotherapy[J]. Semin Radiat Oncol, 2004, 14(1): 52-64. DOI:10.1053/j.semradonc.2003.10.003 |
| [13] |
Peng H, Yang H, Lei J, et al. Optimal fractionation and timing of weekly cone-beam CT in daily surface-guided radiotherapy for breast cancer[J]. Radiat Oncol, 2023, 18(1): 112. DOI:10.1186/s13014-023-02279-4 |
| [14] |
Johansen S, Vikström J, Hjelstuen MH, et al. Dose evaluation and risk estimation for secondary cancer in contralateral breast and a study of correlation between thorax shape and dose to organs at risk following tangentially breast irradiation during deep inspiration breath-hold and free breathing[J]. Acta Oncol, 2011, 50(4): 563-568. DOI:10.3109/0284186X.2010.541933 |
| [15] |
Zeng H, Ran X, An L, et al. Disparities in stage at diagnosis for five common cancers in China: a multicentre, hospital-based, observational study[J]. Lancet Public Health, 2021, 6(12): e877-e887. DOI:10.1016/S2468-2667(21)00157-2 |
| [16] |
王丹琼, 王淑莲. 乳腺癌保乳术后全乳放疗瘤床同步补量研究进展[J]. 中华放射肿瘤学杂志, 2022, 31(11): 1070-1075. Wang DQ, Wang SL. Simultaneous integrated tumor bed boost during whole breast radiotherapy in breast cancer patients after breast‐conserving surgery: a review of the current evidence[J]. Chin J Radiat Oncol, 2022, 31(11): 1070-1075. DOI:10.3760/cma.j.cn113030-20220110-00013 |
| [17] |
Huang E, Buchholz TA, Meric F, et al. Classifying local disease recurrences after breast conservation therapy based on location and histology: new primary tumors have more favorable outcomes than true local disease recurrences[J]. Cancer, 2002, 95(10): 2059-2067. DOI:10.1002/cncr.10952 |
| [18] |
Darréon J, Massabeau C, Geffroy C, et al. Surface-guided radiotherapy overview: technical aspects and clinical applications[J]. Cancer Radiother, 2023, 27(6-7): 504-510. DOI:10.1016/j.canrad.2023.07.003 |
| [19] |
Kügele M, Mannerberg A, Nürring Bekke S, et al. Surface guided radiotherapy (SGRT) improves breast cancer patient setup accuracy[J]. J Appl Clin Med Phys, 2019, 20(9): 61-68. DOI:10.1002/acm2.12700 |
| [20] |
Walter F, Freislederer P, Belka C, et al. Evaluation of daily patient positioning for radiotherapy with a commercial 3D surface-imaging system (CatalystTM)[J]. Radiat Oncol, 2016, 11(1): 154. DOI:10.1186/s13014-016-0728-1 |
| [21] |
李俊禹, 于松茂, 周舜, 等. 光学体表监测系统在乳腺癌术后放疗颈胸膜固定中的应用[J]. 中华放射医学与防护杂志, 2020, 40(7): 524-528. Li JY, Yu SM, Zhou S, et al. Application of optical surface monitoring system(OSMS) during postoperative radiotherapy for breast cancer patients immobilized with neck and thorax thermoplastic mask[J]. Chin J Radiol Med Prot, 2020, 40(7): 524-528. DOI:10.3760/cma.j.issn.0254-5098.2020.07.006 |
| [22] |
González-Sanchis A, Brualla-González L, Fuster-Diana C, et al. Surface-guided radiation therapy for breast cancer: more precise positioning[J]. Clin Transl Oncol, 2021, 23(10): 2120-2126. DOI:10.1007/s12094-021-02617-6 |
| [23] |
Mouawad M, Lailey O, Poulsen P, et al. Intrafraction motion monitoring to determine PTV margins in early stage breast cancer patients receiving neoadjuvant partial breast SABR[J]. Radiother Oncol, 2021, 158: 276-284. DOI:10.1016/j.radonc.2021.02.021 |
| [24] |
Lastrucci A, Serventi E, Francolini G, et al. A retrospective comparison of setup accuracy from CBCT and SGRT data in breast cancer patients[J]. J Med Imaging Radiat Sci, 2024, 55(1): 29-36. DOI:10.1016/j.jmir.2023.10.005 |
| [25] |
Junker Y, Düsberg M, Asadpour R, et al. As easy as 1, 2, 3? How to determine CBCT frequency in adjuvant breast radiotherapy[J]. Cancers (Basel), 2022, 14(17): 4164. DOI:10.3390/cancers14174164 |
| [26] |
Bert C, Metheany KG, Doppke K, et al. A phantom evaluation of a stereo‐vision surface imaging system for radiotherapy patient setup[J]. Med Phys, 2005, 32(9): 2753-2762. DOI:10.1118/1.1984263 |
| [27] |
达飞鹏, 盖绍彦. 光栅投影三维精密测量[M]. 北京: 科学出版社, 2011. Da FP, Gai SY. Grating projection 3D precision measurement[M]. Beijing: Science Press, 2011. |
| [28] |
代馨瑶, 成宇, 曹潘潘, 等. 不同部位体表轮廓对Catalyst HD体表光学系统引导放疗摆位的影响[J]. 中华放射医学与防护杂志, 2023, 43(9): 689-697. Dai XY, Cheng Y, Cao PP, et al. Effects of body contours on the setup errors of the Catalyst HD optical surface imaging system-guided radiotherapy[J]. Chin J Radiol Med Prot, 2023, 43(9): 689-697. DOI:10.3760/cma.j.issn.112271-20221212-00482 |
| [29] |
Laaksomaa M, Moser T, Kritz J, et al. Comparison of three differently shaped ROIs in free breathing breast radiotherapy setup using surface guidance with AlignRTⓇ[J]. Rep Pract Oncol Radiother, 2021, 26(4): 545-552. DOI:10.5603/RPOR.a2021.0062 |
| [30] |
Sauer TO, Ott OJ, Lahmer G, et al. Region of interest optimization for radiation therapy of breast cancer[J]. J Appl Clin Med Phys, 2021, 22(10): 152-160. DOI:10.1002/acm2.13410 |
 2025, Vol. 45
2025, Vol. 45


