2. 火箭军特色医学中心检验科,北京 100088;
3. 军事科学院军事医学研究院辐射医学研究所,北京 100850
2. Clinical Laboratory, PLA Rocket Force Characteristic Medical Center, Beijing 100088, China;
3. Institute of Radiation Medicine, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China
电离辐射引起的DNA双链断裂(DNA double strand breaks, DSBs)随辐射剂量增加而增加。DSBs形成后,H2AX分子的丝氨酸139处快速磷酸化,变成γ-H2AX,从而募集损伤修复相关蛋白,对DSBs进行修复。γ-H2AX存在于整个细胞周期中,随时可以检测[1]。采用显微镜对培养细胞和组织中的γ-H2AX灶进行可视化分析是目前的主要研究手段[2-3],该方案的缺陷是成本高而且无法大规模使用。使用流式细胞术分析γ-H2AX平均荧光强度是一种快速、客观的测定H2AX蛋白磷酸化量的方法, 随着样本数量的增加,采用流式细胞术进行高通量检测γ-H2AX平均荧光的表达已被证明是一种有用且可靠的DNA损伤指标[4-5]。
γ-H2AX表达寿命短,在辐照后的表达水平随时间变化较快,由于苛刻的时间限制和个体差异的影响,γ-H2AX不宜作为辐射事故的生物剂量计,但是将高通量检测γ-H2AX方法用于放射病相关动物实验研究是一个理想的应用场景。
材料与方法 1、主要试剂与仪器Alexa FluorⓇ 488 anti-H2AX Phospho (Ser139) 抗体、DRAQ5TM均购自美国BioLegend公司,0.12%Triton X-100(Beyotime,上海)、磷酸盐缓冲液[phosphate buffered saline,PBS,北京兰杰柯科技有限公司(Biosharp),北京]。流式细胞仪为AttuneNxT(Thermo Fisher Scientific,美国),氨磷汀(WR-2721,Medchem Express,美国)。
2、动物分组及照射条件SPF级C57BL/6J雄性小鼠41只,6~8周龄,体重20~22 g[动物及饲料均由北京药康生物科技有限公司提供, 动物许可证:SYXK(京)2023-0032],于军事医学研究院辐射医学研究所内按组分笼喂养,饲养条件为(23±2)℃、相对湿度(55±15)%, 实验期间小鼠自助摄食摄水。所有实验动物均经过适应性喂养7 d, 其中21只小鼠按随机数字表法,0、1、2、4、6、8、10 Gy分为不同照射组,共7组,每组3只。照射组小鼠进行60Co γ射线照射(军事科学院军事医学研究院辐射医学研究所60Co源),源皮距2.5 m,吸收剂量率为63.8 cGy/min,全身照射,照射剂量为1、2、4、6、8、10 Gy。分别在照后1、4、8和24 h,对不同照射剂量组和0 Gy组小鼠进行尾静脉取血。另外20只小鼠进行WR-2721阳性药物验证:按随机数字表法,在照射剂量4、6 Gy条件下,分为单纯照射组和联合给药组,共4组,每组5只,分别在照后1、4、8和24 h对小鼠行尾静脉取血,检测γ-H2AX平均荧光强度,并检测照后1、7、14、21和30 d血常规。
3、给药方法照射前30 min给予照射对照组小鼠生理盐水200 μl腹腔注射,照射给药组小鼠于照射前30 min给予氨磷汀(WR2721)腹腔注射150 mg/kg。
4、样本处理取小鼠尾静脉血40 μl,立即加入4%甲醛200 μl,室温固定10 min,然后加入1 ml 0.12% Triton X-100室温孵育30 min以溶解红细胞,350 ×g离心5 min。去上清后用1 ml PBS洗涤2次,离心收集细胞沉淀,使用恒温振荡器边涡旋边滴加1 ml 50%冷甲醇,在4℃放置至少10 min(该步骤可放置4℃过夜)。取固定细胞,加入1 ml PBS洗涤,去上清加入100 μl稀释后Alexa FluorⓇ 488 anti-H2AX Phospho (Ser139) 抗体(1% BSA-PBS 1∶100稀释)重悬,37℃避光作用1 h。1 ml PBS洗涤后去上清, 加入500 μl PBS重悬,转移至流式检测专用管中,加入1 μl DRAQ5染液避光10 min,涡旋样本上机检测。
5、流式细胞仪上机检测应用流式细胞仪调整前向角散射光(forward scatter, FSC) 和侧向角散射光(side scatter, SSC),寻找外周血主要细胞群体,进一步使用DRAQ 5荧光探针标记有核细胞,得到纯化后的淋巴细胞和粒细胞群体。根据细胞大小选取淋巴细胞群,而后对淋巴细胞群进行分析,收集5 000个淋巴细胞,测定样品的γ-H2AX平均荧光强度。取照射后1、2、4、8、24 h淋巴细胞中γ-H2AX平均荧光强度分别拟合剂量效应曲线。参照文献[6],在GraphPad Prism 9.0软件中使用最小二乘法进行曲线拟合,Fbac为每组小鼠辐照前背景值,Fres为辐照后长时间(如24 h) 残留的残值,Kprod为辐射诱导焦点常数,Kdec为辐照后焦点衰减常数。拟合方程为:F = Fbac + Fres +Kprod× T × exp(-Kdec×T)。
6、统计学处理用SPSS 27.0统计软件处理数据,用GraphPad Prism 8.0软件作图,符合正态分布的实验数据采用x±s表示,两组样本之间采用独立t检验,多组独立样本间采用单因素方差分析(One-way ANOVA),采用LSD检验进行两两比较。P < 0.05为差异具有统计学意义。
结果 1、剂量-效应曲线照射后24 h以内剂量-效应曲线线性关系良好,淋巴细胞γ-H2AX的荧光强度呈剂量依赖增加,1~10 Gy照射剂量在照后1 h拟合曲线相关度最高(R2=0.991 4);随着照后时间延长,相关系数下降,照后24 h R2为0.946 4,依然>0.9,见表 1,表明通过流式细胞仪在照后24 h以内检测1~10 Gy照射小鼠的淋巴细胞γ-H2AX平均荧光强度能获得可靠性强、相关性高的剂量-效应曲线。
|
|
表 1 所有照射组小鼠淋巴细胞γ-H2AX荧光强度在不同时间点的剂量-效应关系模型 Table 1 Dose-response relationship models of the fluorescence intensity of γ-H2AX at different time |
2、经小鼠外周血直接检测淋巴细胞γ-H2AX评价放射损伤防护药物疗效的应用
每组小鼠DNA损伤的时变动力学改变如图 1所示,辐射诱导γ-H2AX平均荧光水平迅速增加,1 h后到达峰值,在8 h内快速下降,随后至24 h变化趋于平缓。WR-2721给药组小鼠外周血淋巴细胞γ-H2AX平均荧光强度从照射4 h后开始低于照射对照组。照后24 h的荧光强度反映γ-H2AX残留水平,4和6 Gy照后24 h,WR-2721给药组γ-H2AX平均荧光强度均低于4和6 Gy照射组(6 Gy+WR-2721组vs.6 Gy照射组:144.0±8.0 vs. 178.0±18.5,t =3.78,P < 0.05;4 Gy+WR-2721组vs.4 Gy照射组:109.5±9.7 vs. 136.6±5.4,t =5.48,P < 0.05,图 1),其中,6 Gy照射后24 h的WR-2721给药组小鼠γ-H2AX平均荧光强度与4 Gy照射组差异无统计学意义(P > 0.05),提示检测照后24 h外周血淋巴细胞γ-H2AX水平6 Gy照射的WR-2721给药小鼠造血系统DNA损伤可能与4 Gy照射小鼠相当。
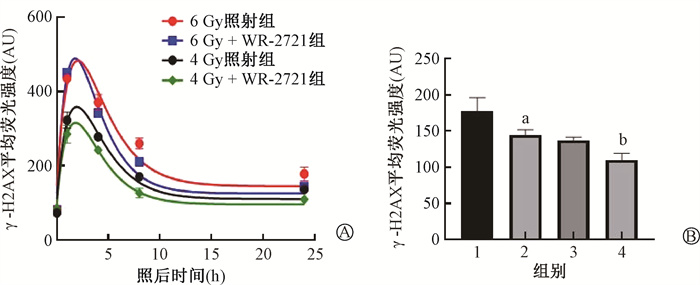
|
注:1. 6 Gy照射组;2. 6 Gy+WR-2721组;3. 4 Gy照射组;4. 4 Gy+WR-2721组。a与1组比较,t =3.78,P < 0.05; 图 1 4和6 Gy照射后各组小鼠血液淋巴细胞γ-H2AX荧光强度变化的时间依赖效应A.基于平均荧光强度,照后1、4、8和24 h γ-H2AX修复动力学的实验数据和拟合曲线;B. 辐照后24 h淋巴细胞γ-H2AX平均荧光强度的变化 Figure 1 Time-dependent effects of the fluorescence intensity of γ-H2AX in the blood lymphocytes of mice after irradiation at 4 and 6 Gy for irradiation and WR-2721 treatment groups A. Experimental data and fitted curves of γ-H2AX repair kinetics at 1, 4, 8 and 24 h post-irradiation, based on mean fluorescence intensity; B. Changes in the mean fluorescence intensity of γ-H2AX in lymphocytes at 24 h post-irradiation |
小鼠外周血白细胞在照后7 d、红细胞和血小板在照后14 d,4和6 Gy给药组均高于0 Gy组(t =3.13~12.86,P < 0.05,图 2)。WR-2721能够减轻辐射对造血系统的放射损伤, 对4和6 Gy照射小鼠的红细胞、血小板和白细胞均有放射损伤防护作用。与照后24 h外周血淋巴细胞γ-H2AX平均荧光强度变化趋势一致,6 Gy+WR-2721组小鼠红细胞、血小板和白细胞计数与4 Gy照射组小鼠趋于一致,表明照射后24 h外周血淋巴细胞γ-H2AX平均荧光强度可预测骨髓型放射病小鼠的损伤程度,在评价和提前预判放射损伤防治药物的疗效上有潜在的应用价值。
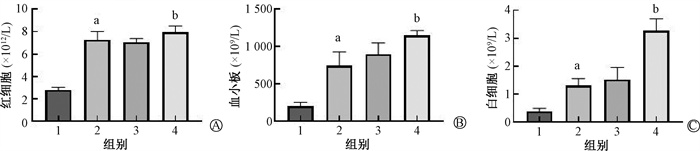
|
注:1. 6 Gy照射组;2. 6 Gy+WR-2721组;3. 4 Gy照射组;4. 4 Gy+WR-2721组;RBC.红细胞;PLT.血小板;WBC.白细胞。a与组1比较,t =12.86、6.33、7.37, P < 0.05;b与组3比较,t =3.13、3.41、6.39,P < 0.05 图 2 WR-2721对4和6 Gy γ射线照射小鼠造血系统的辐射防护作用A.照后14 d红细胞(RBC)数量;B. 照后14 d血小板(PLT)数量;C.照后7 d白细胞(WBC)数量 Figure 2 Radioprotective effects of WR-2721 on the hematopoietic system of mice after γ-ray irradiation at 4 and 6 Gy A.The number of RBC 14 d after IR; B.The number of PLT 14 d after IR; C.The number of WBC 14 d after IR |
讨论
通过流式细胞术分析细胞中的γ-H2AX是一种快速、客观测量DNA损伤的定量方法。尽管测量的总信号不能提供与通过荧光显微镜计数γ-H2AX焦点的数量或大小相同水平的灵敏度[7],但流式细胞术仍然是测量DNA DSB损伤诱导的快速工具。先前Hamasaki等[8]已开发出用于测量γ-H2AX的流式细胞术方法,发现γ-H2AX与照射剂量有很好的依赖关系;然而,使用这些方法分析之前需分离淋巴细胞[4, 9]。Rothkamm和Löbrich[10]、Moquet等[11]、Chen等[12]使用荧光显微镜来计算每个细胞的γ-H2AX焦点的数量,这与使用流式细胞术相比更加费力,同时受到实验之间的高变异性的限制,标准误差通常达到平均值的20%以上,表明内部的高变异性。
流式细胞仪检测γ-H2AX主要存在以下问题:检测γ-H2AX的时效性。γ-H2AX作为DNA损伤的标志,在细胞内持续发生变化,尤其是照后早期达到峰值后迅速下降。不同实验室的操作流程可能带来程序上和时间误差,难以反映机体在照后不同时间点的真实γ-H2AX水平。可供检测γ-H2AX的细胞数量,不论是传统的裂解红细胞方案[13],还是梯度密度离心法纯化提取淋巴细胞进行流式细胞仪检测,反复的离心和纯化都容易导致细胞丢失,淋巴细胞数量在照后会迅速下降,因此实验人员被迫提高采血量,并且尽量在照后早期进行检测,以避免在照后24 h可能面临淋巴细胞数量过少。Chow等[14]为了避免红细胞裂解过程中对白细胞磷酸化表位产生影响,提出了固定/溶解的方案,该方案(4%甲醛/Triton X-100/50%甲醇)可在采血后直接采用甲醛短暂固定的方式停止细胞生理变化,随后使用0.12% Triton X-100直接对红细胞进行溶解,避免流式检测过程中红细胞的干扰,最后使用50%甲醇对细胞蛋白变性,恢复细胞内抗原的流式检测信号。该方案中,白细胞在甲醇里保存24 h对细胞内磷酸化抗原表位的检测无明显影响。
本研究将该方案应用于小鼠外周血淋巴细胞γ-H2AX的检测,有以下特点:①本方案采血量少。由于优化红细胞裂解步骤以及避免梯度密度离心法对细胞的大量丢失,每个时间点仅需小鼠尾静脉血40 μl即可满足检测,并且在照后24 h依然能获得足够的淋巴细胞数量,因此可以在照后多个时间点采集血样。小鼠在24 h内采集血样不超过200 μl (循环血量的10%),能有效避免多次采血导致的低血容量性休克,满足动物福利对小鼠采血量要求。②及时固定。所有样本可收集并放置24 h后统一检测“固定/溶解方案是天然适合流式细胞术分析γ-H2AX的实验方法,新鲜血采集后迅速加入甲醛固定,避免了后续操作过程中γ-H2AX的动态变化,该方案极大地提高了该过程的操作速度和简易性,同时减少组内变异。③简单易得地区分外周血淋巴细胞。DRAQ 5是一种经过大量验证具有高亲和力的远红外荧光活细胞染料,DRAQ 5可以透过细胞膜,可用来标记活细胞或固定后分析死细胞。通过BRAQ 5染料在流式细胞学检测步骤可进一步区分有核细胞和细胞碎片,该方案可有效避免细胞碎片干扰,获得更加清晰的淋巴细胞和粒细胞分群。
本研究使用这种快速流式细胞术检测方法,发现小鼠外周血淋巴细胞γ-H2AX诱导的剂量反应在照射的剂量范围(0~10 Gy)内呈良好线性,在1 h左右达到峰值,随后开始下降,在8 h内快速下降,随后至24 h变化趋于平缓,这与之前的研究一致[6]。WR-2721是第一个获得美国食品和药物管理局(Food and Drug Administration, FDA)批准的临床辐射损伤防治药物, 在大多数临床放射治疗中,WR-2721已被作为放射防护剂,研究已证明在所有放射治疗部位均有效[15]。WR-2721在体内的代谢产物为WR-1065,具有清除组织中自由基的作用,可以选择性地保护正常组织免受放疗、化疗所造成的损害。目前尚无研究直接观察WR-2721对动物体内淋巴细胞照后γ-H2AX变化的影响,本研究选择4和6 Gy建立中度和重度骨髓型放射损伤小鼠模型,以照射前及照射后各组小鼠外周血的血常规指标及γ-H2AX平均荧光强度展开检测用于验证WR-2721辐射防护效果。
本研究所有给药组小鼠在照射前30 min给予WR-2721腹腔注射150 mg/kg。照射后分别在1、4、8、24 h取小鼠尾静脉血直接检测γ-H2AX平均荧光强度,并对平均荧光强度进行DNA修复动力学的拟合曲线。对小鼠进行全身照射4和6 Gy后, WR-2721给药组与照射组相比,红细胞、白细胞和血小板计数的绝对值均显著提高, 验证了WR-2721能够有效改善且部分恢复辐射对于造血系统的损伤。此前,有研究表明,γ-H2AX可反映个体放射敏感性并用于预测前列腺特异膜抗原(prostate-specific membrane antigen, PSMA)靶向放疗的治疗效果[16]。本实验通过经小鼠外周血直接检测淋巴细胞γ-H2AX的方法,发现WR-2721能减少4和6 Gy照射后小鼠淋巴细胞γ-H2AX的产生,每组小鼠照射后24 h的γ-H2AX平均荧光强度值与小鼠血常规三系在照后7或14 d的最低值趋势一致,表明通过照射后24 h外周血淋巴细胞γ-H2AX平均荧光强度可用于预测骨髓型放射病小鼠DNA损伤程度,提前预判药物的放射病防治疗效。
综上所述,本研究为进一步深入研究外周血淋巴细胞γ-H2AX用于辐射生物剂量估算和辐射防护药物评价提供了一种新的方法。以γ-H2AX作为评价放射损伤的重要指标,在照后24 h即可提前研判动物模型的放射损伤程度,也可单独或联合血常规检测用于辐射防护药物疗效评价研究,或用于辐射防护药物筛选和抗放药物之间DNA损伤防护作用的对比研究。
利益冲突 无
作者贡献声明 时磊、董雅负责实验设计、实验操作、数据整理、起草论文;申星、欧红玲、王欣茹指导实验设计和论文修改;张巧云、宋秀军、马盈盈负责协助部分实验和论文整理
| [1] |
Collins PL, Purman C, Porter SI, et al. DNA double-strand breaks induce H2AX phosphorylation domains in a contact-dependent manner[J]. Nat Commun, 2020, 11(1): 3158. DOI:10.1038/s41467-020-16926-x |
| [2] |
Viau M, Testard I, Shim G, et al. Global quantification of γH2AX as a triage tool for the rapid estimation of received dose in the event of accidental radiation exposure[J]. Mutat Res Genet Toxicol Environ Mutagen, 2015, 793: 123-131. DOI:10.1016/j.mrgentox.2015.05.009 |
| [3] |
陈婕, 刘萌萌, 高玲. 基于γ-H2AX焦点检测的局部照射剂量估算三维模型方法的建立[J]. 中华放射医学与防护杂志, 2024, 44(3): 188-193. Chen J, Liu MM, Gao L. Establishing a three-dimensional model for estimating partial-body irradiation doses based on γ-H2AX foci detection[J]. Chin J Radiol Med Prot, 2024, 44(3): 188-193. DOI:10.3760/cma.j.cn112271-20230911-00083 |
| [4] |
Lee Y, Wang Q, Seong KM, et al. High-throughput γ-H2AX assay using imaging flow cytometry[J]. Spec Imag Cytome, 2023, 123-134. DOI:10.1007/978-1-0716-3020-47 |
| [5] |
Wilkins RC, Beaton-Green LA. Development of high-throughput systems for biodosimetry[J]. Radiat Prot Dosim, 2023, 199(14): 1477-1484. DOI:10.1093/rpd/ncad060 |
| [6] |
Andrievski A, Wilkins RC. The response of gamma-H2AX in human lymphocytes and lymphocytes subsets measured in whole blood cultures[J]. Int J Radiat Biol, 2009, 85(4): 369-376. DOI:10.1080/09553000902781147 |
| [7] |
Horn S, Barnard S, Rothkamm K. Gamma-H2AX-based dose estimation for whole and partial body radiation exposure[J]. PLoS One, 2011, 6(9): e25113. DOI:10.1371/journal.pone.0025113 |
| [8] |
Hamasaki K, Imai K, Nakachi K, et al. Short-term culture and gammaH2AX flow cytometry determine differences in individual radiosensitivity in human peripheral T lymphocytes[J]. Environ Mol Mutagen, 2007, 48(1): 38-47. DOI:10.1002/em.20273 |
| [9] |
Ismail IH, Wadhra TI, Hammarsten O. An optimized method for detecting gamma-H2AX in blood cells reveals a significant interindividual variation in the gamma-H2AX response among humans[J]. Nucl Acids Res, 2007, 35(5): e36. DOI:10.1093/nar/gkl1169 |
| [10] |
Rothkamm K, Löbrich M. Evidence for a lack of DNA double-strand break repair in human cells exposed to very low X-ray doses[J]. Proc Natl Acad Sci USA, 2003, 100(9): 5057-5062. DOI:10.1073/pnas.0830918100 |
| [11] |
Moquet J, Ainsbury E, Balázs K, et al. RENEB inter-laboratory comparison 2021: The gamma-H2AX foci assay[J]. Radiat Res, 2023, 199(6): 591-597. DOI:10.1667/RADE-22-00205.1 |
| [12] |
Chen Z, Wakabayashi H, Kuroda R, et al. Radiation exposure lymphocyte damage assessed by γ-H2AX level using flow cytometry[J]. Sci Rep, 2024, 14(1): 4339. DOI:10.1038/s41598-024-54986-x |
| [13] |
胡海亮, 王治东, 张学清, 等. 用流式细胞术检测γ射线诱发淋巴细胞γ-H2AX与照射剂量的关系[J]. 辐射研究与辐射工艺学报, 2012, 30(2): 120-124. Hu HL, Wang ZD, Zhang XQ, et al. Relationship between γ-H2AX in lymphocytes and radiation dose of γ-rays by flow cytometry assay[J]. J Radiat Res Radiat Proc, 2012, 30(2): 120-124. DOI:10.11889/j.1000-3436.2012.rrj.30.120211 |
| [14] |
Chow S, Hedley D, Grom P, et al. Whole blood fixation and permeabilization protocol with red blood cell lysis for flow cytometry of intracellular phosphorylated epitopes in leukocyte subpopulations[J]. Cytometry A, 2005, 67(1): 4-17. DOI:10.1002/cyto.a.20167 |
| [15] |
King M, Joseph S, Albert A, et al. Use of amifostine for cytoprotection during radiation therapy: a review[J]. Oncology, 2020, 98(2): 61-80. DOI:10.1159/000502979 |
| [16] |
Widjaja L, Werner RA, Krischke E, et al. Individual radiosensitivity reflected by γ-H2AX and 53BP1 foci predicts outcome in PSMA-targeted radioligand therapy[J]. Eur J Nucl Med Mol Imaging, 2023, 50(2): 602-612. DOI:10.1007/s00259-022-05974-8 |
 2025, Vol. 45
2025, Vol. 45


