寡转移性疾病(oligometastatic disease,OMD)的概念于1995年由Hellman和Weichselbaum首次提出,并被描述为介于局部转移性疾病和广泛转移性疾病之间的过渡阶段[1]。与广泛性转移相比,在乳腺癌、结直肠癌、肺癌、前列腺癌等多种实体瘤中,已初步证实在系统性治疗基础上添加局部治疗可以改善OMD患者的生存[2-5]。放射治疗、手术、射频消融等都是目前寡转移性肿瘤最常见的局部治疗措施。随着现代放疗技术的进步,体部立体定向放射治疗(stereotactic body radiotherapy,SBRT)和调强放射治疗(intensity-modulated radiotherapy,IMRT)等精准放疗技术在寡转移肿瘤患者中的应用越来越成熟,其能够在精准照射转移病灶的同时,最大限度地减少周围正常器官的放射线暴露来降低不良反应风险。
食管癌(esophageal cancer,EC)发病隐匿,大多数患者确诊时已为局部晚期或存在远处转移。荷兰的一项对3 876例食管胃癌患者尸检报告的分析显示,食管癌最常受影响的远处转移部位是肝脏(56%)、区域外淋巴结(53%)和肺(50%)[6]。转移性食管癌被认为是终末期疾病。尽管免疫治疗改变了晚期食管癌的治疗格局[7-13],但转移性食管癌系统性治疗的手段仍然有限,预后较差,且新型药物研发并不迅猛。虽然一些表现为寡转移状态的患者可能会从局部治疗中得到生存获益,但食管癌寡转移缺乏被广泛接受的定义,同时也缺乏大型随机对照试验数据。因此,通过对现有文献中食管癌寡转移的定义、诊断和治疗方式进行汇总,组织专家深入研究讨论,形成共识以指导临床实践。
一、食管癌寡转移的定义专家共识一:食管鳞癌寡转移定义为3个器官内≤5个转移灶,且单个器官系统中的转移瘤数量≤3个。食管腺癌寡转移定义为单个器官内≤3个转移灶或者1个区域外淋巴结站转移。所有食管癌寡转移灶都应适合局部治疗(证据质量:中;共识水平:98%)。
在欧洲放射肿瘤学会与美国放射肿瘤学会(ESTRO-ASTRO)共识中,“最多5个”和“最多3个”寡转移病灶是最常用的定义。寡转移定义的最多病灶数量应取决于能否对所有转移灶提供安全的根治性放疗[14]。对于寡转移性食管鳞癌,多项回顾性和单臂前瞻性研究表明,放疗可能改善患者的预后[15-17]。在这些研究中,食管鳞癌寡转移的定义为涉及转移器官数1~3个,可测量病灶数3~5个不等。个别研究的定义更为严格,并要求转移病灶直径≤5 cm[17-18]或任何单个器官系统中的转移瘤数量≤3个[18-19]。而最常见的食管鳞癌寡转移定义为≤3个器官和≤5个转移灶(表 1)。因此,寡转移的定义共识的达成可能有助于未来临床试验和前瞻性数据研究纳入标准的同质化。
|
|
表 1 既往研究中食管鳞癌寡转移的定义 Table 1 Definition of oligometastatic esophageal squamous cell carcinoma in previous studies |
食管腺癌和食管鳞癌的分子特征上存在着明显的差别[24]。与食管鳞癌相比,食管腺癌更容易转移至腹膜和骨[25],而腹膜转移通常被认为是多发转移性疾病状态,需要与OMD不同的治疗方式(例如腹腔热灌注化疗)。在寡转移系列临床试验中,食管腺癌多与胃腺癌同时纳入研究并进行评价。对于食管腺癌,大多数专家认为其从一开始就是全身性疾病,对于OMD状态存在争议。然而,非随机Ⅱ期研究AIO-FLOT3证实了食管胃腺癌中存在局限转移状态,与单纯系统性治疗相比,进行局部治疗后,其总生存(overall survival, OS)有所改善[26]。一项多中心回顾性研究显示,转移性食管胃癌患者中寡转移(该研究中定义为≤5个病灶)约占24%[27]。目前,多项探索局部治疗联合全身治疗对食管胃癌寡转移的价值的Ⅲ期随机
试验正在进行中[28-29]。2024年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)最新报道的德国IKF-575 Ⅲ期研究结果显示,化疗/靶向诱导治疗后有限转移的胃/食管胃结合部腺癌患者[仅腹膜后淋巴结(retroperitoneal lymph node,RPLN)转移和/或最多1个器官受累],进行手术干预未取得阳性结果,但仅RPLN转移患者似乎更能从局部治疗中获益。回顾既往文献[26, 28, 30-34],食管腺癌寡转移的定义如表 2所示。欧洲食管胃癌寡转移(Oligometastatic Esophagogastric Cancer, OMEC)项目中,62名专家结合了28项可用的食管胃癌寡转移的相关研究和研究方案,通过德尔菲(Delphi)共识方法制定了食管胃癌寡转移的定义(该定义未包含脑转移患者):1个器官≤3个转移灶或累及1个区域外淋巴结站[35-36]。其中器官特异性寡转移定义为两叶肝脏≤2个转移灶,单叶肝脏≤3个转移灶,单侧肺≤3个转移灶,1处远处淋巴结转移,单侧肾上腺转移,骨或者软组织1处转移灶。1项研究(共纳入252例患者)和4项研究方案认为OMD的最大转移数量取决于受影响的特定器官,这些研究或研究方案被纳入OMD的“器官特异性”定义[26, 29, 37-39],其代表性可能存在不足。同时,该共识缺乏腺癌与鳞癌组织学方面以及食管癌与胃癌的结果分层,可能并不适用于亚洲常见的食管鳞癌患者。鉴于以上原因,本专家共识对食管腺癌和鳞癌的寡转移定义进行了单独限定。其中,食管腺癌寡转移的定义参考了欧洲OMEC项目共识。目前确定的食管腺癌寡转移的定义比ESTRO-ASTRO共识的限制更高,可能是由于其更具侵袭性的肿瘤生物学特性。
|
|
表 2 既往研究中食管腺癌寡转移的定义 Table 2 Definition of oligometastatic esophageal adenocarcinoma in previous studies |
既往脑寡转移定义为1~4个脑转移灶[40],ASCO指南推荐这部分患者使用立体定向放射外科(stereotactic radiosurgery,SRS)治疗[41]。然而多项研究结果表明,在脑转移总体积有限情况下,脑转移数目可能不是影响预后的主要因素[42-43]。目前,颅内寡转移瘤定义为可通过立体定向放射治疗(stereotactic radiotherapy,SRT)代替全脑放射治疗(whole brain radiotherapy,WBRT)治疗,并取得相当甚至更好疗效,且能保护认知功能的转移瘤病灶。因此,本共识中对食管癌颅脑寡转移的定义不再单独予以限制。
区域淋巴结受累不计入同时性食管癌寡转移的转移部位,其参考来自欧洲多学科共识组对非小细胞肺癌寡转移的定义[44]。异时性食管癌寡转移患者的区域淋巴结受累,参照ESO-Shanghai 13研究[18],将所有阳性区域淋巴结共同计为1个病灶,而非区域淋巴结转移则按累及的非区域淋巴结站点数进行计数。同时,弥漫性浆膜转移(脑膜、心包、胸膜、肠系膜)或骨髓受累排除在寡转移定义之外,因为这些转移部位不能进行根治性治疗。
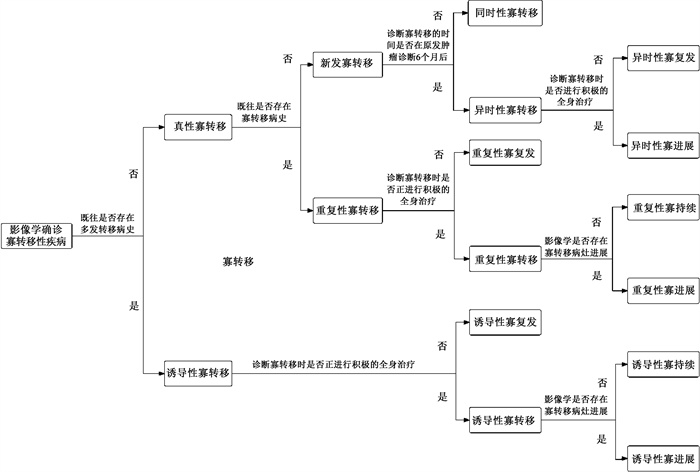
二、食管癌寡转移的分类专家共识二:根据患者的无病间隔、诊断时间和既往治疗等因素,参考欧洲放射肿瘤学会-欧洲癌症研究与治疗组(ESTRO-EORTC)联合专家共识可将寡转移分为9类[45](图 1)。更直观且临床适用的寡转移分类仍需进一步开发和验证(证据质量:高;共识水平:98%)。
|
图 1 寡转移性疾病的分类 Figure 1 Classification of oligometastasis |
寡转移的概念既包括肿瘤负荷的病灶数目,也同时包括病灶在空间和时间等维度上的分布。因此,ESTRO-EORTC联合专家共识中寡转移性疾病分别纳入了无病间隔、诊断时间和既往治疗等各种因素[45]。
ESTRO-EORTC联合专家共识以诊断寡转移之前有无多发转移病史来区分诱导性寡转移(既往多发转移病史)和真性寡转移(无多发转移病史)。真性寡转移的癌症转移能力较低,应以无病状态为根治性治疗的目的,尽可能延长进展到多发转移的时间,从而提高生活质量。而诱导性寡转移是多发转移性疾病通过有效的全身治疗转化为的寡转移性疾病,根据现有证据,大多数患者无法治愈。
真性寡转移疾病又可细分为重复寡转移(既往寡转移疾病史)和新发寡转移(首次诊断寡转移疾病)。寡转移性疾病治疗后最常见的失败模式为多发转移。如果未进展为多发转移,则可能会再次出现寡转移性疾病,即重复性寡转移,可能提示了具有长期低转移能力的癌症生物学特性。在新发寡转移中,又进一步区分为同时性寡转移和异时性寡转移。对于区分同时性和异时性疾病的原发癌诊断与寡转移性疾病发展之间的时间间隔,现有文献尚未达成共识。ESTRO-EORTC沿用了Kim等[46]和Mekenkamp等[47]的定义,将6个月作为时间间隔阈值。同时性寡转移疾病的治疗需要综合考虑原发肿瘤的局部治疗、所有寡转移灶的局部治疗以及全身治疗。Tsai等[48]、Ashworth等[49]认为与异时性寡转移相比,同时性寡转移可能与更差的预后有关。但这一观点并未在所有研究中得到证实[50]。
考虑到寡转移性疾病是在无治疗间隔期间、或是在积极的系统性治疗期间诊断以及寡转移病变在当前影像学上是否正在进展,将其最终细分为寡复发、寡进展和寡持续。标准化的寡转移分类能够为治疗分层提供预后和预测价值。需要明确的是,患者病程中的寡转移性疾病状态可能是不断转变的,具体取决于对局部和全身治疗的反应。
尽管这种分类几乎涵盖各种临床场景,但因其复杂性,其临床应用程度并不普遍[51]。一项系统性评价报告显示,在95项发表的寡转移研究中,只有7项可以对现有文献进行回顾性OMD分类[52]。更直观和临床适用的分类仍需开发和验证。通过检查循环肿瘤DNA(circulating tumor DNA,ctDNA)或肿瘤细胞等特征来破译寡转移的生物学特征的相关研究正在进行中,这些结果未来有望增加寡转移分类的同质性。
三、食管癌寡转移的诊断专家共识三:对于可疑存在寡转移的食管癌患者应采用多模态诊断方法。除内镜检查和组织活检外,所有患者均建议行胸部和上腹部(包括肝脏、肾脏和肾上腺)增强CT扫描。存在可疑脑转移症状或风险的患者,建议行头颅磁共振成像(MRI)检查。推荐首选全身18F-氟代脱氧葡萄糖正电子发射计算机断层显像(18F-FDG-PET/CT)扫描作为基线分期检查以及系统性治疗后再分期检查的依据(证据质量:高;共识水平:98%)。
由于缺乏有效的生物标志物,目前影像学检查仍然是食管癌寡转移最有效的诊断方法。影像学的快速发展允许识别小转移灶,有助于区分寡转移性和多转移性疾病,从而避免广泛转移的患者进行不必要的局部治疗。
1、上消化道内镜检查对可疑存在寡转移的食管癌患者进行分期时仍须遵循传统的肿瘤检查策略。肿瘤浸润深度和淋巴结受累是长期生存的重要预测指标,也是治疗方法的主要决定因素。内镜检查和组织活检仍是初始步骤。此外,通常建议使用超声内镜来帮助评估肿瘤浸润深度和食管旁淋巴结转移。
2、CT对潜在的转移性疾病的评估通常从胸腹CT开始。所有可疑存在寡转移的食管癌患者应至少行胸部和上腹部(包括肝脏、肾脏和肾上腺)增强CT扫描。CT识别淋巴结及其他软组织疾病部位的准确度有限,对骨转移的敏感度更低。对于可疑骨转移的食管癌患者,可辅以骨显像,其灵敏度较高但特异性差。
3、MRI在食管癌的诊断、分期和疗效评价中可作为CT检查的有效补充。具有传统T1、T2和STIR序列的全身磁共振成像(whole-body MRI, WB-MRI)可为检测转移灶提供对比度,而DW可以对肿瘤代谢进行量化。通过DWI序列可以测量整个治疗过程中转移性病灶的整体体积,以评估治疗反应和评估预后。与CT、PET/CT相比,MRI在发现肝转移、脑转移病变方面更具有优势[53-54]。全身磁共振弥散加权成像(WB-DW-MRI)与PET/CT一样,具有多器官评估的优势。既往文献报道食管癌脑转移的发生率为1.6%~3.9%,其中腺癌的发生率高于鳞癌,为1.4%~12.2%,鳞癌仅为0.34%~1.4%[55-59]。因此国内外指南均没有建议将头颅MRI作为临床实践或临床试验筛查的常规检查。由于食管癌脑转移可伴随明显症状,且与不良预后相关,可根据临床症状进行有针对性的头颅MRI检查。
4、PET/CTPET-CT对远处转移的检测较CT更有优势。在一项多中心前瞻性队列研究中,PET/CT的加入导致24%的患者出现临床重要的分期变化,包括15.1%的患者上升到M1B[60]。此外,PET/CT可以帮助识别在5%~20%的患者中使用传统分期方法没有发现的远处转移[61-63]。对于淋巴结转移来说,CT扫描依赖于肿瘤大小,诊断效能相对较差。而PET/CT的敏感性33%~100%,特异性为95%~100%[64]。在912例淋巴结的检测中,PET/CT优于CT,特别是针对>5 mm的转移灶(敏感性为66%,特异性为96%,阳性预测值为82%,阴性预测值为92%)[65]。但对于较小的淋巴结(2~10 mm),可被原发肿瘤高摄取所干扰,PET/CT在胃食管交界附近淋巴结的敏感性较低[66-67]。因此,对于可疑食管癌寡转移患者必要时需结合超声及病理结果评估区域外淋巴结受累情况。
5、超声检查主要用于胸腹腔积液、肝脏转移灶、腹部及颈部、锁骨上区淋巴结转移的诊断。超声引导下穿刺活检可获得病理学诊断证据。
四、食管癌寡转移的总体治疗原则专家共识四:对于食管癌寡转移患者,治疗决策需经多学科团队(multidisciplinary team,MDT)讨论决定,根据具体情况考虑个体化决策。寡转移的异质性给放疗、手术、介入治疗、靶向治疗、化疗以及免疫治疗的联合带来了多种不同的组合选择(证据质量:高;共识水平:100%)。
食管癌寡转移病情复杂且不断发展,其现代诊疗策略需要采用包括外科、消化内科、肿瘤内科、介入科、放射科、病理科、营养科、肿瘤放射治疗科等在内的MDT方法。食管癌寡转移必须与食管的多原发癌和多脏器原发性癌相区别,这必须依靠于临床医生合理解读患者临床特征与病理结果作出判定。考虑到寡转移本身的异质性,食管癌寡转移患者的最佳治疗模式应综合考虑寡转移时间、转移位置、转移灶大小和患者状态,采用个体化治疗模式。
在特定情况下,还应讨论放疗和手术的联合治疗。例如,当对正常组织的累积剂量因多疗程放疗而超出最大剂量限制时,应评估手术是否能作为可行的替代性局部治疗方法。脑转移术后瘤床的局部放疗可以显著降低局部复发率[68-69]。此外,复杂的骨寡转移性病变可能会出现承重骨的病理性骨折或导致脊髓压迫的椎体压缩性骨折,手术可以稳定机械不稳定的脊柱、减轻脊髓压迫[70]。
目前,尚无证明局部消融治疗对寡转移患者有生存获益的随机对照试验发表,因此局部消融治疗作为食管癌寡转移多模式治疗策略之一的循证医学证据较低。在特定情况下,局部消融技术也可作为放疗的补充治疗手段。例如,对于先前已进行放疗并且因安全性/有效性而无法选择再程放疗的疼痛性脊柱寡转移瘤,局部消融治疗可作为挽救治疗的选择。
目前,靶向治疗联合根治性放疗并未纳入食管癌寡转移的随机对照试验的研究方案,但在探索手术干预对寡转移性食管胃癌潜在益处的前瞻性、随机、Ⅲ期RENAISSANCE研究中,人表皮生长因子受体2(HER-2)阳性患者允许一线使用曲妥珠单抗[29]。因此,在特定模式下经过多学科团队讨论,靶向治疗也可能成为个体患者的最佳治疗模式的组成部分。
就目前证据而言,多项回顾性及Ⅱ期研究证据支持化疗联合放疗可以延长食管癌寡转移患者的生存(表 3)。对于食管鳞癌寡转移,在Ⅱ期ESO-Shanghai 13研究中,接受局部治疗联合化疗组的无进展生存(progression free survival, PFS),(12.0 vs.3.4个月,P < 0.000 1)和OS(未达到vs.15.1个月,P=0.005 4)均显著优于单纯化疗组[18]。对于寡转移性食管腺癌,探索放疗联合化疗对比单纯化疗的Ⅱ期NCT03161522研究和Ⅲ期美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)-ACRIN研究也在进行中。
|
|
表 3 放疗联合化疗治疗食管癌寡转移的相关临床研究 Table 3 Relevant clinical studies on radiotherapy combined with chemotherapy for oligometastatic esophageal cancer |
多项随机试验和回顾性研究也证实了放疗联合免疫治疗无论作为同时性食管鳞癌寡转移患者的一线治疗,还是既往治疗后进展的异时性食管鳞癌寡转移患者的后续治疗,均表现出了其良好的疗效和可耐受的不良反应。Wu等[20]报道一项前瞻性、单臂、Ⅱ期研究(ChiCTR21000467),纳入了33例接受放疗联合化疗与免疫治疗的N3或寡转移的初治晚期食管鳞癌患者,其中寡转移患者为27例(81.8%)。在完成所有病灶放疗和4周期化疗的26例患者中,客观缓解率(objective response rate, ORR)为57.7%,疾病控制率(disease control rate,DCR)为73.1%,中位PFS为12.8个月,中位OS未达到。Duan等[72]发现,接受放疗联合化疗与免疫治疗的寡转移食管癌患者的PFS(13.5 vs.8.8个月,P < 0.001)显著优于单纯化疗与免疫治疗组。ESO-Shanghai 13研究中,接受局部治疗联合免疫/化疫与免疫治疗组的寡转移性食管鳞癌患者的PFS(18.0 vs.9.6个月,P=0.044)显著优于单纯免疫/化疗与免疫治疗组,OS(30.7 vs.20.6个月,P=0.190)也有优于单纯免疫/化疗与免疫治疗组的趋势[18]。另一项Ⅱ期研究也显示,一线化疗与免疫治疗失败后进展的食管鳞癌寡转移患者放疗联合化疗与免疫治疗的远隔反应率和未照射病灶的控制率显著提高[16]。此外,一项评估卡瑞利珠单抗联合或不联合放疗治疗化疗后进展的食管癌寡转移的Ⅱ期多中心临床试验(NCT 04512417)也正在进行中。由于免疫联合放疗治疗寡转移性食管腺癌的价值尚未得到随机试验结果的支持,推荐开展评估免疫治疗联合放疗治疗寡转移性食管腺癌患者的临床研究。
五、食管癌寡转移的放射治疗 1、总体原则专家共识五:放射治疗应作为MDT的重要组成部分参与治疗过程。在食管癌寡转移患者放疗的临床应用中,治疗方案需要进一步探索优化,包括放疗时机、放疗技术、放疗剂量、严重不良反应规避等。在技术可行且临床安全的前提下,可考虑把放疗作为原发灶和所有寡转移灶重要的根治性局部治疗方式。对于仅有锁骨上淋巴结转移或毗邻食管区域的远处淋巴结转移患者,若原发病灶和远处转移淋巴结可包含在同一放射野内,可考虑采用局部晚期不可切除食管癌的治疗模式(证据质量:高;共识水平:100%)。
开始积极治疗之前,应权衡放疗各种治疗因素。如根治性放疗是否可行,放疗并发症能否减轻,联合全身治疗是否可耐受,生活质量是否会改善,总生存期是否会延长,以及总体治愈的可能性。在任何情况下,强烈推荐高适形放疗以减少局部根治性治疗的不良反应。当针对多个器官系统进行治疗,或当临床优先考虑因素为尽量减少全身治疗的中断,或根据转移部位充分考虑放射生物学和物理技术上的特点,应选择不同放射治疗分割模式。
在日本食管癌分期(JES第12版,2022年)中[73],锁骨上淋巴结转移和其他有望通过清扫获得根治性治愈的区域外淋巴结转移被定义为M1A,有别于其他远处转移的M1B。Chen等[74]发现,放疗联合化疗和免疫治疗可改善非区域淋巴结转移的ⅣB期食管鳞癌患者的生存。在随机、双盲、安慰剂对照的Ⅲ期研究KEYNOTE 975研究中[75],对于颈段或胸上段食管癌合并仅锁上淋巴结转移的患者,采用了同步放化疗联合帕博利珠单抗治疗,而非单纯系统性治疗。因此,对于预后较好的仅区域外淋巴结转移患者,若寡转移灶毗邻食管区域且可与食管原发灶包含在同一放射野内,可考虑采用局部晚期不可切除食管癌的治疗模式;若寡转移灶与食管距离较远,不可涵盖于食管原发灶放射野内,在经MDT评估其放疗技术可行且临床安全的前提下,应尽早完成原发灶及所有区域外转移淋巴结的放疗。对于脏器寡转移的患者,则应由MDT决策是否实施原发灶放疗联合或不联合转移灶放疗或其他局部治疗手段。
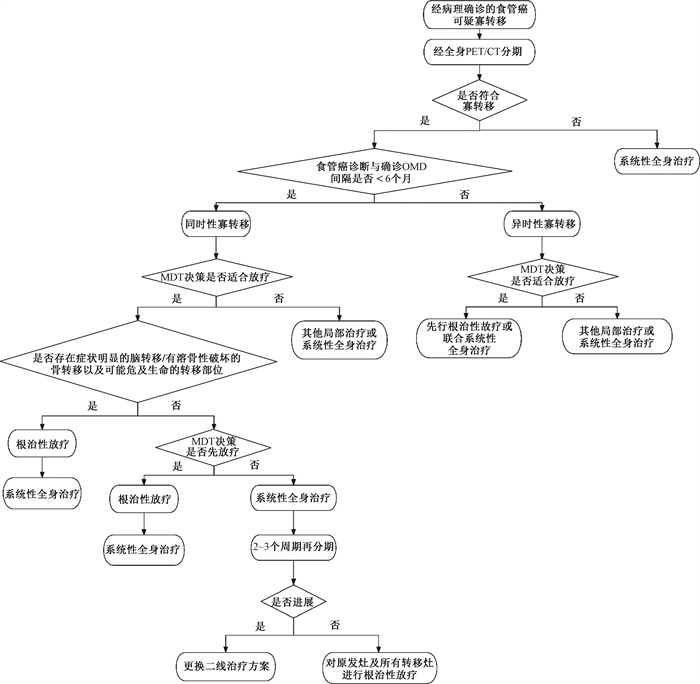
2、放疗时机专家共识六:食管癌寡转移的根治性放疗与系统性治疗的联合时机仍需经MDT(图 2),目前尚缺乏放疗加入时间的明确推荐,建议进一步开展相关的临床研究。对于症状明显的脑转移/有溶骨性破坏的骨转移,以及可能危及生命的转移部位,在进行系统性治疗前可考虑先行局部放疗缓解患者症状(证据质量:中;共识水平:99%)。
|
注:MDT. 治疗决策需经多学科团队 图 2 食管癌寡转移放疗和全身治疗的顺序 Figure 2 Sequence of radiotherapy and systemic treatment for oligometastatic esophageal cancer |
在欧洲食管胃癌寡转移共识中,对无病生存期较短或中等(≤2年)的同时性/异时性寡转移患者推荐先行系统性治疗,经实体肿瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST)评估后未进展者再行局部治疗;对无病生存时间较长(>2年)的异时性寡转移患者,推荐针对寡转移先行局部治疗或联合系统性治疗[39]。但是治疗期间对治疗可能产生的完全缓解或癌症进展,两者都会限制根治性放疗的潜在临床获益。已有研究证实根治性放疗前进行化疗与寡转移的不良局部控制独立相关[76],这可能是因为加速了克隆性肿瘤细胞的增殖,或者存活的肿瘤细胞在接受化疗后可能会产生更多的耐药性并获得更活跃的DNA修复能力[77-78]。并且食管癌全身治疗的预后较差,对所有转移部位进行早期局部根治性放疗可能会通过对抗全身治疗的获得性耐药来改善预后。相对短期和不良反应较轻的局部治疗不会延误全身治疗,但全身治疗的低反应率和高不良反应可能导致局部治疗的不耐受[18]。ESO-Shanghai 13研究中局部干预先于或同步系统治疗进行,其中放疗占局部干预手段的89%。目前尚无有关食管癌同时性寡转移患者诱导全身治疗的最佳持续时间的随机对照研究。
在SBRT联合免疫/靶向治疗共识中,57%~64%的专家认为不应在进行SBRT同一天进行抗PD-1/PD-L1单抗治疗,71%的专家认为不应在进行SBRT同一天进行抗CTLA-4单抗治疗,而75%的专家一致认为不应在进行SBRT同一天进行抗CTLA-4单抗联合抗PD-1单抗治疗[79]。由于大多数免疫检查点抑制剂药物半衰期较长,因此可能没有必要在放疗期间暂停免疫治疗。相比之下,化疗药物半衰期较短,综合考虑患者耐受性及可能重叠的不良反应后应允许延迟化疗。目前尚无随机对照试验证实根治性放疗期间暂停全身治疗的必要性,来自多项回顾性研究的数据表明,在放疗期间同步全身治疗可能是安全的[15, 80-81]。
在获得更好的前瞻性数据之前,专家组推荐对放疗与系统性治疗的联合时机进行多学科团队讨论,均衡考虑患者可能从同步治疗中获得的实质性临床益处和重叠的不良反应带来的潜在风险后进行决策。
3、放疗技术专家共识七:对于食管癌寡转移患者,建议使用先进的放疗技术以保证放疗的安全性。原发灶推荐采用常规分割模式的精准放疗技术,寡转移灶推荐采用SBRT、大分割放疗和基于疾病部位和肿瘤负荷的风险适度的根治性放疗等(证据质量:高;共识水平:100%)。
对于食管癌寡转移,放疗的主要目标是最大限度地控制肿瘤及减少辐射的短期和长期影响。先进的现代放疗技术可以达成更小的摆位边界而不影响肿瘤覆盖,同时限制正常组织的受量,可根据具体情况选择SBRT、立体定向消融放疗(stereotactic ablative radiation therapy,SABR)、常规分割放射治疗等。SBRT具有小野集束照射、剂量跌落陡峭的特点,能够精确靶向转移病灶并降低不良反应风险,因此已成为OMD患者多学科诊疗的标准治疗[14]。在评估OMD患者局部治疗的前瞻性随机Ⅱ期试验中[2, 82],SBRT作为最常用的局部治疗,结果显示了可耐受的不良反应与良好的疗效。在探索食管癌寡转移局部治疗价值的前瞻性Ⅱ期试验ESO-Shanghai 13研究中,则采用SABR作为局部治疗的首选。
在对各种转移灶给予高剂量、大分割放疗时,需要适当的固定,以确保安全、可重复地给予根治性的高剂量放疗。对肺及上腹部等受呼吸运动影响的寡转移灶进行根治性放疗时,使用呼吸相关4D-CT和使用运动补偿策略(例如门控、跟踪、识别内部靶体积、屏气、腹部压迫)对呼吸诱导的目标运动进行个体评估可提高治疗准确性[83]。呼吸相关4D-CT与传统CT相比,使用单层、多层或锥形束采集可以提供呼吸周期中多个点的肿瘤位置的三维数据,而时间分辨率略有降低。为解决实际肿瘤位置与计划肿瘤位置之间存在的差异,应在计划阶段由4D-CT对治疗前CT进行补充。由于肺、胰腺、肝脏等部位的转移瘤难以直接成像,因此通常需要使用植入的基准标记物定位肿瘤以实现实时跟踪。但该方法的使用应在精准性和成本、有创性及可能的标志物迁移之间进行权衡[84]。此外,建议每次治疗前进行在线图像引导以减少误差。
尽管大分割对免疫激活的作用更强,但食管作为空腔脏器,增加单次分割可能会增加出血和食管瘘的风险。对于食管原发灶,推荐采用常规分割模式的精准放疗技术。对于食管原发灶、毗邻食管区域且可与食管原发灶包含在同一放射野内的区域外淋巴结,推荐采用常规分割模式的精准放疗技术。目前,晚期、复发转移性食管癌的标准治疗通常为化疗联合免疫治疗,在免疫联合的基础上,其他部位寡转移病灶,或异时性寡转移患者,由肿瘤放射治疗科医生评估技术可行性及安全性后,在考虑危及器官耐受性的前提下,可优先考虑SBRT治疗。
4、放疗剂量专家共识八:对于食管癌寡转移患者,食管原发病灶放疗剂量推荐为2 Gy等效剂量(equivalent dose, EQD2) 50~60 Gy/25~30次。寡转移灶的放射治疗推荐采用根治性剂量和分割方案以达到较好的局部控制,放疗剂量的具体实施应根据不同部位放疗的不良反应风险进行调整(证据质量:高;共识水平:97%)。
原则上,寡转移性病变的治疗旨在永久局部控制转移病灶,从而达到无病状态。对于食管癌寡转移患者,SBRT的最佳剂量和分割仍然未知。临床实践中放疗剂量分割方案常取决于不同的OMD状态和治疗意图、转移灶的解剖位置和大小、联合治疗的方案以及不同中心的经验。
据报道,生物有效剂量(biologically effective dose, BED10) 100 Gy为达到90%局部控制的阈值[85]。多项研究数据仍支持使用较高的BED(例如,>100 Gy BED10)[86-87]。在寡转移性非小细胞肺癌的ASTRO/ESTRO临床实践指南中推荐单独使用SBRT时应采用BED10 ≥75 Gy,以达到最佳的局部控制,而与全身治疗联合时至少采用50~75 Gy的BED10以达到可接受的局部控制[88]。一项回顾性研究显示,BED10 ≥60 Gy的根治性放疗可以延长异时性寡转移食管癌患者的OS[19]。SBRT联合免疫/靶向治疗共识中,专家组认为无论转移灶的位置和受累器官的风险如何都不主张减少SBRT的剂量,因为这可能会危及局部控制的可能性,必要时可将全身治疗与SBRT序贯进行。
不同转移灶大小和转移部位的剂量差异同样显著。一项纳入6个国际中心1 033例多癌种寡转移患者的回顾性研究发现,对于具有放射抵抗性的病变,较小体积的肿瘤(< 27.7 cm3)≥41.2 Gy/5次和较大体积肿瘤(≥27.7 cm3)≥55.2 Gy/5次的照射剂量均可实现1年局部控制率≥95%[89]。探索寡转移性疾病SBRT的癌症特异性剂量和分割方案的OligoCare研究的中期分析显示,肺和肝脏病变的剂量更高。事实上,肺和肝是并联的高危器官,因此具有相对较高的剂量耐受性。而对邻近脊髓、大血管等具有严格正常组织限量部位的转移性病变,较低的BED也可能达到良好的局部控制[90-91]。
最近的研究显示,低剂量放疗可以刺激效应CD4+T细胞和树突状细胞,诱导CD8+/CD4+T细胞向肿瘤浸润,逆转免疫荒漠状态,从而克服免疫治疗耐药。一项探索放疗联合化疗与免疫二线治疗食管鳞癌寡转移的Ⅱ期研究采用了食管/吻合口病变40 Gy/20次、转移灶30 Gy/10次的较低剂量放疗,结果显示了生存获益和良好的安全性[16]。在免疫治疗时代,未来的研究可能会探索较低剂量放疗下临床是否获益。此外,与有关真性寡转移的研究相比,诱导性寡转移的研究使用的放疗剂量更低。
对于食管癌寡转移患者,有回顾性研究显示原发灶接受≥40 Gy根治性放化疗的预后显著优于姑息性放化疗。评估同步放化疗联合度伐利尤单抗姑息治疗伴有吞咽困难寡转移食管癌和胃食管癌的Ⅱ期单臂PALEO研究,采用了30 Gy/10次的原发灶放疗剂量[92]。对于具有潜在可治愈性的食管癌寡转移患者,尤其是同时性寡转移患者,本共识推荐采用EQD2 50~60 Gy/25~30次的原发灶放疗剂量以实现可接受的局部控制。目前,暂无化疗与免疫治疗联合放疗后食管癌寡转移患者原发灶放疗剂量选择的前瞻性证据,推荐进一步开展相关前瞻性研究以指导临床实践。
5、靶区范围专家共识九:对于食管癌寡转移患者,食管原发病灶靶区推荐采用累及野照射。由于转移灶涉及不同器官和病灶数量,可根据肿瘤大小、位置以及周围正常器官和组织的关系等,进行个体化靶区勾画(证据质量:中;共识水平:100%)。
化疗联合免疫治疗是寡转移食管癌的标准治疗方案。放疗联合免疫治疗时, 基于现代影像的累及野照射,其局部控制率不劣于选择性淋巴引流区照射,且不良反应较低[93]。在探索寡转移食管癌局部治疗疗效的Ⅱ期前瞻性研究中,对于食管原发灶均采用了累及野照射[16, 20]。
在探索放疗联合伊立替康加卡瑞利珠单抗治疗一线化疗与免疫治疗失败的寡转移食管鳞癌的Ⅱ期研究[16]中,均将转移性病灶外扩1 cm作为临床靶区(CTV),CTV外扩5 mm作为计划靶区(PTV)。临床中,对转移灶进行靶区勾画时,要综合考虑患者的体能评分、转移灶的位置、大小、邻近的危及器官以及转移灶附近的既往治疗,在实现疾病控制的同时最大限度地减少潜在的不良反应影响。
6、不良反应的规避专家共识十:目前没有充分证据证明食管癌寡转移放疗联合系统性治疗会产生额外的严重不良反应。但在临床实践中,应综合患者的风险因素、联合治疗方案的强度、寡转移灶的解剖位置等建立风险评估策略,并进行严格的危及器官限量,以减少正常组织损伤和并发症风险(证据质量:高;共识水平:100%)。
一项纳入了108项研究包括多癌种共2 675例患者的系统性分析显示,接受SBRT联合全身治疗后3级及以上不良反应发生率为23%,其中约1/3的不良事件与SBRT有关[79]。另一项纳入了21项研究包括多癌种共1 290例寡转移患者的荟萃分析显示,SABR治疗寡转移患者安全有效,急性和晚期3~5级不良反应的发生率通常不到13%[94]。食管癌寡转移放疗联合全身治疗后常见的高级别治疗相关不良事件为骨髓抑制、疲劳、放射性食管炎、食管瘘、肺炎、恶心、呕吐等(表 4)。目前,并没有充分证据证明放疗联合全身治疗具有不可耐受的不良反应。但SBRT治疗的寡转移病灶可能经过临床筛选以满足关键危及器官的限量,从而降低了潜在不良反应的风险。
|
|
表 4 既往食管癌寡转移研究中≥3级治疗相关不良反应发生率(%) Table 4 Incidence of grade ≥ 3 treatment-related adverse reactions in previous studies on oligometastasis of esophageal cancer (%) |
放射治疗开始前,需根据患者身体状况、营养评分、重要器官功能评估患者的风险因素。由于免疫治疗和放疗联合治疗可能会增加不良反应的发生风险,联合治疗的方案(化疗方案/是否联合免疫治疗)、时机(是否同步放疗)、放疗剂量(是否能达到高BED10剂量)均应慎重决策。对于毗邻重要危及器官,例如脊髓、大血管等的寡转移灶,在追求较高局部控制率的同时应格外注意正常组织并发症的发生。对于一般状况差、伴恶病质、心肺功能差或合并其他重要器官严重疾病、已有食管大出血先兆征象、食管瘘合并严重感染或穿孔征象明显的患者,应尽量避免放疗或充分评估放疗风险。
六、预后因素专家共识十一:目前食管癌寡转移的预后指标仍缺乏高级别证据,放疗联合系统性治疗的预后需考虑临床因素和生物学因素,如转移部位、转移灶数量、转移器官数量、细胞程序性死亡-配体1(programmed cell death ligand, PD-L1)表达等。建议进一步开展相关研究以细化寡转移患者的预后分层,以指导个体化诊疗(证据质量:低;共识水平:100%)。
既往研究显示,孤立性转移、无肺外转移和>12个月的无病间隔时间是转移性食管癌的有利预后因素[95-96]。原发灶放疗联合化疗免疫治疗可改善转移性食管鳞癌中非区域淋巴结转移患者的生存[74]。对于寡转移性食管癌,脑转移和骨转移通常与较差的预后有关,而仅肺寡转移的患者预后相对较好[19, 27]。一项纳入了97项研究的寡转移性食管胃癌的荟萃分析显示,不同寡转移部位影响患者局部治疗的预后,仅肝寡转移、仅肺寡转移、仅区域外淋巴结寡转移、仅脑寡转移和仅肾上腺寡转移的患者局部治疗联合/不联合全身治疗与单独全身治疗的中位OS(月)分别为24 vs.7.6、29 vs.10、19 vs.未知、16 vs.1.8、16 vs. 未知[35]。此外,Chen等[23]发现单个转移灶的寡转移食管癌患者预后较好。另一项比较老年同时性寡转移食管癌患者同步放化疗与单纯化疗的回顾性研究也显示,单个器官转移和1~3个转移灶患者的预后优于2~3个器官转移和4~5个转移灶的患者[15]。由于临床表现的多样性,食管癌寡转移更加需要转向个体化、多学科管理。目前仍需要更多的真实世界数据及前瞻性研究结果,尤其是完善器官特异性寡转移的定义(特定器官的最大转移灶数量),以指导临床实践。在免疫治疗的背景下,对食管癌寡转移不同PD-L1表达水平对预后的影响以及放疗联合免疫治疗能否改善PD-L1低表达患者的肿瘤反应率需要进一步探索,这对于最大限度地提高放疗与全身治疗相结合的临床获益至关重要。其他生物标志物和预后模型的建立亦有待开发和验证。
七、食管癌寡转移根治性放疗后,疾病进展时再次放疗的指征专家共识十二:食管癌寡转移根治性放疗后再次出现疾病进展的治疗决策需要经过MDT,应综合考虑疾病进展与先前治疗部位的空间位置、时间间隔、全身治疗的方案、疾病进展的性质等。对适合手术或其他局部治疗方式的进展病灶可采用相应的治疗手段。对于影像学和临床上出现缓慢进展的患者,在技术可行且临床安全的情况下,可考虑行SBRT治疗。对于快速进展的患者,应优先考虑系统性治疗联合或不联合局部治疗(证据质量:低;共识水平:100%)。
寡转移食管癌进行根治性放疗后,疾病进展模式可分为重复性寡转移和广泛进展两种情况。对于以惰性疾病表型为特征的重复性寡转移疾病,治疗的目的仍是达到无病状态,这就需要通过全身系统性治疗来控制隐匿性转移和/或根治性局部治疗,以达到良好的局部控制。
目前关于重复性寡转移的预后相关研究数据较少。一项有关寡转移性非小细胞肺癌的Ⅱ期研究显示,对所有重复性转移病灶的挽救性根治性局部治疗与改善OS的趋势相关[5]。但该研究涉及到的接受重复性SBRT的病例数较少,并缺乏与单疗程SBRT组的对照。而Milano等[97]前瞻性分析了121例寡转移患者,相较于单疗程SBRT,接受重复SBRT治疗的患者OS有更长的趋势(32 vs.21个月,P=0.13)。此外,一项回顾性研究显示,与接受单疗程SBRT相比,接受重复性SBRT的寡转移患者可以获得OS获益(48.7 vs.34.8个月,P=0.01)[98]。上述两项研究纳入了不同原发肿瘤的患者,这意味着结果不能直接类推至食管癌。
重复性寡转移的食管癌患者在技术上可能适合再次放疗,但是能否获得生存获益尚不清楚,再程放疗对食管癌寡转移的作用需在前瞻性研究中进一步探索。但在食管癌领域,尤其是寡进展情况下,由于全身治疗手段仍然有限,局部治疗的早期干预可能对总体预后产生有利影响。
多学科团队讨论对于重复性放疗至关重要。在寡转移进展中,应重新评估患者以实施最佳的治疗策略。对于影像学评价为缓慢进展的患者,在技术可行且临床安全的情况下,可考虑SBRT作为最佳治疗方法。对于快速进展的患者,应优先考虑系统性治疗联合或不联合局部治疗。
八、随访专家共识十三:对于诊断为食管癌寡转移并接受放疗的患者,建议定期进行临床和CT等影像学随访。放疗后两年内每3个月复查1次,第2~5年每3~6个月复查1次,此后每年复查。可根据临床事件考虑调整随访频率(证据质量:低;共识水平:100%)。
在SABR-COMET研究的长期随访中,约79%接受SBRT的寡转移患者在5年随访期间出现疾病进展/复发[99]。接受放疗的食管癌寡转移患者应接受定期随访,目前随访频率未见相关证据支持,故本共识建议前两年每3个月1次,第2~5年每3~6个月1次,此后每年复查。另外,随访频率具体还应取决于全身性疾病的状态和评估全身治疗反应的需要。若出现不良临床事件,可考虑调整随访频率,采用个体化随访方式。
九、总结当前,本共识在一定程度上明确了食管癌寡转移的定义和分类,对诊断标准、放疗的时机、技术、剂量、联合治疗的模式、重复性放疗的指征提供推荐或参考,并对寡转移的预后因素进行了探讨。本共识的形成有利于形成食管癌寡转移放射治疗的规范化应用和管理。食管癌寡转移领域放疗的研究相对较少,本共识中较多建议是基于低质量证据和/或专家意见,未来需要更多前瞻性研究数据加以验证和更新。
指导专家组成员: 于金明(山东第一医科大学附属肿瘤医院)、李宝生(山东第一医科大学附属肿瘤医院)、王平(天津医科大学肿瘤医院)、王俊杰(北京大学第三医院)、李印(中国医学科学院肿瘤医院)、沈琳(北京大学肿瘤医院)、吴永忠(重庆大学附属肿瘤医院)、袁双虎(中国科学技术大学附属第一医院)
审定专家组成员(按姓氏笔画排序): 马红兵(西安交通大学第二附属医院)、王晖(湖南省肿瘤医院)、王春波(哈尔滨医科大学附属肿瘤医院)、曲宝林(中国人民解放军总医院第一医学中心)、孙新臣(南京医科大学第一附属医院)、李杰(中国医学科学院肿瘤医院山西医院)、李建成(福建省肿瘤医院)、李涛(四川省肿瘤医院)、肖泽芬(中国医学科学院肿瘤医院)、汪浩(安徽医科大学第一附属医院)、张晓智(西安交通大学第一附属医院)、陈明(中山大学肿瘤防治中心)、林勤(厦门大学附属第一医院)、郑安平(安阳市肿瘤医院)、赵仁(宁夏医科大学总医院)、赵快乐(复旦大学附属肿瘤医院)、秦建军(中国医学科学院肿瘤医院)、葛红(河南省肿瘤医院)、韩春(河北医科大学第四医院)、傅小龙(上海市胸科医院)、鲁智豪(北京大学肿瘤医院)
执笔人: 周志国(河北医科大学第四医院)、吕晓岩(河北医科大学第四医院)
执笔专家组成员 (按姓氏笔画排序):习勉(中山大学肿瘤防治中心)、马代远(川北医学院附属医院)、王奇峰(四川省肿瘤医院)、王琳琳(山东第一医科大学附属肿瘤医院)、王澜(河北医科大学第四医院)、王鑫(中国医学科学院肿瘤医院)、王鑫(郑州大学第一附属医院)、巩合义(济南市中心医院)、朱向高(北京大学肿瘤医院内蒙古医院)、刘文扬(中国医学科学院肿瘤医院)、刘芳(中国人民解放军总医院第一医学中心)、刘俊(上海市胸科医院)、刘智华(江西省肿瘤医院)、苏胜发(贵州医科大学附属肿瘤医院)、李巧巧(中山大学肿瘤防治中心)、李宁(中国医学科学院肿瘤医院山西医院)、杨从容(河北医科大学第四医院)、余荣(北京大学肿瘤医院)、沈文斌(河北医科大学第四医院)、张建东(山东第一医科大学第一附属医院)、张耀文(安阳市肿瘤医院)、陈永顺(中山大学附属第八医院)、陈伟霖(福建医科大学附属漳州市医院)、武亚晶(河北医科大学第四医院)、罗宏涛(甘肃省肿瘤医院)、季永领(浙江省肿瘤医院)、周伟(重庆大学附属肿瘤医院)、周涛(中国科学技术大学附属第一医院)、周晔(河北省人民医院)、赵丽娜(空军军医大学西京医院)、赵胜光(上海交通大学医学院附属瑞金医院)、胡威(遵义医科大学附属医院)、姜新(吉林大学白求恩第一医院)、秦颂兵(苏州大学附属第一医院)、钱东(中国科学技术大学附属第一医院)、徐裕金(浙江省肿瘤医院)、黄伟(山东第一医科大学附属肿瘤医院)、曹建忠(中国医学科学院肿瘤医院山西医院)、曹彦硕(北京大学肿瘤医院)、章文成(天津医科大学肿瘤医院)、彭毅(湖北省肿瘤医院)、葛小林(南京医科大学第一附属医院)、谢聪颖(温州医科大学附属第一医院)、蔡旭伟(上海市胸科医院)
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Hellman S, Weichselbaum RR. Oligometastases[J]. J Clin Oncol, 1995, 13(1): 8-10. DOI:10.1200/JCO.1995.13.1.8 |
| [2] |
Palma DA, Olson R, Harrow S, et al. Stereotactic ablative radiotherapy versus standard of care palliative treatment in patients with oligometastatic cancers (SABR-COMET): a randomised, phase 2, open-label trial[J]. Lancet, 2019, 393(10185): 2051-2058. DOI:10.1016/S0140-6736(18)32487-5 |
| [3] |
Ost P, Reynders D, Decaestecker K, et al. Surveillance or metastasis-directed therapy for oligometastatic prostate cancer recurrence: a prospective, randomized, multicenter phase Ⅱ trial[J]. J Clin Oncol, 2018, 36(5): 446-453. DOI:10.1200/JCO.2017.75.4853 |
| [4] |
Dingemans AC, Hendriks L, Berghmans T, et al. Definition of synchronous oligometastatic non-small cell lung cancer-a consensus report[J]. J Thorac Oncol, 2019, 14(12): 2109-2119. DOI:10.1016/j.jtho.2019.07.025 |
| [5] |
Gomez DR, Tang C, Zhang J, et al. Local consolidative therapy vs. maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer: long-term results of a multi-institutional, phase Ⅱ, randomized study[J]. J Clin Oncol, 2019, 37(18): 1558-1565. DOI:10.1200/JCO.19.00201 |
| [6] |
Wu SG, Zhang WW, He ZY, et al. Sites of metastasis and overall survival in esophageal cancer: a population-based study[J]. Cancer Manag Res, 2017, 9: 781-788. DOI:10.2147/CMAR.S150350 |
| [7] |
Sun JM, Shen L, Shah MA, et al. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study[J]. Lancet, 2021, 398(10302): 759-771. DOI:10.1016/S0140-6736(21)01234-4 |
| [8] |
Luo H, Lu J, Bai Y, et al. Effect of camrelizumab vs placebo added to chemotherapy on survival and progression-free survival in patients with advanced or metastatic esophageal squamous cell carcinoma: the ESCORT-1st randomized clinical trial[J]. JAMA, 2021, 326(10): 916-925. DOI:10.1001/jama.2021.12836 |
| [9] |
Xu J, Bai Y, Xu N, et al. Tislelizumab plus chemotherapy as first-line treatment for advanced esophageal squamous cell carcinoma and gastric/gastroesophageal junction adenocarcinoma[J]. Clin Cancer Res, 2020, 26(17): 4542-4550. DOI:10.1158/1078-0432.CCR-19-3561 |
| [10] |
Shen L, Kato K, Kim SB, et al. Tislelizumab versus chemotherapy as second-line treatment for advanced or metastatic esophageal squamous cell carcinoma (RATIONALE-302): a randomized phase Ⅲ study[J]. J Clin Oncol, 2022, 40(26): 3065-3076. DOI:10.1200/JCO.21.01926 |
| [11] |
Huang J, Xu J, Chen Y, et al. Camrelizumab versus investigator's choice of chemotherapy as second-line therapy for advanced or metastatic oesophageal squamous cell carcinoma (ESCORT): a multicentre, randomised, open-label, phase 3 study[J]. Lancet Oncol, 2020, 21(6): 832-842. DOI:10.1016/S1470-2045(20)30110-8 |
| [12] |
Kojima T, Shah MA, Muro K, et al. Randomized phase Ⅲ KEYNOTE-181 study of pembrolizumab versus chemotherapy in advanced esophageal cancer[J]. J Clin Oncol, 2020, 38(35): 4138-4148. DOI:10.1200/JCO.20.01888 |
| [13] |
Kato K, Cho BC, Takahashi M, et al. Nivolumab versus chemotherapy in patients with advanced oesophageal squamous cell carcinoma refractory or intolerant to previous chemotherapy (ATTRACTION-3): a multicentre, randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2019, 20(11): 1506-1517. DOI:10.1016/S1470-2045(19)30626-6 |
| [14] |
Lievens Y, Guckenberger M, Gomez D, et al. Defining oligometastatic disease from a radiation oncology perspective: an ESTRO-ASTRO consensus document[J]. Radiother Oncol, 2020, 148: 157-166. DOI:10.1016/j.radonc.2020.04.003 |
| [15] |
Shi Z, Zhu X, Ke S, et al. Survival impact of concurrent chemoradiotherapy for elderly patients with synchronous oligometastatic esophageal squamous cell carcinoma: a propensity score matching and landmark analyses[J]. Radiother Oncol, 2021, 164: 236-244. DOI:10.1016/j.radonc.2021.09.033 |
| [16] |
Zhao W, Ke S, Cai X, et al. Radiotherapy plus camrelizumab and irinotecan for oligometastatic esophageal squamous cell carcinoma patients after first-line immunotherapy plus chemotherapy failure: an open-label, single-arm, phase Ⅱ trial[J]. Radiother Oncol, 2023, 184: 109679. DOI:10.1016/j.radonc.2023.109679 |
| [17] |
Liu Q, Zhu Z, Chen Y, et al. Phase 2 study of stereotactic body radiation therapy for patients with oligometastatic esophageal squamous cell carcinoma[J]. Int J Radiat Oncol Biol Phys, 2020, 108(3): 707-715. DOI:10.1016/j.ijrobp.2020.05.003 |
| [18] |
Liu Q, Chen J, Lin Y, et al. Systemic therapy with or without local intervention for oligometastatic oesophageal squamous cell carcinoma (ESO-Shanghai 13): an open-label, randomised, phase 2 trial[J]. Lancet Gastroenterol Hepatol, 2024, 9(1): 45-55. DOI:10.1016/S2468-1253(23)00316-3 |
| [19] |
Li J, Wen Y, Xiang Z, et al. Radical radiotherapy for metachronous oligometastasis after initial treatment of esophageal cancer[J]. Radiother Oncol, 2021, 154: 201-206. DOI:10.1016/j.radonc.2020.09.042 |
| [20] |
Wu L, Li B, Wan G, et al. Toripalimab plus chemotherapy and radiotherapy for treatment-naive advanced esophageal squamous cell carcinoma: a single-arm phase 2 trial[J]. Nat Commun, 2024, 15(1): 7116. DOI:10.1038/s41467-024-51105-2 |
| [21] |
Li B, Li W, Fan B, et al. Efficacy of radiotherapy in oligometastatic esophageal squamous cell cancer patients: new evidence from a retrospective study[J]. Int J Radiat Oncol Biol Phys, 2020, 108(3 Suppl): e611. DOI:10.1016/j.ijrobp.2020.07.1857 |
| [22] |
Morinaga T, Iwatsuki M, Yamashita K, et al. Oligometastatic recurrence as a prognostic factor after curative resection of esophageal squamous cell carcinoma[J]. Surg Today, 2021, 51(5): 798-806. DOI:10.1007/s00595-020-02173-6 |
| [23] |
Chen Y, Cheng X, Song H, et al. Outcomes of concurrent chemoradiotherapy versus chemotherapy alone for esophageal squamous cell cancer patients presenting with oligometastases[J]. J Thorac Dis, 2019, 11(4): 1536-1545. DOI:10.21037/jtd.2019.03.10 |
| [24] |
Cancer Genome Atlas Research Network, University AWGA, Agency BCC, et al. Integrated genomic characterization of oesophageal carcinoma[J]. Nature, 2017, 541(7636): 169-175. DOI:10.1038/nature20805 |
| [25] |
Verstegen MH, Harker M, van de Water C, et al. Metastatic pattern in esophageal and gastric cancer: Influenced by site and histology[J]. World J Gastroenterol, 2020, 26(39): 6037-6046. DOI:10.3748/wjg.v26.i39.6037 |
| [26] |
Al-Batran SE, Homann N, Pauligk C, et al. Effect of neoadjuvant chemotherapy followed by surgical resection on survival in patients with limited metastatic gastric or gastroesophageal junction cancer: the AIO-FLOT3 trial[J]. JAMA Oncol, 2017, 3(9): 1237-1244. DOI:10.1001/jamaoncol.2017.0515 |
| [27] |
Kroese TE, Christ SM, van Rossum P, et al. Incidence and survival of patients with oligometastatic esophagogastric cancer: a multicenter cohort study[J]. Radiother Oncol, 2022, 173: 269-276. DOI:10.1016/j.radonc.2022.06.012 |
| [28] |
Eastern Cooperative Oncology Group (ECOG-ACRIN Cancer Research Group). Testing the addition of radiotherapy to the usual treatment (chemotherapy) for patients with esophageal and gastric cancer that has spread to a limited number of other places in the body[Z/OL]. Bethesda: ECOG, 2020. (2020-01-30)[2024-11-05]. clinicaltrials. gov/NCT04248452#study-record-dates.
|
| [29] |
Al-Batran SE, Goetze TO, Mueller DW, et al. The RENAISSANCE (AIO-FLOT5) trial: effect of chemotherapy alone vs. chemotherapy followed by surgical resection on survival and quality of life in patients with limited-metastatic adenocarcinoma of the stomach or esophagogastric junction - a phase Ⅲ trial of the German AIO/CAO-V/CAOGI[J]. BMC Cancer, 2017, 17(1): 893. DOI:10.1186/s12885-017-3918-9 |
| [30] |
Iwatsuki M, Harada K, Wang X, et al. The prognostic factors associated with long-term survival in the patients with synchronous oligometastatic esophageal adenocarcinoma[J]. J Clin Oncol, 2019, 37(15_suppl): e15523. DOI:10.1200/JCO.2019.37.15_suppl.e15523 |
| [31] |
Schmidt T, Alldinger I, Blank S, et al. Surgery in oesophago-gastric cancer with metastatic disease: treatment, prognosis and preoperative patient selection[J]. Eur J Surg Oncol, 2015, 41(10): 1340-1347. DOI:10.1016/j.ejso.2015.05.005 |
| [32] |
Port JL, Nasar A, Lee PC, et al. Definitive therapy for isolated esophageal metastases prolongs survival[J]. Ann Thorac Surg, 2012, 94(2): 413-419; discussion 419-420. DOI:10.1016/j.athoracsur.2012.03.075 |
| [33] |
Al-Batran S-E, Lorenzen S, Riera J, et al. Effect of chemotherapy/targeted therapy alone vs. chemotherapy/targeted therapy followed by radical surgical resection on survival and quality of life in patients with limited-metastatic adenocarcinoma of the stomach or esophagogastric junction: the IKF-575/RENAISSANCE phase Ⅲ trial[J]. J Clin Oncol, 2024, 42(17_suppl): LBA4001. DOI:10.1200/JCO.2024.42.17_suppl.LBA4001 |
| [34] |
M.D. Anderson Cancer Center. Chemotherapy with or without radiation or surgery in treating participants with oligometastatic esophageal or gastric cancer[Z/OL]. Bethesda: M.D. Anderson Cancer Center. (2017-05-19)[2024-10-08]. clinicaltrials. gov/ct2/show/NCT03161522.
|
| [35] |
Kroese TE, van Laarhoven H, Nilsson M, et al. Definition of oligometastatic esophagogastric cancer and impact of local oligometastasis-directed treatment: a systematic review and meta-analysis[J]. Eur J Cancer, 2022, 166: 254-269. DOI:10.1016/j.ejca.2022.02.018 |
| [36] |
Kroese TE, van Laarhoven H, Schoppman SF, et al. Definition, diagnosis and treatment of oligometastatic oesophagogastric cancer: a Delphi consensus study in Europe[J]. Eur J Cancer, 2023, 185: 28-39. DOI:10.1016/j.ejca.2023.02.015 |
| [37] |
Ding Z, Sichuan University. Conversion therapy with sintilimab plus CAPOX in patients with unresectable locally advanced or limited metastatic adenocarcinoma of the stomach or esophagogastric junction(CTSCAPOXSEA)[Z/OL]. Bethesda: Ding Z, Sichuan University, 2020. (2020-02-11)[2024-10-20]. clinicaltrials. gov/study/NCT04263870#study-record-dates.
|
| [38] |
Fudan University. PD-1 antibody combined with modified FLOT regimen in the treatment of unresectable locally advanced or limited metastatic gastric cancer[Z/OL]. Bethesda: Fudan University. (2020-08-12)[2024-10-08]. clinicaltrials. gov/NCT04510064#study-record-dates.
|
| [39] |
Xu D, Sun Yat-sen University. Chemotherapy alone versus surgery plus chemotherapy for distal gastric cancer with one non-curable factor[Z/OL]. Bethesda: Xu D, Sun Yat-sen University. (2018-01-16)[2024-10-08]. clinicaltrials. gov/ct2/show/study/NCT03399253.
|
| [40] |
Vogelbaum MA, Brown PD, Messersmith H, et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline[J]. J Clin Oncol, 2022, 40(5): 492-516. DOI:10.1200/JCO.21.02314 |
| [41] |
Schiff D, Messersmith H, Brastianos PK, et al. Radiation therapy for brain metastases: ASCO guideline endorsement of ASTRO guideline[J]. J Clin Oncol, 2022, 40(20): 2271-2276. DOI:10.1200/JCO.22.00333 |
| [42] |
Yamamoto M, Serizawa T, Shuto T, et al. Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study[J]. Lancet Oncol, 2014, 15(4): 387-395. DOI:10.1016/S1470-2045(14)70061-0 |
| [43] |
Chang WS, Kim HY, Chang JW, et al. Analysis of radiosurgical results in patients with brain metastases according to the number of brain lesions: is stereotactic radiosurgery effective for multiple brain metastases?[J]. J Neurosurg, 2010, 113(Suppl): 73-78. DOI:10.3171/2010.8.GKS10994 |
| [44] |
Dingemans AC, Hendriks L, Berghmans T, et al. Definition of synchronous oligometastatic non-small cell lung cancer-a consensus report[J]. J Thorac Oncol, 2019, 14(12): 2109-2119. DOI:10.1016/j.jtho.2019.07.025 |
| [45] |
Guckenberger M, Lievens Y, Bouma AB, et al. Characterisation and classification of oligometastatic disease: a European Society for Radiotherapy and Oncology and European Organisation for Research and Treatment of Cancer consensus recommendation[J]. Lancet Oncol, 2020, 21(1): e18-e28. DOI:10.1016/S1470-2045(19)30718-1 |
| [46] |
Kim JH, Rha SY, Kim C, et al. Clinicopathologic features of metachronous or synchronous gastric cancer patients with three or more primary sites[J]. Cancer Res Treat, 2010, 42(4): 217-224. DOI:10.4143/crt.2010.42.4.217 |
| [47] |
Mekenkamp LJ, Koopman M, Teerenstra S, et al. Clinicopathological features and outcome in advanced colorectal cancer patients with synchronous vs metachronous metastases[J]. Br J Cancer, 2010, 103(2): 159-164. DOI:10.1038/sj.bjc.6605737 |
| [48] |
Tsai MS, Su YH, Ho MC, et al. Clinicopathological features and prognosis in resectable synchronous and metachronous colorectal liver metastasis[J]. Ann Surg Oncol, 2007, 14(2): 786-794. DOI:10.1245/s10434-006-9215-5 |
| [49] |
Ashworth AB, Senan S, Palma DA, et al. An individual patient data metaanalysis of outcomes and prognostic factors after treatment of oligometastatic non-small-cell lung cancer[J]. Clin Lung Cancer, 2014, 15(5): 346-355. DOI:10.1016/j.cllc.2014.04.003 |
| [50] |
Fleckenstein J, Petroff A, Schäfers HJ, et al. Long-term outcomes in radically treated synchronous vs. metachronous oligometastatic non-small-cell lung cancer[J]. BMC Cancer, 2016, 16: 348. DOI:10.1186/s12885-016-2379-x |
| [51] |
Rim CH, Cho WK, Lee JH, et al. Radiation oncologists' perspectives on oligometastatic disease: a Korean survey study[J]. Cancer Res Treat, 2024, 56(2): 414-421. DOI:10.4143/crt.2023.876 |
| [52] |
Nevens D, Jongen A, Kindts I, et al. Completeness of reporting oligometastatic disease characteristics in the literature and influence on oligometastatic disease classification using the ESTRO/EORTC nomenclature[J]. Int J Radiat Oncol Biol Phys, 2022, 114(4): 587-595. DOI:10.1016/j.ijrobp.2022.06.067 |
| [53] |
Antoch G, Vogt FM, Freudenberg LS, et al. Whole-body dual-modality PET/CT and whole-body MRI for tumor staging in oncology[J]. JAMA, 2003, 290(24): 3199-3206. DOI:10.1001/jama.290.24.3199 |
| [54] |
Li Y, Jin G, Su D. Comparison of gadolinium-enhanced MRI and 18FDG PET/PET-CT for the diagnosis of brain metastases in lung cancer patients: a meta-analysis of 5 prospective studies[J]. Oncotarget, 2017, 8(22): 35743-35749. DOI:10.18632/oncotarget.16182 |
| [55] |
Weinberg JS, Suki D, Hanbali F, et al. Metastasis of esophageal carcinoma to the brain[J]. Cancer, 2003, 98(9): 1925-1933. DOI:10.1002/cncr.11737 |
| [56] |
Cheng S, Yang L, Dai X, et al. The risk and prognostic factors for brain metastases in esophageal cancer patients: an analysis of the SEER database[J]. BMC Cancer, 2021, 21(1): 1057. DOI:10.1186/s12885-021-08802-8 |
| [57] |
Song Z, Lin B, Shao L, et al. Brain metastases from esophageal cancer: Clinical review of 26 cases[J]. World Neurosurg, 2014, 81(1): 131-135. DOI:10.1016/j.wneu.2013.02.058 |
| [58] |
Xiao L, Mowery YM, Czito BG, et al. Brain metastases from esophageal squamous cell carcinoma: clinical characteristics and prognosis[J]. Front Oncol, 2021, 11: 652509. DOI:10.3389/fonc.2021.652509 |
| [59] |
Welch G, Ross HJ, Patel NP, et al. Incidence of brain metastasis from esophageal cancer[J]. Dis Esophagus, 2017, 30(9): 1-6. DOI:10.1093/dote/dox071 |
| [60] |
Boys JA, Worrell SG, Chandrasoma P, et al. Can the risk of lymph node metastases be gauged in endoscopically resected submucosal esophageal adenocarcinomas? a multi-center study[J]. J Gastrointest Surg, 2016, 20(1): 6-12. DOI:10.1007/s11605-015-2950-9 |
| [61] |
Pieterman RM, van Putten JW, Meuzelaar JJ, et al. Preoperative staging of non-small-cell lung cancer with positron-emission tomography[J]. N Engl J Med, 2000, 343(4): 254-261. DOI:10.1056/NEJM200007273430404 |
| [62] |
Mac Manus MP, Hicks RJ, Ball DL, et al. F-18 fluorodeoxyglucose positron emission tomography staging in radical radiotherapy candidates with nonsmall cell lung carcinoma: powerful correlation with survival and high impact on treatment[J]. Cancer, 2001, 92(4): 886-895. DOI:10.1002/1097-0142(20010815)92:4<886::aid-cncr1397>3.0.co;2-v |
| [63] |
Stroobants SG, D'Hoore I, Dooms C, et al. Additional value of whole-body fluorodeoxyglucose positron emission tomography in the detection of distant metastases of non-small-cell lung cancer[J]. Clin Lung Cancer, 2003, 4(4): 242-247. DOI:10.3816/clc.2003.n.005 |
| [64] |
Schwarzenböck S, Souvatzoglou M, Krause BJ. Choline PET and PET/CT in primary diagnosis and staging of prostate cancer[J]. Theranostics, 2012, 2(3): 318-330. DOI:10.7150/thno.4008 |
| [65] |
Shimoyama T, Katagiri H, Harada H, et al. Fracture after radiation therapy for femoral metastasis: incidence, timing and clinical features[J]. J Radiat Res, 2017, 58(5): 661-668. DOI:10.1093/jrr/rrx038 |
| [66] |
Luketich JD, Schauer PR, Meltzer CC, et al. Role of positron emission tomography in staging esophageal cancer[J]. Ann Thorac Surg, 1997, 64(3): 765-769. DOI:10.1016/s0003-4975(97)00624-3 |
| [67] |
Kato H, Kuwano H, Nakajima M, et al. Comparison between positron emission tomography and computed tomography in the use of the assessment of esophageal carcinoma[J]. Cancer, 2002, 94(4): 921-928. |
| [68] |
Mahajan A, Ahmed S, McAleer MF, et al. Post-operative stereotactic radiosurgery versus observation for completely resected brain metastases: a single-centre, randomised, controlled, phase 3 trial[J]. Lancet Oncol, 2017, 18(8): 1040-1048. DOI:10.1016/S1470-2045(17)30414-X |
| [69] |
Eitz KA, Lo SS, Soliman H, et al. Multi-institutional analysis of prognostic factors and outcomes after hypofractionated stereotactic radiotherapy to the resection cavity in patients with brain metastases[J]. JAMA Oncol, 2020, 6(12): 1901-1909. DOI:10.1001/jamaoncol.2020.4630 |
| [70] |
Spratt DE, Beeler WH, de Moraes FY, et al. An integrated multidisciplinary algorithm for the management of spinal metastases: an International Spine Oncology Consortium report[J]. Lancet Oncol, 2017, 18(12): e720-e730. DOI:10.1016/S1470-2045(17)30612-5 |
| [71] |
Shi Z, Zhu X, Ruan C, et al. Evaluation of concurrent chemoradiotherapy for survival outcomes in patients with synchronous oligometastatic esophageal squamous cell carcinoma[J]. JAMA Netw Open, 2022, 5(12): e2244619. DOI:10.1001/jamanetworkopen.2022.44619 |
| [72] |
Duan Y, Li B, Qin W, et al. PD-1 inhibitors and chemotherapy combined with or without radiotherapy for patients with oligometastatic esophageal cancer[J]. Int J Radiat Oncol, 2023, 117(2): e294-e295. DOI:10.1016/j.ijrobp.2023.06.2302 |
| [73] |
Mine S, Tanaka K, Kawachi H, et al. Japanese classification of esophageal cancer, 12th edition: part I[J]. Esophagus, 2024, 21(3): 179-215. DOI:10.1007/s10388-024-01054-y |
| [74] |
Chen B, Chen W, Cheng Q, et al. Comparison of efficacy and safety of combined chemoimmunotherapy with or without radiation therapy for stage ⅣB esophageal squamous cell carcinoma: a multicenter propensity score matching analysis[J]. Int J Radiat Oncol Biol Phys, 2024, 120(4): 1084-1095. DOI:10.1016/j.ijrobp.2024.06.008 |
| [75] |
Shah MA, Bennouna J, Doi T, et al. KEYNOTE-975 study design: a Phase Ⅲ study of definitive chemoradiotherapy plus pembrolizumab in patients with esophageal carcinoma[J]. Future Oncol, 2021, 17(10): 1143-1153. DOI:10.2217/fon-2020-0969 |
| [76] |
Sharma A, Baker S, Duijm M, et al. Prognostic factors for local control and survival for inoperable pulmonary colorectal oligometastases treated with stereotactic body radiotherapy[J]. Radiother Oncol, 2020, 144: 23-29. DOI:10.1016/j.radonc.2019.10.004 |
| [77] |
El Sharouni SY, Kal HB, Battermann JJ. Accelerated regrowth of non-small-cell lung tumours after induction chemotherapy[J]. Br J Cancer, 2003, 89(12): 2184-2189. DOI:10.1038/sj.bjc.6601418 |
| [78] |
Fink MK, Kleeberg UR, Bartels S. Adjuvant therapy-related shortening of survival (ATRESS): an underrated phenomenon[J]. Oncologist, 2015, 20(1): 88. DOI:10.1634/theoncologist.2014-0273 |
| [79] |
Kroeze S, Pavic M, Stellamans K, et al. Metastases-directed stereotactic body radiotherapy in combination with targeted therapy or immunotherapy: systematic review and consensus recommendations by the EORTC-ESTRO OligoCare consortium[J]. Lancet Oncol, 2023, 24(3): e121-e132. DOI:10.1016/S1470-2045(22)00752-5 |
| [80] |
Duan Y, Qin W, Yang L, et al. Safety and efficacy of concurrent or sequential radiotherapy plus (PD-1) inhibitors in oligometastatic esophageal cancer[J]. Cancer Manag Res, 2023, 15: 55-65. DOI:10.2147/CMAR.S391529 |
| [81] |
Matoska T, Banerjee A, Shreenivas A, et al. Definitive chemoradiation associated with improved survival outcomes in patients with synchronous oligometastatic esophageal cancer[J]. Cancers (Basel), 2023, 15(9): 2523. DOI:10.3390/cancers15092523 |
| [82] |
Phillips R, Shi WY, Deek M, et al. Outcomes of observation vs stereotactic ablative radiation for oligometastatic prostate cancer: the ORIOLE phase 2 randomized clinical trial[J]. JAMA Oncol, 2020, 6(5): 650-659. DOI:10.1001/jamaoncol.2020.0147 |
| [83] |
Mayinger M, Kotecha R, Sahgal A, et al. Stereotactic body radiotherapy for lung oligo-metastases: systematic review and International Stereotactic Radiosurgery Society practice guidelines[J]. Lung Cancer, 2023, 182: 107284. DOI:10.1016/j.lungcan.2023.107284 |
| [84] |
Keall PJ, Mageras GS, Balter JM, et al. The management of respiratory motion in radiation oncology report of AAPM Task Group 76[J]. Med Phys, 2006, 33(10): 3874-3900. DOI:10.1118/1.2349696 |
| [85] |
Moreno AC, Fellman B, Hobbs BP, et al. Biologically effective dose in stereotactic body radiotherapy and survival for patients with early-stage NSCLC[J]. J Thorac Oncol, 2020, 15(1): 101-109. DOI:10.1016/j.jtho.2019.08.2505 |
| [86] |
Dell'Acqua V, Surgo A, Kraja F, et al. Stereotactic radiation therapy in oligometastatic colorectal cancer: outcome of 102 patients and 150 lesions[J]. Clin Exp Metastasis, 2019, 36(4): 331-342. DOI:10.1007/s10585-019-09976-z |
| [87] |
Jingu K, Matsuo Y, Onishi H, et al. Dose escalation improves outcome in stereotactic body radiotherapy for pulmonary oligometastases from colorectal cancer[J]. Anticancer Res, 2017, 37(5): 2709-2713. DOI:10.21873/anticanres.11621 |
| [88] |
Iyengar P, All S, Berry MF, et al. Treatment of oligometastatic non-small cell lung cancer: an ASTRO/ESTRO clinical practice guideline[J]. Pract Radiat Oncol, 2023, 13(5): 393-412. DOI:10.1016/j.prro.2023.04.004 |
| [89] |
Cao Y, Chen H, Sahgal A, et al. The impact of local control on widespread progression and survival in oligometastasis-directed SBRT: results from a large international database[J]. Radiother Oncol, 2023, 186: 109769. DOI:10.1016/j.radonc.2023.109769 |
| [90] |
Chang JH, Gandhidasan S, Finnigan R, et al. Stereotactic ablative body radiotherapy for the treatment of spinal oligometastases[J]. Clin Oncol (R Coll Radiol), 2017, 29(7): e119-e125. DOI:10.1016/j.clon.2017.02.004 |
| [91] |
Seo YS, Kim MS, Cho CK, et al. Stereotactic body radiotherapy for oligometastases confined to the para-aortic region: clinical outcomes and the significance of radiotherapy field and dose[J]. Cancer Invest, 2015, 33(5): 180-187. DOI:10.3109/07357907.2015.1019678 |
| [92] |
Day F, Sridharan S, Lynam J, et al. Chemoradiotherapy with concurrent durvalumab for the palliative treatment of oligometastatic oesophageal and gastrooesophageal carcinoma with dysphagia: a single arm phase Ⅱ clinical trial (PALEO, sponsored by the Australasian Gastro-Intestinal Trials Group)[J]. BMC Cancer, 2022, 22(1): 1324. DOI:10.1186/s12885-022-10407-8 |
| [93] |
中国抗癌协会肿瘤放射治疗专业委员会, 中华医学会放射肿瘤治疗学分会, 中国医师协会放射肿瘤治疗医师分会. 食管癌放疗联合免疫治疗专家共识(2023年版)[J]. 中华放射医学与防护杂志, 2023, 43(8): 575-587. Chinese Societyof Radiotherapy,China Anti Cancer Association, Chinese Societyof Radiotherapy,Chinese Medical Association, Chinese Societyof Radiotherapy,Chinese Medical Doctor Association. Experts consensus on radiotherapy combined with immunotherapy for esophageal cancer (2023edition)[J]. Chin J Radiol Med Prot, 2023, 43(8): 575-587. DOI:10.3760/cma.j.cn112271-20230626-00207 |
| [94] |
Lehrer EJ, Singh R, Wang M, et al. Safety and survival rates associated with ablative stereotactic radiotherapy for patients with oligometastatic cancer: a systematic review and meta-analysis[J]. JAMA Oncol, 2021, 7(1): 92-106. DOI:10.1001/jamaoncol.2020.6146 |
| [95] |
王天, 顾大勇, 刘雅恬, 等. 局部放疗联合全身治疗寡转移食管鳞癌疗效分析[J]. 中华肿瘤防治杂志, 2024, 31(1): 27-32, 64. Wang T, Gu DY, Liu YT, et al. Efficacy analysis of radiotherapy combined with systemic treatment for oligometastatic squamous esophageal cancer[J]. Chin J Cancer Prev Treat, 2024, 31(1): 27-32, 64. DOI:10.16073/j.cnki.cjcpt.2024.01.04 |
| [96] |
Jamel S, Tukanova K, Markar S. Detection and management of oligometastatic disease in oesophageal cancer and identification of prognostic factors: A systematic review[J]. World J Gastrointest Oncol, 2019, 11(9): 741-749. DOI:10.4251/wjgo.v11.i9.741 |
| [97] |
Milano MT, Philip A, Okunieff P. Analysis of patients with oligometastases undergoing two or more curative-intent stereotactic radiotherapy courses[J]. Int J Radiat Oncol Biol Phys, 2009, 73(3): 832-837. DOI:10.1016/j.ijrobp.2008.04.073 |
| [98] |
Willmann J, Adilovic S, Vlaskou Badra E, et al. Repeat stereotactic body radiotherapy for oligometastatic disease[J]. Radiother Oncol, 2023, 184: 109671. DOI:10.1016/j.radonc.2023.109671 |
| [99] |
Harrow S, Palma DA, Olson R, et al. Stereotactic radiation for the comprehensive treatment of oligometastases (SABR-COMET): extended long-term outcomes[J]. Int J Radiat Oncol Biol Phys, 2022, 114(4): 611-616. DOI:10.1016/j.ijrobp.2022.05.004 |
 2025, Vol. 45
2025, Vol. 45
