神经内分泌肿瘤(neuroendocrine tumors,NETs)是起源于神经内分泌细胞的肿瘤,其发病率逐年上升[1-3]。177Lu-DOTA-TATE是一种放射性核素标记的生长抑素类似物,可通过肽受体放射性核素治疗(peptide receptor radionuclide therapy,PRRT)用于治疗神经内分泌肿瘤,并在2017年9月和2018年1月分别通过了欧洲药品管理局(EMA)和美国食品药品监督管理局(FDA)的批准上市[4-6]。
177Lu的物理半衰期约为6.7 d,衰变发射出β-粒子(能量分别为497、384和176 keV)以及γ光子(能量分别为113和208 keV)[7]。177Lu衰变产生的γ射线能量较高,穿透力较强,可能危害周围人员的身体健康,因此,需要对接受177Lu-DOTA-TATE治疗的患者进行剂量测量。本研究通过实测接受177Lu-DOTA-TATE治疗的患者距体表不同时间点、不同距离处的剂量率,研究门诊患者出院的安全时间,并通过外照射的衰变规律来研究177Lu-DOTA-TATE在患者体内的衰减规律,估算患者对公众人员和核医学工作人员的辐射剂量。
材料与方法1. 放射性药物制备:177Lu购自德国ITG公司,前体DOTA-TATE购自法国ABX公司,自行制备为成品药物177Lu-DOTA-TATE,使用前通过高效液相色谱仪(1200,美国安捷伦公司)和快速薄层层析纸(ITLC-SG)进行质量控制和放射化学纯度检测,177Lu-DOTA-TATE的生产和质量控制均符合《药品生产质量管理规范》(Good Manufacturing Practice of Medical Products,GMP)的有关规定。
2. 肽受体放射性核素治疗(PRRT):根据临床适应证筛选合适的神经内分泌肿瘤PRRT患者,符合条件者接受177Lu-DOTA-TATE。在注射药物当天,由核医学物理师为患者进行辐射防护知识的说明指导,包括可能存在的辐射危害以及预防措施。21例患者均签署知情同意,该研究经过北京肿瘤医院伦理委员会批准(批号:2018YJZ04)。
3. 患者不同距离处剂量率测量:测量仪器采用美国S.E.International公司生产的Inspector Alert手持式核辐射监测剂量仪,使用G-M计数管,有效直径为45 mm,云母窗密度为1.5~2.0 mg/cm3,测量范围为0.01~1 000 μGy/h,测量灵敏度为1 000计数·min-1·μSv-1·h-1,测量精度为±15%。在测量患者之前,首先测量环境本底的辐射剂量率,测量时间为60 s。对接受177Lu-DOTA-TATE治疗的患者的周围剂量率进行测量,选定的测量高度为距地面1.0 m,测量时距离患者分别为0.25、0.50、1.00、2.00、3.00 m,测量给药后的6个时间点分别为0、2、4、6、20、44、116 h,所有患者均取站立位,从患者正前位和正后位位置各测量3次,结果取正前位和正后位测量结果的平均值。
4. 周围人员所受辐射剂量计算:在神经内分泌肿瘤患者177Lu-DOTA-TATE治疗期间,患者对周围人员的外照射剂量与患者体内177Lu-DOTA-TATE的有效半衰期有关,计算出177Lu-DOTA-TATE的有效半衰期可以帮助制定更好的防护措施,在实际中可以通过测量距离患者体表 1 m处的剂量率而确定,这是一种简单、快速的方法[8-9]。根据辐射剂量率随时间的变化规律见式(1), 利用辐射剂量仪测量患者体外剂量率,并通过时间积分的方式来计算得到周围人员所受的辐射剂量。177Lu在患者体内衰变时,与患者站在一定距离的人在接触时间内的累积剂量D可由式(2)计算:
| $ \dot{D}(r, t)=\dot{D}_0(r) \mathrm{e}^{-0.693 / T_{\mathrm{e}}} $ | (1) |
| $ D=\int\limits_0^t \dot{D}_0 \mathrm{e}^{-\ln (2) \times t / T_e} {\rm{d}}t $ | (2) |
式中,Ḋ为t时刻辐射剂量率,μsv/h;Ḋ0为初始辐射剂量率,μSv/h;t为受照时间,h;Te为177Lu-DOTA-TATE在患者体内的有效半衰期,h。
结果1. 治疗患者注射后不同时间点,不同距离处的辐射剂量率:患者平均注射177Lu-DOTA-TATE药物活度均值为(6.65±0.54)GBq(6.29~7.40 GBq),患者体重均值为(72.3±9.8)kg (54~92 kg),距注射177Lu-DOTA-TATE的患者不同距离处,在不同时间点测得的归一化后的平均辐射剂量率值见表 1。从表 1可以看出,辐射剂量率随距离增大而减小;随着时间的推移,不同距离处测得的辐射剂量率在前期随着肾脏代谢而迅速下降,后期下降速度逐渐减缓,在116 h时,辐射剂量率已经接近本底水平。
|
|
表 1 不同时间接受177Lu-DOTA-TATE治疗的患者在不同距离的归一化平均辐射剂量率(μSv·h-1·GBq-1,x±s) Table 1 Normalized mean radiation dose rates at different distances in patients treated with 177Lu-DOTA-TATE at different times (μSv·h-1·GBq-1, x±s) |
接受177Lu-DOTA-TATE治疗后0~20 h,距离患者1 m处的剂量率(选取其中5例患者)如图 1所示,患者刚注射药物结束后,距离患者1 m处的剂量率非常高,在接下来的几小时后,由于肾脏的快速排泄,辐射剂量率快速下降。注射完药物后,在0 h(未排尿)时测得的剂量率读数最高为(47.47±11.6)μSv/h,在注射后4 h时平均辐射剂量率大幅下降到(17.05±7.22)μSv/h,6 h后继续下降至(12.95±4.25)μSv/h,20 h后剂量率为(9.60±2.54)μSv/h。
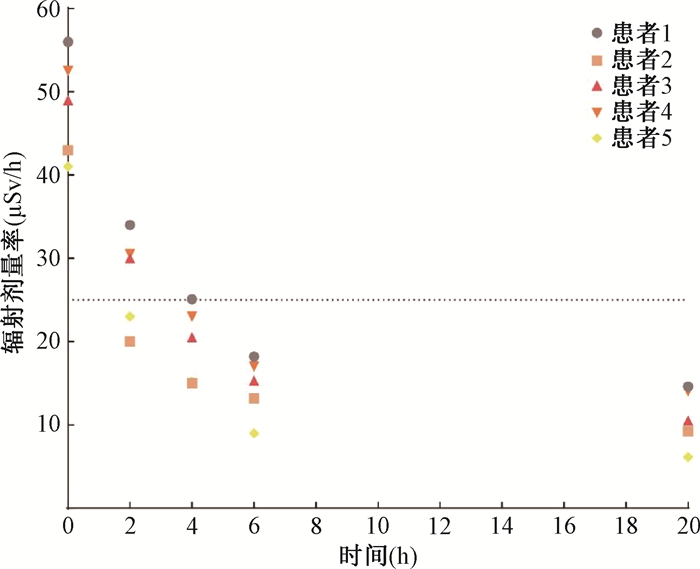
|
注:虚线为距离接受治疗的患者允许出院时1m处的辐射剂量率 图 1 177Lu治疗0~20 h后距离患者1 m处的剂量率(5例患者) Figure 1 Riadiation dose rate at a distance of 1 m from the patient 0-20 h after 177Lu treatment(Five patients) |
2. 177Lu-DOTA-TATE在患者体内的有效半衰期:因接受177Lu-DOTA-TATE治疗的患者在治疗时每个人所注射的药量不同,因此本研究对所测辐射剂量率进行归一化处理,结果见表 1。选择距患者1 m处不同时间点的归一化辐射剂量率值进行双指数曲线拟合,拟合曲线见图 2,得到177Lu-DOTA-TATE在患者体内的有效半衰期,有关辐射剂量学研究的结果表明指数拟合是合适的[9-10]。得到快速衰减阶段的有效半衰期Teff =(1.41±0.25)h(0.9~1.8) h,较慢衰减阶段的有效半衰期为(40.18±6.0)h (32.7~54.73)h。从实际考虑,在计算时选择较慢衰减阶段的有效半衰期进行辐射剂量计算。由图 2可以看出,在最后一次(116 h)测量时平均辐射剂量率已经接近天然本底,因此对患者出院后接触的周围人员可以只考虑0~116 h内的受照剂量。
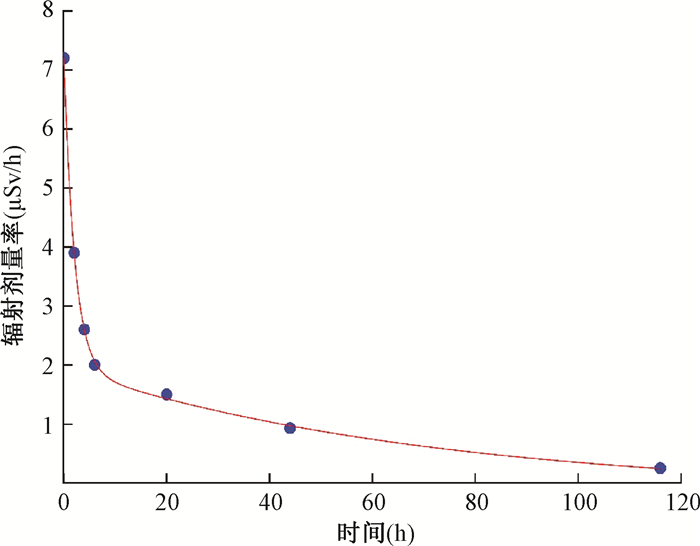
|
图 2 患者每摄入1 GBq 177Lu的周围平均辐射剂量率 Figure 2 Average dose rates around patients at different times after intake of 1 GBq 177Lu |
3. 患者对周围人员的辐射剂量:患者在接受177Lu治疗因为行动难免与周围人员短暂接触,本研究计算了不同距离处在注射后不同时间点10 min患者对周围人员的辐射剂量见表 2。当患者在接受177Lu后治疗6 h出院,周围人员与患者分别距离0.25、0.50、1.00、2.00、3.00 m时,保守假设周围人员一直与患者相处,在6~116 h内周围人员受照剂量分别为2.8、1.9、0.6、0.26、0.096 mSv。
|
|
表 2 不同距离处在接受177Lu治疗不同时间点10 min内患者对周围人员的辐射剂量(μSv) Table 2 Radiation dose of patients 10 min after injection at different times at different distances to the surrounding personnel(μSv) |
4. 工作人员受照剂量:给药时利用输液泵将177Lu-DOTA-TATE自动输入患者体内,输注过程约10 min,护士在给药前负责连结给药泵和给药后输液,此过程距离患者约0.25 m,时间约2 min,输液时护士在距离患者3 m处观察1 h;输液时医生在距离患者3 m处,观察1 h;在摆位时,技师对每个患者的摆位时间在1 min之内,摆位时距离患者最近0.5 m,患者上机扫描时间大部分在注射后0.5、3、20、44和116 h,共摆位5次;物理师在患者出院前需要对患者前后1 m处各测量3次辐射剂量率以评估是否可以出院,出院时间在注射后4或6 h,整个过程约5 min。由测得的0~116 h内的平均辐射剂量率和周围人员受照剂量按公式(2)计算得出工作人员受照剂量,分别是:护士10.24 μSv/患者,医生2.0 μSv/患者,摆位技师4.05 μSv/患者。若患者4 h出院,物理师受照剂量为2.08 μSv/患者,患者6 h出院时,物理师受照剂量为1.08 μSv/患者。
讨论本研究实测接受177Lu-DOTA-TATE治疗的患者体表不同距离处,在不同时间点的剂量率来研究177Lu-DOTA-TATE在患者体内的衰减规律,根据实际的衰减规律计算了177Lu-DOTA-TATE在患者体内的有效半衰期,并估算了患者对周围人员和核医学工作人员的辐射剂量。本研究的结果可以为国内开展177Lu-DOTA-TATE治疗的相关单位制定门诊患者出院的安全时间提供参考,为以后国内制定177Lu核素治疗的放射防护标准提供参考。
Levart等[11]研究者在Lu-DOTA-TATE给药后0 h腹部右外侧0.1和1.0 m处的平均剂量率分别为407和20 μSv/h,本研究实测值比之略大,推测该差异是由于测量位置差异、患者代谢情况不同以及测量误差引起的。Olmstead等[12]在距离接受Lu-DOTA-TATE治疗后4 h的患者身体正中间1 m处测得的平均辐射剂量率为14 μSv/h,本研究实测值17.05 μSv/h与之相差不大。参考国家卫生健康委员会发布的核医学放射防护要求GBZ 120-2020推荐的放射性碘治疗后患者对周围1 m远处辐射剂量率限值(25 μSv/h) [13],本研究中接受177Lu-DOTA-TATE治疗的患者4或6 h后出院时的外照射剂量率处于国家标准限值内,实际中患者身体情况不同,代谢存在差异,建议每位患者出院前进行辐射剂量率测量,符合规定方可出院。
目前,对接受177Lu-DOTA-TATE治疗的患者体内放射性衰变规律的研究,主要从尿液活度、血液活度和外照射来进行测量和分析[14-16]。Abuqbeitah等[17]经研究计算出177Lu-DOTA-TATE,在血液中的有效半衰期和早期清除阶段的有效半衰期分别为0.31±0.13和(4.5±1.0)h。Sandström等[18]通过对159例接受177Lu-DOTA-TATE治疗的患者0~24 h的尿液活度测量以及利用双指数函数拟合不同时间全身放射性活度随时间变化曲线,得到快时相有效半衰期为1.28 h(0.93~1.52 h),慢时相有效半衰期为49.5 h(45.1~56.6 h)。
在注射177Lu-DOTA-TATE前,工作人员会对患者及家属说明辐射可能造成的危害,因此实际中,一般不存在患者与他人长时间共处的情形。从本研究可以看出,在注射后不同的时间点与患者接触10 min周围人员受照剂量最大为45.4 μSv,并随距离增大迅速减小,说明周围人员与注射177Lu药物的患者短暂共处是安全的。本研究保守计算了患者在6 h出院时,在不同距离与患者一直相处的周围人员受照剂量,距离患者0.25,0.5 m处周围人员受照剂量均低于5 mSv;距离患者1、2、3 m处周围人员受照剂量均都低于1 mSv,符合国内外规定的电离辐射防护与安全标准规定的剂量限值[19-20]。保守计算的假设情形在现实中基本不会出现,实际受照剂量远低于计算值。Olmstead等[21]通过对注射177Lu-DOTA-TATE的患者实测距离不足1 m处的剂量,注射后4~20 h内的累积剂量最小为0.03 mSv,最大为0.18 mSv。本研究结果表明,在进行177Lu-DOTA-TATE治疗时,医护人员、物理师、摆位技师一次治疗的受照剂量均远低于国家规定的限值。
本研究表明,神经内分泌肿瘤患者接受177Lu-DOTA-TATE门诊治疗时,患者在6 h后出院时的外照射剂量率及对周围人员的辐射剂量符合我国相关规定与国际放射防护委员会(ICRP)、国际原子能机构(IAEA)关于患者接受7~8 GBq 177Lu-DOTA-TATE治疗后出院时间的建议[13, 22]。177Lu-DOTA-TATE主要通过尿液排出体外,因此要注意出院患者尿液可能造成的放射性危害,建议患者排尿后至少冲水3次,留置导尿的患者增加集尿袋排空次数,增加更换频率,使用过的集尿袋要按有关规定处理。从辐射防护最优化的原则来讲,患者与周围人员需尽量减少接触,以减少不必要的辐射危害。
利益冲突 无
作者贡献声明 潘永祥负责设计实验、数据处理和论文撰写;丁立新负责数据测量;王风负责数据审核和论文指导;杨志指导论文修改
| [1] |
Dasari A, Shen C, Halperin D, et al. Trends in the incidence, prevalence, and survival outcomes in patients with neuroendocrine tumors in the United States[J]. JAMA Oncol, 2017, 3(10): 1335-1342. DOI:10.1001/jamaoncol.2017.0589 |
| [2] |
Pavel M, de Herder WW. ENETS consensus guidelines for the standard of care in neuroendocrine tumors[J]. Neuroendocrinology, 2017, 105(3): 193-195. DOI:10.1159/000457957 |
| [3] |
Garcia-Carbonero R, Rinke A, Valle JW, et al. ENETS consensus guidelines for the standards of care in neuroendocrine neoplasms. systemic therapy 2: chemotherapy[J]. Neuroendocrinology, 2017, 105(3): 281-294. DOI:10.1159/000473892 |
| [4] |
Sorbye H, Kong G, Grozinsky-Glasberg S. PRRT in high-grade gastroenteropancreatic neuroendocrine neoplasms (WHO G3)[J]. Endocr Relat Cancer, 2020, 27(3): R67-R77. DOI:10.1530/ERC-19-0400 |
| [5] |
Pavel M, Öberg K, Falconi M, et al. Gastroenteropancreatic neuroendocrine neoplasms: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2020, 31(7): 844-860. DOI:10.1016/j.annonc.2020.03.304 |
| [6] |
王风, 潘永祥, 丁立新, 等. 177Lu-奥曲肽治疗神经内分泌肿瘤肾脏吸收剂量估算[J]. 中华放射医学与防护杂志, 2021, 41(9): 700-704. Wang F, Pan YX, Ding LX, et al. Estimation of renal absorbed doses in the treatment of neuroendocrine tumors using 177Lu-DOTA-TATE[J]. Chin J Radiol Med Prot, 2021, 41(9): 700-704. DOI:10.3760/cma.j.issn.0254-5098.2021.09.011 |
| [7] |
Kossert K, Nähle OJ, Ott O, et al. Activity determination and nuclear decay data of 177Lu[J]. Appl Radiat Isot, 2012, 70(9): 2215-2221. DOI:10.1016/j.apradiso.2012.02.104 |
| [8] |
Muhammad W, Faaruq S, Matiullah, et al. Release criteria from hospitals of 131I thyrotoxicosis therapy patients in developing countries-case study[J]. Radiat Prot Dosim, 2006, 121(2): 136-139. DOI:10.1093/rpd/ncl003 |
| [9] |
易艳玲, 石洪成, 陈波, 等. 分化型甲状腺癌患者的131I有效半衰期[J]. 原子能科学技术, 2010, 44(B09): 4. DOI: CNKI:SUN:YZJS.0.2010-S1-129. Yi YL, Shi HC, Chen B, et al. Effective 131I half-life in patients with differentiated thyroid carcinoma [J]. Atom Energy Sci Technol, 2010, 44(B09): 4. DOI: CNKI:SUN:YZJS.0.2010-S1-129. |
| [10] |
Delker A, Fendler WP, Kratochwil C, et al. Dosimetry for (177)Lu-DKFZ-PSMA-617: a new radiopharmaceutical for the treatment of metastatic prostate cancer[J]. Eur J Nucl Med Mol Imaging, 2016, 43(1): 42-51. DOI:10.1007/s00259-015-3174-7 |
| [11] |
Levart D, Kalogianni E, Corcoran B, et al. Radiation precautions for inpatient and outpatient 177Lu-Dotatate peptide receptor radionuclide therapy of neuroendocrine tumours[J]. EJNMMI Phys, 2019, 6(1): 7. DOI:10.1186/s40658-019-0243-1 |
| [12] |
Olmstead C, Cruz K, Stodilka R, et al. Quantifying public radiation exposure related to lutetium-177 octreotate therapy for the development of a safe outpatient treatment protocol[J]. Nucl Med Commun, 2015, 36(2): 129-134. DOI:10.1097/MNM.0000000000000232 |
| [13] |
国家卫生健康委员会. GBZ 120-2020核医学放射防护要求[S]. 北京: 中国标准出版社, 2020. National Health Commission. GBZ 120-2020 Requirements for radiological protection in nuclear medicine[S]. Beijing: Standards Press of China, 2020. |
| [14] |
Fitschen J, Knoop BO, Behrendt R, et al. External radiation exposure andeffective half-life in Lu-177-Dota-Tate therapy[J]. Z Med Phys, 2011, 21(4): 266-273. DOI:10.1016/j.zemedi.2011.05.001 |
| [15] |
Hope TA, Abbott A, Colucci K, et al. NANETS/SNMMI procedure standard for somatostatin receptor-based peptide receptor radionuclide therapy with (177)Lu-DOTATATE[J]. J Nucl Med, 2019, 60(7): 937-943. DOI:10.2967/jnumed.118.230607 |
| [16] |
耿建华, 张锦明, 王晓涛, 等. 177Lu-Dotatate治疗的放射防护评估[J]. 中国辐射卫生, 2021, 30(6): 710-719. Geng JH, Zhang JM, Wang XT, et al. Radiation protection evaluation of 177Lu-Dotate treatment[J]. Chin J Radiat Health, 2021, 30(6): 710-719. DOI:10.13491/j.issn.1004-714X.2021.06.011 |
| [17] |
Abuqbeitah M, Demir M, Uslu-Beşli L, et al. Blood clearance and occupational exposure for (177)Lu-DOTATATE compared to (177)Lu-PSMA radionuclide therapy[J]. Radiat Environ Biophys, 2018, 57(1): 55-61. DOI:10.1007/s00411-017-0721-6 |
| [18] |
Sandström M, Garske-Román U, Granberg D, et al. Individualized dosimetry of kidney and bone marrow in patients undergoing 177Lu-DOTA-octreotate treatment[J]. J Nucl Med, 2013, 54(1): 33-41. DOI:10.2967/jnumed.112.107524 |
| [19] |
国家质量监督检验检疫总局. GB 18871-2002电离辐射防护与辐射源安全基本标准[S]. 北京: 中国标准出版社, 2003. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB 18871-2002 Basic standards for protection against ionizing radiation and for the safety of radiation sources[S]. Beijing: Standards Press of China, 2003. |
| [20] |
International Commission on Radiological Protection. ICRP Publication 103. The 2007 recommendations of the International Commission on Radiological Protection[R]. Oxford: Pergamon Press, 2007.
|
| [21] |
Olmstead C, Cruz K, Stodilka R, et al. Quantifying public radiation exposure related to lutetium-177 octreotate therapy for the development of a safe outpatient treatment protocol[J]. Nucl Med Commun, 2015, 36(2): 129-134. DOI:10.1097/MNM.0000000000000232 |
| [22] |
Bennett GF. International basic safety standards for protection against ionizing radiation and for the safety of radiation sources[J]. J Hazard Mater, 1997, 54(1-2): 134-135. DOI:10.1016/S0304-3894(97)89416-2 |
 2024, Vol. 44
2024, Vol. 44


