2. 中国科学院大学附属肿瘤医院 浙江省肿瘤医院放射物理科, 杭州 310022;
3. 福建省肿瘤医院放疗中心, 福州 350014
2. Radiation Physics Department of Cancer Hospital Affiliated to University of Chinese Academy of Sciences Zhejiang Cancer Hospital, Hangzhou 310022, China;
3. Radiotherapy Center of Fujian Cancer Hospital, Fuzhou 350014, China
据国家癌症中心的最新统计结果显示,肺癌仍是我国发病率和死亡率最高的恶性肿瘤[1]。肺癌患者的病程中多伴随脑转移,其概率高达10%~36%[2],脑转移的预后效果差,患者中位生存期仅以月计算。全脑放疗(WBRT)在脑转移的治疗中发挥着重要的作用,但WBRT的长期并发症可能会对患者的生活质量产生负面影响[3]。
近年来的研究表明,小细胞肺癌(SCLC)与非小细胞肺癌(NSCLC)以及不同基因突变的肺癌亚型,在脑转移的分布上存在差异[4-6]。这些研究可为治疗方案提供意见参考,减少低脑转移风险区的剂量以预防或减轻WBRT带来的后遗症[6-7]。Shi等[6]发现小脑半球是小细胞肺癌的高危脑区,中枢前回、额中回、中央旁小叶和小脑半球是非小细胞肺癌的高危脑转移灶。根据组织学上的差异,NSCLC还可细分为腺癌与非腺癌,由于两类患者的数量差异,未对二者的脑转移分布进行讨论。本研究回顾性地分析非小细胞肺癌脑转移中腺癌与非腺癌的分布差异,为制定更合理的优化治疗方案提供依据。
资料与方法1. 研究对象: 收集2020年12月至2023年8月283例在浙江省肿瘤医院就诊且确诊NSCLC患者的CT图像。纳入标准:经病理学诊断确诊为NSCLC,影像学诊断为发生脑转移;患者曾接受全脑放疗或立体定向放射治疗(SRS)。排除标准:患有其他原发颅内肿瘤;患有除肺癌外的其他肿瘤。所有患者对研究知情并签署同意书。研究经医院伦理委员会批准[审批号为IRB-2021-321号(科)]。
2. 数据处理: 基于原发肺癌的不同亚型,对患者数据进行了采集和筛选,并将其分为腺癌和非腺癌两组。为确保不同患者图像的相同脑区域对齐,实现腺癌与非腺癌脑转移的空间分布的比较,需将各个患者的头部CT图像配准到标准MNI空间,该过程通过MIM软件[8]实现。经过配准后的两组数据分别在数据分析与脑影像处理平台(Dpabi)软件上做叠加与平均[9],以便将两组不同亚型的所有患者的脑转移分布可视化,同时对两种亚型的脑转移分布情况求Dice相似系数,具体操作流程如图 1所示。

|
注:CT. 计算机断层成像; GTV. 肿瘤区域 图 1 CT图像数据处理示意图 Figure 1 Schematic diagrams showing the data processing of CT images |
3. 脑转移分布可视化及体素统计:脑转移区域在腺癌组与非腺癌组的叠加图像分别通过MRIcroGL软件完成了二维可视化,并通过BrainNet Viewer软件实现了三维可视化。体素分布的计算采用XjView工具包进行,统计对象为脑转移灶数目(BMs)≥4的脑区,体素尺寸为2 mm × 2 mm × 2 mm格式,统计结果在MATLAB主界面中输出。
4. 差异化分析:Dice值是一种用于比较两个集合相似性的统计指标,其范围在0~1之间,值越接近1表示两个集合越相似,值越接近0表示两个集合越不相似。其计算公式如下:
| $ \operatorname{DSC}=\frac{2 \times|A \cap B|}{|A|+|B|} $ |
式中,A是第一个集合,B是第二个集合;| A∩B |是两个集合交集的元素数量;| A |和| B |分别是两个集合的元素总和。
5. 统计学处理:Dice相似系数主要用于衡量两组数据集间的相似性水平,并非直接量化它们之间的差异程度。因此仍需采用双样本t检验进一步验证腺癌和非腺癌患者的脑转移肿瘤区域的分布差异。为保证结果一致性,分别使用统计参数映射(SPM)[10]与Dpabi软件分析样本数据。需要注意的是,由于样本数据较大,在使用Dpabi进行双样本t检验时,需要确保计算机具备足够的运行内存,否则计算进程将无法正常进行。在进行双样本t检验结果的统计与可视化时,为确保结果的显著性,需将输出的文件设置为P<0.05,可视化的图像在BrainNet Viewer上[11]显示并输出。
结果1. 患者特征: 如表 1所示,共有283例符合条件的肺癌患者(505个脑转移)纳入本研究,其中腺癌与非腺癌分别为191例(67.5%)和92例(32.5%)。腺癌与非腺癌在性别分布上差异有统计学意义(61.3%和87%,χ2=19.39,P=0.001),且皆多为男性患者。腺癌组的年龄的均值为62.04岁,非腺癌组的年龄均值为63.85岁,两者差异无统计学意义。腺癌组中脑转移个数超过4个的患者共有19例(9.9%),非腺癌组中脑转移个数超过4个的患者共有6例(6.5%),两者差异无统计学意义。
|
|
表 1 腺癌与非腺癌的患者的临床特征分布 Table 1 Clinical characteristics of patients with adenocarcinoma vs. non-adenocarcinoma |
2. 腺癌与非腺癌的脑转移分布偏好:如图 2所示,腺癌组所有患者的肿瘤区域的可视叠加图像与各个脑区的体素分布显示脑转移受累频率最高的六个脑区为顶下小叶、小脑后叶、中央额回、中央前回、颞中回、楔前叶。脑转移灶数目(BMS)≥4的脑区体素统计如表 2所示,腺癌脑转移的两侧脑区分布均无体素高于400的脑区,其中右侧体素高于100的脑区有中央额回与顶下小叶,左侧体素高于100的脑区有颞中回与中央前回。
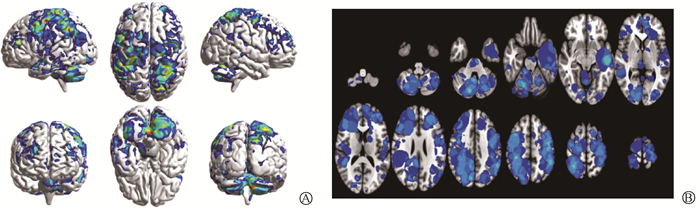
|
图 2 腺癌脑转移分布 A. 三维分布图;B. 平面分布图 Figure 2 Distribution of brain metastases from adenocarcinoma A. 3D distribution; B. Planar distribution |
|
|
表 2 腺癌与非腺癌在各个脑区的体素分布(体素大小为2 mm × 2 mm × 2 mm) Table 2 Distributions of voxels (2 mm × 2 mm × 2 mm) of adenocarcinoma and non-adenocarcinoma in various brain regions |
非腺癌组的叠加图像与体素分布显示,非腺癌脑转移频率最高的六个脑区为小脑后叶、楔前叶、小脑前叶、楔叶、枕中回、颞中回,如图 3所示。非腺癌的两侧脑区分布中,右侧体素高于400的脑区仅有枕中回,左侧体素高于400的脑区有楔前叶、楔叶、枕中回以及颞中回。
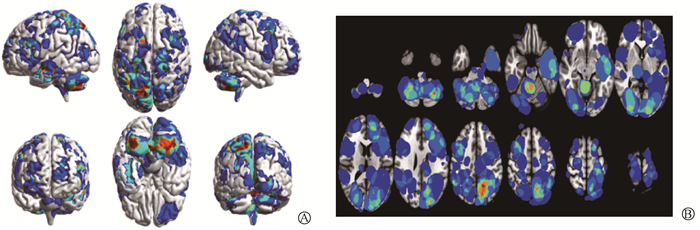
|
图 3 非腺癌脑转移分布 A. 三维分布图;B. 平面分布图 Figure 3 Distribution of brain metastases from non-adenocarcinoma A. 3D distribution; B. Planar distribution |
3. 差异化分析结果:在Python开发环境下计算两者的Dice相似系数为0.105 8,提示腺癌和非腺癌在脑内的分布可能存在差异。对腺癌和非腺癌脑转移在脑区内的分布区域进行比较,结果表明两种亚型在左侧脑的楔前叶、楔叶、顶上小叶、枕中回、小脑扁桃体与边缘叶以及右侧脑的小脑扁桃体与小脑蚓部前端存在一定差异,如图 4所示。这些差异区域在腺癌与非腺癌中的体素数量、以及对应的差异化分析后的体素数量、体素最大值点的坐标,相关的统计量如表 3所示。本研究采用的SPM和Dpabi两种方法进行的差异化分析均得出了一致的结论。然而由于现有方法的限制,未能在Dpabi软件中统计体素最大点的坐标。因此,表 3仅列出SPM软件得到的相应统计数值。腺癌与非腺癌的脑转移分布存在统计学差异的区域中,体素差异高于400的脑区有左侧楔前叶与左侧楔叶(t=2.91、2.16,P < 0.05)。同时,腺癌脑转移在体素高于100的左右脑区无共同受累区域,非腺癌脑转移在体素高于100的左右脑区的共同受累区域有楔叶、枕中回、中央额回。
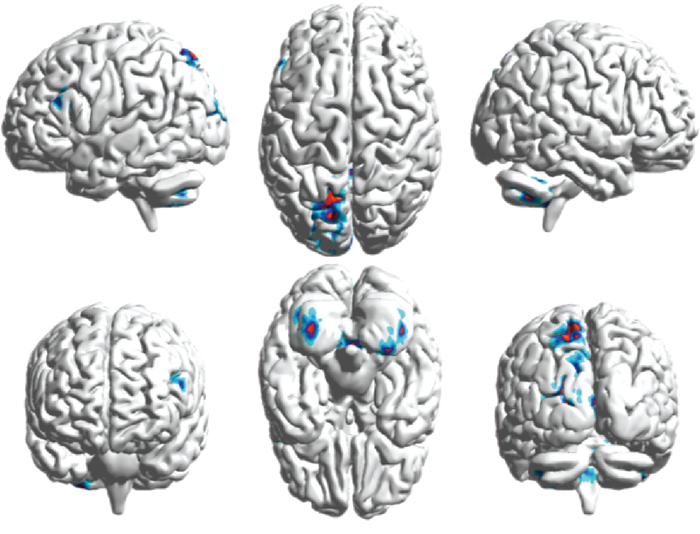
|
图 4 腺癌与非腺癌存在分布差异的区域 Figure 4 Regions with different distributions of brain metastases from adenocarcinoma and non-adenocarcinoma |
|
|
表 3 不同软件比较腺癌与非腺癌脑转移瘤分布差异脑区的的结果 Table 3 Comparison of brain regions with different distributions of brain metastases between adenocarcinoma and non-adenocarcinoma by different softwares |
讨论
癌细胞在转移到器官时表现出偏好的概念可以追溯到1889年,当时Paget发表了“种子和土壤”假说,他提出肿瘤细胞的扩散是受癌细胞(种子)和宿主器官(土壤)之间的相互作用和合作的控制[12]。近年来一些研究已经通过统计分析验证了不同肺癌亚型的脑转移的差异性。Takano等[5]分析了肺癌脑转移的空间分布与表皮生长因子受体(EGFR)突变状态之间的关系,发现EGFR L858R突变的脑转移比EGFR外显子19缺失的脑转移更容易发生在尾状核、小脑和颞叶。由于SCLC与NSCLC存在不同的基因突变模式和肿瘤生物学行为,Shi等[6]描述了二者的脑转移的空间分布,发现在SCLC和NSCLC中,脑干、双侧丘脑、海马、副海马回、杏仁核和颞极的累积脑转移频率分别为6.23%和3.77%。但由于腺癌和鳞状细胞癌患者数量极不均衡,其未调查腺癌和非腺癌之间脑转移分布的差异,而腺癌和非腺癌同样具有不同的基因突变模式。因此,本研究假设两者的脑转移分布可能在空间上偏向于某些脑区域。本研究结果表明,不同亚型的NSCLC脑转移在大脑中存在不同的空间分布偏好。
腺癌与非腺癌在不同脑区的分布偏好上存在差异。在腺癌中,脑转移多发于中央前回、颞中回、小脑后叶、中央额回、楔前叶和顶下小叶;在非腺癌中,脑转移多侵犯于楔前叶、小脑前叶、小脑后叶、楔叶、枕中回和颞中回。腺癌脑转移的分布较为均匀,同一脑区内的脑转移数量极少超过6个,而非腺癌脑转移呈现出个别区域存在更高风险的现象。
腺癌与非腺癌在左右两侧大脑半球的分布偏好上存在差异。非腺癌脑转移更倾向于侵犯左侧脑区,特别是楔叶与楔前叶,在非腺癌脑转移患者中分布最为密集,且主要集中于左脑半球。而腺癌脑转移则在大脑区域未显示明显的左右侧脑区偏好。
全脑放疗主要用于控制和减轻脑转移瘤的数量,防止新的脑转移瘤的形成。然而全脑放疗的范围涉及大脑的广泛区域,其引起的神经不良反应被报告会导致长期的后遗症。通过在全脑放疗过程中降低特定脑功能区域的辐射剂量,有助于减少放疗的神经不良反应。目前,大多数肺癌脑转移患者接受的全脑放疗照射剂量通常为30 Gy/10次或40 Gy/20次。而一项动物研究显示,10 Gy颅内辐射后神经发生减少的小鼠在迷宫测试中的认知表现有所下降,这一项研究再次证实了全脑放疗对脑功能区域的神经不良反应。
本研究表明,腺癌的脑转移呈现中央额回、中央前回,以及顶下小叶的高风险区域,而非腺癌在这些区域的脑转移风险较低。其中,中央额回和中央前回与运动和感觉功能密切相关[13-14],顶下小叶则与情感认知及感官信息解读相关, 其受到损伤可导致记忆损失及认知障碍[15]。因此,针对上述区域的放疗方案可以考虑参考肺癌脑转移中国治疗指南(2021年版)[16]中提到的保护海马的全脑放疗技术,制定个性化的治疗方案。
对于非小细胞非腺癌患者的治疗,可以考虑将中央额回、中央前回和顶下小叶规划为危及器官,并将剂量限制在9~16 Gy之间。同时,对于那些不适合接受SRS但预期生存时间较长的患者,且在放疗开始后一个月内的增强MRI检查发现脑转移灶与上述危及器官的距离大于2 cm的情况,可以考虑采用上述治疗方案进行同步加量。
同样地,楔叶、小脑前叶与枕中回对人体的运动控制,及空间感知以及情绪控制都有着密切联[17-20]。在非腺癌脑转移中上述区域为高风险转移区,而在腺癌脑转移中为低风险区域。因此对于腺癌患者,可以考虑将楔叶、小脑前叶与枕中回剂量限制在9~16 Gy之间,且将该项技术应用在同步放疗中。
综上所述,本研究发现腺癌与非腺癌的脑转移空间分布存在差异,两种亚型均存在偏好于侵犯特定脑区的现象。这些结论可以为制定更优化的治疗方案提供参考。本研究仍存在一些不足之处。首先,没有考虑基因突变因素对NSCLC脑转移分布的影响。其次,纳入研究的病例数量偏少。最后,数据来源单一,未进行多中心采集。因此未来的研究将针对上述问题进行改进。
利益冲突 全体作者无利益冲突,未因该研究接受任何不当的职务或财务利益
作者贡献声明 陈伟负责数据收集、数据分析和论文撰写;杜锋磊负责指导数据统计与分析;左国平与单国平负责提出论文修改意见;陈开强负责基金支持以及提供修改意见
| [1] |
郑荣寿, 张思维, 孙可欣, 等. 2016年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2023, 45(3): 212-220. Zheng RS, Zhang SW, Sun KX, et al. Analysis on the prevalence of malignant tumors in China in 2016[J]. Chin J Oncol, 2023, 45(3): 212-220. DOI:10.3760/cma.j.cn112152-20220922-00647 |
| [2] |
Villano JL, Durbin EB, Normandeau C, et al. Incidence of brain metastasis at initial presentation of lung cancer[J]. Neuro Oncol, 2015, 17(1): 122-128. DOI:10.1093/neuonc/nou099 |
| [3] |
Crockett C, Belderbos J, Levy A, et al. Prophylactic cranial irradiation (PCI), hippocampal avoidance (HA) whole brain radiotherapy (WBRT) and stereotactic radiosurgery (SRS) in small cell lung cancer (SCLC): Where do we stand?[J]. Lung Cancer, 2021, 162: 96-105. DOI:10.1016/j.lungcan.2021.10.016 |
| [4] |
Kwon H, Kim JW, Park M, et al. Brain metastases from lung adenocarcinoma may preferentially involve the distal middle cerebral artery territory and cerebellum[J]. Front Oncol, 2020, 10: 1664. DOI:10.3389/fonc.2020.01664 |
| [5] |
Takano K, Kinoshita M, Takagaki M, et al. Different spatial distributions of brain metastases from lung cancer by histological subtype and mutation status of epidermal growth factor receptor[J]. Neuro Oncol, 2016, 18(5): 716-724. DOI:10.1093/neuonc/nov266 |
| [6] |
Shi W, Wang Y, Xia W, et al. Brain metastases from small cell lung cancer and non-small cell lung cancer: comparison of spatial distribution and identification of metastatic risk regions[J]. J Neurooncol, 2023, 161(1): 97-105. DOI:10.1007/s11060-022-04211-4 |
| [7] |
Yanagihara TK, McFaline-Figueroa JR, Giacalone NJ, et al. A low percentage of metastases in deep brain and temporal lobe structures[J]. Neuro Oncol, 2019, 21(5): 640-647. DOI:10.1093/neuonc/noz023 |
| [8] |
Calusi S, Labanca G, Zani M, et al. A multiparametric method to assess the MIM deformable image registration algorithm[J]. J Appl Clin Med Phys, 2019, 20(4): 75-82. DOI:10.1002/acm2.12564 |
| [9] |
Lu B, Yan CG. Demonstrating quality control procedures for fMRI in DPABI[J]. Front Neurosci, 2023, 17: 1069639. DOI:10.3389/fnins.2023.1069639 |
| [10] |
Nüesch C, Roos E, Egloff C, et al. The effect of different running shoes on treadmill running mechanics and muscle activity assessed using statistical parametric mapping (SPM)[J]. Gait Posture, 2019, 69: 1-7. DOI:10.1016/j.gaitpost.2019.01.013 |
| [11] |
Qiu J, Gu W, Zhang Y, et al. Alterations of the amplitude of low-frequency fluctuation induced by repetitive transcranial magnetic stimulation combined with antidepressants treatment for major depressive disorder[J]. Psychiatry Res Neuroimaging, 2024, 340: 111792. DOI:10.1016/j.pscychresns.2024.111792 |
| [12] |
Ribatti D, Mangialardi G, Vacca A. Stephen Paget and the "seed and soil" theory of metastatic dissemination[J]. Clin Exp Med, 2006, 6(4): 145-149. DOI:10.1007/s10238-006-0117-4 |
| [13] |
Silva AB, Liu JR, Zhao L, et al. A neurosurgical functional dissection of the middle precentral gyrus during speech production[J]. J Neurosci, 2022, 42(45): 8416-8426. DOI:10.1523/JNEUROSCI.1614-22.2022 |
| [14] |
Mastria G, Scaliti E, Mehring C, et al. Morphology, connectivity, and encoding features of tactile and motor representations of the fingers in the human precentral and postcentral gyrus[J]. J Neurosci, 2023, 43(9): 1572-1589. DOI:10.1523/JNEUROSCI.1976-21.2022 |
| [15] |
Merchant S, Frangos E, Parker J, et al. The role of the inferior parietal lobule in writer's cramp[J]. Brain, 2020, 143(6): 1766-1779. DOI:10.1093/brain/awaa138 |
| [16] |
中国医师协会肿瘤医师分会, 中国医疗保健国际交流促进会肿瘤内科分会. 肺癌脑转移中国治疗指南(2021年版)[J]. 中华肿瘤杂志, 2021, 43(3): 269-281. China Medical Doctor Association Oncologist Branch, Association for the Promotion of International Exchange of Health Care, Oncology Branch. Guidelines for the treatment of brain metastasis of lung cancer in China (2021 Edition)[J]. Chin J Oncol, 2021, 43(3): 269-281. DOI:10.3760/cma.j.cn112152-20210104-00009 |
| [17] |
Dadario NB, Sughrue ME. The functional role of the precuneus[J]. Brain, 2023, 146(9): 3598-3607. DOI:10.1093/brain/awad181 |
| [18] |
Tzvi E, Loens S, Donchin O. Mini-review: The role of the cerebellum in visuomotor adaptation[J]. Cerebellum, 2022, 21(2): 306-313. DOI:10.1007/s12311-021-01281-4 |
| [19] |
Geng C, Wang S, Li Z, et al. Resting-state functional network topology alterations of the occipital lobe associated with attention impairment in isolated rapid eye movement behavior disorder[J]. Front Aging Neurosci, 2022, 14: 844483. DOI:10.3389/fnagi.2022.844483 |
| [20] |
Alahmadi A. Investigating the sub-regions of the superior parietal cortex using functional magnetic resonance imaging connectivity[J]. Insights Imaging, 2021, 12(1): 47. DOI:10.1186/s13244-021-00993-9 |
 2024, Vol. 44
2024, Vol. 44


