2. 聊城市人民医院肿瘤内科, 聊城 252000
2. Department of Oncology, Liaocheng People's Hospital, Liaocheng 252000, China
鳞状细胞癌为我国食管癌的主要病理类型[1]。随着治疗手段的进步及多学科联合治疗的开展,食管鳞状细胞癌(ESCC)患者的总体预后较前有了较大改善,但复发或/和转移仍是患者治疗后的主要失败模式[2-4]。ESCC患者经一线治疗后一旦出现复发或/和转移,则预示其预后较差,而再治疗的手段较少。近年来,免疫检查点抑制剂(ICIs)在ESCC上的应用取得了较好疗效,尤其是对于晚期或转移性ESCC患者,在既往应用ICIs联合化疗的众多临床试验研究中,其研究结果均显示出了较好的优越性[5-8]。目前,针对于二线ICIs联合化疗治疗一线治疗后失败的ESCC患者的临床试验较多[9-10],而相关真实世界的临床研究较少,且治疗期间针对不同复发类型的患者加入放射治疗的研究较为少见,放疗对此类患者预后的影响更是鲜有报道[11]。因此,本研究目的是明确临床上ICIs联合化疗或/和放疗二线治疗局部区域复发或和远处转移性ESCC(LR/M ESCC)患者的价值、不良反应及其失败模式,并且进一步明确放射治疗对患者预后的影响。
资料与方法1. 病例资料:收集2018年6月至2021年6月在聊城市人民医院接受ICIs联合放/化疗二线治疗的ESCC患者。入组标准:年龄≥18岁;首诊时患者病理组织学明确诊断为ESCC,此次经影像学、电子胃镜或/和病理等明确诊断为局部区域复发或/和远处转移;东部肿瘤协作组体力状况评分(ECOG PS)≤2;ICIs周期数≥3个;接受了一线治疗,且一线治疗未行ICIs治疗;治疗前无合并感染或其他严重全身性疾病的患者。排除标准:合并其他恶性肿瘤或/和严重重要脏器功能异常;骨髓储备功能不符合临床要求;需要治疗的细菌性或病毒性感染;其他严重全身性疾病患者需要药物干预。入组患者治疗前均签署了治疗知情同意书,该研究也取得了聊城市人民医院伦理委员会伦理审批(伦理审批号:2024021)。
最终纳入了符合条件的患者116例,收集并分析入组患者的一般临床资料和治疗相关结果,包括患者此次治疗前基线临床特征、炎性指标、近期疗效、放射治疗、失败模式以及治疗相关的不良事件(trAEs)等。
2. 炎性相关指标的计算方法和分组:中性粒细胞淋巴细胞比值(NLR)=中性粒细胞计数/淋巴细胞计数,基线检查本组患者NLR值为1.13~18.05,中位4.02,依据中位数值将患者分为疗前≤4.02和>4.02两组。血小板淋巴细胞比值(PLR) =血小板计数/淋巴细胞计数,基线检查本组患者PLR值为为69.37~1 247.06,中位218.99,依据中位数值将患者分为疗前≤218.99和>218.99两组。
3. 放射治疗:共有56例患者接受了放射治疗,其中全部病灶放疗(RAL)组和部分病灶放疗(RPL)组患者分别为33例(58.9%)和23例(41.1%),均采用累及野照射,处方剂量为45~60 Gy/25~30次,1.8~2.0 Gy/次。等效生物剂量(α/β=10 Gy)的中位数为54 Gy。
4. 化学治疗:共有95例(82.8%)患者接受了化疗,2~6个周期,中位4个周期。化疗方案为铂类联合紫杉醇52例(54.7%)、单药紫杉醇29例(30.5%)、替吉奥14例(14.7%)。其中有48例患者在化疗同时接受了ICIs和放疗,另47例患者为化疗联合ICIs治疗。
5. 免疫治疗:116例患者全部接受了ICIs治疗,其中48例(41.4%)患者使用卡瑞丽珠单抗,200 mg/次,3次/周;47例(40.5%)使用信迪利单抗,200 mg/次,3次/周; 13例(11.2%)使用替雷利珠单抗,200 mg/次,3次/周;8例(6.9%)使用帕博利珠单抗,200 mg/次,3次/周;免疫周期为3~28个,中位4个周期。
6. 治疗相关不良反应评价与疗效评价标准:免疫相关反应标准(irRC)用于确定免疫治疗启动后的反应和进展;治疗期间及治疗后的相关不良反应评价根据美国国家癌症研究所不良事件通用术语标准(NCI-CTCAE)5.0版进行分级(本研究只对≥2级的不良反应进行分析);实体瘤免疫相关疗效评价标准(irRECIST)为免疫治疗的疗效评价标准;疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和疾病进展(PD)。治疗后总有效率(ORR)=(CR+PR)/总人数× 100%;疾病控制率(DCR)=(CR+PR+SD)/总人数× 100%。
7. 随访:该组患者均接受了规律复查,复查项目主要包括血液学化验检查及影像学检查(超声、CT、食管钡餐造影等),怀疑食管、吻合口和残胃复发患者行内镜检查,必要时行正电子发射计算机断层显像(PET-CT)等检查。治疗失败模式主要包括局部区域复发(LRR)和远处转移(DM),远处转移性疾病定义为非区域的淋巴结复发和脏器转移。规律复查时间为治疗期间每1~2个月进行一次,治疗结束后1年内为每3个月复查1次,2年内为每6个月复查1次。最后随访日期截止2022年12月31日。
8. 统计学处理:应用SPSS 25.0软件进行统计学分析,单因素生存分析采用Kaplan-Meier法和Log-rank检验,中位时间采用Kaplan-Meier方法计算。采用Cox比例风险回归模型进行多因素分析,将单因素分析中P < 0.05的变量纳入多因素分析。P < 0.05为差异有统计学意义。本研究的主要终点是二线治疗开始后的总生存(OS)和无进展生存(PFS),OS被定义为从治疗开始到死亡日期或最后一次随访的时间。PFS被定义为从治疗开始到首次记录的疾病进展、死亡或最后一次接触(以先发生者为准)的时间。
结果1. 病例资料:患者一般临床情况见表 1。自2018年6月至2021年8月,共收集符合入组条件的116例患者进行该项回顾性分析,男性76例,女性40例;年龄为42~78岁,中位年龄66岁。截至2022年12月31日,中位随访时间为18个月。患者此次治疗前为区域淋巴结复发24例、食管原发灶/吻合口复发26例、食管原发灶+区域淋巴结复发13例、锁上淋巴结复发19例、锁上+纵隔淋巴结复发8例、腹腔淋巴结复发3例、远处脏器转移3例、区域复发+远处脏器转移8例,另外12例为全身多部位淋巴结复发。依据食管癌不同部位淋巴结复发特点,本组患者分为局部区域性复发90例,其他26例;共有95例(82.8%)患者接受了化疗,2~6个周期,中位4个周期;116例患者全部接受了ICIs治疗,免疫周期为3~28个,中位4个周期。
|
|
表 1 患者一般临床资料分析结果 Table 1 Analytical results of general clinical data of patients |
2. 预后分析:全组患者1、2、3年OS和PFS率分别为62.5%、45.7%、43.4%和47.7%、31.1%、25.9%;中位OS和PFS时间分别为19.4个月(95%CI:12.84~25.96)和12.0个月(95%CI:8.68~15.33)。
将可能影响患者预后的一般临床资料进行单因素分析,结果显示患者年龄、失败类型和免疫周期数为影响患者OS的因素(χ2=4.03、5.48、8.95,P < 0.05);免疫周期数为影响患者PFS的因素(χ2=4.32,P < 0.05),见表 2。
|
|
表 2 影响患者预后的单因素分析结果 Table 2 Univariate analysis results of the prognosis of patients |
3. 治疗前NLR和PLR对预后的影响:依据NLR和PLR的中位数值分别将患者分为两组,结果如表 3所示,NLR≤4.02组患者的OS和PFS均显著优于NLR>4.02组患者(χ2=14.93、11.60,P<0.05)。PLR≤218.99组患者的OS和PFS亦均显著优于PLR>218.99组患者(χ2=17.55、8.95,P<0.05)。
|
|
表 3 治疗前NLR和PLR对患者预后影响的分析结果 Table 3 Analysis results of the impacts of pre-treatment NLR and PLR on the prognosis of patients |
4. 放射治疗对预后的影响:56例(48.3%)患者接受了放射治疗,其中局部区域复发组有44例,其他类型组有12例接受了放疗;在区域复发的44例患者中有31例接受了所有病灶的放疗,12例其他类型患者仅2例接受了所有病灶放疗。据此将患者分为CRT+ICIs/RT+ICIs组(56例)和CT+ICIs/ICIs组(60例)。从表 4中可以观察到放射治疗的加入可以显著提高患者的OS时间(χ2=5.93,P<0.05),但对PFS的影响不大(P>0.05)。为进一步明确放疗范围和介入时间,对接受了放疗的56例患者进行了分层分析。结果显示,33例接受了全部病灶放疗患者的OS和PFS率均显著优于接受部分病灶照射的患者(χ2=8.88、4.93,P<0.05);放疗介入的时间对患者的OS和PFS均无显著影响(P>0.05)。详见表 4。
|
|
表 4 放射治疗对患者预后的单因素分析结果 Table 4 Univariate analysis results of the impacts of radiotherapy on the prognosis of patients |
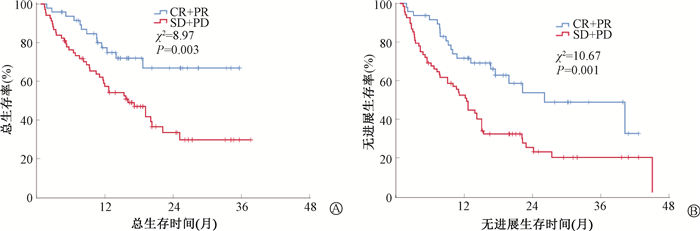
5. 近期疗效对预后的影响:治疗结束后达CR、PR、SD和PD的患者各为7、38、55和16例,ORR为38.8%,DCR为86.2%。CRT+ICIs组和RT+ICIs组患者疗效达CR+PR者27例(23.3%),SD+PD者29例(41.6%);CT+ICIs组和ICIs组患者疗效达PR者18例(21.6%),SD+PD者42例(32.2%);差异有统计学意义(χ2=4.05,P=0.044)。疗效为CR和PR组的45例患者1、2、3年OS率和PFS率分别为75.8%、67.2%、67.2%和53.0%、33.6%、30.2%,中位OS未达到,中位PFS时间为15.0个月;SD和PD组的71例患者1、2、3年OS率和PFS率分别为69.6%、53.1%、35.4%和32.7%、17.8%、17.8%,中位OS和PFS时间分别为33.0个月和9.6个月;两组患者的预后差异有统计学意义(χ2=8.97、10.67,P<0.05),见图 1。
|
注:CR. 完全缓解;PR. 部分缓解;SD. 疾病稳定;PD. 疾病进展 图 1 116例食管鳞癌患者近期疗效对总生存 (A) 和无进展生存 (B) 预后的影响 Figure 1 Impacts of recent treatment efficacy on overall survival (A) and progression-free survival (B) prognosis among 116 ESCC patients |
6. 预后的多因素分析:将影响患者预后的单因素纳入COX多因素分析模型,结果显示复发类型、PLR、免疫周期数、局部放疗介入和近期疗效为影响患者OS的独立性危险因素(HR=2.67、4.63、0.39、2.10、3.35,P<0.05);NLR、PLR、免疫周期数和近期疗效为影响患者PFS的独立性危险因素(HR=1.79、1.89、0.54、2.50,P<0.05),见表 5。
|
|
表 5 影响患者预后的多因素分析结果 Table 5 Multivariate analysis results of the prognosis of patients |
7. 治疗疗后失败模式:治疗结束后共出现治疗失败者38例(32.8%),其中原治疗部位复发15例、新发病变18例,两者兼有5例。具体失败部位如下:食管原发灶复发4例、食管伴淋巴结复发4例、纵隔淋巴结复发6例、颈部淋巴结复发3例、骨转移5例、肺转移2例、肝转移2例、胸膜转移1例、吻合口复发3例、多发淋巴结复发5例、食管原发灶复发伴胸膜转移1例、吻合口合并纵隔淋巴结复发及骨转移1例、颈部淋巴结复发伴胸膜转移1例。
8. 治疗相关不良反应:共有36例(31.0%)患者出现≥2级治疗相关不良反应,其中肺炎8例、骨髓抑制8例、呕血伴骨髓抑制1例、肺炎伴骨髓抑制4例、乏力1例、甲亢1例、甲减5例、鼻腔出血伴甲减1例、皮炎1例、胃肠道反应2例、溶血性贫血1例、食管纵隔瘘1例、心功能下降2例。
讨论ESCC为我国常见的消化道恶性肿瘤,其侵袭性强,预后差,且多数以根治性治疗为目的的ESCC患者最终也发展为局部区域复发或/和远处转移[12]。基于目前现有的临床试验结果,ICIs联合治疗已被推荐作为复发或/和转移性食管癌患者的主要治疗方案[10, 13]。在LR/M ESCC患者中,ICIs和放化疗(CRT)的联合治疗已成为一种新的策略,可能具有协同作用和更大的疗效,但目前研究报道并不多见[14-16]。本研究对一线根治性治疗后失败的116例ESCC患者进行了回顾性分析,结果显示这些患者在接受ICIs联合放/化疗后显示出了较好的疗效。
相较于ICIs联合化疗治疗食管癌患者的研究,ICIs联合放疗/放化疗的相关研究目前还较少,而ICIs联合化疗治疗食管癌患者的临床疗效已经达到了瓶颈期,为克服这一限制,并考虑到食管癌患者主要失败模式为局部区域复发,且放射治疗广泛应用于食管癌患者病情发展的各个阶段,因此近年来ESCC患者的ICIs联合放/化疗越来越受到临床医生的关注。关于放疗免疫疗法的潜在机制及其治疗益处理论证据较为充分[17],但这种疗法的最佳组合方式在临床上仍主要处于试验阶段[18],因缺乏大宗的循证医学证据,且面临着各种挑战。Wu等[14]对127例接受ICIs联合或不联合放疗的LR/M ESCC患者进行了回顾性分析,其结果显示,复发患者可从组合治疗中获益,并认为与单独的ICIs治疗相比,放疗使患者的吞咽困难症状得到了显著改善。Zhao等[11]对接受ICIs联合放/化治疗的198例局部晚期或复发转移性ESCC患者进行了回顾性分析,这组患者的中位OS和PFS时间分别为30.4和15.3个月,ORR和DCR分别为57.1%和94.9%,亚组分析结果显示放疗的加入提高了患者的近期疗效,且全部病灶放疗组患者的预后显著高于部分病灶放疗组患者。在其另一项针对camrelizumab联合或不联合放疗二线治疗LR/M ESCC患者的研究中,其结果同样显示放射治疗可提高患者的预后[19]。一项全国多中心研究结果同样显示,全身治疗的基础上加局部放疗可显著增加寡转移性食管鳞状细胞癌患者的疗效,并使患者无进展生存期改善8.9个月,死亡风险降低54%[20]。
本研究结果与以上研究结果相似,本研究中有56例患者接受了放疗,且放疗的介入可以显著提高患者的OS率,且接受全部病灶放疗的患者OS和PFS率均显著高于部分病灶放疗患者。在全身治疗的基础上加入局部治疗可提高患者预后的可能机制:首先,局部治疗可以较好地改善肿瘤负荷大的情况,从而减少肿瘤耐药和降低微转移的出现概率[21-22];其次,通过局部治疗对肿瘤负荷的减轻,可以较好地缓解远处微转移灶的生长[23];第三,局部治疗可增加药物治疗的敏感性。
目前,临床对于ICIs联合放(化)疗的时间-剂量模式并不明确。本研究结果显示,ICIs与放(化)疗同步拟或序贯,对于患者的预后均未见显著影响,这可能与本研究样本量较小有关。李幼梅等[24]对57例接受放化疗联合ICIs一线治疗局部晚期或转移性食管鳞癌的研究结果与本研究结果相似,即联合治疗顺序对患者的预后无显著性影响。临床上正在进行的Ⅲ期临床试验研究中多数设计方案为ICIs与放(化)疗同步[25-26],TENERGY研究则是在放化疗后序贯应用ICIs[27]。由此可见,ICIs与放(化)疗联合治疗的最佳时间-剂量模式需要更多的临床试验结果来确定。
肿瘤的发生、发展与肿瘤微环境息息相关,炎性细胞为肿瘤微环境的重要组成成分,且与肿瘤细胞的增殖、局部浸润和远处转移均密切相关[28],炎性反应为宿主细胞对肿瘤细胞的一种自我防卫反应,而这一反应往往会抑制细胞凋亡并促进DNA损伤,从而导致肿瘤细胞的过度增殖或/和过早转移[29]。血清学炎性细胞主要包括白细胞、中性粒细胞、淋巴细胞和血小板等,由它们互相联合组成的相关指标可以量化炎症和免疫反应,例如NLR和PLR等在一定程度上可反映肿瘤微环境中更广泛的变化,临床研究证实它们可以作为评估患者预后的生物标记物[30-31]。Li等[30]在其全面评估食管癌患者NLR的预后和临床病理意义对综述中显示较高的NLR与肿瘤分化、肿瘤长度、肿瘤浸润深度、淋巴结转移和临床分期相关,且NLR升高预示食管癌患者全面预后不良。Zhang等[31]的研究结果则显示PLR为预测接受放化疗的食管癌患者DFS的独立因素。Zhao等[32]的研究结果显示,NLR和PLR为预测接受ICIs联合放(化)疗二线治疗的R/M ESCC患者预后的独立性指标。本研究与以上研究结果相似,本研究结果显示较高的NLR和PLR数值与较低的OS率和PFS率显著相关,且为预测患者预后的独立性指标。由于在临床上易获得,即使是基层医院医生也可以依据血常规结果通过简单计算而得出NLR和PLR等相关数值,同时综合考虑既往相关研究和本研究结果,认为NLR和PLR可作为接受ICIs联合放(化)疗二线治疗R/M ESCC患者预后的预测标志物,并值得临床进一步研究。
综合治疗的治疗相关不良反应的发生率和级别往往较单独治疗方案更高一些,本研究与既往相关研究[24, 32-34]中患者不良反应发生情况相当,但不尽相同,这与不同研究中入组患者人群、使用免疫药物及其联合治疗模式不尽相同均有关系。本研究中有31.0%的患者出现≥2级治疗相关不良反应,其中最多见为骨髓抑制和肺炎,最严重的为1例出现了食管纵隔瘘。因此,对于ICIs联合放(化)了带来的不良反应,尤其是后期不良反应值得临床进一步观察和深入研究。
由于本研究为单中心回顾性研究,因此有其固有的局限性:首先,存在选择偏倚和误分类偏倚的风险;其次,炎性指标的水平可能受到一线治疗方案等其他混杂因素的影响;第三,本研究中没有考虑不同的免疫检查点抑制剂可能会对患者的预后产生影响;第四,本研究的治疗方案不统一,主要由主治医生自行决定,而且治疗前没有评估患者的PD-L1表达水平。
总之,本研究结果表明免疫放(化)疗组合可以改善复发或/和转移性食管鳞癌患者的肿瘤反应和总生存期,且不良反应可控,这突出了患者选择的重要性和进一步研究以优化治疗策略的必要性。诸如联合治疗的时机、顺序、持续时间、放疗范围和技术等问题,值得进一步深入研究。最终结果需要进行大宗病例的前瞻性研究来确定和证实。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 王玉芳主要负责、文献查找、论文撰写及修改;刘美荣负责数据收集分析
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
Gronnier C, Collet D. New trends in esophageal cancer management[J]. Cancers (Basel), 2021, 13(12): 3030. DOI:10.3390/cancers13123030 |
| [3] |
Cao W, Chen HD, Yu YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J (Engl), 2021, 134(7): 783-791. DOI:10.1097/CM9.0000000000001474 |
| [4] |
Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-e567. DOI:10.1016/S2214-109X(18)30127-X |
| [5] |
Sun JM, Shen L, Shah MA, et al. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study[J]. Lancet, 2021, 398(10302): 759-771. DOI:10.1016/S0140-6736(21)01234-4 |
| [6] |
Luo H, Lu J, Bai Y, et al. Effect of camrelizumab vs placebo added to chemotherapy on survival and progression-free survival in patients with advanced or metastatic esophageal squamous cell carcinoma: the ESCORT-1st randomized clinical trial[J]. JAMA, 2021, 326(10): 916-925. DOI:10.1001/jama.2021.12836 |
| [7] |
Wang ZX, Cui C, Yao J, et al. Toripalimab plus chemotherapy in treatment-naïve, advanced esophageal squamous cell carcinoma (JUPITER-06): A multi-center phase 3 trial[J]. Cancer Cell, 2022, 40(3): 277-288. e3. DOI:10.1016/j.ccell.2022.02.007 |
| [8] |
Choueiri TK, Powles T, Burotto M, et al. Nivolumab plus cabozantinib versus sunitinib for advanced renal-cell carcinoma[J]. N Engl J Med, 2021, 384(9): 829-841. DOI:10.1056/NEJMoa2026982 |
| [9] |
Cao Y, Qin S, Luo S, et al. Pembrolizumab versus chemotherapy for patients with esophageal squamous cell carcinoma enrolled in the randomized KEYNOTE-181 trial in Asia[J]. ESMO Open, 2022, 7(1): 100341. DOI:10.1016/j.esmoop.2021.100341 |
| [10] |
Huang J, Xu J, Chen Y, et al. Camrelizumab versus investigator's choice of chemotherapy as second-line therapy for advanced or metastatic oesophageal squamous cell carcinoma (ESCORT): a multicentre, randomised, open-label, phase 3 study[J]. Lancet Oncol, 2020, 21(6): 832-842. DOI:10.1016/S1470-2045(20)30110-8 |
| [11] |
Zhao XH, Gao HM, Wen JY, et al. Immune checkpoint inhibitors combined with or without radio(chemo)therapy for locally advanced or recurrent/metastatic esophageal squamous cell carcinoma[J]. Discov Oncol, 2023, 14(1): 165. DOI:10.1007/s12672-023-00783-3 |
| [12] |
Krug S, Michl P. Esophageal cancer: new insights into a heterogenous disease[J]. Digestion, 2017, 95(4): 253-261. DOI:10.1159/000464130 |
| [13] |
Shen L, Kato K, Kim SB, et al. Tislelizumab versus chemotherapy as second-line treatment for advanced or metastatic esophageal squamous cell carcinoma (RATIONALE-302): a randomized phase Ⅲ study[J]. J Clin Oncol, 2022, 40(26): 3065-3076. DOI:10.1200/JCO.21.01926 |
| [14] |
Wu XY, Li YQ, Zhang KN, et al. Immunotherapy with or without radiotherapy for metastatic or recurrent esophageal squamous cell carcinoma: A real-world study[J]. Clin Trans Radiat Oncol, 2022, 38: 130-137. DOI:10.1016/j.ctro.2022.10.011 |
| [15] |
Sihag S, Ku GY, Tan KS, et al. Safety and feasibility of esophagectomy following combined immunotherapy and chemoradiotherapy for esophageal cancer[J]. J Thorac Cardiovasc Surg, 2021, 161(3): 836-843. e1. DOI:10.1016/j.jtcvs.2020.11.106 |
| [16] |
Wang R, Liu S, Chen B, et al. Recent advances in combination of immunotherapy and chemoradiotherapy for locally advanced esophageal squamous cell carcinoma[J]. Cancers (Basel), 2022, 14(20): 5168. DOI:10.3390/cancers14205168 |
| [17] |
Jagodinsky JC, Harari PM, Morris ZS. The promise of combining radiation therapy with immunotherapy[J]. Int J Radiat Oncol Biol Phys, 2020, 108(1): 6-16. DOI:10.1016/j.ijrobp.2020.04.023 |
| [18] |
Jiang M, Hu Y, Lin G, et al. Radiotherapy combined with immune checkpoint inhibitors in locally advanced/metastatic esophageal squamous cell carcinoma: clinical trials, efficacy and future directions[J]. Front Immunol, 2023, 14: 1177085. DOI:10.3389/fimmu.2023.1177085 |
| [19] |
Zhao XH, Shen WB, Wang D, et al. The prognosis value of CONUT and SIS score for recurrent or metastatic esophageal squamous cell carcinoma patients treated with second-line immunotherapy[J]. Front Oncol, 2023, 13: 1167625. DOI:10.3389/fonc.2023.1167625 |
| [20] |
Liu Q, Chen JQ, Lin Y, et al. Systemic therapy with or without local intervention for oligometastatic oesophageal squamous cell carcinoma (ESO-Shanghai 13): an open-label, randomised, phase 2 trial[J]. Lancet Gastroenterol Hepatol, 2024, 9(1): 45-55. DOI:10.1016/S2468-1253(23)00316-3 |
| [21] |
Gundem G, Van Loo P, Kremeyer B, et al. The evolutionary history of lethal metastatic prostate cancer[J]. Nature, 2015, 520(7547): 353-357. DOI:10.1038/nature14347 |
| [22] |
Kim MY, Oskarsson T, Acharyya S, et al. Tumor self-seeding by circulating cancer cells[J]. Cell, 2009, 139(7): 1315-1326. DOI:10.1016/j.cell.2009.11.025 |
| [23] |
Twyman-Saint Victor C, Rech AJ, Maity A, et al. Radiation and dual checkpoint blockade activate non-redundant immune mechanisms in cancer[J]. Nature, 2015, 520(7547): 373-377. DOI:10.1038/nature14292 |
| [24] |
李幼梅, 李曙光, 宋春洋, 等. 放化疗联合免疫一线治疗局部晚期或转移性食管鳞癌的初步分析[J]. 中华放射医学与防护杂志, 2023, 43(10): 766-773. Li YM, Li SG, Song CY, et al. A preliminary analysis of chemoradiotherapy combined with immunotherapy as first-line treament for locally advanced or metastatic esophageal squamous cell carcinoma[J]. Chin J Radiat Med Prot, 2023, 43(10): 766-773. DOI:10.3760/cma.j.cn112271-20230221-00048 |
| [25] |
Yu R, Wang W, Li T, et al. RATIONALE 311: tislelizumab plus concurrent chemoradiotherapy for localized esophageal squamous cell carcinoma[J]. Future Oncol, 2021, 17(31): 4081-4089. DOI:10.2217/fon-2021-0632 |
| [26] |
Shah MA, Bennouna J, Doi T, et al. KEYNOTE-975 study design: a phase Ⅲ study of definitive chemoradiotherapy plus pembrolizumab in patients with esophageal carcinoma[J]. Future Oncol, 2021, 17(10): 1143-1153. DOI:10.2217/fon-2020-0969 |
| [27] |
Bando H, Kotani D, Tsushima T, et al. TENERGY: multicenter phase Ⅱ study of atezolizumab monotherapy following definitive chemoradiotherapy with 5-FU plus cisplatin in patients with unresectable locally advanced esophageal squamous cell carcinoma[J]. BMC Cancer, 2020, 20(1): 336. DOI:10.1186/s12885-020-06716-5 |
| [28] |
Shrihari TG. Dual role of inflammatory mediators in cancer[J]. Ecancerme-dicalscience, 2017, 11: 721. DOI:10.3332/ecancer.2017.721.eCollection2017 |
| [29] |
Suzuki T, Ishibashi Y, Tsujimoto H, et al. A novel systemic inflammatory score combined with immunoinflammatory markers accurately reflects prognosis in patients with esophageal cancer[J]. In Vivo, 2020, 34(6): 3705-3711. DOI:10.21873/invivo.12218 |
| [30] |
Li B, Xiong F, Yi S, et al. Prognostic and clinicopathologic significance of neutrophil-to-lymphocyte ratio in esophageal cancer: an update meta-analysis[J]. Technol Cancer Res Treat, 2022, 21: 15330338211070140. DOI:10.1177/15330338211070140 |
| [31] |
Zhang Y, Han N, Zeng X, et al. Impact of platelets to lymphocytes ratio and lymphocytes during radical concurrent radiotherapy and chemotherapy on patients with nonmetastatic esophageal squamous cell carcinoma[J]. J Oncol, 2022, 2022: 3412349. DOI:10.1155/2022/3412349 |
| [32] |
Zhao XH, Shen WB, Zhu SC, et al. The prognostic value of nutritional immunoinflammatory indicators for patients with esophageal squamous cell carcinoma treated with second-line immunotherapy combined with radio (chemo) therapy[J]. Chin J Clin Oncol, 2023, 50(14): 720-727. DOI:10.12354/j.issn.1000-8179.2023.20230297 |
| [33] |
Zhang W, Yan C, Zhang T, et al. Addition of camrelizumab to docetaxel, cisplatin, and radiation therapy in patients with locally advanced esophageal squamous cell carcinoma: a phase 1b study[J]. Oncoimmunology, 2021, 10(1): 1971418. DOI:10.1080/2162402X.2021.1971418 |
| [34] |
Park S, Oh D, Choi YL, et al. Durvalumab and tremelimumab with definitive chemoradiotherapy for locally advanced esophageal squamous cell carcinoma[J]. Cancer, 2022, 128(11): 2148-2158. DOI:10.1002/cncr.34176 |
 2024, Vol. 44
2024, Vol. 44


