2. 大连医科大学附属第二医院胸部肿瘤科, 116027 大连
2. Department of Thoracic Oncology, the Second Hospital of Dalian Medical University, Dalian 116027, China
头颈部肿瘤起源于口腔、咽、喉等部位的黏膜上皮细胞,病理类型以鳞状细胞癌为主。据统计,头颈部肿瘤每年的发病人数超过80万,死亡人数超过45万[1],吸烟、酗酒、人乳头瘤病毒(HPV)感染等是头颈部肿瘤的主要致病因素。大多数患者就诊时已为局部晚期,同步放化疗(CRT)是主要的治疗方式,但患者的5年生存率仍低于50%[2-3]。研究发现,诱导化疗序贯CRT可进一步提高部分患者的生存获益[3-5]。80%~90%的头颈部鳞癌表皮生长因子受体(EGFR)呈过表达状态,且EGFR与肿瘤细胞的存活、增殖、组织侵袭和转移以及抑制细胞凋亡有关[6-7]。尼妥珠单抗是一种人源化靶向EGFR的单克隆抗体,在目前已发表联合CRT的研究中取得了高效、低不良反应的效果[8-9]。本研究回顾性分析了尼妥珠单抗联合TP方案诱导化疗序贯CRT在局晚期头颈部鳞癌中的疗效及安全性。
资料与方法1. 研究患者:收集2018年1月至2022年6月大连医科大学附属第二医院收治的局部晚期头颈部鳞癌(除外鼻咽癌)患者的临床资料,共65例。纳入标准:①病理组织学、影像学等检查证实为局部晚期(Ⅲ期/ⅣA期/ⅣB期)头颈部鳞癌。②既往未行任何抗肿瘤治疗。③年龄在18~75岁之间。④预计生存期≥6个月,无严重心肝肾功能异常,能够耐受化疗及放射治疗。⑤拒绝行手术治疗。⑥诱导治疗2~3个周期,序贯以顺铂为基础的同步放化疗。⑦无其他第二原发肿瘤。排除标准:①病理组织学为腺癌、腺鳞癌等非鳞癌者。②影像学检查证实分期不符者。③诱导治疗方案不符者。④拒绝接受放疗、未完成放疗者。患者的原发病灶及颈部淋巴结均以头颈部增强磁共振成像(MRI)检查为基础,分期依照美国癌症联合委员会(AJCC)第8版TNM分期。根据诱导治疗方案的不同分为Nimo-TP组34例,TP组31例。本研究已通过大连医科大学附属第二医院伦理委员会审批(No.2022-148),且所有患者均已签署知情同意书。
2. 诱导治疗:诱导方案包括Nimo-TP和TP两种。TP方案为白蛋白结合型紫杉醇(260 mg/m2,d1),顺铂(75 mg/m2,d2~4)。Nimo-TP组于化疗前1 d予尼妥珠单抗(200 mg)。诱导治疗每3周一次,共2~3周期。
3. 同步放化疗:所有患者均采用三维适形调强放疗(IMRT)。依照头颈部肿瘤的国际靶区勾画指南进行放疗靶区勾画设计。肿瘤原发病灶和临床阳性淋巴结(GTVp/GTVnd)的处方剂量为69.96 Gy/33次,每次2.12 Gy。高危临床靶区(CTV1)剂量为60.06 Gy/33次,每次1.82 Gy。低危临床靶区(CTV2)剂量为50.96 Gy/28次,每次1.82 Gy。所有患者在放疗期间每周皆给予顺铂单药化疗(30 mg/m2),两组中位顺铂剂量均为100 mg/m2,差异无统计学意义(P>0.05);Nimo-TP组有16例患者在CRT期间联合了尼妥珠单抗(200 mg/周),TP组所有患者均未使用尼妥珠单抗。
4. 疗效及不良反应:所有患者均依照实体瘤疗效评价标准(RECIST 1.1)评估疗效。诱导治疗完成后2周进行首次疗效评估,在CRT结束后1个月再次进行疗效评估。本研究的终点包括诱导治疗后的客观缓解率(ORR)、总生存(OS)、无进展生存(PFS)、无局部区域复发生存(LRRFS)、无远处转移生存(DMFS)以及诱导治疗期间的不良反应。ORR定义为治疗后疗效达完全缓解(CR)和/或部分缓解(PR)的患者所占的比例;OS定义为从确诊日期到任何原因死亡的时间;PFS定义为从确诊日期到肿瘤进展或任何原因死亡的时间;LRRFS定义为从确诊日期到出现原发肿瘤或区域淋巴结进展的时间;DMFS定义为从确诊日期到肿瘤出现远处组织或器官转移的时间。依照常见不良事件评价标准(CTCAE 5.0)评估诱导治疗期间的不良反应。根据美国放射肿瘤协作组(RTOG)急性放射不良反应标准评估从放疗开始到之后90 d内的不良反应。
5. 随访:治疗结束后的2年内每3个月随访一次,2~5年内每6个月随访一次,5年后每年随访一次。末次随访时间为2023年7月1日,中位随访时间为21.1个月(5.6~57.3个月)。随访资料来源于门诊和住院患者的病历以及电话回访。
6. 统计学处理:采用SPSS 26.0软件进行统计学分析。应用Kaplan-Meier法计算两组的OS、PFS、LRRFS、DMFS,并用log-rank检验比较差异。应用Cox比例风险模型进行单因素和多因素预后分析。P<0.05为差异具有统计学意义。
结果1. 患者基本资料:Nimo-TP组和TP两组中大多数患者为男性(85.3%和100%),患者的平均年龄分别为(59.7±8.9)岁和(57.6±7.1)岁。患者中口咽癌的数量最多。两组中ⅣA期患者占比均最高(61.8% vs. 67.7%)。所有患者按照东部肿瘤协作组(ECOG)评分标准均评为1分,见表 1。
|
|
表 1 患者基本资料 Table 1 General data of patients |
2. 疗效及生存结果:诱导治疗后,Nimo-TP组有1例达到CR,22例达到了PR,11例为疾病稳定(SD),没有患者发生疾病进展(PD), ORR为67.6%。TP组没有患者达到CR,13例PR,17例SD,1例PD, ORR为41.9%。两组诱导治疗后ORR差异有统计学意义(χ2=4.34,P =0.037)。在CRT后,Nimo-TP组和TP组分别有6例和3例达到了CR,24例和18例达到了PR,1例和7例为SD,两组均有3例发生PD。两组全部治疗完成后的ORR差异有统计学意义(88.2% vs. 67.7%,χ2=4.03,P=0.045)。
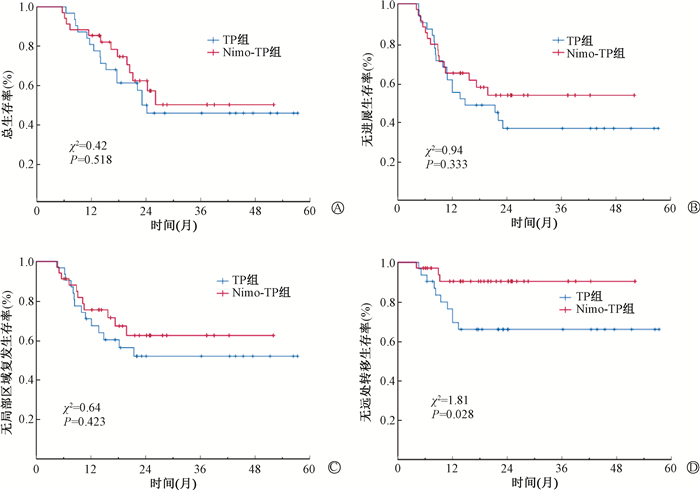
随访期间有30例发生疾病进展(Nimo-TP组13例,TP组17例),其中17例为局部区域复发(Nimo-TP组10例,TP组7例),5例发生了远处转移(Nimo-TP组2例,TP组3例),8例既发生了局部区域复发又合并有远处转移(Nimo-TP组1例,TP组7例)。共有29例死亡(Nimo-TP组13例,TP组16例),其中25例为肿瘤相关死亡,1例死于急性心梗(TP组),3例死因不明(Nimo-TP组2例,TP组1例)。1例失访(Nimo-TP组)。Nimo-TP组和TP组的1、2年OS率分别为85.3%和80.6%、62.0%和49.5%;1、2年PFS率分别为64.7%和54.8%、53.4%和36.5%;1、2年LRRFS率分别为75.5%和71.0%、62.5%和52.0%;但差异均无统计学意义(P>0.05)。1、2年DMFS率分别为90.4%和69.5%、90.4%和66.0%,差异具有统计学意义(χ2=1.81, P=0.028),见图 1。
|
注:Nimo-TP. 尼妥珠单抗+诱导化疗;TP. 诱导化疗 图 1 Nimo-TP组和TP组的生存曲线 A. 总生存(OS);B. 无进展生存(PFS);C. 无局部区域复发生存(LRRFS);D. 无远处转移生存(DMFS) Figure 1 Survival curves of the Nimo-TP and TP groups A. OS; B. PFS; C. LRFS; D. DMFS |
3. 不良反应:在诱导期间,最常见的不良事件依次为血液学不良反应、新陈代谢/营养不良、神经系统和胃肠道不良反应。Nimo-TP组分别有7例和4例患者发生1~2级皮疹和黏膜炎,没有3~4级不良反应发生。CRT期间最常见的不良事件依次为放射性黏膜炎、血液学不良反应以及放射性皮炎。CRT期间Nimo-TP组分别有14例和12例发生1~2级皮肤、黏膜不良反应,有3例和19例发生3~4级不良反应,差异无统计学意义。两组在IC和CRT阶段的不良事件差异没有统计学意义(P>0.05),见表 2,3。
|
|
表 2 诱导治疗期间治疗相关不良反应(n,%) Table 2 Treatment-related adverse reactions during IC (n, %) |
|
|
表 3 同步放化疗期间治疗不良反应(n,%) Table 3 Treatment-related adverse reactions during CRT (n, %) |
4. 单因素生存分析:单因素分析结果显示,IC后疗效达到CR/PR的患者在OS、PFS、LRRFS存在获益(P<0.05)。Nimo-TP组较TP组在DMFS上有获益(P=0.042)。性别、年龄、吸烟史、饮酒史、原发部位、T分期、N分期、临床分期、诱导周期数与OS、PFS、LRRFS、DMFS均无相关性,见表 4。
|
|
表 4 影响局晚期头颈部鳞癌患者生存结果的单因素分析 Table 4 Univariate analyses of survival outcomes of LA-HNSCC patients |
5. 多因素生存分析:将单因素分析中明显影响生存结果的因素(IC疗效、诱导方案、临床分期)纳入多因素COX比例风险模型后得出,IC后达到CR/PR是PFS、LRRFS的独立预后因素(P<0.05);Nimo-TP方案诱导治疗是DMFS的独立预后因素(P=0.045),见表 5。
|
|
表 5 影响局晚期头颈部鳞癌患者生存结果的多因素分析 Table 5 Multivariate analyses of survival outcomes of LA-HNSCC patients |
讨论
同步放化疗是LA-HNSCC的标准治疗,但患者的疗效仍不理想。数十年来,有研究通过不断探索发现诱导化疗序贯同步放化疗可能会使部分患者疗效进一步提高[3-5]。目前,紫杉醇/顺铂/5-氟尿嘧啶(TPF)方案是诱导化疗的一线方案,但三药联合方案明显增加了治疗相关不良反应,患者的依从性较差,影响了后续治疗的实施[10]。并且,亚洲人群对化疗药物的耐受性较差,通常需要对剂量进行调整。近年来在鼻咽癌中进行的关于诱导化疗的研究显示,TP方案有着不劣于TPF方案的疗效,并且不良反应较少[11-12]。因此,本研究尝试使用TP方案诱导化疗。
绝大多数头颈部鳞癌存在EGFR的过表达,使得靶向治疗联合化疗成为了一种可能。目前,头颈部鳞癌应用的靶向EGFR的药物主要有西妥昔单抗、帕尼单抗、尼妥珠单抗等。既往研究表明,西妥昔单抗联合诱导化疗加重了皮肤/黏膜不良反应,影响了患者对后续治疗的依从性[13]。而Patil等[14]的研究证实了尼妥珠单抗在LA-HNSCC患者中的良好疗效和轻微的不良反应。因此,本研究旨在探索尼妥珠单抗联合TP方案诱导治疗在LA-HNSCC中的疗效和安全性。
本研究显示,Nimo-TP组在IC和CRT后达到CR/PR的患者占比更高,且多因素分析结果表明,在OS、PFS、LRRFS上有一定的获益趋势。这与已经发表的AGMT和EORTC两项关于西妥昔单抗联合诱导化疗的研究结果相一致[13, 15]。因此,考虑尼妥珠单抗除了靶向拮抗EGFR发挥抗肿瘤作用外,还可以通过刺激NK细胞介导的先天性免疫和增强T淋巴细胞识别EGFR阳性肿瘤细胞的能力,进而避免肿瘤细胞发生免疫逃逸,使得Nimo-TP组表现出了较好的近期疗效和生存结果[16]。另一方面,多因素分析结果表明,IC后疗效达到CR/PR是PFS、LRRFS的独立预后因素。与之相似,Lin等[17]的研究中也得出了同样的结果。此外,本研究中虽然两组患者IC后和CRT后的ORR差异有统计学意义,但多因素分析结果显示诱导治疗方案并非PFS、LRRFS的独立预后因素。考虑选择Nimo-TP方案可使患者获得更好的近期疗效,虽能够在一定程度上降低LA-HNSCC局部复发的风险,但后续的CRT对局部控制起到了更重要的作用,从而导致了多因素分析时两组之间的PFS和LRRFS差异无统计学意义。
较单纯CRT而言,诱导化疗的加入可降低局部晚期头颈部鳞癌远处转移的发生。而本研究结果显示,Nimo-TP方案是DMFS的独立预后因素,即相比单纯诱导化疗,尼妥珠单抗的加入进一步降低了远处转移的发生。由于EGFR与肿瘤细胞的组织侵袭和转移相关,尼妥珠单抗的加入对降低LA-HNSCC的远处转移起到了关键性作用[6]。但目前在LA-HNSCC中尚缺少关于诱导化疗联合尼妥珠单抗的大型Ⅲ期随机对照研究,因此本研究结果仍需进一步验证。
在不良反应方面,与既往的PF/TPF诱导化疗方案相比,TP组患者在IC期间3~4级不良反应发生率显著减少[18-19],没有患者发生3级及以上的皮肤黏膜反应,加入尼妥珠单抗后虽然增加了1~2级不良反应的发生概率,但两组之间差异没有统计学意义。另外,Nimo-TP组有接近一半的患者在CRT期间联合了尼妥珠单抗靶向治疗,3~4级皮肤黏膜不良反应较TP组有所增加,但两组间差异无统计学意义,这与既往研究一致[9, 20]。文献报道,尼妥珠单抗与EGFR的亲和力较低,在正常组织中EGFR呈现低表达状态,而头颈部肿瘤组织中EGFR为过度表达状态[21],两者间EGFR亲和力的差异使得尼妥珠单抗能够更精准地作用于肿瘤组织。Rojo等[22]在尼妥珠单抗治疗后的头颈部肿瘤样本中观察到EGFR磷酸化减少,而没有在皮肤组织中观察到这种现象的发生。综上,或许能够解释尼妥珠单抗在LA-HNSCC患者中轻微的皮肤或黏膜不良反应。
最后,本研究受局限于样本量较小、随访时间较短、口咽癌患者未全部检测HPV状态,以及由于患者依从性、不良反应等原因导致同步放化疗期间顺铂剂量低于标准用量,可能会导致本研究中两组患者的疗效和生存结果偏低。此外,本研究属于回顾性研究,在一些不良反应事件评估中可能存在一定偏差。总之,本研究证实了在尼妥珠单抗联合诱导化疗在局晚期头颈部鳞癌患者中的应用价值,后续还需要大样本、长期随访的研究来进一步证实。
利益冲突 本文作者不涉及任何利益冲突
作者贡献声明 雷宏彬、马瑞兰、张海琛负责构思和设计、研究实施、统计分析、起草论文;陈诗倩、滕云、潘子萍负责数据收集、分析
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Braakhuis BJ, Brakenhoff RH, Leemans CR. Treatment choice for locally advanced head and neck cancers on the basis of risk factors: biological risk factors[J]. Ann Oncol, 2012, 23 Suppl 10: x173-177. DOI:10.1093/annonc/mds299 |
| [3] |
Lacas B, Carmel A, Landais C, et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): An update on 107 randomized trials and 19, 805 patients, on behalf of MACH-NC Group[J]. Radiother Oncol, 2021, 156: 281-293. DOI:10.1016/j.radonc.2021.01.013 |
| [4] |
Petit C, Lacas B, Pignon JP, et al. Chemotherapy and radiotherapy in locally advanced head and neck cancer: an individual patient data network meta-analysis[J]. Lancet Oncol, 2021, 22(5): 727-736. DOI:10.1016/S1470-2045(21)00076-0 |
| [5] |
Vidal L, Ben Aharon I, Limon D, et al. Role of induction chemotherapy prior to chemoradiation in head and neck squamous cell cancer-systematic review and meta-analysis[J]. Cancer J, 2017, 23(2): 79-83. DOI:10.1097/PPO.0000000000000253 |
| [6] |
Yarden Y, Sliwkowski MX. Untangling the ErbB signalling network[J]. Nat Rev Mol Cell Biol, 2001, 2(2): 127-137. DOI:10.1038/35052073 |
| [7] |
Trivedi S, Ferris RL. Epidermal growth factor receptor-targeted therapy for head and neck cancer[J]. Otolaryngol Clin North Am, 2021, 54(4): 743-749. DOI:10.1016/j.otc.2021.04.005 |
| [8] |
Reddy BK, Lokesh V, Vidyasagar MS, et al. Nimotuzumab provides survival benefit to patients with inoperable advanced squamous cell carcinoma of the head and neck: a randomized, open-label, phase Ⅱb, 5-year study in Indian patients[J]. Oral Oncol, 2014, 50(5): 498-505. DOI:10.1016/j.oraloncology.2013.11.008 |
| [9] |
Menon N, Patil V, Noronha V, et al. Quality of life in patients with locally advanced head and neck cancer treated with concurrent chemoradiation with cisplatin and nimotuzumab versus cisplatin alone - additional data from a phase 3 trial[J]. Oral Oncol, 2021, 122: 105517. DOI:10.1016/j.oraloncology.2021.105517 |
| [10] |
Forastiere AA, Adelstein DJ, Manola J. Induction chemotherapy meta-analysis in head and neck cancer: right answer, wrong question[J]. J Clin Oncol, 2013, 31(23): 2844-2846. DOI:10.1200/JCO.2013.50.3136 |
| [11] |
Wang Y, Wang C, He S, et al. Induction chemotherapy regimen of docetaxel plus cisplatin versus docetaxel, cisplatin plus fluorouracil followed by concurrent chemoradiotherapy in locoregionally advanced nasopharyngeal carcinoma: Preliminary results of an open-label, noninferiority, multicentre, randomised, controlled phase 3 trial[J]. E Clin Med, 2022, 53: 101625. DOI:10.1016/j.eclinm.2022.101625 |
| [12] |
He Y, Guo T, Wang J, et al. Which induction chemotherapy regimen followed by cisplatin-based concurrent chemoradiotherapy is the best choice among PF, TP and TPF for locoregionally advanced nasopharyngeal carcinoma?[J]. Ann Transl Med, 2019, 7(5): 104. DOI:10.21037/atm.2019.02.15 |
| [13] |
Keil F, Hartl M, Altorjai G, et al. Docetaxel, cisplatin and 5-FU compared with docetaxel, cisplatin and cetuximab as induction chemotherapy in advanced squamous cell carcinoma of the head and neck: Results of a randomised phase Ⅱ AGMT trial[J]. Eur J Cancer, 2021, 151: 201-210. DOI:10.1016/j.ejca.2021.03.051 |
| [14] |
Patil VM, Noronha V, Joshi A, et al. A randomized phase 3 trial comparing nimotuzumab plus cisplatin chemoradiotherapy versus cisplatin chemoradiotherapy alone in locally advanced head and neck cancer[J]. Cancer, 2019, 125(18): 3184-3197. DOI:10.1002/cncr.32179 |
| [15] |
Specenier PM, Remenar E, Buter J, et al. TPF plus cetuximab induction chemotherapy followed by biochemoradiation with weekly cetuximab plus weekly cisplatin or carboplatin: a randomized phase Ⅱ EORTC trial[J]. Ann Oncol, 2017, 28(9): 2219-2224. DOI:10.1093/annonc/mdx300 |
| [16] |
Mazorra Z, Chao L, Lavastida A, et al. Nimotuzumab: beyond the EGFR signaling cascade inhibition[J]. Semin Oncol, 2018, 45(1-2): 18-26. DOI:10.1053/j.seminoncol.2018.04.008 |
| [17] |
Lin TC, Huang CH, Lien MY, et al. Tumor volume reduction rate to induction chemotherapy is a prognostic factor for locally advanced head and neck squamous cell carcinoma: A retrospective cohort study[J]. Technol Cancer Res Treat, 2022, 21: 15330338221107714. DOI:10.1177/15330338221107714 |
| [18] |
Hitt R, López-Pousa A, Martínez-Trufero J, et al. Phase Ⅲ study comparing cisplatin plus fluorouracil to paclitaxel, cisplatin, and fluorouracil induction chemotherapy followed by chemoradiotherapy in locally advanced head and neck cancer[J]. J Clin Oncol, 2005, 23(34): 8636-8645. DOI:10.1200/JCO.2004.00.1990 |
| [19] |
Ghi MG, Paccagnella A, Ferrari D, et al. Induction TPF followed by concomitant treatment versus concomitant treatment alone in locally advanced head and neck cancer. A phase Ⅱ-Ⅲ trial[J]. Ann Oncol, 2017, 28(9): 2206-2212. DOI:10.1093/annonc/mdx299 |
| [20] |
de Castro Junior G, Segalla JG, de Azevedo SJ, et al. A randomised phase Ⅱ study of chemoradiotherapy with or without nimotuzumab in locally advanced oesophageal cancer: NICE trial[J]. Eur J Cancer, 2018, 88: 21-30. DOI:10.1016/j.ejca.2017.10.005 |
| [21] |
Berger C, Krengel U, Stang E, et al. Nimotuzumab and cetuximab block ligand-independent EGF receptor signaling efficiently at different concentrations[J]. J Immunother, 2011, 34(7): 550-555. DOI:10.1097/CJI.0b013e31822a5ca6 |
| [22] |
Rojo F, Gracias E, Villena N, et al. Pharmacodynamic trial of nimotuzumab in unresectable squamous cell carcinoma of the head and neck: a SENDO Foundation study[J]. Clin Cancer Res, 2010, 16(8): 2474-2482. DOI:10.1158/1078-0432.CCR-09-3042 |
 2024, Vol. 44
2024, Vol. 44


