2. 广州医科大学公共卫生学院, 广州 511436
2. Guangzhou Medical University, School of Public Health, Guangzhou 511436, China
肝癌在我国癌症患者中发病率及死亡率均位居前列[1]。放射治疗是中、晚期肝癌患者的首选治疗方案,可能诱发放射性肝损伤(RILD)[2-3]。肝脏放射敏感性相对较高,受到电离辐射照射后极易产生RILD[4],导致患者产生晚期放射性肝纤维化、肝功能衰竭甚至死亡[5-6]。研究表明,氧化应激在RILD中扮演着重要的角色[7],但目前国内外研究主要集中在单次大剂量辐射构建的RILD模型,如Kim和Jung[8]对小鼠进行20 Gy全身照射6周和肖会会等[9]对小鼠肝脏给予20、25 Gy照射4周后处死小鼠,观察到RILD的产生;或者是单次小剂量照射导致的即时肝脏辐射损伤的研究,如蔡丽娜等[10]对小鼠进行0.8和1.6 Gy全身辐照后24 h的氧化应激水平水平研究。关于单次照射剂量1.8~2.0 Gy剂量诱导肝脏损伤的研究尚少,尚不明确。
本研究采用X射线(2和4 Gy)对小鼠进行全身辐射,初步建立小鼠低剂量肝脏损伤模型,在不同的时间点进行观察,重点探索辐射致小鼠肝损伤早期随时间变化的规律,为单次X射线照射诱导肝损伤研究提供实验依据,同时为肝癌患者RILD的早期干预治疗提供思路。
材料与方法1. 实验动物及照射条件:选取8周龄无特定病原体级(SPF)C57BL/6J雄性小鼠54只[购自广东省医学实验动物中心,动物生产许可证号: SCXK(粤)2018-0002],实验前在洁净动物房适应性喂养1周,饲养环境温度21℃~25℃,相对湿度45%~65%,采用12 h光照、12 h黑暗的昼夜交替模式。动物实验通过广东省职业病防治院实验动物伦理委员会审批(批号:GDHODAEC2022016)。用随机数字表法将小鼠分为对照组、2、4 Gy组,每个组又分为照后1、3、7 d组,共分9组,每组6只。适应性饲养后,照射当天对小鼠称重,进行单次全身照射,分别照射0、2和4 Gy。照射剂量率为0.757 7 Gy/min,焦点距离(FSD)为700 mm,射野面积为18.65 cm × 18.65 cm。
2. 主要试剂和仪器:丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱甘肽(GSH)试剂盒(南京建成生物工程研究所);CIX3 X射线生物辐射器(英国Xs-trahl公司);全波长酶标仪(美国Thermo Fisher公司)。
3. 样本收集与检测:分别于照后1、3和7 d后称重,并给予小鼠异氟烷吸入性麻醉,摘除眼球取血,收集血样后进行脱颈椎处死并解剖。取小鼠肝脏组织进行称重,根据肝脏指数=肝脏重量/体重计算肝脏指数。取血过程中,吸取20 μl新鲜血液于装有2 ml血细胞稀释液的离心管内轻轻混匀,使用全自动血细胞分析仪对小鼠外周血白细胞、中性粒细胞和淋巴细胞进行计数,收集血样5 ml于采血管中,3 000 r/min,离心半径为16.8 cm,4℃离心10 min,吸取血清备用。使用全自动生化分析仪检测天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)及碱性磷酸酶(ALP)。
4. 组织病理学检查:切取小鼠肝脏组织,用4%多聚甲醛进行固定,梯度脱水,石蜡包埋,固定后进行5~7 μm厚切片。用苏木素-伊红(HE)染色后,在光学显微镜下观察组织病理形态变化。
5. 小鼠肝脏组织氧化-抗氧化指标检测:取小鼠肝脏组织20~30 mg装入研磨管中,并以组织(mg)∶磷酸盐缓冲液(PBS,ml)=1∶9的比例加入0.01 mol/L PBS稀释后进行研磨,65 Hz、-20℃研磨2 min。对组织液进行离心,12 000 r/min,离心半径为8.4 cm,4℃离心5 min,取上清液即为配制的10%肝脏组织匀浆,分装于-80℃保存。根据MDA、SOD和GSH试剂盒说明书, 将肝脏匀浆液与不同试剂混匀,经孵育、离心、静置等步骤后,使用酶标仪分别于532、450和405 nm波长处读数。
6. 统计学处理:采用SPSS 25.0软件进行统计分析。对计量资料采用x ± s描述,多组间进行比较前先进行方差齐性分析及正态性检验,方差齐且符合正态分布的计量资料采用方差分析(ANOVA),组间两两比较采用LSD检验分析;方差齐但不符合正态分布时采用Kruskal-Wallis秩和检验;方差不齐且不符合正态分布时采用Welch′s ANOVA。肝脏氧化-抗氧化水平与组织病理学损伤程度之间的相关性分析采用Spearman检验。P < 0.05为差异有统计学意义。
结果1. 小鼠体重和肝脏指数:与对照组相比,2 Gy组和4 Gy组小鼠在照后1、3、7 d体重均显著下降(F = 84.03、27.11、25.50, P < 0.001);肝脏指数在照后1、7 d均显著上升(F = 28.40、17.75, P < 0.001)。与照后1 d相比,2 Gy组和4 Gy组3、7 d的体重均显著上升(F = 21.25、52.35, P < 0.001),见表 1。
|
|
表 1 各组小鼠照后不同时间体重与肝脏指数结果(x ± s) Table 1 Body weight and liver indices of various groups of mice at varying days post-irradiation(x ± s) |
2. 小鼠外周血细胞计数:与对照组相比,照后1、3、7 d小鼠外周血白细胞、中性粒细胞及淋巴细胞均显著下降,且呈现随辐射剂量增加而降低的趋势(F = 8.42~22.91, P < 0.05);与同剂量组照后1 d相比,照后7 d小鼠外周血白细胞、中性粒细胞及淋巴细胞均显著上升(F = 3.60~29.56,P < 0.05),见表 2。
|
|
表 2 各组小鼠照后不同时间外周血细胞计数检测结果(x ± s) Table 2 Peripheral blood cell counts of various groups of mice at varying days post-irradiation(x ± s) |
3. 小鼠血清AST、ALT及ALP水平检测结果:与对照组相比,照后1 d,4 Gy组小鼠AST、ALT水平显著升高(H=7.24、7.82,P < 0.05);2、4 Gy组小鼠ALP在照后1、3 d显著升高(H=11.86、9.75,P < 0.05);与同剂量组照后1 d相比,2 Gy组AST水平显著降低(H=7.25,P < 0.05),见表 3。
|
|
表 3 各组小鼠照后不同时间血清中AST、ALT及ALP水平检测结果 Table 3 AST, ALT, and ALP levels in the serum of various groups of mice at varying days post-irradiation |
4. 小鼠肝脏组织病理学改变:肝脏组织病理显示,光镜下观察2 Gy组照后1 d小鼠肝细胞轻度至中度肿胀变性、脱落、轻微脂肪变性,炎症细胞轻度浸润,局灶性出血,部分肝组织血管管壁变性;3 d后肝细胞肿胀变性加重并出现坏死,部分肝组织血管内皮脱落、周围肝细胞轻度颗粒变性;7 d后肝细胞变性、坏死减轻,但血管内皮脱落及周围肝细胞颗粒变性加重。4 Gy组照后1 d,小鼠肝细胞轻度肿胀、变性、坏死,血管壁变薄,血管周围肝细胞轻度颗粒变性;照后3 d,肝细胞肿胀、变性加重并出现坏死,血管内皮中度脱落、周围肝细胞颗粒变性较前加重;照后7 d,肝细胞肿胀变性、坏死继续加重,见图 1。
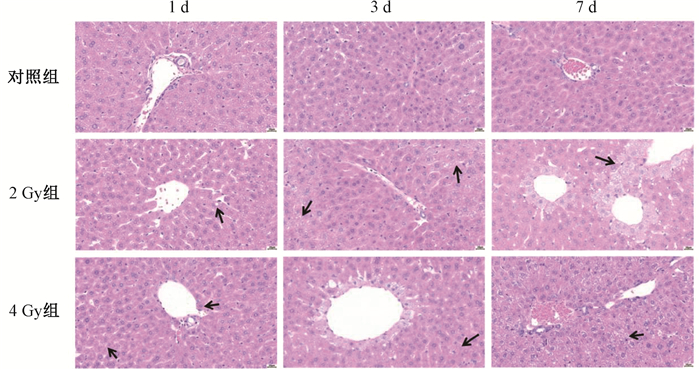
|
注:箭头表示较明显的损伤部位 图 1 不同剂量X射线照后1、3、7 d小鼠肝组织病理学改变 HE染色 × 400 Figure 1 Histopathological changes in the liver of mice exposed to X-rays at varying doses at 1, 3, and 7 d post-irradiation HE staining × 400 |
5. 小鼠肝脏组织氧化-抗氧化水平:如表 4所示,与对照组相比,2和4 Gy组小鼠照后1、3、7 d肝组织MDA水平均显著升高(F = 3.57、197.88、6.55, P < 0.05)。与2 Gy组照后1 d相比,照后3 d组小鼠肝组织MDA水平显著升高(F = 39.61, P < 0.001)。与4 Gy组照后1 d相比,照后3、7 d组小鼠肝组织MDA水平均显著升高(F = 124.28, P < 0.001)。
|
|
表 4 各组小鼠照后不同时间肝脏MDA、SOD、GSH水平检测结果 Table 4 MDA, SOD and GSH levels in the liver of various groups of mice at varying days post-irradiation |
与对照组相比,照后3 d,2和4 Gy组小鼠肝组织SOD水平均显著升高(F = 3.66, P < 0.05),照后7 d,2 Gy组小鼠肝组织SOD水平均显著降低(F = 20.90, P < 0.001)。与2 Gy组、4 Gy组照后1 d相比,照后7 d组小鼠肝组织SOD水平均显著降低(F = 28.91、6.63, P < 0.05)。
与对照组相比,照后1、3 d,2和4 Gy组小鼠肝组织GSH水平均显著降低(F = 3.57、3.89, P < 0.05),照后7 d显著升高(F = 74.10, P < 0.001)。与2 Gy组、4 Gy组照后1 d相比,照后3 d,2 Gy组GSH水平均显著升高(P < 0.05),照后7 d,2 Gy组、4 Gy组均显著升高(F = 35.84、137.47, P < 0.001),见表 4。
6. 小鼠组织氧化-抗氧化水平与组织病理学损伤程度的相关性分析:肝脏组织中MDA水平在照后1、3、7 d均与组织病理学损伤程度呈正相关(r=0.34、0.86、0.38,P < 0.05),其相关具有显著性;SOD水平在照后1 d与组织病理学损伤程度呈现正相关(r=0.38,P=0.033),GSH水平在照后1 d与组织病理学损伤程度呈现负相关(r=-0.76,P=0.001),其余时间点相关无显著性。见表 5。
|
|
表 5 小鼠肝脏组织氧化-抗氧化水平与组织病理学损伤程度的相关性分析 Table 5 Correlations between the oxidative-antioxidant levels and histopathological damage in the liver tissues of mice |
讨论
电离辐射对机体的早期损伤主要表现为外周血细胞减少[11]。本研究对小鼠进行单次2和4 Gy照射后,白细胞、中性粒细胞、淋巴细胞均显著减少,呈现一定剂量关系。不同剂量X射线辐射后,辐照小鼠体重均显著下降,肝脏指数显著升高。病理组织学观察到小鼠肝细胞出现肿胀、变性,炎性细胞轻度浸润,局灶性出血,肝组织血管管壁变性、内皮细胞脱落等改变。4 Gy辐照组小鼠AST、ALT、ALP在辐照后1 d均显著升高,这与蔡丽娜等[10]结果相似。提示本研究不同剂量X射线辐照诱导小鼠放射性肝损伤的模型构建成功。
氧化应激反应在RILD的发生发展过程中扮演了极其重要的角色[12]。电离辐射可直接作用于肝组织中的水分子,发生解离,产生大量氧自由基(ROS),形成的过氧化物会诱发脂质过氧化反应,产生大量MDA,MDA水平的变化反映了肝脏脂质过氧化水平,也间接反映肝脏氧化损伤的程度[13]。MDA介导的氧化应激反应,不仅可以形成脂质过氧化产物,还可以通过链式反应,放大活性氧的作用,引起并加剧生物膜损伤,导致细胞代谢和功能障碍,引发细胞损伤甚至死亡,最终导致肝功能异常及肝脏病理改变[14]。
本研究显示,在照后1、3、7 d,小鼠肝脏MDA水平均显著上升,并且其上升水平与肝脏组织病理损伤程度在各观察点均呈现显著相关性。这比Humpton等[15]观察到在辐照后72 h肝脏过氧化物产生明显增高,脂质过氧化指标开始出现异常的时机出现得更早一些,与陆春怡等[16]、刘芳等[17]发现分别给予小鼠3、8 Gy全身照射,可显著增加小鼠肝脏MDA水平,并伴随组织病理学损伤改变的结果一致。但本研究观察到照后7 d内,MDA水平呈现先上升后下降的变化规律以及其与组织病理损伤程度的显著相关性在以往的研究中较少提及,提示MDA水平的动态变化可以间接反映肝脏发生氧化应激反应的程度及组织病理损伤严重程度。
SOD是机体内重要的抗氧化酶,通过酶促反应清除氧自由基,为应对氧自由基的产生,能迅速代偿性上调其活性水平,促进氧自由基的清除[18-19],调控体内各种活性氧水平,维持活性氧平衡状态。本研究中,SOD水平和MDA水平一样,呈现先上升后下降的趋势,但其出现显著差异的时间稍有延迟,在照后3 d达峰,随后数值回落,在照后7 d低于对照组。此前有研究表明,在给予小鼠1、2、3、4 Gy照射后,小鼠肝脏组织SOD活性随着剂量增加而下降[20],与本研究结果不同,这可能是由于该研究阳性对照组小鼠辐照前给予羧甲基纤维素钠灌胃,降低了小鼠机体SOD活性和对辐射的耐受性。本研究结果提示电离辐射作用于肝脏组织产生的氧自由基在诱导脂质过氧化作用的同时,可以激活肝组织内抗氧化物酶的活性,增强机体的抗氧化能力。
GSH作为机体一种强效抗氧化剂,可直接还原氧自由基,并激活多种抗氧化物酶,提高机体抗氧化抵御能力,其含量的多少是衡量机体抗氧化能力大小的重要因素。本研究中,GSH在照后1、3 d显著降低,在照后7 d显著增高,这与Yi等[21]采用6 Gy 60Co γ射线照射雄性昆明小鼠1 d后,辐照组小鼠肝脏GSH水平降低的结果相似,这可能是因为GSH作为氧自由基的直接清除剂,在辐照后会被产生的氧自由基大量消耗,而其消耗的程度与辐照的剂量有关,随着辐照剂量增大,辐照初期产生的氧自由基超过了抗氧化系统的消除能力,导致GSH水平下降,而当氧化水平累积到一定程度时,机体抗氧化等修复机制会随之启动,通过诱导抗氧化剂介导适应性反应,使GSH在辐照后期为应对氧化损伤起主导作用而产生适应性增高[22]。
SOD和GSH作为体内重要的抗氧化剂和自由基清除剂,能够还原过氧化物,清除自由基,从而维持体内稳态平衡[23-25],可作为一种潜在有效的辐射防护剂,从而减轻或避免RILD。本研究结果发现了小鼠肝脏MDA、SOD、GSH在照后7 d的变化规律,揭示了照后前3 d肝脏组织内氧化应激反应持续增强,第3天开始抗氧化反应占据主导地位的现象,为早期辐照致肝损伤的抗氧化干预治疗提供了思路。
本研究发现给予单次放疗剂量辐射可诱导小鼠肝脏组织病理损伤和氧化-抗氧化水平变化,并具有一定的剂量效应和时间效应关系,可能引起放射性肝损伤。本研究结果为单次放疗剂量X射线诱导肝损伤作用机制及远期效应研究提供实验依据,同时为肝癌患者RILD的早期干预治疗提供参考方向。
利益冲突 无
作者贡献声明 李明芳、张灵钰、蔡丽娜负责实验设计、实验操作、数据整理、起草论文;张素芬、蔡雅诗负责协助部分实验和论文整理;杨宇华、陈慧峰、邹剑明、黄伟旭指导实验设计和论文修改
| [1] |
金保, 杜顺达, 毛一雷, 等. 《原发性肝癌诊疗指南(2022年版)》更新要点解读[J]. 协和医学杂志, 2022, 13(5): 789-795. Jin B, Du SD, Mao YL, et al. Interpretation of the Guidelines for the Diagnosis and Treatment of Primary Liver Cancer (2022 edition)[J]. Union Med J, 2022, 13(5): 789-795. |
| [2] |
Koay EJ, Owen D, Das P. Radiation-induced liver disease and modern radiotherapy[J]. Semin Radiat Oncol, 2018, 28(4): 321-331. DOI:10.1016/j.semradonc.2018.06.007 |
| [3] |
Chen G, Zhao Q, Yuan B, et al. ALKBH5-modified HMGB1-STING activation contributes to radiation induced liver disease via innate immune response[J]. Int J Radiat Oncol Biol Phys, 2021, 111(2): 491-501. DOI:10.1016/j.ijrobp.2021.05.115 |
| [4] |
Schaub SK, Hartvigson PE, Lock MI, et al. Stereotactic body radiation therapy for hepatocellular carcinoma: current trends and controversies[J]. Technol Cancer Res Treat, 2018, 17: 1533033818790217. DOI:10.1177/1533033818790217 |
| [5] |
谢思, 杨明, 黄缘, 等. 晚期原发性肝癌综合治疗后黄疸的诊治及鉴别1例报告[J]. 临床肝胆病杂志, 2021, 37(2): 400-402. Xie S, Yang M, Huang Y, et al. Diagnosis and treatment and differentiation of jaundice after comprehensive treatment of advanced primary liver cancer: A case report[J]. J Clin Hepat Dis, 2021, 37(2): 400-402. DOI:10.3969/j.issn.1001-5256.2021.02.030 |
| [6] |
周蔼斌, 周俊平. 细胞因子及其信号通路在放射性肝损伤发病中的作用研究进展[J]. 实用肝脏病杂志, 2016, 19(6): 766-769. Zhou AB, Zhou JP. Progress in investigating the role of cytokines and their signaling pathways in the pathogenesis of radiation liver injury[J]. J Prac Liver Dis, 2016, 19(6): 766-769. DOI:10.3969/j.issn.1672-5069.2016.06.039 |
| [7] |
Muriel P, Gordillo KR. Role of oxidative stress in liver health and disease[J]. Oxid Med Cell Longev, 2016, 2016: 9037051. DOI:10.1155/2016/9037051 |
| [8] |
Kim J, Jung Y. Radiation-induced liver disease: current understanding and future perspectives[J]. Exp Mol Med, 2017, 49(7): e359. DOI:10.1038/emm.2017.85 |
| [9] |
肖会会, 刘苓苓, 张永康, 等. 精准放疗下C57BL/6J鼠放射性肝损伤模型的建立[J]. 中国辐射卫生, 2023, 32(6): 611-617. Xiao HH, Liu LL, Zhang YK, et al. Establishment of a radioactive liver injury model in C57BL/6J mice under precision radiotherapy[J]. China Radiat Health, 2023, 32(6): 611-617. DOI:10.13491/j.issn.1004-714X.2023.06.003 |
| [10] |
蔡丽娜, 张素芬, 黄伟旭, 等. 不同剂量X射线诱导小鼠肝损伤中氧化应激水平及其与核因子-κB和转化生长因子-β1的相关性[J]. 环境与职业医学, 2023, 40(2): 202-208. Cai LN, Zhang SF, Huang WX, et al. The level of oxidative stress and its correlation with nuclear factor- κB and transforming growth factor- β1 in mice[J]. Environ Occup Med, 2023, 40(2): 202-208. |
| [11] |
Shao L, Luo Y, Zhou D. Hematopoietic stem cell injury induced by ionizing radiation[J]. Antioxid Red Sig, 2014, 20(9): 1447-1462. DOI:10.1089/ars.2013.5635 |
| [12] |
Liguori I, Russo G, Curcio F, et al. Oxidative stress, aging, and diseases[J]. Clin Interv Aging, 2018, 13: 757-772. DOI:10.2147/CIA.S158513 |
| [13] |
Li T, Cao Y, Li B, et al. The biological effects of radiation-induced liver damage and its natural protective medicine[J]. Prog Biophys Mol Biol, 2021, 167: 87-95. DOI:10.1016/j.pbiomolbio.2021.06.012 |
| [14] |
Abadi S, Shirazi A, Alizadeh AM, et al. The effect of melatonin on superoxide dismutase and glutathione peroxidase activity, and malondialdehyde levels in the targeted and the non-targeted lung and heart tissues after irradiation in xenograft mice colon cancer[J]. Curr Mol Pharmacol, 2018, 11(4): 326-335. DOI:10.2174/1874467211666180830150154 |
| [15] |
Humpton TJ, Hock AK, Kiourtis C, et al. A noninvasive iRFP713 p53 reporter reveals dynamic p53 activity in response to irradiation and liver regeneration in vivo[J]. Sci Signal, 2022, 15(720): eabd9099. DOI:10.1126/scisignal.abd9099 |
| [16] |
陆春怡, 高斐, 朱慧, 等. 富硒长双歧杆菌DD98对X射线所致放射性肝损伤小鼠的保护作用[J]. 现代食品科技, 2021, 37(6): 10-19. Lu CY, Gao F, Zhu H, et al. Protective effect of selenium-rich bifidobacterium longum DD98 in mice with X-ray-induced radioactive liver injury[J]. Mod Food Technol, 2021, 37(6): 10-19. DOI:10.13982/j.mfst.1673-9078.2021.6.0957 |
| [17] |
刘芳, 张引红, 高渊涛, 等. 小鼠多能干细胞对小鼠肝脏电离辐射损伤的作用[J]. 中国生物制品学杂志, 2020, 33(4): 415-419. Liu F, Zhang YH, Gao YT, et al. Effect of mouse pluripotent stem cells on ionizing radiation damage in the mouse liver[J]. Chin J Bio Prod, 2020, 33(4): 415-419. DOI:10.13200/j.cnki.cjb.003034 |
| [18] |
Chen Y, Zhu L, Meng H, et al. Ferulic acid protects human lens epithelial cells against ionizing radiation-induced oxidative damage by activating Nrf2/HO-1 signal pathway[J]. Oxid Med Cell Longev, 2022, 2022: 6932188. DOI:10.1155/2022/6932188 |
| [19] |
Marrocco I, Altieri F, Peluso I. Measurement and clinical significance of biomarkers of oxidative stress in humans[J]. Oxid Med Cell Longev, 2017, 2017: 6501046. DOI:10.1155/2017/6501046 |
| [20] |
张静, 刘丽波. 龙血竭对X射线暴露小鼠肝脏脂质过氧化及抗氧化酶的影响[J]. 卫生研究, 2017, 46(2): 243-245. Zhang J, Liu LB. Effect of dragon blood depletion on hepatic lipid peroxidation and antioxidant enzymes in X-ray exposed mice[J]. Health Res, 2017, 46(2): 243-245. DOI:10.19813/j.cnki.weishengyanjiu.2017.02.013 |
| [21] |
Yi J, Chen C, Liu X, et al. Radioprotection of EGCG based on immunoregulatory effect and antioxidant activity against 60Co γ radiation-induced injury in mice[J]. Food Chem Toxicol, 2020, 135: 111051. DOI:10.1016/j.fct.2019.111051 |
| [22] |
Calabrese EJ, Kozumbo WJ. The hormetic dose-response mechanism: Nrf2 activation[J]. Pharmacol Res, 2021, 167: 105526. DOI:10.1016/j.phrs.2021.105526 |
| [23] |
Morgan MT, Nguyen L, Hancock HL, et al. Glutathione limits aquacopper(Ⅰ) to sub-femtomolar concentrations through cooperative assembly of a tetranuclear cluster[J]. J Biol Chem, 2017, 292(52): 21558-21567. DOI:10.1074/jbc.M117.817452 |
| [24] |
Jalili C, Farzaei MH, Roshankhah S, et al. Resveratrol attenuates malathion-induced liver damage by reducing oxidative stress[J]. J Lab Phy, 2019, 11(3): 212-219. DOI:10.4103/JLP.JLP_43_19 |
| [25] |
Azhar M, Aida A, Abdelbaset M, et al. Biophysical and bio-chemical roles of Moringa oleifera leaves as radioprotector[J]. Prog Biophys Mol Biol, 2018, 140: 142-149. DOI:10.1016/j.pbiomolbio.2018.06.003 |
 2024, Vol. 44
2024, Vol. 44


