2. 四川大学华西第二医院放射医学实验室, 成都 610041;
3. 四川大学华西基础医学与法医学院 放射医学研究室, 成都 610041
2. Laboratory of Radiation Medicine, West China Second University Hospital, Sichuan University, Chengdu 610041, China;
3. Laboratory of Radiation Medicine, West China School of Basic Medical Sciences & Forensic Medicine, Sichuan University, Chengdu 610041, China
放射性食管炎(radiation-induced esophagitis,RIE)是食管癌、肺癌、纵隔恶性肿瘤和淋巴瘤等放疗时常见的剂量限制不良反应,同步化疗时更易发生[1-2]。一项同步放化疗的非小细胞肺癌荟萃分析表明,约95%的患者会出现RIE,其中33%的患者会出现3级以上的食管炎[3]。此外,在所有放射治疗中,包括三维适形放射治疗、调强放射治疗和质子治疗,急性RIE的发生频率都是固定的[4-5]。RIE临床表现为咽下疼痛或胸骨后疼痛,严重者可出现食管溃疡、食管狭窄、硬化和气管食管瘘等症状[2]。主要病理过程是辐射引起上皮细胞DNA损伤,并通过多种信号通路产生应激相关的促炎因子,导致细胞死亡,最终引起食管黏膜上皮的损伤和溃疡。一些药物如表没食子儿茶素没食子酸酯(EGCG)、阿米福斯汀和谷氨酰胺只能部分缓解RIE的严重程度,对预防和治疗RIE的效果非常有限[6]。本研究以不同剂量辐照的大鼠食管组织为研究对象进行蛋白组学测序,筛选差异蛋白进行功能富集分析,旨在寻找影响RIE的关键蛋白和潜在通路,为进一步深入揭示RIE的生物学机制和潜在防治靶点提供理论依据。
材料与方法1. 实验动物与分组:雄性Sprague-Dawley(SD)大鼠24只,6周龄,体质量200~220 g,购于成都达硕实验动物有限公司[生产许可证号:SCXK(川)2020-0030],饲养于成都医学院第二附属医院无特定病原体级动物房屏障环境内,饲养温度18~25℃,相对湿度40%~70%。所有大鼠饲养1周适应环境后,按简单随机化方法分为对照组、25和35 Gy照射组,每组8只。根据之前的研究,单次照射剂量≥25 Gy时,SD大鼠出现体重、食物摄入量、饮水量和食管病理结构的改变[6]。因此,本实验选用25和35 Gy的X射线照射大鼠食管。
2. 仪器与照射条件:大鼠腹腔注射氯胺酮(75 mg/kg)和甲苯噻嗪(10 mg/kg)麻醉,剃去颈胸毛发,用胶布将大鼠固定在塑料板上,其他组织用3 cm厚的铅板屏蔽。使用225 keV X-RAD 225辐照仪(Precision X-ray,North Branford,美国)X射线以400 cGy/min的剂量率对耳朵下缘3 cm × 4 cm的食管区域分别进行单剂量25和35 Gy照射,源皮距为50 cm。对照组小鼠在相同条件下进行0 Gy假照射。
3. 样本收集与蛋白提取:照射后7 d,收集每只大鼠照射野内的食管组织,两只大鼠的组织混合为1个样本,每组获得4个样本,共计12个,将这些样本迅速放入液氮中。随后,将食管组织研磨成粉,加入蛋白裂解液冰上裂解5 min,再加入终浓度为10 mmol/L的二硫苏糖醇(DTT,北京索莱宝公司)超声混匀,13 000 × g,4℃离心20 min后取上清;加入4倍体积的冷丙酮沉降蛋白,并用含DTT的冷丙酮洗涤蛋白沉淀后风干;使用尿素(美国Sigma公司)和四乙基溴化铵(TEAB,pH 8.0,美国Sigma公司)复溶蛋白,并用Bradford法测定蛋白浓度;最后通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对蛋白样品进行质量控制。
4. 酶解和除盐:取100 μg样品用TEAB溶液稀释5倍,按胰酶∶蛋白=1 ∶50的比例加入胰蛋白酶,37℃酶解过夜。酶解后的肽段用C18柱脱盐,真空冷冻干燥脱盐后的肽段。
5. 串联质谱标签(TMT)标记和分组分:先用500 mmol/L TEAB溶液溶解多肽,根据TMT试剂盒(美国Thermo Scientific公司)说明书进行标记。然后,用Ultimate 3000 HPLC(美国Thermo DINOEX公司)分离肽段样品,碱性条件下逐渐升高的乙腈浓度可以实现肽段分离,流速为1 ml/min,每分钟收集一管,共收集42个次级馏分并合并成12个组分,脱盐干燥。
6. LC-MS/MS分析:样品通过纳升流速的液相UltiMate 3000 RSLCnano系统进行分离。样品先用C18捕获柱(3 μm,120 Å,0.1×20 mm)洗脱,接着再用分析柱(2 μm,120 Å,0.75×150 mm)进行分离。利用两个流动相(流动相A:2%乙腈/0.1%甲酸/98%水,流动相B:98%乙腈/0.1%甲酸/2%水)建立分析梯度,液相的流速设置为300 nl/min。肽段经由超高液相系统分离后使用Q Exactive HF液质联用系统(美国Thermo公司)进行分析。
7. 数据库查询与分析:使用Maxquant 1.6.17.0软件对二级质谱数据进行数据库检索分析,数据库为uniprot-Rattus_Rat-10116-v20210123.fasta (共36 187条序列)。表达显著差异的判定标准为:在adj. P≤0.05情况下,丨差异倍数(fold change)丨≥1.5时,认为表达显著变化。
8. 功能富集分析:采用Metascape数据库(https://www.metascape.org)中的Gene Ontology(GO)、Kyoto Encyclopedia of Genes and Genomes(KEGG)和Reactome Gene Sets 3种数据集对上调和下调的蛋白进行功能富集分析。蛋白互作(protein protein interaction,PPI)分析是通过STRING数据库(https://string-db.org)构建差异蛋白互作网络,寻找关键节点蛋白。GO、KEGG和Reactome Gene Sets分析均以adj. P < 0.05为差异有统计学意义,PPI分析以连接度≥10作为阈值。
9. 苏木素-伊红(HE)染色与免疫组织化学染色:收集的食管组织经固定、石蜡包埋、3 μm切片、烘片、脱蜡复水后,HE染色,用中性树脂和盖玻片封片。在光学显微镜下观察食管组织的形态学变化。石蜡切片经脱蜡复水、抗原修复、灭火、封闭后,4℃过夜孵育一抗Hp(英国Abcam公司)和Ndufs4(美国Proteintech公司),然后孵育二抗、洗涤、DAB显色、苏木精复染、脱水封片。在光学显微镜下观察Hp和Ndufs4的信号变化。
10. Western blot:食管样本用含蛋白酶抑制剂混合物(美国MCE公司)的组织裂解缓冲液(武汉塞维尔公司)进行裂解。用二喹啉甲酸(BCA)定量试剂盒(美国Thermo Scientific公司)测定蛋白浓度,将等量的蛋白质加载到SDS-PAGE胶中进行分离、转膜、封闭后,使用上述Hp和Ndufs4抗体孵育过夜,最后孵育二抗、曝光。
11. 统计学处理:采用GraphPad Prism 8.4软件对数据进行分析。两组蛋白相对表达符合正态分布,两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
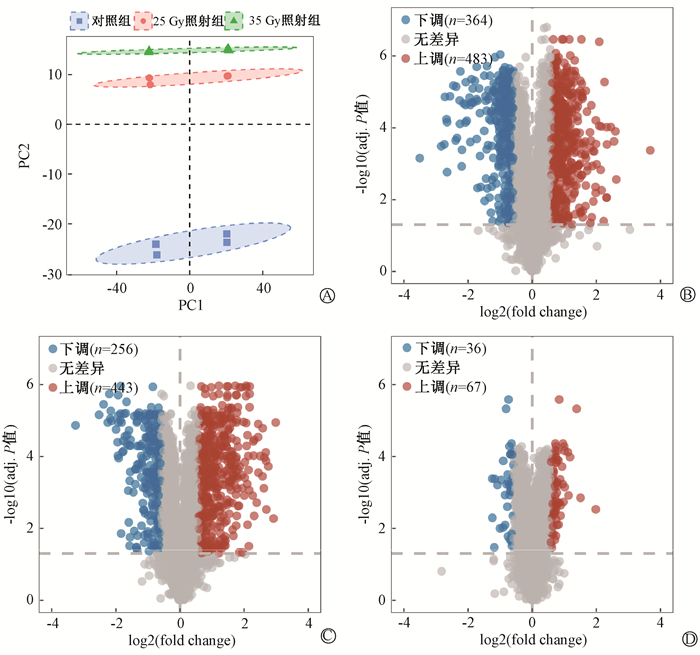
结果1. 电离辐射对大鼠食管组织蛋白表达谱的影响:为了探索电离辐射对食管组织中蛋白水平的影响,采用不同剂量的X射线辐照构建大鼠RIE模型,7 d后收集辐照和未辐照的大鼠食管组织进行TMT蛋白组学测序。主成分分析发现辐照和未辐照大鼠食管样本之间存在明显的分离,表明辐照前后蛋白表达存在明显差异(图 1A)。对25和35 Gy照射组和对照组中的蛋白水平进行两两比较,结果发现,与对照组相比,25 Gy照射组差异蛋白共847个,其中包含上调蛋白483个,下调蛋白364个(图 1B);35 Gy照射组差异蛋白共699个,其中上调蛋白443个,下调蛋白256个(图 1C)。与25 Gy照射组相比,35 Gy照射组差异蛋白共103个,其中上调蛋白67个,下调蛋白36个(图 1D)。以上结果表明照射后大鼠食管组织的蛋白表达谱发生明显改变。
|
图 1 电离辐射对大鼠食管组织蛋白表达谱的影响 Figure 1 Impacts of ionizing radiation on protein expression profiles of the esophageal tissues of rats |
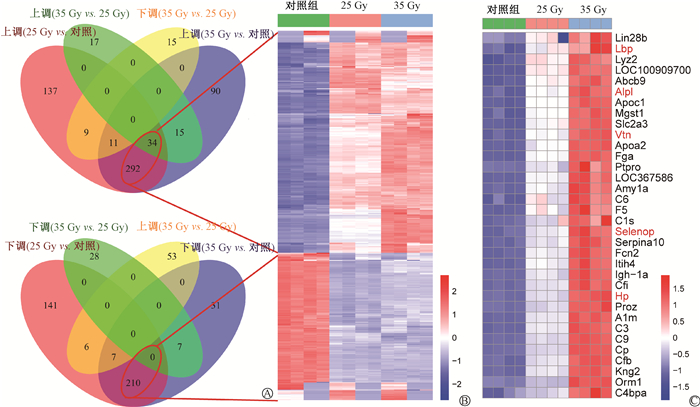
2. 筛选不同剂量照射后共同变化的蛋白:为了筛选不同剂量照射后共同上调或下调的蛋白,根据35 Gy≥25 Gy>对照或35 Gy≤25 Gy<对照的标准进行筛选。结果发现,不同剂量照射后均上调的蛋白有326个,均下调的蛋白有210个(图 2A和2B)。在共同上调蛋白中有34个蛋白呈剂量依赖性变化(35 Gy>25 Gy>对照)(图 2C),其中,脂多糖结合蛋白(lipopolysaccharide-binding protein,Lbp)、碱性磷酸酶(alkaline phosphatase,Alpl)、血浆中玻璃体连接蛋白(vitronectin,Vtn)、硒蛋白P(selenoprotein P,Selenop)、结合珠蛋白(haptoglobin,Hp)5种蛋白已被报道用于辐射损伤的防治或早期标志物[7-11],它们可能在放射性食管炎进展中也具有重要意义。
|
图 2 不同剂量照射后共同上调或下调蛋白的韦恩图(A)、热图(B)以及剂量依赖性上调蛋白的热图(C) Figure 2 Venn diagrams (A) and heatmaps (B) of common proteins up- or down-regulated after irradiation at different doses, and heatmaps (C) of dose-dependent up-regulated proteins |
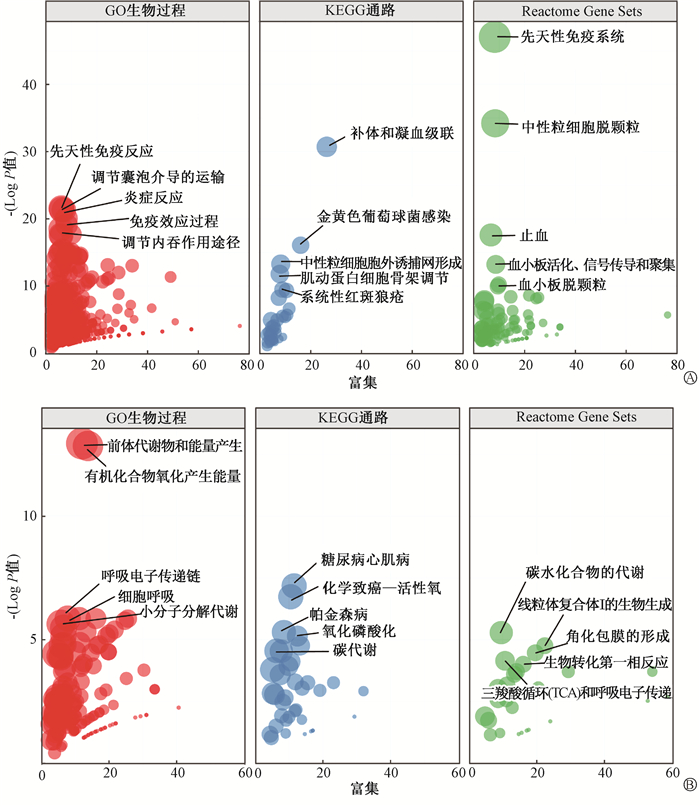
3. 共同变化蛋白涉及的生物过程和信号通路富集分析:选择GO、KEGG和Reactome Gene Sets 3种数据集对上述共同上调或下调蛋白进行功能富集分析。每种富集分析都根据P值进行排序,图中显示最相关的5种关键事件。GO分析表明,共同上调的蛋白主要涉及先天性免疫反应、调节囊泡介导的运输、炎症反应、免疫效应过程以及调节内吞作用途径等生物学过程(图 3A);共同下调的蛋白主要涉及前体代谢物和能量产生、有机化合物氧化产生能量、呼吸电子传递链、细胞呼吸以及小分子分解代谢等生物学过程(图 3B)。KEGG分析表明,共同上调蛋白主要涉及补体和凝血级联、金黄色葡萄球菌感染、中性粒细胞胞外诱捕网形成、肌动蛋白细胞骨架调节以及系统性红斑狼疮等多种通路(图 3A);共同下调蛋白主要涉及糖尿病心肌病、化学致癌-活性氧、帕金森病、氧化磷酸化以及碳代谢等多种通路(图 3B)。Reactome Gene Sets分析表明,共同上调蛋白主要涉及先天性免疫系统、中性粒细胞脱颗粒、止血、血小板活化、信号传导和聚集以及血小板脱颗粒等信号通路(图 3A);共同下调蛋白中主要涉及碳水化合物的代谢、线粒体复合体Ⅰ的生物生成、角化包膜的形成、三羧酸(TCA)循环和呼吸电子传递以及生物转化第一相反应等信号通路(图 3B)。以上研究结果从剂量依赖性蛋白角度富集分析相关的生物学功能,为深入了解RIE进展机制提供理论依据。
|
图 3 不同剂量照射后共同上调的蛋白(A)和下调的蛋白(B)功能富集分析 Figure 3 Functional enrichment analysis of common up-regulated proteins (A) and down-regulated proteins (B) after irradiation at different doses |
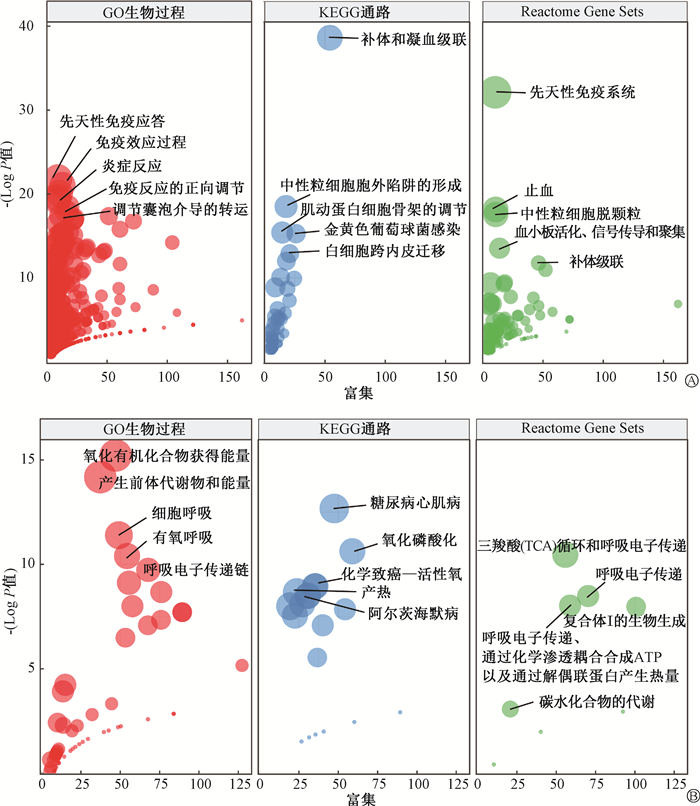
4. 筛选节点蛋白并进行功能分析:为了确定与RIE相关的关键蛋白,利用STRING数据库对上述536个共同上调或下调的蛋白进行了PPI网络构建,以连接度≥10筛选节点蛋白。结果发现,PPI网络复合体中共有155个节点蛋白,其中上调130个,下调25个。随后,对上述节点蛋白再次进行GO生物学过程,KEGG和Reactome Gene Sets信号通路分析,发现先天性免疫应答、补体和凝血级联以及先天性免疫系统涉及的途径最相关;对下调节点蛋白进行功能富集,发现通过氧化有机化合物获得能量、糖尿病心肌病以及TCA和呼吸电子传递涉及的途径最相关(图 4)。
|
图 4 对上调(A)和下调(B)节点蛋白再次进行功能富集分析 Figure 4 Secondary functional enrichment analysis of up-regulated (A) and down-regulated (B) nodes proteins |
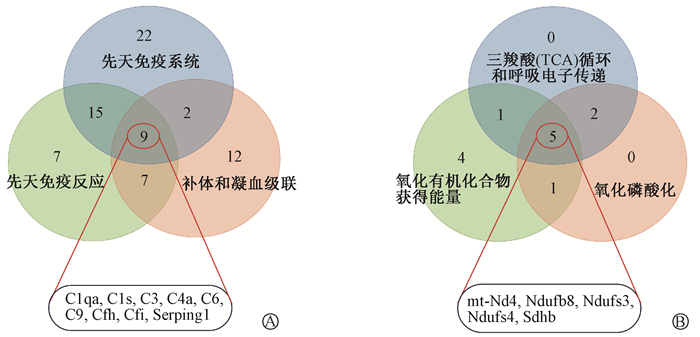
5. 筛选参与RIE的关键蛋白:虽然上述结果显示KEGG通路最相关的是糖尿病心肌病,但排名第二的氧化磷酸化与辐射损伤关系更密切,因此,分别选取了3种富集分析中最明显条目(上调:先天性免疫应答、补体和凝血级联以及先天性免疫系统;下调:氧化有机化合物获得能量、氧化磷酸化以及TCA循环和呼吸电子传递)中的节点蛋白取交集,分别得到9个补体相关的上调蛋白,即C1qa、C1s、C3、C4a、C6、C9、Cfh、Cfi和Serping1;以及5个线粒体相关的下调蛋白,即mt-Nd4、Ndufb8、Ndufs3、Ndufs4、和Sdhb(图 5)。这些蛋白可能是参与RIE进展的关键蛋白。
|
图 5 对节点蛋白功能富集分析中最明显的条目取交集获得关键的上调(A)和下调(B)蛋白 Figure 5 Common key up-regulated (A) and down-regulated (B) proteins present in the respective intersections of the most pronounced entries obtained using the functional enrichment analysis of nodes proteins |
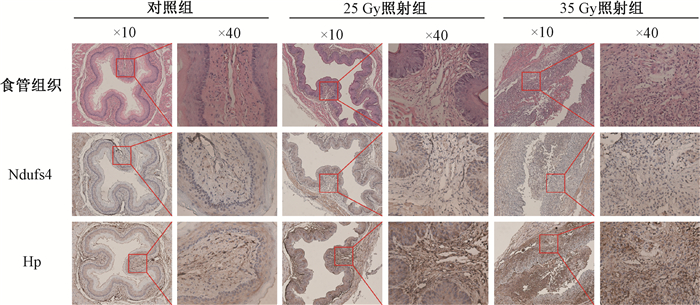
6. 验证照射后食管结构和功能的变化情况:为了探讨不同辐射剂量对食管结构的影响,在辐射后第7天进行HE染色。结果显示,对照组大鼠的食管上皮、固有层、黏膜肌层、黏膜下层、肌层和外膜完整,未观察到炎症细胞浸润;25 Gy照射组出现上皮增厚,35 Gy照射组则出现上皮脱落,且都存在大量炎性细胞浸润(图 6)。随着辐射剂量的增加,食管结构变化更为明显。此外,在第7天大多数受照的大鼠都出现了高音尖叫,这可能是RIE引起的。
|
图 6 观察食管组织辐照后的形态变化(HE染色)和Hp和Ndufs4的蛋白表达(免疫组织化学染色) Figure 6 Morphological changes (HE staining) and expressions of Hp and Ndufs4 proteins (immunohistochemical staining) of irradiated esophageal tissues |
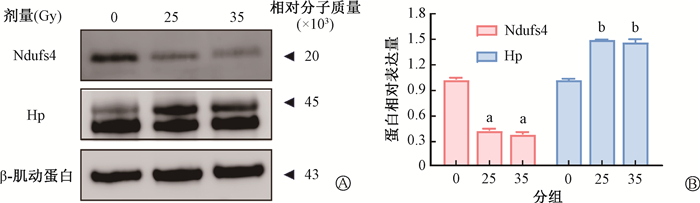
根据差异蛋白表达丰度和差异倍数选择上调蛋白Hp以及下调蛋白线粒体膜呼吸链NADH脱氢酶(Ndufs4)进行免疫组织化学法和Western blot验证。结果发现,Ndufs4蛋白在免疫组织化学染色中变化不明显,在Western blot中显著下调(t = 59.27、54.07,P < 0.001),而Hp蛋白在大鼠食管组织中表达均显著上调(t = 27.94、10.96,P < 0.001),差异具有统计学意义(图 7),这与测序的结果一致。
|
注:a与0 Gy Ndufs4比较,t = 59.27、54.07,P < 0.001;b与0 Gy Hp比较,t = 27.94、10.96,P < 0.001 图 7 Western blot检测辐照后食管组织中Hp和Ndufs4蛋白表达(A)与定量分析(B) Figure 7 Expressions (A) and quantitative analysis (B) of the Hp and Ndufs4 proteins in irradiated esophageal tissues detected using Western blot |
讨论
放射性食管炎(RIE)是食管癌和胸部肿瘤放射治疗过程中的常见并发症,影响治疗效果,同时降低患者的生活质量。当放疗剂量达到30 Gy时,可引起食管神经及肌肉的损伤,导致食管蠕动减弱;随着照射剂量的增大,食管损伤加重。目前食管癌和肺癌的放疗处方剂量多在60~70 Gy,因此,绝大部分患者会发生不同程度的放射性食管炎[12]。早期放射性食管炎(3个月内发生)一般通过积极的预防和治疗,绝大多数患者的组织损伤可以修复;而晚期放射性食管炎(3个月后发生)常因治疗不及时导致难以完全修复而出现组织纤维化,从而影响组织器官的结构或功能[12-13]。因此,了解早期放射性食管炎的分子变化,对治疗和预防该疾病具有重要意义。
本研究利用定量蛋白组学报道了大鼠RIE中蛋白表达谱的变化,不同剂量照射后共同上调的差异蛋白有326个,共同下调的差异蛋白有210个。这些蛋白质在不同辐照剂量照射后变化规律一致,提示它们可能在食管辐射反应过程中至关重要。为了聚焦RIE发生发展中最关键的蛋白,对这些蛋白进行了PPI互作网络分析,发现共有155个节点蛋白。其中,上调节点蛋白有130个,通过生物信息学分析发现这些蛋白富集最显著的生物过程和通路分别为先天性免疫应答、补体和凝血级联以及先天性免疫系统。取交集得到对应的节点蛋白均是补体通路相关蛋白,分别为C1qa、C1s、C3、C4a、C6、C9、Cfh、Cfi和Serping 1。补体系统作为免疫系统的重要组成部分,已有研究表明长新冠肺炎患者出现补体系统的异常激活,进而导致了组织损伤和其他长期症状的出现[14]。另有研究表明,母乳中的补体系统通过塑造后代的肠道微生物群,使其不易受到某些致病菌的影响[15]。此外,补体系统在辐射损伤中也发挥重要作用,有研究报道辐照可以刺激小胶质细胞释放C1q引发补体级联反应,从而介导神经炎症和星形胶质细胞激活、突触丧失和认知能力下降[16];胶质细胞选择性缺失C1q可预防辐射引起的认知缺陷和神经炎症[17]。但其他补体相关蛋白在辐射损伤的研究有待进一步探索。下调节点蛋白有25个,主要富集在氧化有机化合物获得能量、氧化磷酸化以及TCA循环和呼吸电子传递通路,取交集获得5个节点蛋白,分别为mt-Nd4、Ndufb8、Ndufs3、Ndufs4和Sdhb。这些蛋白均是线粒体能量产生过程的蛋白,但它们在辐射损伤中的作用有待进一步研究。
根据蛋白表达丰度和差异倍数选择上调蛋白Hp和下调蛋白Ndufs4进行实验验证,证实了它们的表达情况与测序结果一致。已有研究报道Hp是辐射损伤的潜在标志物,而Ndufs4在辐射损伤中的作用尚不清楚。Ndufs4是线粒体呼吸链复合体Ⅰ(CI)中的一个相对分子质量为18 000的附属亚基,也是最广泛研究的作为线粒体疾病模型的CI亚基,它与多种炎症、神经系统和代谢紊乱疾病相关。Jin等[18]研究发现全身缺失Ndufs4的小鼠会导致全身炎症和骨质疏松症,肝脏缺失Ndufs4会导致脂肪酸氧化代谢转变为糖酵解,从而在循环中积累脂肪酸和乳酸。最新研究也表明,Ndufs4表达降低对促进糖尿病肾病进展的足细胞的生物能量能力、嵴完整性和线粒体形态有显著影响,而Ndufs4基因条件过表达后会显著改善损伤情况[19]。因此,Ndufs4的缺乏可能会对整体或局部损伤组织有重要意义。
综上所述,本研究对大鼠受照后食管组织蛋白表达水平的变化进行了分析,发现电离辐射可以显著改变食管组织的蛋白表达谱,引发食管组织先天免疫系统激活和能量代谢失衡,同时还为RIE提供了生物标志物及防治靶点。
利益冲突 无
作者贡献声明 张月华负责论文撰写及修改;刘杭丰负责实验验证;张舒羽负责写作指导;杜梦洁、蒙晓晨负责图片修改;涂文玲负责实验设计和数据分析
| [1] |
Baker S, Fairchild A. Radiation-induced esophagitis in lung cancer[J]. Lung Cancer (Auckl), 2016, 7: 119-127. DOI:10.2147/LCTT.S96443 |
| [2] |
Murro D, Jakate S. Radiation esophagitis[J]. Arch Pathol Lab Med, 2015, 139(6): 827-830. DOI:10.5858/arpa.2014-0111-RS |
| [3] |
Palma DA, Senan S, Oberije C, et al. Predicting esophagitis after chemoradiation therapy for non-small cell lung cancer: an individual patient data meta-analysis[J]. Int J Radiat Oncol Biol Phys, 2013, 87(4): 690-696. DOI:10.1016/j.ijrobp.2013.07.029 |
| [4] |
Bradley JD, Bae K, Graham MV, et al. Primary analysis of the phase Ⅱ component of a phase Ⅰ/Ⅱ dose intensification study using three-dimensional conformal radiation therapy and concurrent chemotherapy for patients with inoperable non-small-cell lung cancer: RTOG 0117[J]. J Clin Oncol, 2010, 28(14): 2475-2480. DOI:10.1200/JCO.2009.27.1205 |
| [5] |
Gomez DR, Tucker SL, Martel MK, et al. Predictors of high-grade esophagitis after definitive three-dimensional conformal therapy, intensity-modulated radiation therapy, or proton beam therapy for non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 84(4): 1010-1016. DOI:10.1016/j.ijrobp.2012.01.071 |
| [6] |
Tu W, Feng Y, Lai Q, et al. Metabolic profiling implicates a critical role of cyclooxygenase-2-mediated arachidonic acid metabolism in radiation-induced esophageal injury in rats[J]. Radiat Res, 2022, 197(5): 480-490. DOI:10.1667/RADE-20-00240.1 |
| [7] |
Chalubinska-Fendler J, Graczyk L, Piotrowski G, et al. Lipopolysaccharide-binding protein is an early biomarker of cardiac function after radiation therapy for breast cancer[J]. Int J Radiat Oncol Biol Phys, 2019, 104(5): 1074-1083. DOI:10.1016/j.ijrobp.2019.04.002 |
| [8] |
Rentea RM, Lam V, Biesterveld B, et al. Radiation-induced changes in intestinal and tissue-nonspecific alkaline phosphatase: implications for recovery after radiation therapy[J]. Am J Surg, 2016, 212(4): 602-608. DOI:10.1016/j.amjsurg.2016.06.005 |
| [9] |
Yu JH, Zhao QY, Liu Y, et al. The plasma levels and polymorphisms of vitronectin predict radiation pneumonitis in patients with lung cancer receiving thoracic radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2021, 110(3): 757-765. DOI:10.1016/j.ijrobp.2021.01.018 |
| [10] |
Eckers JC, Kalen AL, Xiao W, et al. Selenoprotein P inhibits radiation-induced late reactive oxygen species accumulation and normal cell injury[J]. Int J Radiat Oncol Biol Phys, 2013, 87(3): 619-625. DOI:10.1016/j.ijrobp.2013.06.2063 |
| [11] |
Zhou S, Li Y, He L, et al. Haptoglobin is an early indicator of survival after radiation-induced severe injury and bone marrow transplantation in mice[J]. Stem Cell Res Ther, 2022, 13(1): 461. DOI:10.1186/s13287-022-03162-x |
| [12] |
杨从容,王军,袁双虎. 放射性食管炎的预防与治疗临床实践指南[J]. 中华肿瘤防治杂志, 2023, 30(6): 324-332. DOI: 10.16073/j.cnki.cjcpt.2023.06.02. Yang CR, Wang J, Yuan SH, et al. Clinical practice guidelines for the prevention and treatment of radiation esophagitis[J]. Chin J Cancer Prev Treat, 2023, 30(6): 324-332. DOI: 10.16073/j.cnki.cjcpt.2023.06.02. |
| [13] |
Werner-Wasik M, Yorke E, Deasy J, et al. Radiation dose-volume effects in the esophagus[J]. Int J Radiat Oncol Biol Phys, 2010, 76: S86-93. DOI:10.1016/j.ijrobp.2009.05.070 |
| [14] |
Cervia-Hasler C, Brüningk SC, Hoch T, et al. Persistent complement dysregulation with signs of thromboinflammation in active Long Covid[J]. Science, 2024, 383(6680): eadg7942. DOI:10.1126/science.adg7942 |
| [15] |
Xu D, Zhou S, Liu Y, et al. Complement in breast milk modifies offspring gut microbiota to promote infant health[J]. Cell, 2024, 187(3): 750-763. DOI:10.1016/j.cell.2023.12.019 |
| [16] |
Korimerla N, Wahl DR. A complementary strategy to mitigate radiation-induced cognitive decline[J]. Cancer Res, 2021, 81(7): 1635-1636. DOI:10.1158/0008-5472.CAN-20-4277 |
| [17] |
Markarian M, Krattli RP Jr, Baddour JD, et al. Glia-selective deletion of complement C1q prevents radiation-induced cognitive deficits and neuroinflammation[J]. Cancer Res, 2021, 81(7): 1732-1744. DOI:10.1158/0008-5472.CAN-20-2565 |
| [18] |
Jin Z, Wei W, Yang M, et al. Mitochondrial complex Ⅰ activity suppresses inflammation and enhances bone resorption by shifting macrophage-osteoclast polarization[J]. Cell Metab, 2014, 20(3): 483-498. DOI:10.1016/j.cmet.2014.07.011 |
| [19] |
Mise K, Long J, Galvan DL, et al. NDUFS4 regulates cristae remodeling in diabetic kidney disease[J]. Nat Commun, 2024, 15(1). DOI:10.1038/s41467-024-46366-w |
 2024, Vol. 44
2024, Vol. 44


