氡是一种天然放射性气体,广泛存在于环境之中,由铀系、钍系和锕系三大天然放射系衰变而来[1]。氡及其子体对公众的照射剂量占天然辐射源所产生的总辐射剂量的50%以上[2]。氡是已知的致肺癌因子,其危险程度仅次于吸烟[3]。国际癌症研究机构(IARC)将氡及其子体划入Ⅰ类致癌因子。世界卫生组织(WHO)也将氡列为19种已知的人类重要致癌因子之一[4]。相关流行病学调查结果显示,在氡浓度100 Bq/m3环境中长期暴露可导致发生肺癌的风险提高14%[5-6]。
已有不少研究证实,在长期暴露于(5 ~ 10)×104 Bq/m3氡及其子体的条件下,氡可通过DNA双链断裂、线粒体损伤、能量代谢异常、支气管上皮间充质转化等多种途径造成小鼠肺组织损伤,进而导致肺癌的发生[7-9]。一些放射性工作人员可能暴露在更高的氡浓度中,如匈牙利某村下方的铀矿隧道因废弃未再进行通风后可以测量到平均410 (21.3 ~ 1 936)kBq/m3的氡浓度[10],这意味着铀矿等含氡的放射性工作场所在出现设备故障或矿道坍塌等特殊情况下可能导致放射性工作人员处于急性高氡暴露环境。国际放射防护委员会(ICRP)126号报告[11]指出氡不可能导致应急照射情况,但对此并未有明确说明。高浓度氡急性暴露对肺组织和机体的影响如何鲜有报道。因此,本研究通过使用HD-3型生态氡室构建急性高氡暴露小鼠模型,初步探讨其对机体的健康影响。
材料与方法1. 主要试剂与仪器:超氧化物歧化酶(SOD)测定试剂盒、丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所;4%多聚甲醛购自武汉赛维尔生物科技有限公司;0.5 ml EDTA-K2抗凝离心管购自苏州科同生物医药科技有限公司;MoticSMZ-168体式显微镜购自厦门麦克奥迪实业集团有限公司;测氡仪购自苏州速核仪器有限公司;HD-3型多功能生态氡室由省部共建放射医学与辐射防护国家重点实验室提供;电子分析天平购自瑞士Precisa公司;纯水仪购自美国Millipore公司;全自动动物血液体液分析仪购自希森美康医用电子(上海)有限公司;辐照饲料、玉米芯垫料购自苏州大学实验动物中心。
2. 急性高氡暴露小鼠模型构建:雄性BALB/c小鼠,6 ~ 8周龄,共24只,购自维通利华实验动物技术有限公司[许可证号:SCXK(浙)2024-0001]。用随机数表法将小鼠分成3个实验组与3个对照组,每组各4只。在小鼠适应性饲养1周后,利用HD-3型生态氡室将实验组小鼠一次性暴露于平均氡浓度7 × 105 Bq/m3的环境中10 h,随后将其置于本底辐射水平环境中与对照组小鼠一起饲养。在小鼠氡暴露后1、2、3个月时使用电子天平称量各组小鼠体重,称量前需将小鼠禁食12 h以上,随后获取小鼠血液与肺组织样本进行后续实验。每个时间点对应的对照组小鼠一同收样。
3. 小鼠肺组织病理学观察:将一部分肺组织样本用4%多聚甲醛固定,随后将肺组织样品送武汉赛维尔生物科技有限公司进行包埋、石蜡切片制作及苏木精-伊红(HE)染色。将制作好的HE染色病理切片置于体式显微镜下进行组织病理学观察。
4. 小鼠血常规检测:将一部分血液样本保留全血于抗凝管中,随后取小鼠全血25 μl与稀释液175 μl于EP管中混合均匀并放入全自动动物血液体液分析仪中,利用其配套软件XN进行血常规检测。
5. SOD含量检测:将提取好的血清用生理盐水稀释5倍;肺组织按照组织重量∶生理盐水体积=1∶9的比例制成10%组织匀浆并用生理盐水再稀释成2%的组织匀浆。后续实验步骤按照SOD测定试剂盒操作说明进行。
6. MDA含量检测:小鼠血清不稀释;将一部分上述肺组织10%组织匀浆用生理盐水稀释成5%的组织匀浆。后续实验步骤按照MDA检测试剂盒操作说明进行。
7. 统计学处理:采用Graphpad Prism 9软件进行统计学分析。符合正态分布的计量资料以x±s表示,两组数值变量资料均数的比较采用t检验,P < 0.05为差异有统计学意义。
结果1. 急性高氡暴露对小鼠体重的影响:如表 1,除在氡暴露后3个月时实验组的小鼠体重有所增加(t = 2.84,P < 0.05)外,其他时间点的体重并无显著变化(P > 0.05)。
|
|
表 1 不同组小鼠受照后不同时间体重变化(g,x±s) Table 1 Body weights of mice for different groups at different time after exposure(g, x±s) |
2. 急性高氡暴露对小鼠肺组织病理学的影响:如图 1,各时间点小鼠肺组织的被膜结构清晰、实质为支气管各级分支及其终末的大量肺泡,各级支气管结构无明显异常。对照组小鼠随时间延长出现轻微的肺泡壁增厚;氡暴露后1、2个月实验组较各自对照组出现肺泡壁增厚且可见少量粒细胞浸润;氡暴露后3个月实验组与对照组病理观察差异较前两组减小。
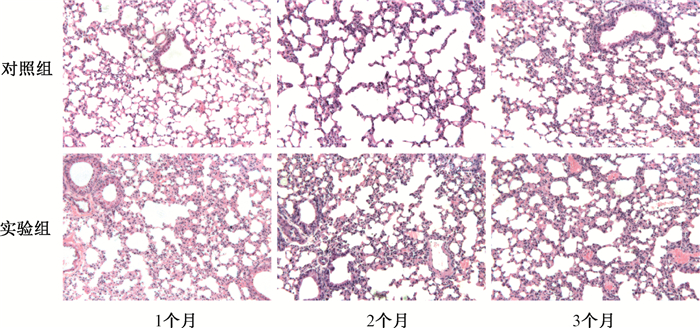
|
图 1 各组小鼠受照后不同时间肺组织病理形态HE染色×200 Figure 1 Pathological morphologies of lung tissues of various groups of mice at different time after exposure HE staining ×200 |
3. 急性高氡暴露对小鼠血常规的影响:如表 2所示,白细胞与红细胞计数未见明显变化(P > 0.05);血红蛋白含量与淋巴细胞计数在氡暴露后2个月时有所升高(t = 2.85、2.59,P < 0.05);血小板计数在氡暴露后3个月时明显下降(t = 2.68,P < 0.05)。
|
|
表 2 小鼠受照后不同时间血常规检测(x±s) Table 2 Routine blood results of mice at different time after exposure(x±s) |
4.急性高氡暴露对小鼠血清与肺组织SOD与MDA含量的影响:如表 3所示,在小鼠血清样本中,与相应的对照组相比,实验组SOD与MDA含量并无显著变化(P > 0.05)。而在肺组织样本中,高氡暴露后2个月时,实验组SOD含量下降(t = 2.54,P < 0.05);MDA含量在高氡暴露后1个月时出现上升(t = 2.49,P < 0.05),随后恢复到基线。在氡暴露后3个月时,SOD与MDA指标无明显差异(P > 0.05)。
|
|
表 3 小鼠血清及肺组织SOD与MDA含量(x±s) Table 3 SOD and MDA levels in the serum and lung tissues of mice(x±s) |
讨论
氡在不同环境中浓度各异[11],并且其浓度受基岩的岩石矿物成分、土壤渗透性和孔隙度、土壤湿度、大气条件(温度、大气压力和风)等因素影响[12-13]。这些因素的相互作用使得氡浓度波动很大,特殊情况下可以出现氡浓度的极高积累,如Somlai等[10]在位于Kvágószls村下方15 ~ 55 m处的废弃不通风的铀矿隧道测量到平均410 (21.3 ~ 1 936) kBq/m3的高氡浓度。据此,本研究使用7 × 105 Bq/m3氡浓度进行急性氡暴露实验并且在此浓度下暴露10 h的累积剂量约为11个工作水平月(WLM)[14]。根据ICRP提供的危险系数的剂量转换约定[11],本研究对应氡剂量已超过放射性工作人员的年剂量限值20 mSv。以此模拟氡急性暴露情况时如果损伤机体可修复,可以说明大多数氡急性暴露情况所致损伤无需过多医疗救治。
在本研究中,小鼠体重在3个月以前未出现明显变化,在3个月时体重增加可能是个体差异、饮食习惯等原因所致。在以往的氡致小鼠肺损伤研究中,氡暴露累积剂量达60 WLM可以引起小鼠肺组织明显的病理改变,如肺泡壁增厚、肺泡断裂、粒细胞浸润等[7, 9]。本研究中,急性高氡暴露后可以观察到小鼠肺组织的损伤改变,但随时间延长,实验组与对照组之间的改变程度逐渐减小且在3个月时未观察到明显差异。这说明在此浓度下的急性暴露可能导致早期出现肺组织损伤,但是由于暴露时间短或累积暴露剂量低,机体可以自我修复。在血常规检测中,虽然各项指标的改变大多差异无统计学意义,但其中血小板在3个月时仍下降,这可能是由于血小板对氡暴露反应敏感、时间长、修复慢[15]。淋巴细胞计数出现一过性升高,提示有轻微炎症的发生,这与肺组织中粒细胞浸润增多的现象相符。氧化应激损伤指标是机体对外界影响因素比较敏感的指标之一 [16],当机体出现氧化应激损伤时通常会出现SOD含量的降低与MDA含量的升高[17]。本研究中,SOD与MDA在血清中的检测无明显对应关系,且无明显变化,提示氡暴露并未引起血液系统中的氧化应激损伤。在肺组织中两项指标有较好的对应关系,且肺组织出现一定程度的损伤改变。这可能是由于氡暴露方式导致肺组织最先接受暴露,且氡的子体也大部分滞留于肺中所致。在氡暴露后3个月时,实验组与对照组SOD与MDA指标无明显差异,说明机体对此剂量下的氧化应激损伤具有自我修复能力。同时,在氡的相关研究中,氡既可以通过氧化应激途径造成小鼠肺组织的损伤[9],同时也可以激活抗氧化途径来减轻氧化应激损伤[18-19],这取决于小鼠所接受的氡暴露的浓度、时间及累积剂量等。本研究中所使用的氡暴露浓度与时间所致的氡累积剂量介于用氡治疗炎症和氡致明显辐射损伤的累积剂量之间[20-21]。后续可就相关实验做进一步优化,以全面探讨急性高氡暴露的生物作用。
综上所述,本研究初步探讨了急性高氡暴露对小鼠的生物学效应,发现小鼠急性高氡暴露后,肺组织出现一定程度的损伤,并且可以检测到氧化应激指标的变化。但在暴露后3个月内,损伤逐渐被修复,氧化应激指标也恢复正常。此外,急性高氡暴露未引起小鼠体重和血常规的明显改变。这说明急性高氡暴露可引起肺组织出现一定的损伤,但机体可以对此进行自我修复。因此在面对特殊情况下的急性高氡暴露,无需做过多医疗救治。当然,在实际情况中,高氡暴露场所往往还伴随粉尘、其他有害气体等复杂暴露情况,具体生物学效应和防护措施需要进一步研究。
利益冲突 无
作者贡献声明 顾鹏诚负责实验和论文撰写;史更生、韩健芳、杨继良、任像鲲参与实验操作与数据分析;陈娜、万骏、孙亮参与实验方案设计和文章审校;崔凤梅、涂彧指导论文修改
| [1] |
Miró C, Andrade E, Reis M, et al. Development of a couple of methods for measuring radon exhalation from building materials commonly used in the Iberian Peninsula[J]. Radiat Prot Dosim, 2014, 160(1-3): 177-180. DOI:10.1093/rpd/ncu063 |
| [2] |
Sahu P, Panigrahi DC, Mishra DP. A comprehensive review on sources of radon and factors affecting radon concentration in underground uranium mines[J]. Environ Earth Sci, 2016, 75(7): 617. DOI:10.1007/s12665-016-5433-8 |
| [3] |
International Commission on Radiological Protection. ICRP Publication 120. Radiological protection in cardiology[R]. Stockholm: ICRP, 2013.
|
| [4] |
杜钟庆. 氡的损伤效应研究进展[J]. 职业与健康, 2017, 33(8): 1141-1145. Du ZQ. Research progress on the damage effect of radon[J]. Occup Health, 2017, 33(8): 1141-1145. DOI:10.13329/j.cnki.zyyjk.2017.0349 |
| [5] |
Malinovsky G, Yarmoshenko I, Zhukovsky M. Radon, smoking and HPV as lung cancer risk factors in ecological studies[J]. Int J Radiat Biol, 2017, 94(1): 62-69. DOI:10.1080/09553002.2018.1399225 |
| [6] |
Malinovsky G, Yarmoshenko I, Vasilyev A. Meta-analysis of case-control studies on the relationship between lung cancer and indoor radon exposure[J]. Radiat Environ Biophys, 2019, 58: 39-47. DOI:10.1007/s00411-018-0770-5 |
| [7] |
Chen HQ, Chen N, Li FS, et al. Repeated radon exposure induced lung injury and epithelial-mesenchymal transition through the PI3K/AKT/mTOR pathway in human bronchial epithelial cells and mice[J]. Toxicol Lett, 2020, 334: 4-13. DOI:10.1016/j.toxlet.2020.09.008 |
| [8] |
陈晓玉. 氡诱导的DNA损伤应答反应及ATM调控作用研究[D]. 苏州: 苏州大学, 2022. DOI: 10.27351/d.cnki.gszhu.2022.000321. Chen XY. Radon-induced DNA damage response and the regulatory effect of ATM on it[D]. Suzhou: Soochow University, 2022. DOI: 10.27351/d.cnki.gszhu.2022.000321. |
| [9] |
方丽君. 氧化应激在氡及其子体致BALB/c小鼠肺组织线粒体损伤中的作用[D]. 苏州: 苏州大学, 2019. DOI: 10.27351/d.cnki.gszhu.2019.003359. Fang LJ. The role of oxidative stress in the mitochondrial damage of the lung tissue of BALB/c mice induced by radon and its progeny[D]. Suzhou: Soochow University, 2019. DOI: 10.27351/d.cnki.gszhu.2019.003359. |
| [10] |
Somlai J, Gorjánácz Z, Várhegyi A, et al. Radon concentration in houses over a closed Hungarian uranium mine[J]. Sci Total Environ, 2006, 367(2-3): 653-665. DOI:10.1016/j.scitotenv.2006.02.043 |
| [11] |
International Commission on Radiological Protection. ICRP Publication 126. Radiological protection against radon exposure[R]. Stockholm: ICRP, 2014.
|
| [12] |
Ćujić M, Janković ML, Petrović J, et al. Radon-222:environmental behavior and impact to (human and non-human)biota[J]. Int J Biometeorol, 2021, 65: 69-83. DOI:10.1007/s00484-020-01860-w |
| [13] |
Kropat G, Bochud F, Jaboyedoff M, et al. Major influencing factors of indoor radon concentrations in Switzerland[J]. J Environ Radioactiv, 2014, 129: 7-22. DOI:10.1016/j.jenvrad.2013.11.010 |
| [14] |
Chen J. A Review of radon exposure in non-uranium mines-estimation of potential radon exposure in Canadian mines[J]. Health Phys, 2023, 124(4): 244-256. DOI:10.1097/HP.0000000000001661 |
| [15] |
Xu Y, Hu M, Chen S, et al. Tannic acid attenuated irradiation-induced apoptosis in megakaryocytes[J]. Exp Cell Res, 2018, 370(2): 409-416. DOI:10.1016/j.yexcr.2018.07.003 |
| [16] |
姜自启, 刘星, 裴炜炜, 等. 氡吸入致小鼠肺组织和外周血的氧化损伤[J]. 江苏预防医学, 2016, 27(2): 133-135. Jiang ZQ, Liu X, Pei WW, et al. The redox damage of lung tissue and peripheral blood in mice upon radon inhalation[J]. Jiangsu J Prev Med, 2016, 27(2): 133-135. DOI:10.13668/j.issn.1006-9070.2016.02.002 |
| [17] |
孙娇娇. 氡染毒致小鼠肺组织和人支气管上皮细胞线粒体损伤及其机制研究[D]. 苏州: 苏州大学, 2021. DOI: 10.27351/d.cnki.gszhu.2021.000257. Sun JJ. Alteration in Mitochondria of the lung tissue of BALB/c mice and BEAS-2B and its mechanism upon exposure to radon[D]. Suzhou: Soochow University, 2021. DOI: 10.27351/d.cnki.gszhu.2021.000257. |
| [18] |
Takahiro K, Hina S, Shota N, et al. Radon inhalation decreases DNA damage induced by oxidative stress in mouse organs via the activation of antioxidative functions[J]. J Radiat Res, 2021, 62(5): 861-867. DOI:10.1093/jrr/rrab069 |
| [19] |
Takahiro K, Norie K, Akihiro S, et al. Evaluation of the redox state in mouse organs following radon inhalation[J]. J Radiat Res, 2021, 62(2): 206-216. DOI:10.1093/jrr/rraa129 |
| [20] |
Reo E, Takahiro K, Norie K, et al. Difference in the action mechanism of radon inhalation and radon hot spring water drinking in suppression of hyperuricemia in mice[J]. J Radiat Res, 2016, 57(3): 250-257. DOI:10.1093/jrr/rrw014 |
| [21] |
Takahiro K, Yuichi N, Teruaki T, et al. Radon inhalation protects mice from carbon-tetrachloride-induced hepatic and renal damage[J]. Inflammation, 2010, 34(6): 559-567. DOI:10.1007/s10753-010-9263-7 |
 2024, Vol. 44
2024, Vol. 44


