2. 郑州大学第一附属医院神经内科, 郑州 450052
2. Internal Medicine-Neurology of Radiology, First Affiliated Hospital of Zhengzhou University, Zhenzhou 450052, China
在脑血管疾病的诊治及评估过程中,神经影像学检查具有重要的指导意义,头颅CT平扫、CT血管成像(CT angiography, CTA)及CT灌注成像(CT perfusion, CTP)的联合扫描已广泛应用于急性缺血性脑卒中(acute ischemic stroke, AIS)患者的临床评估中,尤其是治疗时间窗延长的患者[1-4]。其中,CTP检查不仅可以准确评估脑组织血流灌注情况,识别缺血和梗死的严重程度,也可以有效评估颅内血管情况,如侧支循环的评估[5]以及血管痉挛的检测[6]等。
CTP检查作为一种连续、多次、动态的扫描技术,广泛应用于缺血性脑卒中患者的动态评估,但是其辐射剂量一般较高[7-8]。因此,能否在不损害图像质量与灌注参数准确性的同时,有效降低CTP检查时患者所受辐射剂量,是CTP检查需要注意的问题。既往研究中,通常通过降低管电压、管电流或增加采样时间间隔的方式来降低辐射剂量[9-11]。随着计算机图像重建技术的进展,重建算法的改进亦可进一步改善图像质量并降低扫描辐射剂量。深度学习图像重建算法(deep learning image reconstruction, DLIR)以深度神经网络(deep neural network, DNN)为基础,以高剂量滤波反投影(filtered back projection, FBP)图像为标准来训练数据,通过大量复杂的训练、验证及测试,输出图像不仅成功消除噪声,还可充分保留噪声纹理、解剖和病理细节[12]。目前多项体模及临床研究均已表明,DLIR算法在各部位扫描中具有图像质量改善及辐射剂量降低的价值[13-15],然而目前DLIR在CTP检查的临床用研究较少。因此,本研究旨在探讨DLIR算法结合低管电流扫描在脑CTP检查中图像质量及诊断参数中的应用价值。
资料与方法1.病例资料:本研究前瞻性收集2022年3月至2023年3月于郑州大学第一附属医院急诊绿色通道收治的可疑AIS发作的患者,具体选择流程见图 1,记录患者的基本临床资料。纳入标准:临床可疑急性期脑梗死发作,且在发病24 h内完成头颅CT平扫及CTP检查;既往无大面积缺血性脑卒中病史;无严重的重要脏器病变,如心、肾功能不全等。排除标准:头部外伤、肿瘤性、出血性疾病患者;因患者躁动或造影剂注射失败导致图像质量差、不能满足诊断需求者;碘对比剂过敏者;行CT检查前已接受治疗的患者。本研究已通过本院伦理审查委员会批准(2022-KY-0929-002)。所有患者检查前均已签署知情同意书。
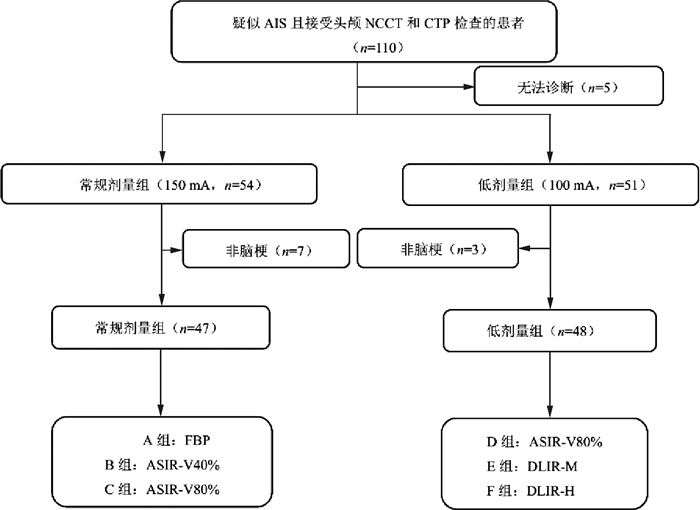
|
注:AIS.急性缺血性脑卒中;NCCT.CT平扫;CTP.CT灌注成像;FBP.滤波反投影算法;ASIR-V.自适应迭代重建算法;DLIR.深度学习重建算法 图 1 患者选择流程图 Figure 1 Flow chart of patient selection |
2.检查扫描方案:所有CT检查均在256排宽体探测器CT(APEX CT,美国通用医疗)上进行,探测器宽度160 mm。头颅CT平扫:轴位扫描,扫描范围为颅底至颅顶,管电压120 kV,自动控制管电流(100~500 mAs),噪声指数2.5 HU,矩阵512×512,扫描层厚5 mm,层间距5 mm。CTP检查:轴位扫描,扫描范围同头颅平扫,管电压80 kV,管电流分别为150 mA(常规剂量组)和100 mA(低剂量组),扫描层厚为5 mm,旋转时间为1.0 s。经右侧肘前静脉使用双筒高压注射器注入碘海醇(350 mg I/ml)50 ml,注射流率5 ml/s,并跟注50 ml生理盐水,注射速率同对比剂,对比剂注射5 s后开始扫描,采集频次为20次,具体为12次×2.0 s+8次×3.0 s,总扫描时间48 s。
3.深度学习图像重建算法:本研究使用的DLIR算法(TrueFidelity,美国通用医疗)使用搭配了百万网络参数的DNN,学习目标数据为高辐射剂量下FBP算法生成投影空间的原始正弦图序列,使得可以提升低辐射剂量下CT图像的图像质量。具体来说,在网络训练的过程中,百万级的网络架构参数使网络模型能够部分恢复由于辐射剂量不足带来所投影空间正弦图序列的数据缺陷问题。DLIR算法的低、中、高3个等级代表着弥补上述缺陷问题的范围程度,低等级DLIR算法对低辐射剂量投影空间正弦图序列的数据缺陷弥补有限,而高等级DLIR算法能够最大范围地对低辐射剂量投影空间正弦图序列的数据缺陷进行弥补。因此,由于学习的目标为高辐射剂量的FBP图像,基于DLIR重建的低剂量CT图像,即使使用较高的校正算法等级,也能够尽可能地保持图像纹理,不会引起迭代算法造成的损失图像纹理的问题[12]。
4.图像后处理与分析:常规剂量组所获取的CTP图像应用FBP算法及自适应迭代重建算法(adaptive statistic alternative reconstruction-Veo, ASIR-V)40%、ASIR-V80%进行重建并依次命名为A~C组[14, 16];低剂量组所获取的CTP图像分别应用ASIR-V80%、DLIR-M和DLIR-H进行重建,分别命名为D、E、F组,所有图像重建层厚和重建层间距均为5 mm,共获得6组CTP图像。所有图像均上传至GE AW 4.7工作站进行后处理分析。
5.图像评估
(1) CTP客观图像质量评估:采用基于去卷积算法的CT Perfusion 4 D软件包(美国通用医疗)进行图像后处理,自动生成相应的脑血容量(cerebral blood volume, CBV)、脑血流量(cerebral blood flow, CBF)、残余组织达峰时间(time to maximum of the tissue residue function, Tmax)、平均通过时间(mean transit time, MTT)及达峰时间(time to peak, TTP)等灌注参数图。在Average图上分别于健侧额叶、颞叶、顶叶的灰质及白质区域各手动勾画直径约为10 mm左右的感兴趣区(region of interest, ROI),勾画时尽可能避开脑裂、脑沟、血管等部位,得到对应原始图像动脉峰值期的平均CT值、噪声值,即标准差(standard deviation,SD),以及伪彩图上对应部位的CBV、CBF、Tmax、MTT、TTP等灌注参数。以上所有数值均在同一层面连续勾画3次,并测量记录平均值,并确保同一患者各组图像的ROI均放置于同一位置。此外,计算并比较不同重建算法所得CTP图像的信号噪声比(signal-noise ratio, SNR)、对比噪声比(contrast-to-noise ratio, CNR),计算公式具体如下:
| $S N R=\frac{\sum\left(C T \text {值}_{\text {额叶}}+C T \text {值}_{\text {颞叶}}+C T \text {值}_{\text {顶叶}}\right)}{\sum\left(S D \text {值}_{\text {额叶}}+S D \text {值}_{\text {颞叶}}+S D \text {值}_{\text {顶叶}}\right)}$ | (1) |
| $C N R=\frac{C T值_ \text {灰质}-C T值_ \text {白质}}{\sqrt{S D值_\text {灰质}^2+S D 值_ \text {白质}}}$ | (2) |
(2) CTP主观图像质量评估:6组CTP图像的主观评分由2位有10年以上诊断经验的放射科医师采用双盲法分别进行评估,具体参考Abels等[17]的3分评分法(2分为图像质量好、1分为图像质量中等、0分为图像差),评估内容在灌注伪彩图中进行,包括以下4个方面:脑灰质区域与白质区域的区分;缺血脑组织区域与正常脑组织的区分;图像均质性(缺血脑组织区域的对比度、边界及一致性);伪影的补偿。4项分值相加共8分。总分≤3分表示图像质量差,无法诊断,总分>3分且≤6分表示图像质量中等但仍可满足诊断要求,总分>6分即图像质量高且诊断价值较高。
(3) CTP灌注参数评估:参考陈鹏军等[18]的研究,分别以发病后1周内复查的头颅MRI或CT平扫图像为标准,评估基于不同重建算法的各组CTP图像对急性缺血性脑卒中患者梗死病灶的检出率。所有图像均已匿名处理并打乱顺序,图像评估在评估者不知晓重建算法及患者信息的前提下进行。此外,将所有AIS患者的头颅CT平扫及6组CTP图像导入RAPID软件中,分别用于Alberta卒中项目早期CT评分(Alberta stroke program early CT score, ASPECTS)、梗死核心和缺血半暗带体积的自动计算。
6.扫描辐射剂量计算:记录扫描图像时的CT容积剂量指数(CT dose index volume, CTDIvol)和剂量长度乘积(dose length product, DLP),并计算有效剂量(effective radiation dose, E), E(mSv)= DLP(mGy·cm)×k,其中k值为组织权重因子,颅脑扫描时取0.002 3 mSv · mGy-1· cm-1。
7.统计学处理:采用SPSS 25.0软件进行统计学分析。采用Kolmogorov-Smirnov检验对计量资料进行正态性检验;符合正态分布的资料采用x±s表示,不符合正态分布则采用中位数和四分位数[M(Q1,Q3)]表示,两组资料的组间比较采用独立样本t检验或Mann-Whitney U检验。计数资料采用例数和百分比表示,组间比较采用卡方检验。符合正态分布和方差齐性的多组重建算法图像间的比较采用单因素方差分析(One-way ANOVA),校正调整后的成对比较采用Bonferroni法(方差齐时)或Tamhane′s T2法(方差不齐时)进行;不符合正态分布资料的多组比较采用Kruskal-Wallis检验。两位诊断医师主观评分的一致性评估采用Kappa检验,Kappa值<0.2,一致性极低;0.2≤Kappa值<0.4,一致性一般;0.4≤Kappa值<0.6,一致性中等;0.6≤Kappa值<0.8,一致性较高;Kappa值≥0.8,几乎完全一致。P<0.05为差异有统计学意义。
结果1.患者基本资料:本研究共113例疑似AIS患者,其中常规剂量组58例,低剂量组55例,共排除6例因躁动无法完成检查或心功能差导致图像无法满足诊断要求者、2例脑出血患者,最终常规剂量组纳入54例患者,经复查确诊脑梗死47例,其余7例患者中4例诊断为短暂性脑缺血发作,2例为急性前庭功能疾患,1例为突发低血压休克;低剂量组纳入51例,经复查确诊脑梗死48例,其他3例患者中2例为短暂性脑缺血发作,1例为烟雾病突发偏侧肢体无力。
两组扫描患者在年龄、性别、体质量指数(BMI)、临床危险因素、血管闭塞部位以及入院时美国国立卫生研究院卒中量表(NIHSS)评分、病后改良Rankin量表(mRS)评分、发病至行CT检查的时间以及CT平扫的ASPECTS评分等方面差异均无统计学意义(P>0.05,表 1)。
|
|
表 1 不同条件下扫描的急性缺血性脑卒中患者基本资料的比较 Table 1 Comparison of basic data of patients with acute ischemic stroke scanned under different conditions |
2.CTP客观图像质量评估:比较6组重建图像中额叶、颞叶及顶叶的灰质与白质区域的SD值、SNR及CNR,差异均有统计学意义(F=40.58~212.13,P<0.001)。在脑灰质区域中,C、D和F组的SD值均低于其他各组,差异有统计学意义(P<0.05);C组和F组的SNR值差异亦无统计学意义(P>0.05)。在脑白质区域中,C组和F组的SD值、SNR值与其他各组相比差异均有统计学意义(P<0.05)。C组和F组的CNR值也高于其他各组,差异有统计学意义(P<0.05)。在灰质和白质区域,A组的SD值均最高,SNR和CNR值均最低(表 2)。
|
|
表 2 6组不同算法重建CT灌注成像图像客观质量之间的比较(x±s) Table 2 Comparison of objective quality of CT perfusion images reconstructed using six algorithms(x±s) |
3.CTP主观图像质量评估:两位医师对6组重建CTP伪彩图(包括CBF、CBV、Tmax、MTT及TTP)图像质量的主观评分均>6分,可满足诊断要求,但各灌注参数的总体评分差异均有统计学意义(F=5.06~11.25,P<0.05)。两位诊断医师均认为,B组、C组和F组5个灌注参数的主观评分差异无统计学意义(P>0.05);A组和D组的主观评分差异均无统计学意义(P>0.05)。其中1位诊断医师认为,E组Tmax参数的主观评分高于D组(P<0.05),余两组间各参数之间均无明显差异(P>0.05)。6组图像整体的主观评分从高到低依次为:C组≈F组≈B组>E组>D组≈A组。
两位医师对CBF、Tmax、MTT及TTP 4组伪彩图的诊断一致性较高(κ=0.638、0.692、0.695、0.657),对CBV图像的诊断一致性中等(κ=0.548)。
4.灌注参数评估:6组CTP灌注参数比较发现,脑灰质区域参数CBF、CBV和脑白质区域CBF、MTT的6组差异有统计学意义(F=2.45~4.92,P<0.05),其余各参数值在6组间的差异均无统计学意义(P>0.05)。脑灰质区域中,D~F组的CBF值虽稍减小,但6组两两比较差异均无统计学意义(P>0.05);但D组和E组的CBV值均低于A~C组(P<0.05),F组的CBV值仅与B组之间差异有统计学意义(P<0.05)。脑白质区域中,6组的CBF值两两比较差异均无统计学意义(P>0.05);D组的MTT值均低于其他各组(P<0.05,表 3)。
|
|
表 3 6组不同算法重建CT灌注成像常用灌注参数之间的比较(x±s) Table 3 Comparison of common perfusion parameters of CT perfusion images reconstructed using six algorithms(x±s) |
常规剂量组经MRI或CT平扫复查确诊的47例脑梗死患者中,A~C组CTP图像对急性脑梗死的检出率均为83.0%(39/47)。低剂量组确诊的48例脑梗死患者中,D~F组CTP图像对急性脑梗死的检出率均为79.2%(38/48)。6组图像在病灶检出率方面的差异无统计学意义(P=0.946),即不同扫描条件下不同算法重建的图像对脑梗死的测量准确度相当。
此外,比较6组重建图像经RAPID软件自动计算的梗死核心、低灌注体积及缺血半暗带等参数发现,各组图像之间的差异均无统计学意义(P>0.05,图 2)。
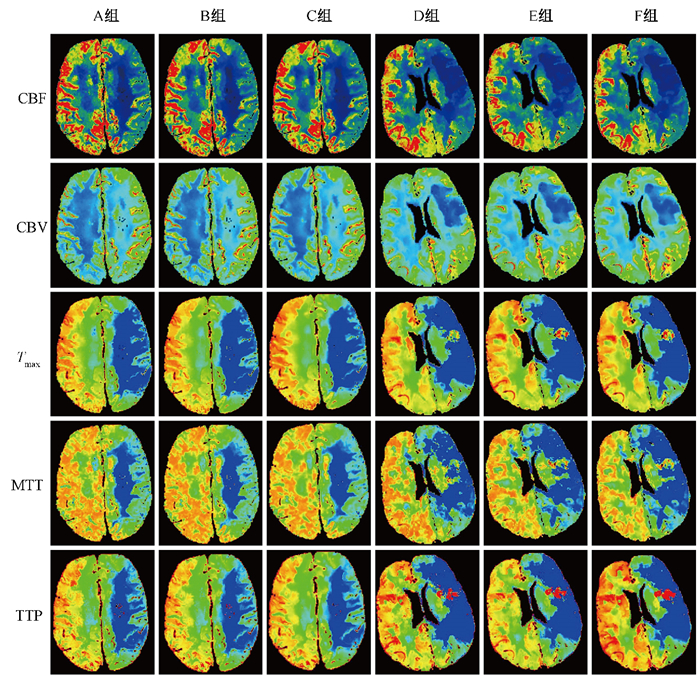
|
注:CBF.脑血流量;CBV.脑血容量;Tmax.残余组织达峰时间;MTT.平均通过时间;TTP.达峰时间 图 2 2例患者重建图像示例 A~C组.患者一,女性,53岁,发作性反应迟钝24 h,管电流150 mA条件下扫描,重建算法分别为FBP、ASIR-V40%和ASIR-V 80%;D~F组.患者二,男性,59岁,意识不清10 h,管电流100 mA条件下扫描,重建算法分别为ASIR-V 80%、DLIR-M和DLIR-H Figure 2 Examples of reconstructed images of two patients Groups A-C. Patient 1, female, 53 years old, with paroxysmal unresponsiveness for 24 h, scanned with tube current of 150 mA, the reconstruction algorithms were FBP, ASIR-V40% and ASIR-V 80%, respectively; Groups D-F. Patient 2, male, 59 years old, unconscious for 10 h, scanned with tube current of 100 mA, the reconstruction algorithms were ASIR-V 80%, DLIR-M and DLIR-H, respectively |
5.辐射剂量评价:分别比较不同扫描条件下所有患者CTP检查的CTDIvol、DLP值及计算所得的E值,见表 1。两组之间各参数差异均有统计学意义(t=2 604.09、1 140.30、2 768.30,P<0.001),E值降低约33.5%。
讨论本研究首次评估了低剂量扫描条件下DLIR算法在CTP图像质量及诊断参数中的应用价值,结果表明在辐射剂量降低33.5%的条件下结合DLIR-H算法可达与常规剂量下结合ASIR-V 80%算法图像质量相当的CTP图像;此外,在各组图像的灌注参数、对AIS患者梗死灶的检出率及检出准确性的比较中,结果表明80 kV、100 mA的低管电流扫描可保证灌注参数值及梗死相关参数的准确性。
Wintermark等[9]发现,在CTP检查中,降低扫描管电压至80 kV不仅可减少患者辐射剂量,同时也增加脑灰质和白质的对比度差异。另有研究表明,将管电压降低到80 kV时,DNA双链发生断裂的细胞会显著减少;进一步将管电压降低至70 kV,DNA双链的断裂会呈现上升趋势[19]。Ioannidis等[20]通过比较增加采样时间间隔和标准1 s采样间隔下灌注参数之间的相关性发现,当采样间隔增加至3 s时,灌注参数发生明显变化,最佳扫描的采样间隔为2 s。本研究中选择的扫描管电压、采样间隔均为在推荐采用的扫描条件。管电流与辐射剂量呈线性相关,若其他扫描条件不变,辐射剂量的降低与管电流成正比。因此,本研究选择降低管电流来降低辐射剂量。
Murase等[21]研究发现,随着管电流的降低,灌注参数的准确性随之降低,MTT首先改变,根据中心容积定理,CBV和CBF也随之变化,且脑白质区域灌注参数的变化小于脑灰质。本研究中,ASIR-V80%重建的两组图像中,脑白质区域D组的MTT值低于C组,脑灰质区域两组的MTT值无明显差异,同图像SD值的变化一致,但与上述研究存在差异。这可能是由于两个研究中ROI的位置不同所致,本研究中灰白质分别为健侧额、颞和顶叶的灰白质区域,但Murase等[21]的研究中选择基底神经节区作为灰质ROI,该区域的灌注参数往往会受到大血管的影响。在Murphy等[22]的研究中,同一患者同时采用50 mA管电流扫描结合ASIR-V80%算法重建的图像与100 mA结合FBP算法下图像的MTT值无明显差异。在本研究中,对比常规辐射剂量FBP算法重建图像(A组)与低剂量ASIR-V80%算法图像(D组),D组的白质区域MTT值降低,灰质区域CBV值降低。这一现象提示,高权重的迭代算法可能会改变临床使用的CTP诊断参数。
既往研究表明,迭代算法可显著改善图像噪声,但更高权重的迭代重建会改变噪声幅度和图像纹理,限制了迭代算法降低临床诊断CT辐射剂量的进一步应用[23-24]。目前,临床CT血管扫描研究证实了DLIR算法能够实现低剂量的CT血管扫描,如冠状动脉CT血管造影,下肢动脉CT血管造影等[25-26]。CTP扫描由于扫描期相较多,患者在单次检查中受到辐射剂量较大,因此,低剂量的CTP扫描方案具有较高的评估卒中的临床价值。然而,目前还没有出现将DLIR算法应用于降低CTP扫描辐射剂量的临床研究。本研究中,采用DLIR算法进行图像重建后发现,E组在灰白质的SD值均高于C组,SNR值均低于C组,CNR值低于C组;F组与C组的各客观参数值差异无统计学意义。进一步比较灌注参数,E组的灰质CBV值低于C组,白质MTT值低于C组,F组和C组的各灌注参数值差异无统计学意义,即DLIR-M算法并没有消除白质区域高噪声带来的影响,但更高强度的DLIR-H算法基本弥补了由于管电流降低导致的高噪声,这表明脑组织对不同强度DLIR算法的敏感性不同,3种不同重建强度可能适用于不同部位的扫描。
在6组CTP图像的梗死病灶检出比较中,D~F组对病灶的检出率相同(79.2%),与150 mA管电流扫描图像的病灶检出率(83.0%)相近,与MRI相比准确性降低。或由于本研究中小病灶较多,两组患者中由穿支动脉引起的病变均为8例,此类小血管闭塞引起的低灌注损伤易观察,而梗死核心一般较小,在CTP图像上不容易观察[18]。此外,CTP图像上部分容积效应的存在使得小病灶的检出更加困难[27]。在剔除小病灶后发现,所有复查图像上存在的病灶在CTP图像上均能有效检出。此外,RAPID软件自动计算梗死核心和缺血半暗带的体积大小差异无统计学意义,表明DLIR算法的使用并不影响患者的治疗决策,即筛选可从溶栓或机械取栓中获益的患者。
本研究仍存在局限性:首先,本研究中病例样本量稍小,仍需增加样本量或对病灶分布进行亚组分析;其次,由于伦理问题,无法对同一患者进行多次扫描,因此分别对不同患者进行不同条件扫描,但两组患者基线资料并无差异,因此研究结果并未受到过多影响;最后,本研究应用一种低管电流方案扫描,未探讨DLIR算法可在保证图像质量及诊断的前提下降低辐射剂量的最大限度,仍需更大样本量及双低扫描条件的对比研究。
综上,DLIR-H算法可以在降低管电流扫描下提高AIS患者CTP检查的图像质量,且不改变灌注参数值的准确性,显著降低了患者检查所受辐射剂量。
利益冲突 本文作者声明不存在与本稿件相关的利益冲突
作者贡献声明 雷丽敏、周宇涵负责实验设计、统计分析和论文撰写;郭晓旭、王慧、马金平负责图像后处理分析;王芝浩、曹伟萌负责数据收集整理;高远、许予明负责论文指导;岳松伟负责选题设计、论文指导和修改
临床试验注册号:中国临床试验注册中心,ChiCTR2100045258
Clinical Trial Registration: Chinese Clinical Trial Registry, ChiCTR2100045258
| [1] |
Khumtong R, Krings T, Pereira VM, et al. Comparison of multimodal CT scan protocols used for decision-making on mechanical thrombectomy in acute ischemic stroke[J]. Neuroradiology, 2020, 62(3): 399-406. DOI:10.1007/s00234-019-02351-5 |
| [2] |
Wu RR, Lu SS, Cao YZ, et al. Hypoperfusion intensity ratio correlates with clinical outcome of endovascular thrombectomy in acute ischaemic stroke patients with late therapeutic window[J]. Clin Radiol, 2022, 77(8): 570-576. DOI:10.1016/j.crad.2022.04.003 |
| [3] |
Nogueira RG, Jadhav AP, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct[J]. N Engl J Med, 2018, 378(1): 11-21. DOI:10.1056/NEJMoa1706442 |
| [4] |
Albers GW, Marks MP, Kemp S, et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging[J]. N Engl J Med, 2018, 378(8): 708-718. DOI:10.1056/NEJMoa1713973 |
| [5] |
Lu SS, Zhang X, Xu XQ, et al. Comparison of CT angiography collaterals for predicting target perfusion profile and clinical outcome in patients with acute ischemic stroke[J]. Eur Radiol, 2019, 29(9): 4922-4929. DOI:10.1007/s00330-019-06027-9 |
| [6] |
Gallissot F, Lenfant M, Thouant P, et al. Temporal averaging angiographic reconstructions from whole-brain CT perfusion for the detection of vasospasm[J]. J Neuroradiol, 2023, 50(3): 333-340. DOI:10.1016/j.neurad.2022.10.001 |
| [7] |
Hoang JK, Wang C, Frush DP, et al. Estimation of radiation exposure for brain perfusion CT: standard protocol compared with deviations in protocol[J]. AJR Am J Roentgenol, 2013, 201(5): W730-734. DOI:10.2214/AJR.12.10031 |
| [8] |
Vagal A, Wintermark M, Nael K, et al. Automated CT perfusion imaging for acute ischemic stroke: Pearls and pitfalls for real-world use[J]. Neurology, 2019, 93(20): 888-898. DOI:10.1212/WNL.0000000000008481 |
| [9] |
Wintermark M, Maeder P, Verdun FR, et al. Using 80 kVp versus 120 kVp in perfusion CT measurement of regional cerebral blood flow[J]. AJNR Am J Neuroradiol, 2000, 21(10): 1881-1884. |
| [10] |
Manniesing R, Oei MT, van Ginneken B, et al. Quantitative dose dependency analysis of whole-brain CT perfusion imaging[J]. Radiology, 2016, 278(1): 190-197. DOI:10.1148/radiol.2015142230 |
| [11] |
Ma G, Cao YZ, Shen GC, et al. CT perfusion with increased temporal sampling interval to predict target mismatch status in patients with acute ischemic stroke[J]. Neuroradiology, 2023, 65(1): 105-111. DOI:10.1007/s00234-022-03026-4 |
| [12] |
Jiang H, Eugene L, Brian N, et al. A new era of image reconstruction: TrueFidelityTM, Technical white paper on deep learning image reconstruction[M]. Chicago, USA: GE HealthCare, 2020.
|
| [13] |
Heinrich A, Schenkl S, Buckreus D, et al. CT-based thermometry with virtual monoenergetic images by dual-energy of fat, muscle and bone using FBP, iterative and deep learning-based reconstruction[J]. Eur Radiol, 2022, 32(1): 424-431. DOI:10.1007/s00330-021-08206-z |
| [14] |
Jiang B, Li N, Shi X, et al. Deep learning reconstruction shows better lung nodule detection for ultra-low-dose chest CT[J]. Radiology, 2022, 303(1): 202-212. DOI:10.1148/radiol.210551 |
| [15] |
Huang X, Zhao W, Wang G, et al. Improving image quality with deep learning image reconstruction in double-low-dose head CT angiography compared with standard dose and adaptive statistical iterative reconstruction[J]. Br J Radiol, 2023, 96(1143): 20220625. DOI:10.1259/bjr.20220625 |
| [16] |
Lei L, Zhou Y, Guo X, et al. The value of a deep learning image reconstruction algorithm in whole-brain computed tomography perfusion in patients with acute ischemic stroke[J]. Quant Imaging Med Surg, 2023, 13(12): 8173-8189. DOI:10.21037/qims-23-547 |
| [17] |
Abels B, Klotz E, Tomandl BF, et al. CT perfusion in acute ischemic stroke: a comparison of 2-second and 1-second temporal resolution[J]. AJNR Am J Neuroradiol, 2011, 32(9): 1632-1639. DOI:10.3174/ajnr.A2576 |
| [18] |
陈鹏军, 林桂涵, 卢陈英, 等. 低剂量双源CT颅脑灌注成像在超急性期脑梗死中的诊断价值[J]. 中华放射学杂志, 2020, 54(2): 112-118. Chen PJ, Lin GH, Lu CY, et al. Diagnostic value of low dose dual-source CT cerebral perfusion imaging in patients with hyperacute cerebral infarction[J]. Chin J Radiol, 2020, 54(2): 112-118. DOI:10.3760/cma.j.issn.1005-1201.2020.02.005 |
| [19] |
林竹潇, 张龙江, 周长圣, 等. 冠状动脉CT成像不同管电压对外周血淋巴细胞DNA双链断裂影响的研究[J]. 放射学实践, 2018, 33(5): 454-458. Lin ZX, Zhang LJ, Zhou CS, et al. Impact of different tube voltage of coronary CT angiography on the DNA double strand breaks in human peripheral lymphocytes[J]. Radiol Pract, 2018, 33(5): 454-458. DOI:10.13609/j.cnki.1000-0313.2018.05.003 |
| [20] |
Ioannidis GS, Christensen S, Nikiforaki K, et al. Cerebral CT perfusion in acute stroke: the effect of lowering the tube load and sampling rate on the reproducibility of parametric maps[J]. Diagnostics (Basel), 2021, 11(6): 1121. DOI:10.3390/diagnostics11061121 |
| [21] |
Murase K, Nanjo T, Ii S, et al. Effect of x-ray tube current on the accuracy of cerebral perfusion parameters obtained by CT perfusion studies[J]. Phys Med Biol, 2005, 50(21): 5019-5029. DOI:10.1088/0031-9155/50/21/005 |
| [22] |
Murphy A, So A, Lee TY, et al. Low dose CT perfusion in acute ischemic stroke[J]. Neuroradiology, 2014, 56(12): 1055-1062. DOI:10.1007/s00234-014-1434-z |
| [23] |
Zhu Z, Zhao Y, Zhao X, et al. Impact of preset and postset adaptive statistical iterative reconstruction-V on image quality in nonenhanced abdominal-pelvic CT on wide-detector revolution CT[J]. Quant Imaging Med Surg, 2021, 11(1): 264-275. DOI:10.21037/qims-19-945 |
| [24] |
Li K, Tang J, Chen GH. Statistical model based iterative reconstruction (MBIR) in clinical CT systems: experimental assessment of noise performance[J]. Med Phys, 2014, 41(4): 041906. DOI:10.1118/1.4867863 |
| [25] |
Benz DC, Ersözlü S, Mojon F, et al. Radiation dose reduction with deep-learning image reconstruction for coronary computed tomography angiography[J]. Eur Radiol, 2022, 32(4): 2620-2628. DOI:10.1007/s00330-021-08367-x |
| [26] |
Qu T, Guo Y, Li J, et al. Iterative reconstruction vs deep learning image reconstruction: comparison of image quality and diagnostic accuracy of arterial stenosis in low-dose lower extremity CT angiography[J]. Br J Radiol, 2022, 95(1140): 20220196. DOI:10.1259/bjr.20220196 |
| [27] |
Lin L, Bivard A, Parsons MW. Perfusion patterns of ischemic stroke on computed tomography perfusion[J]. J Stroke, 2013, 15(3): 164-173. DOI:10.5853/jos.2013.15.3.164 |
 2024, Vol. 44
2024, Vol. 44


