脑转移瘤是成人最常见的继发性肿瘤之一,随着诊疗水平的提高和肿瘤患者生存期的延长,脑转移瘤的发病率进一步提高[1]。大分割立体定向放射治疗(hypofractionated stereotactic radiotherapy,HSRT)对于小靶区可提供高剂量和高适形度照射,进而提高肿瘤控制率[2];同时,其陡峭的剂量跌落可更好地保护周围正常组织,比全脑放疗明显降低患者认知功能障碍和记忆功能衰退的风险[3],成为脑转移瘤的首选治疗策略。放射治疗中,良好的体位固定能够提高摆位的重复性和治疗的准确性,尤其对于HSRT,对肿瘤的精确定位提出了更严格的要求。因头部不受呼吸和内脏器官运动的影响,位置较为稳定,因此患者的摆位是精确治疗的关键。脑转移瘤HSRT常规使用封闭式热塑面罩固定体位,以及传统的激光灯+面罩标记引导摆位,为了提高患者的舒适度以及缓解由封闭式面罩引起的“面罩焦虑症”,开放式面罩在头部放疗的体位固定中越来越广泛使用[4],且开放式面罩可联合光学表面监测系统(optical surface monitoring system,OSMS)引导摆位,OSMS利用光斑成像法实时重建体表的三维影像,与参考影像配准获得治疗中心六维方向的位移误差,指导治疗师摆位;并在治疗过程中实时动态监测位移变化,同时与加速器联动,实现治疗中门控作用。本研究通过比较脑转移瘤HSRT开放式面罩固定联合OSMS引导摆位,与封闭式头颈肩热塑面罩固定联合激光灯+面罩标记引导摆位的平移和旋转误差,评估开放式面罩固定联合OSMS引导摆位的分次间摆位精度,并计算适合本单位的脑转移瘤HSRT的计划靶区体积(planning target volume,PTV)外放边界。
资料与方法 1、临床资料回顾性选取2021年8月至2023年4月于深圳市人民医院行头部放疗的脑转移瘤患者55例,年龄27~68岁,中位年龄46岁。所选病例按照不同的体位固定设备+摆位引导方式进行分组,A组19例采用Q-Fix Encompass开放式面罩固定+英国VisionRT公司OSMS v5.1.2自动移床功能引导摆位;B组36例采用常规封闭式头颈肩热塑面罩固定+LAP公司三维激光灯摆位,其中B1组17例封闭式面罩+个体化发泡胶,B2组19例封闭式面罩+标准头枕。3组患者临床特征差异均无统计学意义(P>0.05),见表 1。
|
|
表 1 3组患者临床资料比较[例(%)] Table 1 Comparison of patient characteristics between the three groups [n (%)] |
2、CT模拟定位和计划设计
两组患者均采取仰卧位,头后伸,抬起下颌部,双手掌心向内贴于身体两侧。A组采用Q-Fix SRS碳纤维板和Encompass开放式面罩固定(图 1 A),该面罩由前后两块热塑面膜形成360°包围;上界在眉弓上缘1~2指,下界在鼻孔下缘,两侧在耳屏前留有开孔作为OSMS监测的感兴趣区域;垫片有1~4档位用于调整每个位置的松紧度,定位时标记好档位;面罩冷却成型前放置咬合器,限定下颚位置和头部转动幅度。B组采用常规头颈肩板和封闭式头颈肩热塑面罩固定+个体化发泡胶(图 1 B)或+标准化头枕(图 1 C)。待膜具完全冷却定型后,采用德国西门子SOMATOM Definition AS大孔径CT定位扫描,扫描范围从头顶到锁骨下缘,扫描条件为120 kV、410 mAs、层厚2 mm。图像经内网传输至美国瓦里安Eclipse 13.6放疗计划系统,与磁共振(MR)图像融合配准后勾画靶区和危及器官,并由物理师设计放疗计划,计划处方30 Gy覆盖95%PTV,分割模式5、6、10次,计划设计采用共面或非共面容积弧形调强放射治疗(volumetric arc radiotherapy,VMAT)或调强放射治疗(intensity modulated radiotherapy,IMRT)技术,6 MV X射线,非均整(flattening filter free,FFF)或均整(flattening filter,FF)模式。所有计划应用Edge直线加速器(Varian,美国)执行。主管医师评估确认计划后将放疗计划、模拟定位CT图像和计划CT外轮廓分别传输至Mosaiq(Elekta,瑞典)网络和OSMS工作站。

|
图 1 3组头部固定系统 A. 开放式热塑面罩;B. 封闭式头颈肩热塑面罩+发泡胶;C. 封闭式头颈肩热塑面罩+标准头枕 Figure 1 Immobilization systems of the three groups A. Open thermoplastic mask; B. Full head-neck-shoulders thermoplastic mask+ polyurethane foam cushion; C. Full head-neck-shoulders thermoplastic mask+ standard headrest |
3、A组治疗摆位流程
首次治疗时,OSMS工作站导入计划文件(RT plan)和计划CT体表轮廓文件(RT structure),并勾画监控感兴趣区(region of interest,ROI),ROI包括:额头、眉毛、双眼和鼻子,上界眉骨1~2指上,外界耳屏前,下界鼻孔下缘。患者平躺于治疗床,按照模拟定位开放式面罩各项参数固定患者,先根据体表标记和激光线等中心摆位,OSMS将实时重建的表面与计划CT参考表面的ROI进行配准,预摆位手动调整使平移误差≤2 cm和旋转误差≤2°,之后使用自动移床(Move Couch 6DoF)功能使六维方向误差数值均接近0。使用Edge加速器搭载的锥形束CT(cone beam computed tomography,CBCT)影像验证系统采集CBCT影像,使用全扇面头部扫描模式,扫描条件为100 kVp,150 mAs。CBCT影像与定位CT影像基于骨自动配准,经医生与技师共同确认自动配准结果,配准误差≤2 mm/2°,即可确认此次摆位误差;否则需重新摆位、CBCT扫描和配准图像。获取床平移和旋转六维方向摆位误差:左右(x轴)、进出(y轴)、升降(z轴)、x轴旋转、y轴旋转和z轴旋转,并应用六维床校正。然后采集OSMS表面影像,作为后续治疗OSMS引导摆位和本次治疗分次内监控的参考影像。
4、B组治疗摆位流程c患者使用常规封闭式头颈肩热塑面罩+发泡胶(B1组)和封闭式头颈肩热塑面罩+标准头枕(B2组)固定,应用体表标记线和激光灯摆位后,采集CBCT图像,CBCT采集条件和配准方式与A组相同,经过医生与技师共同确认自动配准结果,配准误差≤2 mm/2°,即可确认此次的摆位误差,校准误差后进行临床治疗;否则需重新摆位,重新CBCT扫描和配准图像。所有患者每次治疗前均进行CBCT位置验证,记录六维方向配准误差作为摆位误差并进行统计分析。
5、统计学处理采用Excel 2007和SPSS 19.0软件进行分析。患者临床特征比较使用行×列表资料χ2检验,当超过20%理论频数<5,使用Fisher精确概率法;六维方向的配准误差使用绝对值进行统计分析,数据符合正态分布,以x±s表示。3组病例对应摆位误差数据行单因素方差分析,采用SNK法进行两两比较。三维矢量误差定义为x、y和z轴平移误差平方和的平方根[4],同时采用van Herk公式2.5∑+0.7σ计算CTV-PTV外扩边界[5],式中∑为所有患者系统误差的标准差,系统误差定义为患者各个分次摆位误差的均值;σ为所有患者随机误差的均方根,随机误差定义为患者各个分次摆位误差的标准差。P<0.05为差异具有统计学意义。
结果 1、摆位误差分析比较55例患者共采集CBCT 288次,其中A组97次,B1组93次,B2组98次。3组平移和旋转误差均值在2 mm和1°范围内,3组中A组平移和旋转误差以及3D矢量误差均值最小,除z轴旋转方向与B1组比较,差异无统计学意义外(P>0.05),其余方向摆位误差与B1组和B2组比较,差异均存在统计学意义(P<0.05);y轴、z轴、z轴旋转方向和3D矢量误差B1与B2组比较,差异存在统计学意义(P<0.05),3组六维方向摆位误差详见表 2。
|
|
表 2 3组间平移和旋转方向摆位误差比较(x±s) Table 2 Comparison of translational and rotational set-up errors between the three groups(x±s) |
2、3组摆位误差累积分布频率比较
平移误差≥2 mm的分布频率,A组、B1组和B2组在x轴方向分别为0、6.5%和5.1%;y轴方向3组分别为0、9.7%和27.6%;z轴方向分别为0、3.2%和14.3%。旋转误差≥1°的分布频率在x轴旋转方向3组分别为15.5%、28.0%和36.7%;y轴旋转方向分别为19.6%、50.6%和52.1%;z轴旋转方向分别为18.5%、23.7%和37.7%。旋转误差≥2°的分布频率在x轴旋转方向3组分别为0、0和6.1%;y轴旋转方向分别为0、6.5%和8.2%;z轴旋转方向分别为0、0和7.1%,见图 2。
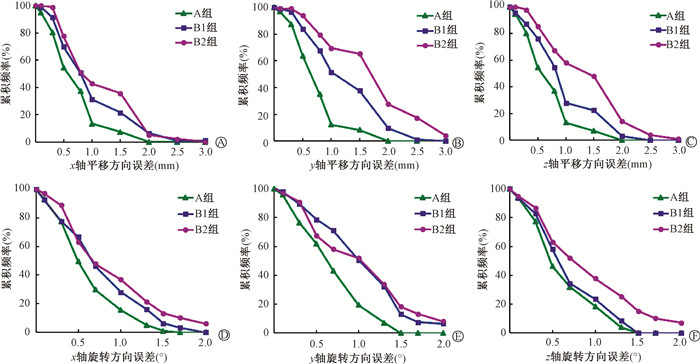
|
注:A组. 开放式面罩固定;B1组. 封闭式面罩+个体化发泡胶;B2组. 封闭式面罩+标准头枕 图 2 3组平移和旋转误差累积分布频率 A~C. 分别为x、y和z轴平移方向;D~F. 分别为x、y和z轴旋转方向 Figure 2 Cumulative frequency of translational and rotational setup errors of the three groups A-C. Translational directions along x, y, and z axis; D-F. Rotational directions around roll, pitch, and yaw |
3、3组摆位系统误差、随机误差及CTV-PTV外放边界比较
3个平移方向的系统误差、随机误差及CTV-PTV外放边界,3组比较A组均最小;B1组和B2组相比x轴方向相近,其他两个方向,B1组小于B2组,详见表 3。
|
|
表 3 3组间摆位误差及PTV外扩边界比较(mm) Table 3 Comparison of setup errors and planning target volume margins between the three groups (mm) |
讨论
有研究发现,采用封闭式热塑头颈肩面罩固定及激光灯+面罩标记引导摆位,脑转移瘤放疗的摆位误差较大,达(3.9 ± 1.7)mm,分析摆位误差较大的原因主要来源于封闭式热塑面罩冷却硬化后出现回缩,导致面罩紧贴甚至挤压面部,使患者头部更深入头枕,引起前后方向摆位误差增大达2.7 mm;而患者基于治疗室激光灯+面罩标记引导摆位,无法识别头部在面罩内的位移变化[6]。Ingrosso等[7]也通过对脑转移瘤封闭式面罩固定HSRT患者的摆位误差进行分析,发现37例患者中17例患者平移误差超过6 mm或旋转误差大于3°,增加了患者重复摆位的频率,延长了摆位时间。此外,应用封闭式面罩不可避免地使患者产生束缚感和压迫感,增加患者出现焦虑和幽闭恐惧症的风险,研究报道其发生率高达14%~58%[8-9],严重的面罩焦虑会导致面罩内头部活动增加、患者依从性差甚至出现治疗中断等问题,影响放疗疗效[10-11]。
开放式面罩既可改善患者舒适度,减轻患者焦虑和幽闭恐惧症的发生,提高患者的依从性[12];且其更大的优势是其开孔设计可以联合应用OSMS引导摆位,提高摆位精度[13]。Naidoo和Leech[14]的一项荟萃分析发现,与传统基于激光灯+体表标记引导摆位相比,OSMS引导摆位可明显提高乳腺癌放疗患者的摆位准确性和重复性,减小残余摆位误差;并可降低常规影像引导技术的应用频率,提高治疗效率。另外,有研究发现因患者头部在面罩内转动,必然引起轻微的平移[15-16],因此,旋转误差与平移误差校准之间存在相互作用,导致对摆位误差的一次矫正不足以完全校准患者的体位,需要进行一次以上位置校准;而OSMS通过光学引导对患者不会产生额外的电离辐射,极大减小了继发性肿瘤的发生风险[17]。本研究结果显示,使用开放式面罩联合OSMS引导摆位,与封闭式面罩联合激光灯+面罩标记引导摆位相比,可显著改善脑转移瘤HSRT患者六维方向的摆位误差,与Zhou等[18]和Ingrosso等[7]研究结果一致。且本研究发现开放式面罩组无> 2 mm/2°摆位误差,极大地降低了重复摆位率,减少了摆位时间。此外,开放式面罩组旋转方向≥ 1°摆位误差的累积频率明显小于封闭式面罩组,有研究发现与平移方向误差相比,旋转误差更易导致靶区和危及器官的显著剂量差异[19-20],提示开放式面罩联合OSMS引导摆位可更有效降低旋转方向误差,提高脑转移瘤HSRT患者的位置精度和剂量精度。
本研究中,开放式面罩组摆位误差较小的原因主要在于:①Q-Fix开放式面罩采用双层坚硬的凯夫拉热塑性材料制成,面罩孔隙较封闭式头颈肩热塑面罩更小,并有多处加强带设计,以及在下颌部分做了加厚处理,因此比封闭式面罩固定强度更高,冷却硬化后回缩更小。②集成垫片设计可进行独立的前后两片面罩间松紧度调节,也可缓解面罩冷却后回缩现象的影响。③咬合器配件的增加,进一步固定面罩和面部的相对位置,减少了头部在平移方向,及俯仰和左右旋转方向的运动,加强面罩的固定效果,进而显著减少了整个头部的摆位误差。
开放式面罩固定联合OSMS引导摆位作为一种新的摆位方式,在摆位精度方面比封闭式头颈肩面罩组显示出明显优势,但为确保开放式面罩固定的稳定性,及暴露出合适的OSMS监测感兴趣区域,在面罩制作时需要至少两名定位技师同时操作,固定并按压感兴趣区边缘面罩,使其与患者面部皮肤紧密贴合;同时将面罩下部向上折叠,使其环绕患者的下颌以实现额外的刚性和稳定度。此外,Q-Fix开放式面罩对头颅枕部的支撑和固定使用的是面膜联合标准头枕,其固定精度是否优于同类开放式面罩使用的个体化的水化枕,仍需后续进一步临床比较研究。
本研究封闭式面罩的两个亚组中,左右方向的平移和旋转误差在两个亚组间差异均没有统计学意义,考虑原因在于人体头部左右平移和旋转固定主要来源于头颈肩面罩在头部前方即人脸轮廓上进行固定限制,只有少部分靠近枕部位置是靠下方头枕或固定垫限制,位移主要受面罩限制,故两亚组间左右方向平移和旋转误差无差异。头脚平移方向两亚组之间存在差异,是因为标准头枕无法与每位患者的头型吻合而产生空隙,使颈部和双肩位置下方缺少支撑和固定,导致颈部和头枕在头脚方向的相对位置难以固定;而发泡胶可使患者在头部、颈部以及双肩位置都有一个适形的固定,联合头颈肩面罩对头顶产生一个包裹限制,因而患者在头脚方向上的移动度大大减少。前后方向上由于头部与标准头枕之间因不吻合产生的间隙,使得在这个方向上的位移误差比个体化发泡胶组的明显增加,与Androjna等[21]对不同头枕影响头颈部肿瘤摆位误差的研究结果一致,个体化头枕比标准头枕明显降低头脚和前后方向的误差。
即使应用有创的刚性头部框架固定系统,头部也会出现由于框架滑动和变形引起的无法控制的摆位误差[22]。因此治疗中为确保靶区剂量覆盖,临床靶区增加一个外放边界PTV是十分必要的。头部不受呼吸运动的影响,体位固定的不确定度和摆位误差就成为设定PTV的重要参考指标。本研究根据van Herk的计算公式[5]分别计算出各组的PTV外放边界,开放式面罩组3个方向上的外放边界均小于封闭式面罩组。PTV外放边界减小对于降低放疗不良反应具有重要的作用,Navran等[23]发现头颈部肿瘤中PTV外放边界减小是放疗不良反应的独立预测因素。Russo等[24]也发现减小PTV外放边界,可有效减少正常脑组织和重要危及器官的剂量,降低放疗不良反应,提高患者生活质量。需要指出的是,本研究使用的van Herk计算公式[5]没有包含旋转误差,以及计划系统建模、靶区勾画和加速器校准等其他不确定性来源,因此,建议将计算的值作为PTV外放的最小值,并且在实践中还需纳入额外的其他不确定度的外扩边界将更为合适。
综上所述,脑转移瘤HSRT中,开放式面罩联合OSMS引导摆位,与头颈肩封闭式面罩联合激光灯+面罩标记引导摆位相比,既可以提高患者舒适度,又可以减少六维方向摆位误差,提高患者的摆位精度,降低重复摆位率,减少CBCT扫描频次,进而减少患者发生继发性肿瘤的风险。两组相应的PTV外放边界值,可为放疗医生和物理师制定和评估放疗计划提供参考。
利益冲突 无
作者贡献声明 李隆兴负责研究设计、数据采集和论文内容审阅;高艳负责研究设计、数据整理分析和论文撰写;陈洪涛、李子煌、史亚滨负责临床数据资料采集和分析、对论文内容审阅修改
| [1] |
Kocher M, Soffietti R, Abacioglu U, et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study[J]. J Clin Oncol, 2011, 29(2): 134-141. DOI:10.1200/JCO.2010.30.1655 |
| [2] |
Pan H, Cerviño LI, Pawlicki T, et al. Frameless real-time surface imaging-guided radiosurgery clinical outcomes for brain metastases[J]. Neurosurgery, 2012, 71(4): 844-851. DOI:10.1227/NEU.0b013e3182647ad5 |
| [3] |
Andrews DW, Scott CB, Sperduto PW, et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase Ⅲ results of the RTOG 9508 randomised trial[J]. Lancet, 2004, 363(9422): 1665-1672. DOI:10.1016/S0140-6736(04)16250-8 |
| [4] |
Cheo T, Loh Y, Chen D, et al. Measuring radiotherapy setup errors at multiple neck levels in nasopharyngeal cancer (NPC): A case for differential PTV expansion[J]. Radiother Oncol, 2015, 117(3): 419-424. DOI:10.1016/j.radonc.2015.09.032 |
| [5] |
van Herk M. Errors and margins in radiotherapy[J]. Semin Radiat Oncol, 2004, 14(1): 52-64. DOI:10.1053/j.semradonc.2003.10.003 |
| [6] |
Guckenberger M, Roesch J, Baier K, et al. Dosimetric consequences of translational and rotational errors in frame-less image-guided radiosurgery[J]. Radiat Oncol, 2012, 7(1): 63. DOI:10.1186/1748-717X-7-6 |
| [7] |
Ingrosso G, Miceli R, Fedele D, et al. Cone-beam computed tomography in hypofractionated stereotactic radiotherapy for brain metastases[J]. Radiat Oncol, 2012, 7: 54. DOI:10.1186/1748-717X-7-54 |
| [8] |
Nixon JL, Cartmill B, Turner J, et al. Exploring the prevalence and experience of mask anxiety for the person with head and neck cancer undergoing radiotherapy[J]. J Med Radiat Sci, 2018, 65(4): 282-290. DOI:10.1002/jmrs.308 |
| [9] |
Oultram S, Findlay N, Clover K, et al. A comparison between patient self-report and radiation therapists' ability to identify anxiety and distress in head and neck cancer patients requiring immobilization for radiation therapy[J]. J Radiother Pract, 2012, 11(2): 74-82. DOI:10.1017/S1460396911000136 |
| [10] |
Nixon JL, Brown B, Pigott AE, et al. A prospective examination of mask anxiety during radiotherapy for head and neck cancer and patient perceptions of management strategies[J]. J Med Radiat Sci, 2019, 66(3): 184-190. DOI:10.1002/jmrs.346 |
| [11] |
Molassiotis A, Rogers M. Symptom experience and regaining normality in the first year following a diagnosis of head and neck cancer: a qualitative longitudinal study[J]. Palliat Support Care, 2012, 10(3): 197-204. DOI:10.1017/S147895151200020X |
| [12] |
Li G, Ballangrud A, Kuo LC, et al. Motion monitoring for cranial frameless stereotactic radiosurgery using video-based three-dimensional optical surface imaging[J]. Med Phys, 2011, 38(7): 3981-3994. DOI:10.1118/1.3596526 |
| [13] |
Li G, Ballangrud A, Chan M, et al. Clinical experience with two frameless stereotactic radiosurgery (fSRS) systems using optical surface imaging for motion monitoring[J]. J Appl Clin Med Phys, 2015, 16(4): 149-162. DOI:10.1120/jacmp.v16i4.5416 |
| [14] |
Naidoo W, Leech M. Feasibility of surface guided radiotherapy for patient positioning in breast radiotherapy versus conventional tattoo-based setups- a systematic review[J]. Tech Innov Patient Support Radiat Oncol, 2022, 22: 39-49. DOI:10.1016/j.tipsro.2022.03.001 |
| [15] |
Zhao B, Maquilan G, Jiang S, et al. Minimal mask immobilization with optical surface guidance for head and neck radiotherapy[J]. J Appl Clin Med Phys, 2018, 19(1): 17-24. DOI:10.1002/acm2.12211 |
| [16] |
Barnes M, Yeo A, Thompson K, et al. A retrospective analysis of setup and intrafraction positional variation in stereotactic radiotherapy treatments[J]. J Appl Clin Med Phys, 2020, 21(12): 109-119. DOI:10.1002/acm2.13076 |
| [17] |
Kan MW, Leung LH, Wong W, et al. Radiation dose from cone beam computed tomography for image-guided radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2008, 70(1): 272-279. DOI:10.1016/j.ijrobp.2007.08.062 |
| [18] |
Zhou S, Li J, Zhu X, et al. Initial clinical experience of surface guided stereotactic radiation therapy with open-face mask immobilization for improving setup accuracy: a retrospective study[J]. Radiat Oncol, 2022, 17(1): 104. DOI:10.1186/s13014-022-02077-4 |
| [19] |
Guckenberger M, Meyer J, Vordermark D, et al. Magnitude and clinical relevance of translational and rotational patient setup errors: a cone-beam CT study[J]. Int J Radiat Oncol Biol Phys, 2006, 65(3): 934-942. DOI:10.1016/j.ijrobp.2006.02.019 |
| [20] |
Kim GY, Pawlicki T, Le QT, et al. Linac-based on-board imaging feasibility and the dosimetric consequences of head roll in head-and-neck IMRT plans[J]. Med Dosim, 2008, 33(1): 93-99. DOI:10.1016/j.meddos.2007.05.004 |
| [21] |
Androjna S, Marcius VZ, Peterlin P, et al. Assessment of set-up errors in the radiotherapy of patients with head and neck cancer: standard vs. individual head support[J]. Radiol Oncol, 2020, 54(3): 364-370. DOI:10.2478/raon-2020-0036 |
| [22] |
Ramakrishna N, Rosca F, Friesen S, et al. A clinical comparison of patient setup and intra-fraction motion using frame-based radiosurgery versus a frameless image-guided radiosurgery system for intracranial lesions[J]. Radiother Oncol, 2010, 95(1): 109-115. DOI:10.1016/j.radonc.2009.12.030 |
| [23] |
Navran A, Heemsbergen W, Janssen T, et al. The impact of margin reduction on outcome and toxicity in head and neck cancer patients treated with image-guided volumetric modulated arc therapy (VMAT)[J]. Radiother Oncol, 2019, 130: 25-31. DOI:10.1016/j.radonc.2018.06.032 |
| [24] |
Russo M, Owen R, Bernard A, et al. Evaluation of accuracy and reproducibility of a relocatable maxillary fixation system for fractionated intracranial stereotactic radiation therapy[J]. J Med Radiat Sci, 2016, 63(1): 41-47. DOI:10.1002/jmrs.142 |
 2024, Vol. 44
2024, Vol. 44


