塑料制品在为生活提供极大便利的同时也产生了大量不易降解的环境垃圾[1-2]。微塑料(直径<5 mm)及其分解成分沿食物链逐级传递,最终会对水体和陆地生物造成长期、慢性的健康风险[3-4]。核能的特殊优势为人类带来巨大的社会和经济效益的同时也伴随着较高的安全风险,且在工业、环境及医疗领域均存在微塑料和放射性双重暴露的情况。然而,目前关于该方面影响的研究鲜有报道,本课题组前期工作中关注并初步评估了一种微塑料成分对电离辐射毒性效应的影响[5]。进一步深入研究微塑料-放射性双重暴露对水体生物及人类造成的生存和健康风险对于保护非人类物种多样性和维护医源性辐照患者健康均具有重要意义。
四溴双酚A(tetrabromobisphenol A,TBBPA)是广泛使用的反应型阻燃剂和增塑剂之一,主要由电子行业塑料垃圾产生的塑料碎片(包括微塑料)进一步释放产生[6]。在水体环境中四溴双酚A的释放作用愈加明显,其浓度范围从几皮克到4 870 ng/L[7-8]。在受其污染的地区,职业或非职业暴露人群日摄入量甚至超过1 mg·kg-1·d-1[9]。近年来,四溴双酚A作为典型的塑料毒物被广泛研究[10]。斑马鱼(Danio rerio,zebrafish)是毒理学研究的理想模型[5]。本研究旨在以斑马鱼成鱼为模型,研究四溴双酚A对肝脏辐射毒性效应的影响,为揭示微塑料和放射性双重污染的严重性及其潜在机制提供科学依据,为开辟针对受污染水体生物的救治策略奠定基础。
材料与方法 1、斑马鱼饲养、分组及处理方式野生型AB斑马鱼种鱼购自中国斑马鱼资源中心,于本实验室鱼房饲养繁殖。鱼房设置14 h光照/10 h黑暗交替光周期,斑马鱼养殖系统维持(28±1)℃的淡水循环,pH调节至7~7.8,电导率调节至500~550。斑马鱼用新鲜丰年虫每天喂食两次,实验开始之前驯养14 d。选取4~6月龄同批次健康成年斑马鱼根据处理方法的不同,采用3种方式按随机数表法进行分组。
(1) 四溴双酚A暴露浓度筛选实验:分为4组:对照组和3、30、300 μg/L四溴双酚A处理组。四溴双酚A处理组给予相应浓度的四溴双酚A暴露10 d,对照组给予等体积的二甲基亚砜(DMSO)溶剂进行同时暴露。
(2) 双重暴露对肝脏功能具体影响实验:分为5组:对照组、电离辐射组(10、20或30 Gy)和电离辐射+四溴双酚A(60、300和1 500 μg/L)联合组。
(3) 四溴双酚A对肝脏辐射毒性效应影响实验:分为3组:对照组、电离辐射组(20 Gy)和电离辐射+四溴双酚A(300 μg/L)联合组。
电离辐射组和电离辐射+四溴双酚A联合组用137Cs γ射线对斑马鱼进行10、20或30 Gy一次性全身照射,对照组斑马鱼在相同条件下接受0 Gy假照射。电离辐射+四溴双酚A联合组于照射前1 d给予60、300或1 500 μg/L四溴双酚A预暴露,并于照射后持续暴露9 d;对照组和电离辐射组给予等体积的DMSO溶剂进行相同暴露。暴露终点对斑马鱼进行冰浴安乐死后,用眼科显微角膜剪和眼科镊尽可能完整剖取其肝脏用于后续实验。
2、试剂与仪器四溴双酚A购自梯希爱(上海)化成工业发展有限公司;丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)活性检测试剂盒购自北京索莱宝生物科技有限公司;RNA提取TRIzol试剂购自日本TaKaRa公司;实时荧光定量聚合酶链式反应(qRT-PCR)所用SYBR Green试剂购自瑞士罗氏公司;酶联免疫吸附测定(ELISA)水平检测试剂盒购自上海科兴商贸有限公司;丙二醛(MDA)水平和超氧化物歧化酶(SOD)活性检测试剂盒购自苏州格锐思生物科技有限公司;吖啶橙(AO)染色凋亡检测试剂盒购自盐城艾迪生生物科技有限公司;甲醇、乙腈和甲酸购自美国费希尔公司。137Cs γ射线照射源(USD Autocell40)购自加拿大原子能有限公司,剂量率为0.84 Gy/min;斑马鱼养殖系统(Z-A-D5)购自上海海圣生物实验设备有限公司;解剖体视显微镜(SZ680)购自重庆奥特光学仪器有限公司;多功能酶标仪(EnSpire eq ®)购自美国PerkinElmer公司;实时荧光定量PCR仪(C1000TM Thermal Cycler)购自美国Bio-Bad公司;激光共聚焦显微镜(7CSSP8)购自德国Leica公司;T3(100 mm × 2.1 mm,1.8 μm)色谱柱购自美国沃特世公司;超高效液相色谱(Vanquish Flex UHPLC)和高分辨率质谱仪(Q-Exactive)购自美国赛默飞公司。
3、ALT/AST活性检测采用冰浴法使斑马鱼安乐死,解剖成鱼并取肝脏放入去皮的1.5 ml EP管中称重。按照1 ml/0.1 g的比例加入提取液进行冰浴匀浆,3 500×g,4℃离心10 min,将上清液转移至新EP管中。吸取1 μl上清液用分光光度计测定蛋白浓度。按照试剂盒说明依次加样,混匀后室温放置10 min,在505 nm处测定吸光值。实验过程中同时设置标准管和空白管,以绘制标准曲线。依标准曲线和蛋白浓度计算酶活力。
4、ELISA实验使用ELISA试剂盒对活性氧(ROS)水平和肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和环氧合酶2(Cox-2)、Caspase-8、Caspase-9的蛋白水平进行测定。按照250 μl/0.1 g的比例加入磷酸盐缓冲液(PBS)进行冰浴匀浆。3 500×g,4℃离心10 min,将上清液转移至新EP管中待测。设置待测样品孔、标准品孔和空白孔,每孔加入酶标试剂,空白孔除外。37℃温育30 min后洗板,加入显色剂避光显色10 min,加入终止液。以空白孔调零,用酶标仪于450 nm波长处测定各孔的吸光度值。
5、MDA含量检测取材及样本浓度测定方法同ALT/AST活性检测。之后按照试剂盒说明将300 μl工作液与200 μl样本混匀,95℃水浴30 min。冰浴冷却,可看到有红色产物,3 500×g,25℃离心10 min。每管取200 μl上清液加至96孔板中,分别于532和600 nm处读取吸光度值。按照样本浓度计算MDA含量。
6、SOD活性检测取材及样本浓度测定方法同ALT/AST活性检测。之后按照试剂盒操作步骤依次加样,混匀后室温避光放置30 min,于450 nm波长处测定各孔吸光度值。按照试剂盒说明计算抑制百分率,按照样本浓度计算各样品酶活力。
7、QRT-PCR检测基因表达剖取斑马鱼肝脏,采用TRIzol裂解法提取总RNA,反转录获得cDNA,检测各基因的mRNA表达水平,包括TNF-α、IL-1β、Cox-2、Caspase-8及Caspase-9。同时检测管家基因β-肌动蛋白的表达作为内参。扩增条件:50℃ 2 min、95℃ 10 min、95℃ 15 s、60℃ 1 min,循环35次,数据采用2-ΔΔCt法进行分析。各基因引物序列见表 1。
|
|
表 1 相关基因qRT-PCR检测引物 Table 1 Primers of the related genes for qRT-PCR assay |
8、AO染色检测细胞凋亡
剖取斑马鱼肝脏,于4%多聚甲醛中固定过夜,之后于20%蔗糖溶液中脱水2 h,经最佳切削温度混合物(OCT)包埋后于-20℃冷冻,切片。制好的冰冻切片经PBST(PBS+0.5% Triton)溶液清洗3遍,每片滴加200 μl AO染液,室温避光染色15 min。用PBS清洗3遍后封片,于激光共聚焦显微镜下观察各组肝脏细胞凋亡情况并拍照。
9、统计学处理应用SPSS 20.0软件进行统计分析。数据符合正态分布和方差齐性,以x±s表示,多组间数据比较采用单因素方差(One-way ANOVA)检验。P<0.05为差异有统计学意义。
10、非靶向代谢组学评价(1) 代谢物提取:称取100 mg组织样品进行液氮研磨,以120 μl 50%甲醇进行代谢物提取,-20℃过夜沉淀。4 000×g离心20 min,分离上清于放-80℃冰箱保存。
(2) 液相参数说明:样品由液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)系统采集,使用Vanquish Flex UHPLC系统进行色谱分离。使用ACQUITY UPLC T3色谱柱,流速为0.4 ml/min(35℃),流动相为溶剂A(水,0.1%甲酸)和溶剂B(乙腈,0.1%甲酸)。梯度洗脱条件设置为:0~0.5 min,5%B;0.5~7 min,5% ~100%B;7~8 min,100%B;8~8.1 min,100%~5%B;8.1~10 min,5%B。
(3) 质谱参数说明:使用高分辨率串联质谱仪Q-Exactive在正、负离子模式下检测洗脱的代谢物。在70 000分辨率下收集前体光谱(70~1 050 m/z),最大注入时间设置为100 ms。在17 500分辨率下收集片段谱,最大注入时间为80 ms。
(4) 信息分析流程:对质谱下机原始数据利用Proteowizard的MSConvert软件转换成可读数据mzXML。利用XCMS软件进行峰提取,并做峰提取质量控制。对提取到的物质利用CAMERA进行加和离子注释,然后利用metaX软件进行一级鉴定。候选鉴定物质分别利用人类代谢组数据库(human metabolome database,HMDB)、京都基因与基因组百科数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)等数据库进行代谢物注释,解释代谢物的物理化学性质、生物功能。利用metaX软件对差异代谢物进行定量及筛选,本研究关注了在对照组、电离辐射组和电离辐射+四溴双酚A联合组之间持续上、下调的差异代谢物。采用Students′s t检验对每两组间代谢物含量差异进行统计学分析,使用检错率(false discovery rate,FDR,Benjamini-Hochberg法)对多次检验的P值进行调整。通过metaX软件采用有监督的偏最小二乘法判别分析法(PLS-DA)区分每两组间代谢谱差异。计算变量差异贡献程度(variable important for the projection,VIP)值,以VIP≥1.0和P<0.05为标准筛选每两组间的差异代谢物。
结果 1、四溴双酚A起效剂量筛选及与电离辐射联合暴露对斑马鱼肝脏功能的影响经检测其肝脏ALT和AST活性水平呈剂量依赖式上升,且300 μg/L处理组上升显著(ALT:t=-2.22,P<0.05;AST:t=-3.20,P<0.05,图 1A和1B)。故选取300 μg/L的四溴双酚A与电离辐射(20 Gy)对斑马鱼进行联合暴露,暴露终点时单纯电离辐射组斑马鱼ALT和AST较对照组发生一定程度的上升,而联合暴露组呈现进一步的显著上升趋势(与对照组相比,t=-0.14、-1.19、-5.10、-3.01,P<.05;与电离辐射组相比,t=-2.35、-2.55,P<.05;图 1C和1D)。说明300 μg/L四溴双酚A可显著损害斑马鱼肝脏功能,并使电离辐射导致的肝脏毒性进一步加重。
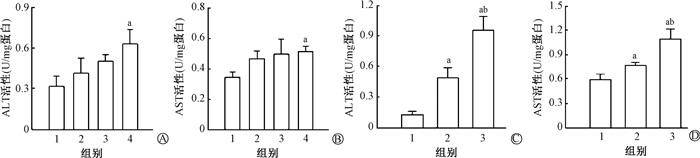
|
注:图A、B中,1. 对照组;2. 3 μg/L四溴双酚A组;3. 30 μg/L四溴双酚A组;4. 300 μg/L四溴双酚A组。图C、D中,1. 对照组;2. 电离辐射组;3. 电离辐射+四溴双酚A(300 μg/L)联合组。a与对照组比较,t=-2.22、-3.20、-0.14、-1.19、-5.10、-3.01,P<0.05;b与电离辐射组比较,t=-2.35、-2.55,P<0.05 图 1 四溴双酚A致斑马鱼肝脏毒性作用起效剂量筛选及与电离辐射联合暴露对肝脏功能的影响 A-B. 不同浓度的四溴双酚A对肝功酶ALT(A)和AST(B)活性的影响;C-D. 单纯电离辐射和电离辐射+四溴双酚A(300 μg/L)暴露对ALT(C)和AST(D) 活性的影响 Figure 1 Screening of initial effective dose of TBBPA that induces liver toxicity of zebrafish and effects of ionizing radiation (IR) + TBBPA on liver function A-B. Effects of different concentrations of TBBPA on the activities of liver enzymes ALT (A) and AST (B); C-D. Effects of IR and IR+TBBPA (300 μg/L) on the activities of ALT (C) and AST (D) |
2、不同浓度四溴双酚A与不同剂量电离辐射双重暴露对肝脏功能的影响
如表 2所示,10 Gy电离辐射暴露未能引起肝脏功能的显著改变,而60 μg/L四溴双酚A联合暴露即可引起肝脏辐射毒性的加重(60、300和1 500 μg/L联合组与对照组相比,t=-18.64 ~ -4.12,P<0.05;与电离辐射组相比,t=-12.27 ~ -2.53,P<0.05);从20 Gy电离辐射剂量起可诱导明显的肝功能下降,在此辐射剂量下从300 μg/L四溴双酚A浓度起联合暴露可加剧肝脏辐射毒性(60、300和1 500 μg/L联合组与对照组相比,t=-8.18 ~ -4.63,P<0.05;与电离辐射组相比,t=-5.22 ~ -2.79,P<0.05);在30 Gy电离辐射暴露条件下,1 500 μg/L的四溴双酚A暴露方可表现出对肝脏辐射毒性的加剧作用(60、300和1 500 μg/L联合组与对照组相比,t=-9.50 ~ -2.85,P<0.05;与电离辐射组相比,t=-4.52 ~ -0.84,P<0.05)。以上结果提示,在较低剂量电离辐射条件下,较低浓度四溴双酚A暴露可表现出对肝脏辐射毒性的加剧;在较高剂量电离辐射条件下,较低浓度四溴双酚A联合暴露对肝脏毒性升高,较高浓度四溴双酚A联合暴露表现出对肝脏辐射毒性作用加剧。
|
|
表 2 不同浓度四溴双酚A与不同剂量电离辐射双重暴露后肝功指标改变(μ/mg蛋白,x±s) Table 2 Changes in liver function indexes after dual exposure to TBBPA at different concentrations and IR at different doses (μ/mg蛋白, x±s) |
3、四溴双酚A对电离辐射诱导的斑马鱼肝脏氧化应激水平的影响
ROS、MDA和SOD水平检测发现,单纯电离辐射组上述标志物水平较对照组有一定程度的升高,而联合组呈现显著升高趋势(与对照组相比,t=-3.35 ~ -2.88,P<0.05;与电离辐射组相比,t=-2.87 ~ -2.38,P<0.05,表 3)。以上结果说明300 μg/L四溴双酚A暴露可导致电离辐射诱导的斑马鱼肝脏氧化应激作用进一步增强。
|
|
表 3 各组斑马鱼处理后肝脏氧化应激标志物水平改变(x±s) Table 3 Changes in oxidative stress markers in treated zebrafish livers of each group (x±s) |
4、四溴双酚A对电离辐射诱导的斑马鱼肝脏炎症水平的影响
单纯电离辐射组上述因子的mRNA表达水平较对照组有一定程度的升高,而联合组呈现显著升高趋势(TNF-α、IL-1β和Cox-2与对照组相比,t=-12.29 ~ -2.89,P<0.05;与电离辐射组相比,t=-4.40 ~ -2.65,P<0.05,表 4)。ELISA实验结果揭示,TNF-α、IL-1β和Cox-2的蛋白表达水平呈现相似的趋势(与对照组相比,t=-7.72 ~ -5.00,P<0.05;与电离辐射组相比,t=-2.83 ~ -2.31,P<0.05,表 4)。以上结果说明300 μg/L四溴双酚A暴露可加剧电离辐射诱导的斑马鱼肝脏炎症水平。
|
|
表 4 各组斑马鱼处理后肝脏炎症因子表达水平改变(x±s) Table 4 Changes in expression levels of pro-inflammatory cytokines in treated zebrafish livers of each group (x±s) |
5、四溴双酚A对电离辐射诱导的斑马鱼肝脏凋亡情况的影响
AO染色结果显示,暴露终点时单纯电离辐射组斑马鱼肝脏绿色荧光较对照组增强,四溴双酚A和电离辐射联合组斑马鱼肝脏的荧光强度较对照组和电离辐射组均明显增强,提示凋亡肝细胞增多,肝脏损伤加重(图 2)。QRT-PCR实验结果揭示,单纯电离辐射组斑马鱼肝脏的凋亡相关基因Caspase-8和Caspase-9的mRNA水平较对照组有一定程度的升高,而四溴双酚A和电离辐射联合组呈现显著升高趋势(与对照组相比,t=-5.17、-5.17,P<.05;与电离辐射组相比,t=-2.38、-2.39,P<.05,表 5)。ELISA实验结果揭示,Caspase-8和Caspase-9的蛋白表达水平呈现相似的趋势(与对照组相比,t=-5.90、-7.49,P<.05;与电离辐射组相比,t=-4.14、-3.81,P<.05,表 5)。上述结果表明300 μg/L四溴双酚A暴露可加剧电离辐射诱导的斑马鱼肝脏凋亡水平,从而加重肝细胞损伤。
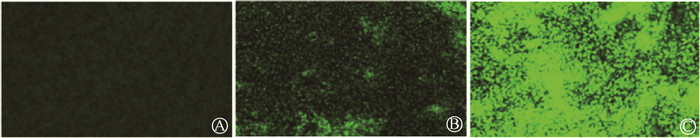
|
图 2 AO染色检测单纯电离辐射和电离辐射+四溴双酚A(300 μg/L)暴露对斑马鱼肝脏细胞凋亡情况的影响 A. 对照组;B. 电离辐射组;C. 电离辐射+四溴双酚A联合组 Figure 2 Effects of IR and IR+TBBPA (300 μg/L) on liver cell apoptosis of zebrafish by AO staining A. Control group; B. IR group; C. IR+TBBPA group |
|
|
表 5 各组斑马鱼处理后肝脏凋亡因子表达水平改变(x±s) Table 5 Changes in expression levels of pro-apoptotic factors in treated zebrafish livers of each group (x±s) |
6、四溴双酚A对电离辐射诱导的斑马鱼肝脏代谢组学特征的影响
如图 3A所示,对对照组、电离辐射组和电离辐射+四溴双酚A联合组斑马鱼肝脏代谢组学检测数据进行PLS-DA分析,显示3组区分明显,表明3组代谢轮廓存在显著差异。随机置换测试(n=200,R2Y=0.946,Q2Y=0.602)结果见图 3B,证明该评价模型具有良好的可信度和预测性,差异代谢物分析比较准确。以VIP≥1和P<0.05为评判标准,共鉴定到296种上调和534种下调的代谢离子(图 3C)。基于上述差异代谢离子,通过KEGG代谢通路富集分析,共鉴定到14条四溴双酚A处理加剧的电离辐射所致紊乱的关键代谢通路(图 3D)。上述代谢通路所包含的对照组、电离辐射组和电离辐射+四溴双酚A组之间持续上/下调的差异代谢物中,以D-葡萄糖酸、对甲酚和L-3-苯基乳酸富集最为明显(P<0.05)。

|
图 3 四溴双酚A对电离辐射诱导的斑马鱼肝脏代谢组学特征的影响 A. 对照组、电离辐射组和电离辐射+四溴双酚A(300 μg/L) 组斑马鱼肝脏代谢轮廓PLS-DA分析展示;B. PLS-DA模型随机置换测试(n=200);C. 对照组、电离辐射组和电离辐射+四溴双酚A (300 μg/L)联合组之间持续上/下调的差异代谢离子热图分析展示,1 ~ 6.各组经测试的样本编号;D. KEGG富集分析对照组、电离辐射组和电离辐射+四溴双酚A(300 μg/L)联合组之间持续上/下调的关键差异代谢通路 Figure 3 Effects of TBBPA on IR-induced liver metabolomic features of zebrafish A. PLS-DA analysis of liver metabolic profiles of zebrafish in the control, IR and IR+TBBPA (300 μg/L) groups; B. Random permutation tests of PLS-DA model (n=200); C. Heat map analysis of consistently up/down and differentially metabolized ions among the control, IR and IR+TBBPA (300 μg/L) groups; 1-6, number of samples tested in each group; D. KEGG enrichment analysis of consistently up/down metabolic pathways with key differences among the control, IR, and IR+TBBPA (300 μg/L) groups |
讨论
塑料泛滥和放射性污染均是威胁人类及非人类物种健康的重大公共卫生问题,因其危害严重而引起全球关切。在受微塑料污染的水体中,无论是淡水还是海水,一旦发生核泄漏,水生生物都将面临微塑料和放射性双重危害。在人类医疗领域,接受放射诊断或治疗的患者(例如需要放射治疗的癌症患者)也会不可避免地遭受来自饮食和医疗器械的微塑料暴露危害。然而,微塑料和电离辐射双重暴露对机体可能造成的健康风险尚不清楚,研究这一双重暴露产生的放射生物效应对维护物种多样性具有重要意义。斑马鱼肝脏结构和主要生理过程与哺乳动物高度相同[11-12],已被用作体内药物肝毒性筛选和环境污染物肝毒性评价的的通用模式生物[13-14]。因此,本研究基于斑马鱼成鱼模型,综合生化指标、氧化应激、炎症、凋亡水平检测及代谢组学分析等多种方法,评价了四溴双酚A对肝脏辐射毒性效应的影响,发现300 μg/L四溴双酚A暴露可加剧电离辐射诱导的斑马鱼肝脏毒性效应,包括使氧化应激、炎症和凋亡水平进一步升高等,且四溴双酚A加重了辐射导致的肝脏代谢紊乱。研究立足环境科学、生命科学及医学方向相互交叉的共同健康问题,警示了微塑料和放射性双重污染的严重性,与日常生产生活息息相关。
在实验设计中,于照射前用四溴双酚A对成年斑马鱼进行为期1 d的预处理,以模拟自然状态下突发核泄漏时,环境水体或饮用水已遭微塑料污染的真实情况。在四溴双酚A剂量筛选中,通过设置浓度梯度以确立四溴双酚A对斑马鱼肝脏的剂量-毒性关系。ALT和AST活性水平检测结果显示,300 μg/L为引发肝脏损伤的起效浓度,因此选择在此浓度(相对较低的显著性浓度)下探究四溴双酚A是否会加重照射后斑马鱼的肝脏毒性。在照射剂量选择中,根据文献报道采用了20 Gy的亚致死剂量(仅引起病理损伤而不导致死亡)处理斑马鱼[15]。炎症反应、氧化应激和细胞凋亡是电离辐射可诱发的典型生物效应,且炎症反应与氧化应激和细胞凋亡密切相关,高活性氧和DNA损伤水平可导致促炎因子(如TNF-α)的过表达,从而介导炎症水平的升高,炎症反应亦可通过对活性氧和DNA损伤的正反馈促进电离辐射直接和间接的生物效应[16-20]。因此,从上述3个方面对四溴双酚A影响肝脏辐射毒性的机制进行了初步探索,检测了相应标志物的变化趋势,发现其确实会加重斑马鱼肝脏辐射毒性效应。
非靶向代谢组学分析揭示,四溴双酚A加剧了电离辐射诱导的生物合成、降解及代谢等多条肝脏代谢通路的改变,在对照组、电离辐射组和电离辐射+四溴双酚A联合组3组间持续上/下调的差异代谢物主要为D-葡萄糖酸和对甲酚。其中,D-葡萄糖酸在多个差异代谢途径中均被富集,D-葡萄糖酸是D-葡萄糖醛基氧化的产物,而葡萄糖是体内主要的能源物质,通过有氧氧化和无氧糖酵解等途径为机体提供能量ATP。因此,D-葡萄糖酸含量的持续变化提示四溴双酚A可能进一步加重了斑马鱼肝脏能量代谢的紊乱。研究显示,游离或与蛋白结合的对甲酚通过调控MAPKs信号通路诱导细胞氧化应激,从而抑制其增殖[21-22]。由此提示,3组间含量持续变化的对甲酚可能通过影响肝脏的氧化应激水平介导四溴双酚A对辐照斑马鱼的肝脏毒性。
值得注意的是,尽管四溴双酚A和电离辐射的环境水平低于本研究中使用的水平,但由于生物累积和生物转化过程的存在,其长期和慢性毒性作用不可能完全避免。且现实情况中亦存在四溴双酚A或电离辐射高污染事件偶发的可能。因此,本研究结果仍值得在实际情况下借鉴。然而,这些污染物环境水平的毒理学效应仍应得到进一步研究和关注。
总之,该研究警示了微塑料-辐射双重暴露对水生生物生存危害的严重性,同时提示受辐照人员应尽量减少塑料生活器具的使用。研究结果为辐射损伤患者饮食指导原则的制定提供了实验基础和依据,为影响电离辐射损伤的因素再添新发现。
利益冲突 本研究由署名作者按以下贡献声明独立开展,未因进行该研究而接受任何不正当的职务或财务利益,不涉及任何利益冲突
作者贡献声明 张书琴负责实验的开展实施、数据整理和论文的撰写;尚悦、程雅佳负责协助实验开展、数据整理及论文的修改;朱彤、王周旋负责协助实验操作和论文校对;樊赛军负责论文的设计、实验的指导和论文的审阅
| [1] |
Tian S, Yan S, Meng Z, et al. New insights into bisphenols induced obesity in zebrafish (Danio rerio): Activation of cannabinoid receptor CB1[J]. J Hazard Mater, 2021, 418: 126100. DOI:10.1016/j.jhazmat.2021.126100 |
| [2] |
刘超, 张晓然, 刘俊峰, 等. 塑料制品中微塑料的释放行为及在环境中的迁移规律研究进展[J]. 环境工程, 2022, 40(5): 205-217. Liu C, Zhang XR, Liu JF, et al. Release of microplastics from plastic products and the environmrntal transport behaviors: a review[J]. Environ Engi, 2022, 40(5): 205-217. DOI:10.13205/j.hjgc.202205030 |
| [3] |
Thompson RC, Olsen Y, Mitchell RP, et al. Lost at sea: where is all the plastic?[J]. Science, 2004, 304(5672): 838. DOI:10.1126/science.1094559 |
| [4] |
Zhang K, Zheng S, Liang J, et al. Microplastic load of benthic fauna in Jiaozhou Bay, China[J]. Environ Pollut, 2023, 320: 121073. DOI:10.1016/j.envpol.2023.121073 |
| [5] |
Shang Y, Zhang S, Cheng Y, et al. Tetrabromobisphenol a exacerbates the overall radioactive hazard to zebrafish (Danio rerio)[J]. Environ Pollut, 2023, 316(Pt 2): 120424. DOI:10.1016/j.envpol.2022.120424 |
| [6] |
Leslie HA, Van Velzen MJM, Brandsma SH, et al. Discovery and quantification of plastic particle pollution in human blood[J]. Environ Int, 2022, 163: 107199. DOI:10.1016/j.envint.2022.107199 |
| [7] |
Jenner LC, Rotchell JM, Bennett RT, et al. Detection of microplastics in human lung tissue using muFTIR spectroscopy[J]. Sci Total Environ, 2022, 831: 154907. DOI:10.1016/j.scitotenv.2022.154907 |
| [8] |
Ragusa A, Svelato A, Santacroce C, et al. Plasticenta: first evidence of microplastics in human placenta[J]. Environ Int, 2021, 146: 106274. DOI:10.1016/j.envint.2020.106274 |
| [9] |
Pravalie R, Bandoc G. Nuclear energy: Between global electricity demand, worldwide decarbonisation imperativeness, and planetary environmental implications[J]. J Environ Manage, 2018, 209: 81-92. DOI:10.1016/j.jenvman.2017.12.043 |
| [10] |
Liu Y, Guo XQ, Li SW, et al. Discharge of treated Fukushima nuclear accident contaminated water: macroscopic and microscopic simulations[J]. Natl Sci Rev, 2022, 9(1): nwab209. DOI:10.1093/nsr/nwab209 |
| [11] |
Macedo WV, Duarte Oliveira GH, Zaiat M. Tetrabromobisphenol A (TBBPA) anaerobic biodegradation occurs during acidogenesis[J]. Chemosphere, 2021, 282: 130995. DOI:10.1016/j.chemosphere.2021.130995 |
| [12] |
Li Y, Dong M, Xiong Y, et al. Effects of postnatal exposure to tetrabromobisphenol A on testis development in mice and early key events[J]. Arch Toxicol, 2022, 96(6): 1881-1892. DOI:10.1007/s00204-022-03259-5 |
| [13] |
Miao B, Yakubu S, Zhu Q, et al. A review on Tetrabromobisphenol A: human biomonitoring, toxicity, detection and treatment in the environment[J]. Molecules, 2023, 28(6): 2505. DOI:10.3390/molecules28062505 |
| [14] |
Pang S, Gao Y, Li A, et al. Tetrabromobisphenol A perturbs erythropoiesis and impairs blood circulation in zebrafish embryos[J]. Environ Sci Technol, 2020, 54(20): 12998-13007. DOI:10.1021/acs.est.0c02934 |
| [15] |
Traver D, Winzeler A, Stern HM, et al. Effects of lethal irradiation in zebrafish and rescue by hematopoietic cell transplantation[J]. Blood, 2004, 104(5): 1298-1305. DOI:10.1182/blood-2004-01-0100 |
| [16] |
韩春山, 梁军, 姚如永. 电离辐射效应与细胞凋亡的调控研究进展[J]. 齐鲁医学杂志, 2004, 19(6): 556-557. Han CS, Liang J, Yao RY. Research progress on the effects of ionizing radiation and the regulation of cell apoptosis[J]. Med J Qilu, 2004, 19(6): 556-557. DOI:10.7538/tws.2022.youxian.044 |
| [17] |
Helm JS, Rudel RA. Adverse outcome pathways for ionizing radiation and breast cancer involve direct and indirect DNA damage, oxidative stress, inflammation, genomic instability, and interaction with hormonal regulation of the breast[J]. Arch Toxicol, 2020, 94(5): 1511-1549. DOI:10.1007/s00204-020-02752-z |
| [18] |
Hladik D, Tapio S. Effects of ionizing radiation on the mammalian brain[J]. Mutat Res Rev Mutat Res, 2016, 770(Pt B): 219-230. DOI:10.1016/j.mrrev.2016.08.003 |
| [19] |
Soliman AF, Anees LM, Ibrahim DM. Cardioprotective effect of zingerone against oxidative stress, inflammation, and apoptosis induced by cisplatin or gamma radiation in rats[J]. Naunyn Schmiedebergs Arch Pharmacol, 2018, 391(8): 819-832. DOI:10.1007/s00210-018-1506-4 |
| [20] |
Zhang J, Zheng Y, Hong B, et al. Dihydroquercetin composite nanofibrous membrane prevents UVA radiation-mediated inflammation, apoptosis and oxidative stress by modulating MAPKs/Nrf2 signaling in human epidermal keratinocytes[J]. Biomed Pharmacother, 2022, 155: 113727. DOI:10.1016/j.biopha.2022.113727 |
| [21] |
李莉. 对甲酚对人脐静脉内皮细胞增殖和细胞周期影响的研究[D]. 重庆: 第三军医大学, 2014. Li L. Protein-bound P-cresol inhibits human umbilical vein endothelial cell proliferation by cell cycle arrest at G0/G1[D]. Chongqing: The Third Millitary Medical University, 2014. |
| [22] |
林伟, 夏剑岚, 王毅. 尿毒症毒素硫酸盐对甲酚对血管内皮细胞的体外作用[J]. 解剖学报, 2014, 45(2): 216-220. Lin W, Xia JL, Wang Y. Effects of the uremic toxin p-cresylsulfate on human umbilical vein endotheilial cell function in vitro[J]. Acta Anat Sin, 2014, 45(2): 216-220. DOI:10.3969/j.issn.0529-1356.2014.02.013 |
 2024, Vol. 44
2024, Vol. 44


