2. 江阴市人民医院中西医结合肿瘤科, 江阴 214400;
3. 南通大学医学院, 南通 226000;
4. 江阴市人民医院放疗科, 江阴 214400;
5. 江阴市人民医院消化内科, 江阴 214400
2. Department of Integrative Medicine and Oncology, Jiangyin People's Hospital, Jiangyin 214400, China;
3. School of Medicine, Nantong University, Nantong 226000, China;
4. Department of Radiotherapy, Jiangyin People's Hospital, Jiangyin 214400, China;
5. Department of Gastroenterology, Jiangyin People's Hospital, Jiangyin 214400, China
急性放射性肠炎是腹盆腔肿瘤放射治疗后引起的常见并发症,放射可导致会阴部皮肤灼伤溃烂剥脱,肠黏膜损伤,绒毛破坏,患者表现为腹痛、腹泻、便血,严重影响日常生活,目前中药治疗该病有独特效果[1]。辐射可致肠道活性氧增多,氧化应激标志物丙二醛(MDA)含量升高,超氧化物歧化酶(SOD)活性和过氧化氢酶(CAT)表达降低[2]。PI3K/Akt通路参与多种生物学功能包括细胞增殖、分化、存活以及炎症[3-4]。PI3K/Akt信号通路是放射性肠炎的潜在治疗靶点,辐射可激活PI3K/Akt通路,照射小鼠肠道中Akt蛋白的磷酸化水平增加[5]。
目前临床常用于预防放射性肠炎的药物有益生菌制剂、放射防护剂和氨基水杨酸类等药物,然而中医药在该病的防治上更具优势[6-7]。针对放疗后的不良反应,临床使用清化凉血护络汤让盆腔外放射治疗患者同步服用取得了满意疗效。前期临床实践发现,清化凉血护络汤可以有效预防放射性肠炎的发生和减轻症状,动物实验也证实了清化凉血护络汤能改善大鼠急性放射性肠炎的症状,抑制炎症因子的表达,并减轻及修复肠道黏膜损伤[8]。但是否是通过PI3K/Akt信号通路发挥作用尚待研究,因此,本研究建立大鼠放射性肠炎和体外细胞辐射模型,进一步探讨该方在抗氧化损伤和抑制炎症方面的作用,以及治疗放射性肠炎的作用机制,为临床中药的推广应用提供实验依据。
材料与方法 1、动物与药物健康成年SPF级雄性SD大鼠36只,体重220~250 g,6~8周龄,由斯贝福(北京)生物技术有限公司提供,许可证号:SCXK(京)2019-0010。饲养环境温度20~25℃,相对湿度50%~65%。大鼠自助饮水和摄食,且有昼夜交替照明。清化凉血护络汤由沈伟生自拟,药方为黄柏10 g、苍术10 g、黄芩10 g、白芍30 g、老鹳草15 g、仙鹤草30 g、紫草30 g、红景天30 g、地榆10 g、败酱草15 g、大血藤30 g、马齿苋15 g组成(均为颗粒剂),由江阴天江药业有限公司提供。将所有药物混合,热水冲泡制成汤剂。人的用药剂量为235 g(总生药量)/60 kg(体重)=3.92 g/kg,根据人与动物体表面积换算出250 g大鼠灌胃的原药剂量为3.92 g/kg×6.3(大鼠与人每公斤体重剂量折算系数)×0.25 kg=6.17 g。以原药剂量作为高剂量组,剂量为24.68 g/kg,原药剂量稀释4倍为低剂量组,剂量6.17 g/kg。
2、试剂与仪器SOD、CAT、MDA、肿瘤坏死因子ɑ(TNF-ɑ)、白介素6(IL-6)、白介素1β(IL-1β)检测试剂盒购自北京索莱宝科技有限公司;TNF-ɑ、IL-6、IL-1β和GAPDH引物购自上海生工生物工程有限公司;PI3K和p-PI3K(phospho-PI3KCA)抗体购自北京博奥森公司;Akt、p-Akt、GAPDH抗体和羊抗兔二抗购自武汉三鹰生物技术有限公司;BCA蛋白浓度试剂盒购自上海碧云天生物技术有限公司;IEC-6细胞购自于上海中乔新舟生物科技有限公司。Synergy直线加速器购自瑞典医科达医疗器械有限公司;多功能酶标仪为美国Bio-rad公司生产;化学发光成像系统为美国Bio-rad公司生产。
3、动物模型建立将所有大鼠按随机区组法分为对照组、模型组、低剂量组、高剂量组,每组9只。适应性饲养7 d后进行实验。对照组为正常大鼠,模型组、低剂量组、高剂量组大鼠放射性肠炎模型按前期研究中的方法构建[8],以6 MV X射线照射大鼠腹部(耻骨联合至肛门),照射野面积2 cm × 5 cm,源皮距100 cm,总剂量17.5 Gy。给药大鼠照射前给予清化凉血护络汤连续灌胃7 d,2次/d,一次1 ml,对照组和模型组等体积生理盐水灌胃。照射当天6 h后灌胃,之后连续给药7 d后处死大鼠,每组各取6只大鼠照射部位约2 cm的直肠组织,一半置于液氮中,另一半置于TRIzol中并转移至-80℃保存。
4、细胞培养与分组IEC-6细胞用含有10%胎牛血清(FBS)和10 μg/ml胰岛素的DMEM完全培养基培养,培养于37℃、5% CO2细胞培养箱中,待细胞融合度80%后进行传代培养。取正常大鼠动脉血,离心半径8 cm,3 500 r/min,离心10 min制成空白血清,取高剂量组大鼠动脉血相同离心条件制成含药血清。将细胞分为对照组、辐射组、空白组和给药组,对照组为正常细胞不作处理,其余各组细胞都接受10 Gy单次剂量照射,空白组为培养液中含10%空白血清,给药组为培养液中加入10%含药血清。
5、氧化应激指标和炎症因子表达检测各组取部分直肠组织在冰上用组织研磨器研磨成10%的组织匀浆液,离心半径3 cm,3 000 r/min,4℃离心15 min取上清液检测。按照说明书步骤采用ELISA检测各组大鼠直肠组织匀浆液中SOD活性、CAT表达及MDA含量;收集各组细胞上清液,检测各组细胞培养液上清中TNF-ɑ、IL-6和IL-1β含量。
6、qRT-PCR检测取部分照射部位直肠组织,PBS清洗后,剪碎并称取破碎直肠100 mg加入液氮碾磨成粉末状,置于玻璃匀浆管中,加入1 ml TRIzol混匀,玻璃匀浆器冰点匀浆。将匀浆液移入2 ml离心管中,提取直肠组织总RNA,按照PrimeScript RT Reagent Kit说明书配制反转录体系,反转录成cDNA,使用Bio-Rad′s CFX96实时荧光定量PCR系统进行扩增,反应体系的配制和反应条件参照SYBR ® Premix Ex Taq Ⅱ说明书,引物序列见表 1。内参照基因使用GAPDH,以2-ΔΔCt法计算目的基因mRNA相对表达量。
|
|
表 1 各基因引物序列 Table 1 Primer sequences of various genes |
7、Western blot检测
每组大鼠各取部分照射部位直肠组织按照BCA蛋白浓度试剂盒说明提取直肠组织总蛋白,每孔配制含30 μg总蛋白经10%聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,浓缩胶80 V 30 min,分离胶120 V 60 min,之后恒流250 mA湿转90 min到PVDF膜后,于5%脱脂奶粉封闭液封闭2 h,依次孵育一抗4℃过夜和二抗抗体室温1 h。PI3K、Akt、p-PI3K、p-Akt和GAPDH的一抗稀释比例分别为1∶1 000、1∶1 000、1∶500、1∶500、1∶2 000,二抗稀释比例为1∶4 000。电化学发光(ECL)试剂A和B液等比例混合后平铺于膜上,并置于ECL成像系统中反应曝光,显影后用Image lab图像处理系统分析目标蛋白条带的灰度值,以GADPH作内参照对比得到的相对灰度值进行分析。
8、统计学处理数据采用GraphPad Prism 9.0软件进行统计分析和作图,符合正态分布的计量资料以x±s表示,两组间均数比较采用独立样本t检验。P<0.05为差异具有统计学意义。
结果 1、各组大鼠肛周和粪便情况照射后第7天模型组肠黏膜损伤最严重,低剂量组和高剂量组表现为轻微黏膜下组织水肿和少量炎性细胞浸润。对照组大鼠肛周皮毛正常,大便正常;模型组肛周有大量黄色粘液,稀便或水样便;低剂量组和高剂量组肛周有少量粘液,大便尚成形。
2、清化凉血护络汤对大鼠放射性肠炎直肠组织中的氧化应激影响与对照组相比,模型组SOD和CAT的表达显著下降,MDA的表达显著升高,两组差异具有统计学意义(t=11.01、19.09、9.18,P<0.05);与模型组相比,低剂量组和高剂量组SOD和CAT的表达均显著上升,MDA的表达均显著下降,差异具有统计学意义(t=4.86、8.72、6.94、8.50、14.28、10.66,P<0.05);与低剂量组相比,高剂量组SOD、CAT和MDA的表达差异具有统计学意义(t=2.91、9.35、5.47,P<0.05),见表 2。以上结果提示清化凉血护络汤可减轻大鼠放射性肠炎直肠组织中的氧化应激反应。
|
|
表 2 各组大鼠氧化应激水平的比较(x±s) Table 2 Comparison of oxidative stress levels of rats in various groups (x±s) |
3、清化凉血护络汤对大鼠放射性肠炎直肠组织中炎症因子mRNA表达的调节
与对照组相比,模型组TNF-ɑ、IL-6和IL-1β的mRNA水平表达均明显升高,差异具有统计学意义(t=9.89、5.25、10.98,P<0.05);与模型组相比,低剂量组和高剂量组TNF-ɑ、IL-6和IL-1β的mRNA水平表达均明显下降,差异具有统计学意义(t=5.60、2.95、4.31、9.16、4.66、13.35,P<0.05);与低剂量组相比,高剂量组TNF-ɑ、IL-6和IL-1β的mRNA表达差异具有统计学意义(t=3.17、2.94、11.47,P<0.05),见表 3。表明清化凉血护络汤可抑制大鼠放射性肠炎直肠组织中的炎症因子mRNA水平表达。
|
|
表 3 各组大鼠炎症因子mRNA表达的比较(x±s) Table 3 Comparison of the mRNA expressions of inflammatory factors in rats of various groups(x±s) |
4、清化凉血护络汤对大鼠放射性肠炎直肠组织中PI3K/Akt信号通路表达的影响
Western blot检测结果见图 1,与对照组相比,模型组直肠组织中p-PI3K/PI3K和p-Akt/Akt比值均升高,差异具有统计学意义(t=11.00、16.61,P<0.05);而低剂量组和高剂量组与模型组相比,直肠组织中p-PI3K/PI3K和p-Akt/Akt比值均降低,差异具有统计学意义(t=22.35、13.56、18.23、13.85,P<0.05)。提示清化凉血护络汤可以抑制大鼠放射性肠炎直肠组织中PI3K/Akt信号通路的激活。
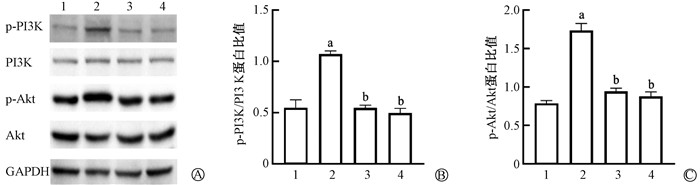
|
注:1. 对照组;2. 模型组;3. 低剂量组;4. 高剂量组。a与对照组比较,t=11.00、16.61,P<0.05;b与模型组比较,t=22.35、13.56、18.23、13.85,P<0.05 图 1 清化凉血护络汤对大鼠放射性肠炎直肠组织中PI3K/Akt信号通路表达的影响 A. p-PI3K、PI3K、p-Akt、Akt蛋白表达;B. p-PI3K/PI3K蛋白比值;C. p-Akt/Akt蛋白比值 Figure 1 Impacts of Qinghua Liangxue Huluo Decoction on the expression of the PI3K/Akt signaling pathway in rectal tissues of rats with radiation enteritis A. Expressions of p-PI3K, PI3K, p-Akt, and Akt proteins; B. Ratio of p-PI3K/PI3K proteins; C. Ratio of p-Akt/Akt proteins |
5、清化凉血护络汤对大鼠肠上皮细胞辐射后氧化应激的影响
与对照组相比,IEC-6辐射组上清中SOD和CAT的含量明显降低,MDA的含量明显升高,差异具有统计学意义(t=11.85、19.92、20.30,P<0.05)。与辐射组相比,给药组能显著提升辐射后SOD和CAT的水平,降低MDA的水平,差异具有统计学意义(t=6.85、10.44、10.44,P<0.05)。
|
|
表 4 各组细胞氧化应激水平的比较(x±s) Table 4 Comparison of oxidative stress levels in rats of various groups (x±s) |
6、清化凉血护络汤对大鼠肠上皮细胞辐射后炎症因子的影响
与对照组相比,IEC-6细胞辐射组上清中TNF-ɑ、IL-6和IL-1β的表达均明显升高,差异具有统计学意义(t=39.05、48.54、65.17,P<0.05)。与辐射组相比,给药组能显著抑制辐射后细胞上清中TNF-ɑ、IL-6和IL-1β的表达上升,差异具有统计学意义(t=12.07、6.87、14.80,P<0.05)。
|
|
表 5 各组细胞炎症因子的比较(x±s) Table 5 Comparison of inflammatory factors levels in rats of various groups(x±s) |
7、清化凉血护络汤对辐射后大鼠肠上皮细胞中PI3K/Akt信号通路表达的影响
Western blot检测结果见图 2,与对照组相比较,辐射组细胞中p-PI3K/PI3K和p-Akt/Akt比值均升高,差异具有统计学意义(t=12.06、12.17,P<0.05);而给药组与辐射组相比,细胞中p-PI3K/PI3K和p-Akt/Akt比值均降低,差异具有统计学意义(t=10.95、5.59,P<0.05)。提示清化凉血护络汤可以抑制大鼠肠上皮细胞辐射后PI3K/Akt信号通路的激活。
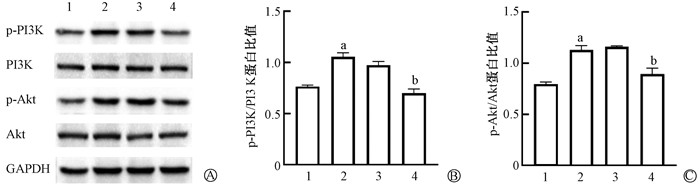
|
注:1. 对照组;2. 辐射组;3. 空白组;4. 给药组; a与对照组比较,t=12.06、12.17,P<0.05;b与模型组比较,t=10.95、5.59,P<0.05 图 2 清化凉血护络汤对大鼠肠上皮细胞辐射后PI3K/Akt信号通路表达的影响 A. p-PI3K、PI3K、p-Akt、Akt蛋白表达;B. p-PI3K/PI3K蛋白比值;C. p-Akt/Akt蛋白比值 Figure 2 Impacts of Qinghua Liangxue Huluo Decoction on the expression of the PI3K/Akt signaling pathway in intestinal epithelial cells of rats after radiation A. Expressions of p-PI3K, PI3K, p-Akt, and Akt Proteins; B. Ratio of p-PI3K/PI3K proteins; C. Ratio of p-Akt/Akt proteins |
讨论
急性放射性肠炎常累及小肠及直肠,目前缺乏有效防治手段。急性放射性肠炎发生机制较为复杂,氧化应激反应是放射性肠炎发生发展的重要过程。电离辐射产生大量的氧自由基可通过直接攻击作用或氧化作用造成DNA及蛋白质等生物大分子的损伤,从而造成肠组织损伤和引发炎症[10]。SOD和CAT作为抗氧化酶,具有清除活性氧自由基,抗脂质过氧化损伤能力,防护肠道辐射损伤的功效[11]。MDA是脂质过氧化的标记物,其含量间接反映了氧化损伤的程度,辐射后可通过增加肠组织MDA水平来诱导氧化应激[12]。本研究从动物和细胞两个方面进行探讨,发现清化凉血护络汤能升高辐射后大鼠直肠组织和肠上皮细胞培养上清中SOD和CAT的活性和降低MDA含量。上述结果提示该方可以预防辐射诱导的氧化应激,提高受照大鼠直肠组织对氧化应激的抑制作用,对肠黏膜的损伤具有重要的保护作用。
课题组前期研究验证了清化凉血护络汤对大鼠放射性肠炎的预防作用,但未阐明其可能参与的信号通路途径,因此课题组通过网络药理学辨识该方的有效成分,预测了相关作用通路等信息,其中PI3K/Akt通路相关性评分较高。PI3K/Akt通路参与辐射诱导的肠道损伤,辐射可以激活PI3K进而催化调控活化的Akt易位和磷酸化[5]。同时有研究表明,辐射大鼠肠上皮细胞中PI3K、Akt蛋白的磷酸化水平增加[13-14]。本研究进一步证明了PI3K/Akt通路可能在清化凉血护络汤预防辐射诱导的放射性肠炎中有重要作用,辐射后肠道中p-PI3K和p-AKT蛋白表达上调受到该方的抑制,同样辐射后肠上皮细胞中的PI3K/Akt信号通路激活也被该方阻断。一方面,PI3K/Akt信号通路与辐射诱导的氧化应激损伤相关。辐射诱导促进氧化应激和自噬的下调可以通过PI3K/Akt信号激活的mTOR协同工作,改变肠道的功能和对辐射后慢性胃肠道疾病的影响[5]。白藜芦醇可以通过负向调控SIRT1/FOXO3A和PI3K/AKT途径抑制氧化应激和凋亡来减少辐射诱导的肠损伤[15]。另一方面,PI3K/Akt信号通路还参与调节辐射诱导的炎症因子表达。白藜芦醇可以通过抑制PI3K/Akt/mTOR通路有效地减弱与大鼠放射性肠炎相关的多种炎症因子表达[16]。大补脾汤可抑制与大鼠放射性肺损伤相关的炎症因子表达,其机制与调控PI3K/Akt信号通路相关[17]。课题组前期研究发现大鼠放射性肠炎建模后在第7天损伤最严重,血清中炎症因子的含量最高[8],本研究又进一步检测了该方对大鼠放射性肠炎直肠组织中炎症因子表达的抑制作用。综上所述,推测清化凉血护络汤可能通过抑制PI3K/Akt通路减轻氧化应激反应和炎症因子表达。本研究结果为靶向PI3K/Akt通路作为防治辐射诱导的肠道损伤提供了必要的理论基础。
总之,清化凉血护络汤能够通过抑制PI3K/Akt通路改善辐射诱导的氧化应激反应和炎症因子表达,从而减轻大鼠放射性肠炎的症状。本研究结果支持清化凉血护络汤可以作为一种有希望的放疗辅助药物,减轻放射后肠道并发症,从而提高治疗的安全性。这项研究仍然需要得到进一步临床研究的支持。关于其更深的作用机制有待于下一步从细胞学、分子水平进行多层次、多方面的探索。
利益冲突 无
作者贡献声明 朱琳负责实验操作、数据采集、统计分析;张婷、李愈协助实验操作;殷华芳、沈伟生给予实验内容建议并参与论文修改;王坚指导实验方法和论文修改;沈卫东指导课题设计
| [1] |
王闯闯, 宁洪鑫, 李航, 等. 中药单体防治放射性肠损伤的作用及机制研究进展[J]. 中国中药杂志, 2023, 48(14): 3743-3752. Wang CC, Ning HX, Li H, et al. Research progress in prevention and treatment of radiation-induced intestinal injury by traditional Chinese medicine active components[J]. China J Chin Mater Med, 2023, 48(14): 3743-3752. DOI:10.19540/j.cnki.cjcmm.20230411.602 |
| [2] |
许杰, 周雅丽, 王文, 等. 重组人ADMTS13通过调节炎症和氧化应激水平改善放射性肠损伤[J]. 中华放射医学与防护杂志, 2022, 42(6): 416-421. Xu J, Zhou YL, Wang W, et al. Recombinant human ADMTS13 improves radiation intestinal damage by regulating inflammation and oxidative stress level[J]. Chin J Radiol Med Prot, 2022, 42(6): 416-421. DOI:10.3760/cma.j.cn112271-20220125-00033 |
| [3] |
Lu R, He Z, Zhang W, et al. Oroxin B alleviates osteoarthritis through anti-inflammation and inhibition of PI3K/AKT/mTOR signaling pathway and enhancement of autophagy[J]. Front Endocrinol (Lausanne), 2022, 13: 1060721. DOI:10.3389/fendo.2022.1060721 |
| [4] |
Xie S, Chen M, Yan B, et al. Identification of a role for the PI3K/AKT/mTOR signaling pathway in innate immune cells[J]. PLoS One, 2014, 9(4): e94496. DOI:10.1371/journal.pone.0094496 |
| [5] |
Datta K, Suman S, Fornace AJ Jr. Radiation persistently promoted oxidative stress, activated mTOR via PI3K/Akt, and downregulated autophagy pathway in mouse intestine[J]. Int J Biochem Cell Biol, 2014, 57: 167-176. DOI:10.1016/j.biocel.2014.10.022 |
| [6] |
张丽娟, 燕忠生. 放射性肠炎的发病相关因素及预防研究进展[J]. 临床医学研究与实践, 2022, 7(2): 196-198. Zhang LJ, Yan ZS. Research progress on pathogenesis related factors and prevention of radiation enteritis[J]. Clin Med Res Pract, 2022, 7(2): 196-198. DOI:10.19347/j.cnki.2096-1413.202202059 |
| [7] |
袁庆延, 丁曙晴. 中医药防治放射性肠炎研究进展[J]. 世界中医药, 2016, 11(11): 2490-2494, 2499. Yuan QY, Ding SQ. Research progress on prevention and treatment of radiation enteritis by Chinese medicine[J]. World Chin Med, 2016, 11(11): 2490-2494, 2499. DOI:10.3969/j.issn.1673-7202.2016.11.074 |
| [8] |
董豆, 朱琳, 王坚, 等. 清化凉血护络汤预防大鼠急性放射性肠炎的作用及机制研究[J]. 东南大学学报(医学版), 2019, 42(2): 305-311. Dong D, Zhu L, Wang J, et al. Effect and mechanism of Qinghua Liangxue Huluo Decoction on prevention of acute radiation enteritis in rats[J]. J Southeast Univ (Med Sci Edit), 2019, 42(2): 305-311. DOI:10.3969/j.issn.1671-6264.2023.02.021 |
| [9] |
Korkut C, Asoglu O, Aksoy M, et al. Histopathological comparison of topical therapy modalities for acute radiation proctitis in an experimental rat model[J]. World J Gastroenterol, 2006, 12(30): 4879-4883. DOI:10.3748/wjg.v12.i30.4879 |
| [10] |
吴雨珊, 宋依杰, 王冰. 放射性肠炎的病理机制、治疗策略及药物研究进展[J]. 中国现代应用药学, 2022, 39(2): 277-284. Wu YS, Song YJ, Wang B. Research progress in pathogenesis, treatment strategy and drugs of radiation enteritis[J]. Chin J Mod Appl Pharmacol, 2022, 39(2): 277-284. DOI:10.13748/j.cnki.issn1007-7693.2022.02.023 |
| [11] |
Musa AE, Shabeeb D, Alhilfi H. Protective effect of melatonin against radiotherapy-induced small intestinal oxidative stress: Biochemical evaluation[J]. Medicina (Kaunas), 2019, 55(6): 308. DOI:10.3390/medicina55060308 |
| [12] |
Li Z, Gao Y, Du L, et al. Anti-inflammatory and anti-apoptotic effects of Shaoyao decoction on X-ray radiation-induced enteritis of C57BL/6 mice[J]. J Ethnopharmacol, 2022, 292: 115158. DOI:10.1016/j.jep.2022.115158 |
| [13] |
Qin H, Zhang H, Zhang X, et al. Resveratrol protects intestinal epithelial cells against radiation-induced damage by promoting autophagy and inhibiting apoptosis through SIRT1 activation[J]. J Radiat Res, 2021, 62(4): 574-581. DOI:10.1093/jrr/rrab035 |
| [14] |
Wang Y, Su P, Zhuo Z, et al. Ginsenoside Rk1 attenuates radiation-induced intestinal injury through the PI3K/AKT/mTOR pathway[J]. Biochem Biophys Res Commun, 2023, 643: 111-120. DOI:10.1016/j.bbrc.2022.12.072 |
| [15] |
Qin H, Zhang H, Zhang X, et al. Resveratrol attenuates radiation enteritis through the SIRT1/FOXO3a and PI3K/AKT signaling pathways[J]. Biochem Biophys Res Commun, 2021, 554: 199-205. DOI:10.1016/j.bbrc.2021.03.122 |
| [16] |
Radwan RR, Karam HM. Resveratrol attenuates intestinal injury in irradiated rats via PI3K/Akt/mTOR signaling pathway[J]. Environ Toxicol, 2020, 35(2): 223-230. DOI:10.1002/tox.22859 |
| [17] |
张朝宁, 余臣祖. 敦煌医学古方大补脾汤对放射性肺损伤大鼠PI3K/Akt信号通路的影响[J]. 中国中医药信息杂志, 2021, 28(11): 51-55. Zhang CN, Yu CZ. Effect of Dabupi Decoction on PI3K/Akt signaling pathway in rats with radiation lung injury[J]. China Inform J Tradit Chin Med, 2021, 28(11): 51-55. DOI:10.19879/j.cnki.1005-5304.202102320 |
 2024, Vol. 44
2024, Vol. 44


