日光中的中波紫外线(ultraviolet B, UVB)过度或长期暴露会导致皮肤细胞的损伤,甚至引发多种皮肤疾病[1]。针对UVB辐射诱导皮肤损伤的治疗,现有的药物主要用于缓解紫外线引起的红斑、疼痛和瘙痒等症状,但不能缩短晒伤修复时间,且尚无特异性靶向治疗药物能够完全治愈皮肤损伤[2]。因此,研发对UVB辐射引起的皮肤损伤的新型防治药物对维护皮肤健康具有重要意义。
N6-甲基腺苷(m6A)是RNA分子上最普遍和最丰富的修饰,是一种调控RNA代谢的新机制,对调节细胞生长、分化和响应环境刺激起着关键作用[3]。已有研究表明,RNA m6A修饰参与UVB辐射应激反应[4],但关于RNA m6A甲基转移酶METTL14在UVB辐射诱导皮肤损伤中的具体调控作用及机制尚未完全明确,针对METTL14为靶点的UVB所致皮肤损伤的精准干预策略也少有报道。
本研究拟探讨METTL14在UVB诱导皮肤损伤辐射敏感性的调控作用,并初步探讨靶向抑制METTL14干预UVB诱导小鼠皮肤损伤的可行性,为预防和治疗紫外线皮肤辐射损伤及研发新型制剂提供更加完善的实验依据。
材料与方法 1、主要试剂二喹啉甲酸(BCA)蛋白检测试剂盒、10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)配制试剂盒、二抗山羊抗兔和山羊抗小鼠抗体购于上海碧云天生物技术公司。Flag、METTL14抗体购于美国Immunoway公司,GAPDH购于美国Proteintech公司,CCK-8试剂盒购于苏州新赛美公司,脱毛膏购于法国Veet公司,m6A RNA甲基化定量检测试剂盒购于美国Abcam公司,RNA快速提取试剂盒购于上海奕杉生物公司,S-腺苷同型半胱氨酸(SAH)购于美国MedChemexpress公司。
2、实验动物分组及照射SPF级6~8周龄雌性C57BL/6J小鼠,15~20 g,合格证号:20231108Abzz0619000906,购于北京维通利华实验动物有限公司,适应性饲养1周,按随机数表法将小鼠分为4组,每组4只:健康对照组、单纯照射组、生理盐水组、给药组(1和5 mg/kg SAH组)。除健康对照组不给予UVB照射,其余各组给予150 mJ/cm2 UVB照射[5]。生理盐水组和给药组在照前和照后连续两次分别皮下注射生理盐水或不同浓度的SAH溶液200 μl,连续观察至小鼠皮肤损伤愈合。采用法国Bio-Sun紫外线辐照仪,选择发射光谱波长为312 nm的UVB灯。该动物实验伦理由苏州大学实验动物中心医学伦理委员会审核通过(伦理号:202311A0038)。
3、UVB辐射小鼠皮肤损伤的评分标准参照文献[6],根据红斑颜色、皮肤肿胀和硬化程度以及皮肤破坏情况,采用0~3分客观评分。其中,0分:照射前的皮肤;1分:皮肤呈粉色,略微肿胀,轻微糜烂;2分:皮肤呈红色,轻微硬化,渗出;3分:皮肤呈深红色,硬化,溃疡。综合考虑上述各项评分,对小鼠皮肤UVB辐射损伤的程度进行综合评估。
4、苏木素-伊红(HE)染色和马松(Masson)染色按照HE染色试剂盒和Masson染色试剂盒(北京索莱宝公司)说明书染色。使用光学显微镜(日本Olympus, IX73)观察并做图像采集分析。
5、细胞培养与UVB照射人永生化角质形成细胞HaCaT购自德国DSMZ公司,人皮肤成纤维细胞株WS1购自美国ATCC公司,并由本实验室保存。DMEM高糖培养基、胎牛血清(FBS)购自美国HyClone公司。细胞培养于含10%胎牛血清,1%青霉素-链霉素的DMEM培养基中,于5% CO2、37℃条件下培养,每2天换液,2~3 d传代。UVB照射采用日本SANKYO DENKI UVB灯,发射波长为280~320 nm,照射距离约为20 cm,光强0.6 mw/cm2,照射剂量采用韩国Genuv紫外线辐射计校准。
6、细胞实验分组将细胞分为空白组(不做任何处理)、照射组(给予UVB照射),对照组(对照腺病毒转染的皮肤细胞)、过表达组(过表达METTL14腺病毒转染的皮肤细胞)。根据HaCaT和WS1细胞的辐射敏感性不同,分别施加10和30 mJ/cm2的UVB照射剂量。
7、细胞存活检测将处于对数生长期的HaCaT和WS1细胞,调整其浓度以200 μl/孔接种于96孔板中,将培养板置于37℃培养箱中培养,待24 h长满至70%~80%,进行UVB照射,分别在辐照后24 h每孔加入CCK-8溶液,培养箱中孵育1 h后,用酶标仪检测450 nm处的吸光度(A),并计算细胞的相对存活率,存活率(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
8、RNA m6A水平检测利用RNA快速提取试剂盒提取皮肤细胞的总RNA,动物组织经TRIzol法提取总RNA,使用美国Thermo Fisher公司NanoDrop 2000c仪器检测RNA浓度和A260/A280比值。使用m6A RNA甲基化定量检测试剂盒检测总RNA m6A水平,使用酶标仪在450 nm处检测吸光度,根据阳性标准品和阴性对照标准品计算总RNA的m6A百分比:m6A(%)=(样品A值-阴性对照A值)/[样本RNA输入量/(阳性对照A值-阴性对照A值)]/阳性对照输入量×100%。
9、Western blot检测加入细胞裂解液提取细胞的总蛋白,用BCA法测定蛋白浓度。10%的SDS-PAGE凝胶中进行电泳分离,并将蛋白转移到聚偏二氟乙烯(PVDF)膜,BSA封闭。将膜分别与一抗在4℃摇床下孵育过夜。用磷酸盐吐温缓冲液(PBST)洗膜3次,加入二抗室温孵育1 h,使用电化学发光(ECL)试剂盒显影。采用Image J软件分析目的蛋白表达水平。
10、重组腺病毒感染过表达METTL14腺病毒载体由济南维真生物科技公司设计并合成,腺病毒过表达载体为pAdM-FH,元件顺序为:CMV-Flag-6xHis-SV40pA-loxP。取对数生长期的细胞进行消化离心,采用离心半径8.3 cm,1 000 r/min,离心5 min后弃上清获取细胞沉淀,重悬后接种于60 mm的培养皿,细胞的融合率为50%左右,根据最佳感染复数(MOI)值稀释腺病毒原液后进行转染,感染24 h后,通过Western blot检测目的基因的表达。
11、克隆形成实验将处于对数生长期的皮肤细胞接种于6孔板中,分别进行0、5、10 mJ/cm2的UVB照射。继续培养10~14 d,培养皿中会出现肉眼可见的细胞克隆团,终止培养。经结晶紫染色后统计克隆细胞的数量,计算克隆细胞存活率并进行拍照。公式为:克隆存活率(%)=过表达组克隆数/对照组克隆数×100%。
12、流式细胞术分析细胞凋亡率采用流式细胞术进行检测。将处于对数生长期的皮肤细胞接种于6孔板中,24 h后进行UVB照射,放入培养箱中继续培养48 h。到达时间点后收集上清液和消化的细胞悬液,按照凋亡检测试剂盒(杭州联科生物公司)说明书制样,流式细胞仪(美国BD公司, FACSVerse)检测细胞凋亡率。
13、统计学处理采用SPSS 24.0软件进行统计学分析,数据符合正态分布,用x±s表示,组间比较使用两独立样本t检验。P<0.05为差异具有统计学意义。
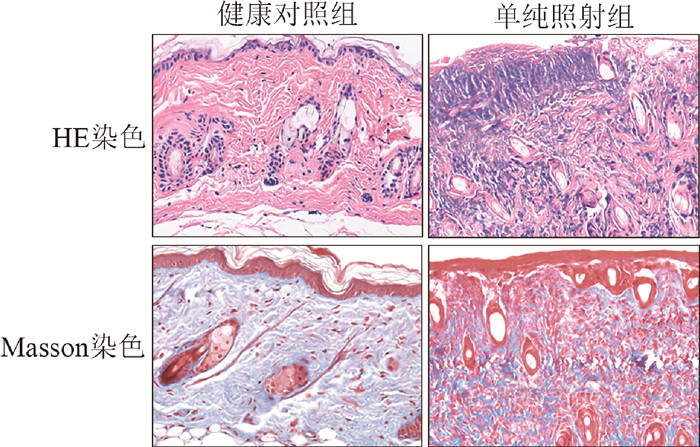
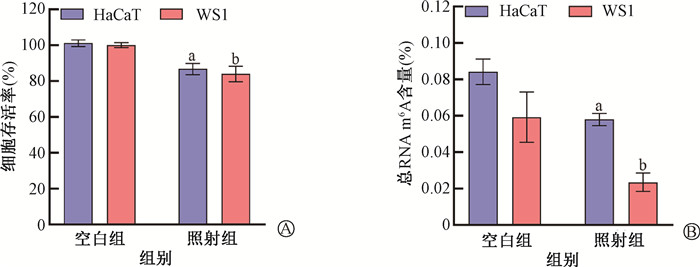
结果 1、RNA m6A甲基化修饰水平与UVB诱导皮肤损伤相关建立UVB诱导皮肤辐射损伤模型,依据UVB辐射诱导皮肤损伤标准进行评分比较。150 mJ/cm2 UVB照射后48 h,单纯照射组皮肤呈现明显的红斑和轻微肿胀表现。在照射后的第4天,损伤程度明显加重,表现为深红色、皮肤硬化、焦痂和溃疡症状。UVB辐射诱导皮肤损伤评分随着照射后时间的延长,皮肤损伤逐渐加重,照射后第4天达到极点,之后逐渐恢复。图 1显示,单纯照射组真皮及皮下脂肪可见致密的炎症细胞浸润,组织结构紊乱,胶原纤维断裂,紊乱,含量减少。HaCaT细胞10 mJ/cm2,WS1细胞30 mJ/cm2 UVB照射下,细胞存活率明显降低(图 2A,t=7.64、7.15,P<0.05)。UVB照射后24 h HaCaT和WS1细胞m6A水平显著降低(t=4.78、4.36;图 2B),150 mJ/cm2 UVB照射后第4天与健康对照组小鼠相比,皮肤组织总RNA m6A含量下调,分别为0.18%和0.16%(t=3.07,P<0.05)。
|
图 1 150 mJ/cm2 UVB照射后第4天小鼠皮肤组织的病理改变和胶原蛋白分布 ×100 Figure 1 The pathological changes and collagen distribution of mice skin tissues on the fourth day after 150 mJ/cm2 UVB radiation ×100 |
|
注:a与HaCaT细胞空白组比较,t=7.64、4.78,P<0.05;b与WS1细胞空白组比较,t=7.15、4.36,P<0.05 图 2 UVB照射后24 h对皮肤细胞HaCaT和WS1存活和总RNA m6A水平的影响 A. 细胞存活率;B. 总RNA m6A水平 Figure 2 Effects of UVB irradiation on skin cell survival and total RNA m6A levels 24 h after exposure A. Cell survival rates; B. Total RNA m6A levels |
2、甲基转移酶METTL14在UVB辐射诱导皮肤损伤中的变化
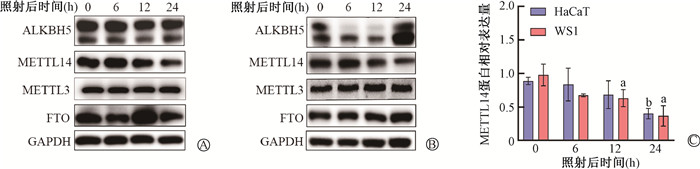
HaCaT和WS1细胞分别给予10、30 mJ/cm2 UVB照射后的不同时间点m6A相关酶的表达情况(图 3A、3B),随着照射后时间的推移,METTL14蛋白表达降低,呈现时间依赖性,而其他m6A相关蛋白酶无时间依赖性变化(t=6.39、2.93、4.76,P<0.05;图 3C),提示METTL14可能参与UVB辐射诱导皮肤损伤,调控UVB辐射后皮肤细胞m6A水平降低。
|
注:a与HaCaT细胞空白组比较,t=2.93,P<0.05;b与WS1细胞空白组比较,t=6.39、4.76,P<0.05 图 3 UVB照射后不同时间皮肤细胞m6A相关蛋白的表达 A. HaCaT细胞在10 mJ/cm2 UVB照射后不同时间m6A相关酶的表达情况;B. WS1细胞在30 mJ/cm2 UVB照射后不同时间m6A相关酶的表达情况;C. HaCaT和WS1细胞METTL14蛋白表达随辐照后时间变化的定量分析 Figure 3 Expression of m6A-related proteins in skin cells at different times after UVB irradiation A. Expression of m6A-related proteins in HaCaT cells at different times after 10 mJ/cm2 UVB irradiation; B. Expression of m6A-related proteins in WS1 cells at different times after 30 mJ/cm2 UVB irradiation; C. Quantitative analysis of METTL14 expression with time after irradiation |
3、METTL14过表达促进UVB诱导的皮肤损伤
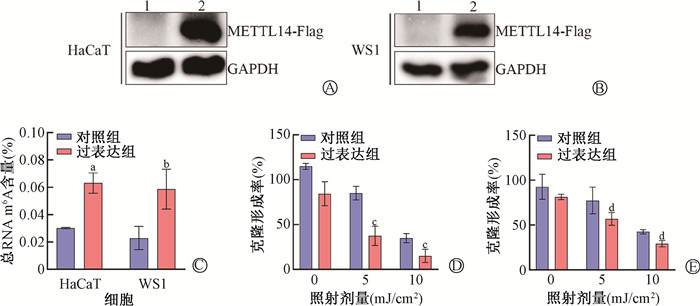
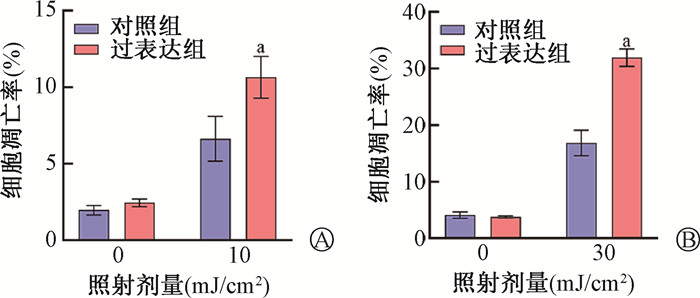
METTL14过表达腺病毒感染的HaCaT细胞和WS1细胞中METTL14蛋白表达均明显增加(图 4A、4B),过表达组细胞m6A水平上调(t=7.66、3.67,图 4C),与对照组相比,过表达组的HaCaT、WS1细胞在0、5、10 mJ/cm2的UVB照射后,克隆形成能力减弱(t=6.29、3.84、5.37、5.44,P<0.05,图 4D、4E)。流式细胞仪检测过表达METTL14对HaCaT和WS1细胞凋亡的影响(图 5),在未照射条件下,过表达组与对照组比较细胞凋亡率无明显差异,而UVB照射后过表达组的细胞凋亡率比对照组明显增加(t=3.48、9.54,P<0.05)。以上结果提示,METTL14增加皮肤细胞对UVB的辐射敏感性。
|
注:1. 对照组;2. 过表达组。a与HaCaT细胞对照组比较,t=7.66,P<0.05;b与WS1细胞对照组比较,t=3.67,P<0.05;c与同剂量照射的HaCaT细胞对照组比较,t=6.29、3.84,P<0.05;d与同剂量照射的WS1细胞对照组比较,t=5.37、5.44,P<0.05 图 4 Western blot检测皮肤细胞METTL14的蛋白表达和过表达METTL14增加皮肤细胞对UVB辐射的敏感性 A、B. Western blot检测HaCaT、WS1细胞METTL14的蛋白表达;C. 过表达METTL14的HaCaT和WS1细胞m6A水平变化;D. HaCaT细胞克隆存活率;E. WS1细胞克隆存活率 Figure 4 METTL14 overexpression increases the sensitivity of skin cells to UVB irradiation A, B. Western blot protein bands showing METTL14 protein expression in HaCaT and WS1 cells; C. m6A levels in HaCaT and WS1 cells overexpressing METTL14; D, E. Clone formation rates of HaCaT and WS1 cells after UVB irradiation in METTL14 overexpression and control groups |
|
注:a与同剂量照射下对照组比较,t=3.48、9.54,P<0.05; 图 5 过表达METTL14促进皮肤细胞UVB诱导的细胞凋亡 A. 对照组和过表达组的HaCaT细胞给予10 mJ/cm2 UVB照射后48 h的细胞凋亡率;B. 过表达METTL14的WS1细胞给予30 mJ/cm2 UVB照射后48 h的细胞凋亡率 Figure 5 METTL14 Overexpression promotes skin cell apoptosis A. Apoptosis rates in HaCaT cells overexpressing METTL14 48 h after 10 mJ/cm2 UVB exposure; B. Apoptosis rates in WS1 cells overexpressing METTL14 48 h after 30 mJ/cm2 UVB exposure |
4、靶向抑制METTL14有效缓解UVB引起的皮肤损伤
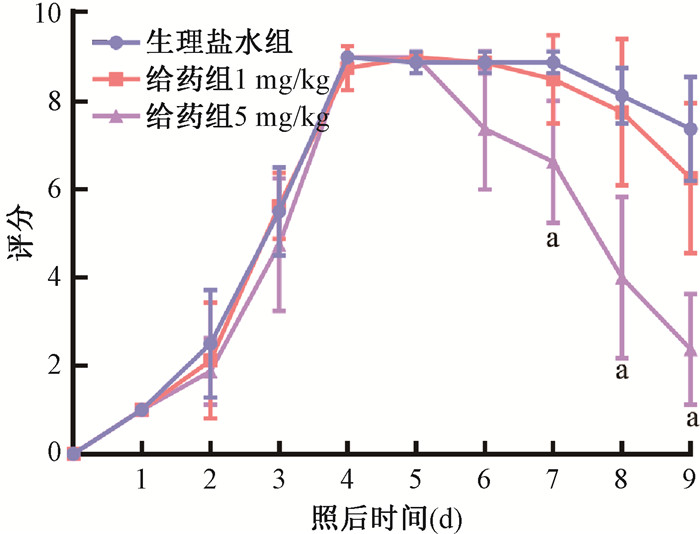
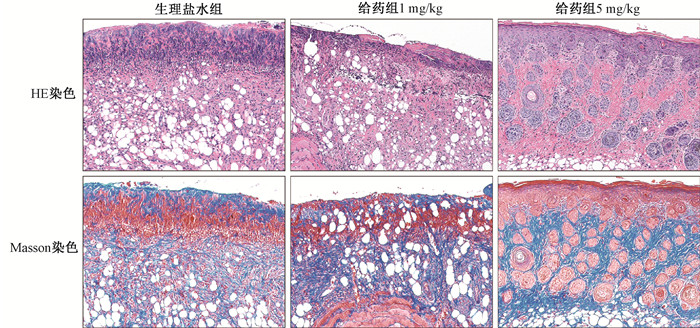
通过建立UVB诱导皮肤辐射损伤模型,验证其抑制剂SAH对UVB诱导皮肤辐射损伤进展的影响,依据UVB辐射诱导皮肤损伤标准进行评分比较(图 6)。150 mJ/cm2 UVB照射后第7天,SAH 5 mg/kg给药组的皮肤损伤评分与生理盐水组之间差异具有统计学意义(t=3.21,P<0.05),说明SAH能够缓解150 mJ/cm2 UVB照射后引起的皮肤损伤严重程度,促进皮肤损伤的恢复。在照射后第9天时,5 mg/kg给药组小鼠皮肤损伤大部分愈合(t=5.81,P<0.05)。HE染色显示(图 7),生理盐水组小鼠组织结构紊乱,可见大量炎性细胞浸润;1 mg/kg给药组小鼠与生理盐水组相似;5 mg/kg给药组小鼠皮肤隔层结构有序排列,少许炎性细胞浸润,较生理盐水组明显减轻。Masson染色显示(图 7),生理盐水组和1 mg/kg给药组胶原纤维减少,胶原纤维断裂、紊乱;而5 mg/kg给药组胶原纤维排列有序,胶原纤维降解较前两组减少。
|
a与同一时间的生理盐水组比较,t=3.21、4.27、5.81,P<0.05 图 6 150 mJ/cm2 UVB照射后不同处理的小鼠皮肤损伤评分统计 Figure 6 Skin injury scores of different treatment groups after 150 mJ/cm2 UVB exposure |
|
图 7 各组小鼠皮肤组织的病理改变和胶原分布 ×200 Figure 7 The pathological changes and collagen distribution of mice skin tissues ×200 |
讨论
UVB是人体皮肤重要的外源性危险因素之一,与皮肤癌患病风险增加相关[7]。N6-甲基腺苷(m6A)RNA甲基化是真核细胞中最常见和最丰富的表观遗传学修饰类型[8]。新近的研究表明,RNA m6A甲基化修饰在皮肤疾病中起着至关重要的作用[9-10]。本研究在UVB辐射皮肤损伤的体内外模型中发现,UVB辐射诱导的皮肤损伤伴有m6A甲基化水平降低,提示m6A甲基化修饰可能参与对UVB辐射诱导的皮肤损伤的调控。
RNA m6A甲基化修饰由多组分m6A甲基转移酶复合体(MTC)催化[11]。RNA m6A甲基转移酶3/甲基转移酶14(METTL3/METTL14)被鉴定为MTC的两个核心组分,它们形成稳定的异二聚体,两者协调诱导m6A甲基化修饰,且METTL14是RNA m6A内稳态的关键因素[12-13]。Yang等[9]发现METTL14在UVB诱导DNA损伤的修复中起到关键作用,并抑制UVB辐射诱导的皮肤肿瘤发生。本研究发现UVB辐射诱导小鼠皮肤METTL14蛋白表达下降,并且在皮肤细胞中呈时间依赖性下降。本研究还发现,METTL14增加皮肤细胞对UVB辐射的敏感性,即过表达METTL14可使暴露于UVB的HaCaT和WS1细胞的克隆形成能力减弱。UVB诱导皮肤辐射损伤的过程伴随着多种死亡方式的发生,而细胞凋亡被确定为紫外线攻击皮肤细胞死亡的主要类型[14-15]。本研究发现,过表达METTL14促进人永生化角质形成细胞HaCaT和人皮肤成纤维细胞WS1细胞凋亡。
METTL14等甲基转移酶以S-腺苷甲硫氨酸(SAM)为甲基供体,在前体mRNA转录后立即催化腺苷(A)甲基化为m6A。S-腺苷同型半胱氨酸(SAH)是SAM的降解产物,降低甲基转移酶与SAM的交互作用,因此作为METTL3-METTL14异二聚体复合物的抑制剂[16]。本研究发现,小鼠皮下注射SAH靶向抑制METTL14能显著减轻UVB引起的皮肤损伤的严重程度,促进皮肤损伤的恢复速度,减少胶原纤维降解。上述结果共同提示,METTL14在UVB诱导皮肤损伤中起着重要的调节作用,靶向抑制METTL14则可能是干预UVB诱导皮肤辐射损伤的潜在新靶点。
课题组后续将采用MeRIP-seq、MeRIP-qPCR等技术方法,继续深入探究METTL14促进UVB诱导皮肤损伤的机制,筛选验证METTL14作用的关键下游靶基因。预期本研究所获相关结果将为深入阐明RNA m6A甲基转移酶METTL14调控UVB辐射诱导皮肤损伤的机制提供重要的科学依据,并将为精准干预UVB辐射诱导皮肤损伤提供新靶点和新思路。
利益冲突 无
作者贡献声明 方少芬负责实验实施和论文撰写;冯阳、张琦、朱巍参与实验设计;焦旸、曹建平提供研究思路和指导论文修改
| [1] |
Matsumura Y, Ananthaswamy HN. Toxic effects of ultraviolet radiation on the skin[J]. Toxicol Appl Pharmacol, 2004, 195(3): 298-308. DOI:10.1016/j.taap.2003.08.019 |
| [2] |
Han A, Maibach HI. Management of acute sunburn[J]. Am J Clin Dermatol, 2004, 5(1): 39-47. DOI:10.2165/00128071-200405010-00006 |
| [3] |
Luo X, Zhu S, Li J, et al. Potential genetic therapies based on m6A methylation for skin regeneration: Wound healing and scars/keloids[J]. Front Bioeng Biotechnol, 2023, 11: 1143866. DOI:10.3389/fbioe.2023.1143866 |
| [4] |
Xiang Y, Laurent B, Hsu CH, et al. RNA m6A methylation regulates the ultraviolet-induced DNA damage response[J]. Nature, 2017, 543(7646): 573-576. DOI:10.1038/nature21671 |
| [5] |
Chen YY, Lee YH, Wang BJ, et al. Skin damage induced by zinc oxide nanoparticles combined with UVB is mediated by activating cell pyroptosis via the NLRP3 inflammasome-autophagy-exosomal pathway[J]. Part Fibre Toxicol, 2022, 19(1): 2. DOI:10.1186/s12989-021-00443-w |
| [6] |
Chen Y, Lian N, Chen S, et al. GSDME deficiency leads to the aggravation of UVB-induced skin inflammation through enhancing recruitment and activation of neutrophils[J]. Cell Death Dis, 2022, 13(10): 841. DOI:10.1038/s41419-022-05276-9 |
| [7] |
Yang Y, Wu R, Sargsyan D, et al. UVB drives different stages of epigenome alterations during progression of skin cancer[J]. Cancer Lett, 2019, 449: 20-30. DOI:10.1016/j.canlet.2019.02.010 |
| [8] |
Boccaletto P, Stefaniak F, Ray A, et al. MODOMICS: a database of RNA modification pathways. 2021 update[J]. Nucleic Acids Res, 2022, 50(D1): D231-D235. DOI:10.1093/nar/gkab1083 |
| [9] |
Yang Z, Yang S, Cui YH, et al. METTL14 facilitates global genome repair and suppresses skin tumorigenesis[J]. Proc Natl Acad Sci USA, 2021, 118(35): e2025948118. DOI:10.1073/pnas.2025948118 |
| [10] |
Liang D, Lin WJ, Ren M, et al. m6A reader YTHDC1 modulates autophagy by targeting SQSTM1 in diabetic skin[J]. Autophagy, 2022, 18(6): 1318-1337. DOI:10.1080/15548627.2021.1974175 |
| [11] |
Deng X, Su R, Weng H, et al. RNA N6-methyladenosine modification in cancers: current status and perspectives[J]. Cell Res, 2018, 28(5): 507-517. DOI:10.1038/s41422-018-0034-6 |
| [12] |
Dou X, Huang L, Xiao Y, et al. METTL14 is a chromatin regulator independent of its RNA N6-methyladenosine methyltransferase activity[J]. Protein Cell, 2023, 14(9): 683-697. DOI:10.1093/procel/pwad009 |
| [13] |
Zeng ZC, Pan Q, Sun YM, et al. METTL3 protects METTL14 from STUB1-mediated degradation to maintain m6A homeostasis[J]. EMBO Rep, 2023, 24(3): e55762. DOI:10.15252/embr.202255762 |
| [14] |
Vats K, Kruglov O, Mizes A, et al. Keratinocyte death by ferroptosis initiates skin inflammation after UVB exposure[J]. Redox Biol, 2021, 47: 102143. DOI:10.1016/j.redox.2021.102143 |
| [15] |
Tang Z, Tong X, Huang J, et al. Research progress of keratinocyte-programmed cell death in UV-induced Skin photodamage[J]. Photodermatol Photoimmunol Photomed, 2021, 37(5): 442-448. DOI:10.1111/phpp.12679 |
| [16] |
Wang P, Doxtader KA, Nam Y. Structural basis for cooperative function of Mettl3 and Mettl14 methyltransferases[J]. Mol Cell, 2016, 63(2): 306-317. DOI:10.1016/j.molcel.2016.05.041 |
 2024, Vol. 44
2024, Vol. 44


