铀(uranium, U)是一种天然存在的锕系元素,已大规模应用于核工业中重要核燃料——低浓缩铀的生产,且其副产物贫铀亦用途广泛,目前已成为一种倍受全球关注的环境污染物[1-2],相关核事故的风险不容忽视。无论是天然铀、低浓缩铀还是贫铀,一旦通过食入、吸入或伤口吸收进入体内,主要以稳定的六价铀酰离子(UO22+)形式通过血液循环转移至其靶器官/细胞,如肾近端小管上皮细胞中[3],引起以化学毒性为主的肾近端小管损伤,严重者甚至导致肾功能衰竭[1-2]。促进体内放射性核素的排除是治疗放射性核素内污染的主要措施,但蓄积于细胞内的铀难以排出是铀促排解毒治疗面临的难题。多项研究表明,细胞毒性浓度的铀暴露能在多种类型细胞包括肾近端小管上皮细胞的溶酶体内形成磷酸盐结晶[4-5]。本研究团队最新发现,瞬时受体电位粘脂蛋白1(transient receptor potential mucolipin 1,TRPML1/MCOLN1)特异性小分子激动剂ML-SA1通过激活细胞天然清除功能——溶酶体胞吐,可显著降低体内/体外肾近端小管上皮细胞内铀蓄积及细胞毒性[6]。本研究拟从细胞水平进一步探究新型TRPML1激动剂ML-SA5通过诱导溶酶体胞吐促进人肾近端小管上皮HK-2细胞内蓄积铀的排出及减轻铀致细胞损伤的作用及其机制,以期为铀促排解毒新药的研发提供参考。
材料与方法 1、主要试剂DMEM/F12培养基、胎牛血清、青霉素-链霉素溶液和0.25%胰酶(含EDTA)购自美国GIBCO公司,醋酸铀酰购自美国Chem-Impex公司,ML-SA5购自上海DC Chemicals公司,溶酶体胞吐抑制剂Vacuolin-1购自美国Selleck公司,兔抗人溶酶体相关膜蛋白1(lysosomal associated membrane protein 1,LAMP-1)抗体购自武汉Abclonal公司,兔抗人肾损伤分子1(kidney injury molecule 1,KIM-1)抗体购自美国LifeSpan公司,兔抗人转录因子EB(transcription factor EB,TFEB)抗体购自美国Cell Signaling公司,兔抗人TRPML1抗体购自瑞典Atlas Antibodies公司,荧光二抗Alexa Fluor 488/555驴抗兔IgG购自美国Invitrogen公司,4′,6-二脒基-2-苯基吲哚(DAPI)、LysoTracker荧光探针购自上海碧云天生物技术有限公司,钙黄绿素(Calcein-AM)-碘化丙啶(PI)细胞双染试剂盒购自上海东仁化学科技有限公司。
2、细胞培养及分组人肾近端小管上皮HK-2细胞购自中国科学院细胞库,用含10%胎牛血清和1%青-链霉素的DMEM/F12培养基,置于饱和湿度、37℃、5%CO2的培养箱中培养。检测细胞质膜LAMP-1蛋白表达、细胞内铀含量、KIM-1蛋白表达及细胞死亡率等指标的实验分组如下:空白对照组(Ctrl组)、ML-SA5组(M组)、Vacuolin-1组(V组)、ML-SA5联合Vacuolin-1组(M+V组)、单纯铀染毒组(U组)、铀染毒+ML-SA5组(U+M组)、铀染毒+Vacuolin-1组(U+V组)及铀染毒+ML-SA5联合Vacuolin-1组(U+M+V组)。检测细胞内TFEB核转位、溶酶体生成及TRPML1蛋白表达情况的实验分组如下:Ctrl组、M组、U组及U+M组。采用300 μmol/L铀孵育细胞24 h,建立负载铀的HK-2细胞;ML-SA5和Vacuolin-1溶于DMSO中,作用浓度分别为10和2 μmol/L,于铀染毒HK-2细胞24 h后加入处理0.5 h。
3、免疫荧光法检测HK-2细胞质膜LAMP-1蛋白表达情况取对数生长期的HK-2细胞,以8×104/孔接种于24孔板中过夜贴壁,按上述实验分组处理后,将孔板置于冰上,磷酸盐缓冲液(PBS)清洗3次,加入兔抗人LAMP-1抗体4℃孵育1 h,PBS清洗两次,加入Alexa Fluor 488标记的荧光二抗室温避光孵育1 h,PBS清洗两次,用4%的多聚甲醛室温固定15 min,PBS清洗两次,DAPI作用5 min后PBS清洗两次,各孔再加入200 μl PBS,在倒置荧光显微镜下观察及拍照,采用ImageJ软件分析各组细胞的绿色荧光强度。
4、免疫荧光法检测HK-2细胞KIM-1、TFEB核转位、LAMP-1及TRPML1蛋白表达按上述实验分组处理HK-2细胞后,将24孔板置于冰上,PBS清洗3次,4%的多聚甲醛室温固定15 min,PBS清洗两次,10%的小牛血清37℃封闭1 h,分别加入相应的抗体(兔抗人KIM-1、TFEB、LAMP-1和TRPML1抗体),4℃孵育过夜,PBS清洗两次,加入Alexa Fluor 488或555标记的荧光二抗室温避光孵育1 h,PBS清洗两次,DAPI作用5 min,PBS清洗两次后,各孔加入200 μl PBS,在倒置荧光显微镜下观察及拍照,采用ImageJ软件分析各组细胞蛋白表达或核转位情况。
5、ICP-MS检测HK-2细胞内铀含量将HK-2细胞以2×105/孔接种于12孔板中,按上述实验分组处理后,收集各组细胞,加入2 ml碱性裂解液,37℃裂解2 h,稀释一定倍数后采用ICP-MS检测细胞内铀含量。
6、Calcein-AM/PI双染色法检测HK-2细胞死亡率按上述实验分组处理贴壁于24孔板中的HK-2细胞后,每孔加入500 μl Calcein-AM和PI染色工作液,37℃培养箱内孵育15 min后,在倒置荧光显微镜下观察及拍照,计数绿色的活细胞数和红色的死细胞数,计算细胞死亡率:细胞死亡率(%)=死细胞数/(活细胞数+死细胞数)×100%。
7、LysoTracker荧光探针法检测HK-2细胞的溶酶体数量按上述实验分组处理贴壁于24孔板中的HK-2细胞后,每孔加入75 nmol/L LysoTracker工作液500 μl,37℃孵育20 min,Hank′s平衡盐溶液(HBSS)清洗两次,采用高内涵细胞成像分析系统采集图像,ImageJ软件分析各组细胞的红色荧光强度。
8、统计学处理采用GraphPad Prism 8.0.2进行数据分析。数据符合正态分布,以x±s表示。两组间比较采用多重t检验。P<0.05为差异具有统计学意义。
结果 1、ML-SA5明显提高了负载铀的HK-2细胞的溶酶体胞吐本实验采用免疫荧光法检测质膜LAMP-1定位以反映溶酶体胞吐的结果显示,Ctrl组、M组、V组、M+V组、U组、U+M组、U+V组和U+M+V组质膜LAMP-1相对平均荧光强度分别为1.00±0.02、1.32±0.34、1.21±0.42、1.19±0.38、2.74±0.23、3.53±0.34、1.52±0.15和1.46±0.40;与Ctrl组相比,U组定位于细胞质膜的LAMP-1蛋白明显增多(t = 12.86,P<0.05),而U+M组显著高于U组(t = 3.33,P<0.05),U+V组定位于细胞质膜的LAMP-1较U组显著降低(t = 7.61,P<0.05),但是U+M+V组定位于细胞质膜的LAMP-1较U组未见增加,见图 1。结果表明,ML-SA5能明显提高负载铀的HK-2细胞LAMP-1在质膜的定位,此作用能被溶酶体胞吐抑制剂Vacuolin-1所抵消。
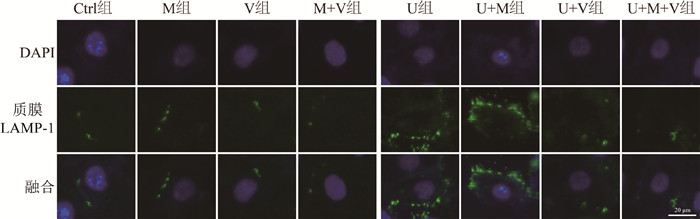
|
图 1 各处理组HK-2细胞质膜LAMP-1免疫荧光染色图 ×40 Figure 1 Immunofluorescence images of surface LAMP-1 in HK-2 cells in different treatment groups ×40 |
2、ML-SA5通过促进溶酶体胞吐降低负载铀的HK-2细胞内铀含量
采用ICP-MS检测细胞内铀含量的结果显示,U组、U+M组、U+V组和U+M+ V组分别为(1 169.35±36.03)、(999.30±46.51)、(1 331.62±89.66)和(1 251.62±108.60)ng/104细胞;与U组相比,U+M组HK-2细胞内铀含量明显降低(t = 5.01,P<0.05),而U+V组HK-2细胞内铀含量则显著增加(t = 2.91,P<0.05),但是U+M+V组的细胞内铀含量较U+V组未见明显变化,表明ML-SA5能有效降低负载铀的HK-2细胞内铀含量,其作用能被Vacuolin-1所抵消。
3、ML-SA5通过促进溶酶体胞吐减轻负载铀的HK-2细胞损伤及死亡KIM-1是检测早期肾近端小管上皮细胞损伤的敏感指标。由表 1可见,与Ctrl组相比,U组HK-2细胞KIM-1荧光强度及细胞死亡率明显增加(t = 18.86、38.53,P<0.05);与U组相比,U+M组HK-2细胞KIM-1表达及细胞死亡率显著降低(t = 3.81、3.24,P<0.05),而U+V组HK-2细胞KIM-1表达和细胞死亡率则明显增加(t = 4.35、2.82,P<0.05),但U+M+V组HK-2细胞KIM-1表达及细胞死亡率并未明显降低,表明ML-SA5能够减轻铀诱导HK-2细胞的损伤及细胞死亡,其作用能被Vacuolin-1所抵消。
|
|
表 1 各处理组HK-2细胞KIM-1相对平均荧光强度及细胞死亡率(x±s) Table 1 Relative mean fluorescence intensity of KIM-1 in HK-2 cells and rate of cell death in different treatment groups (x±s) |
4、ML-SA5促进负载铀的HK-2细胞TFEB核转位
免疫荧光法检测调控溶酶体胞吐和溶酶体生物发生的关键转录因子TFEB核转位的结果显示,Ctrl组、M组、U组和U+M组TFEB核转位率分别为(30.99±3.50)%、(52.33±2.63)%、(51.52±1.72)%和(65.81±2.07)%;与Ctrl组相比,M组或U组HK-2细胞TFEB核转位率均明显增加(t = 8.43、9.12,P<0.05);与U组相比,U+M组HK-2细胞TFEB核转位率进一步提高(t = 9.20,P<0.05),见图 2。
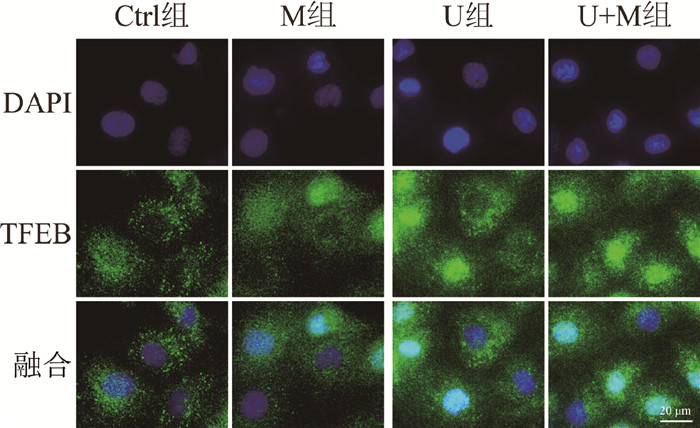
|
图 2 各处理组HK-2细胞TFEB核转位免疫荧光染色图 ×40 Figure 2 Immunofluorescence images of TFEB nuclear translocation in HK-2 cells in different treatment groups ×40 |
5、ML-SA5明显提高负载铀的HK-2细胞的溶酶体生物发生
免疫荧光法检测TFEB下游靶基因LAMP-1蛋白表达及溶酶体探针LysoTracker检测溶酶体数量变化的结果显示,Ctrl组、M组、U组和U+M组LAMP-1相对平均荧光强度分别为1.00±0.10、1.52±0.21、4.26±0.33和5.29±0.49,LysoTracker相对平均荧光强度分别为1.00±0.01、1.32±0.11、1.25±0.06和1.52±0.14;与Ctrl组相比,M组或U组HK-2细胞LAMP-1(t = 3.89、16.47,P<0.05)及LysoTracker荧光强度(t = 5.11、7.75,P<0.05)均显著增加;而且与U组相比,U+M组的LAMP-1蛋白表达和LysoTracker荧光强度进一步增加(t = 3.05、3.13,P<0.05),见图 3。以上结果表明,ML-SA5能够促进负载铀的HK-2细胞的溶酶体生物发生。
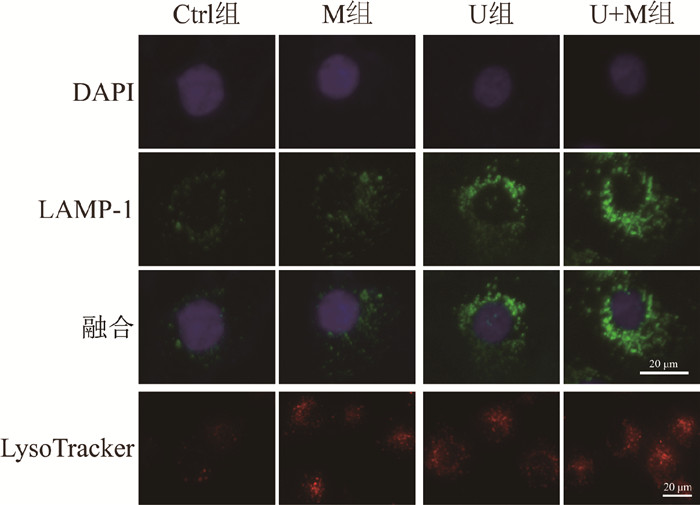
|
图 3 各处理组HK-2细胞LAMP-1和溶酶体免疫荧光染色图 ×40 Figure 3 Immunofluorescence images of LAMP-1 and lysosomes in HK-2 cells in different treatment groups ×40 |
6、ML-SA5明显提高负载铀的HK-2细胞的TRPML1蛋白表达
免疫荧光法检测TFEB下游靶基因TRPML1蛋白表达的结果显示,Ctrl组、M组、U组和U+M组TRPML1相对平均荧光强度分别为1.00±0.06、1.45±0.18、7.08±0.32和7.97±0.37;与Ctrl组相比,M组或U组HK-2细胞TRPML1的荧光强度均显著增加(t = 4.23、32.33,P<0.05);与U组相比,U+M组的TRPML1表达进一步增加(t = 3.17,P<0.05),见图 4,表明ML-SA5能够有效提高负载铀的HK-2细胞的TRPML1蛋白表达。
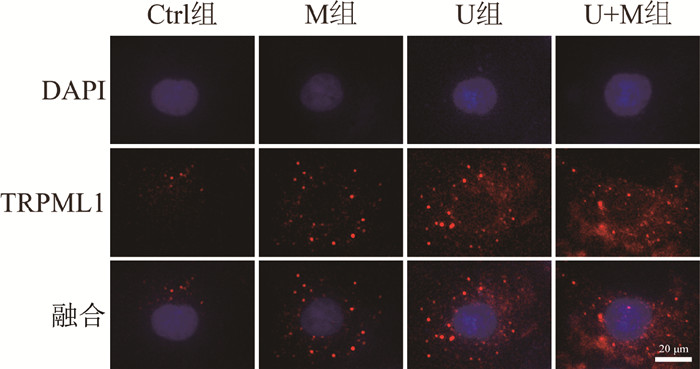
|
图 4 各处理组HK-2细胞TRPML1免疫荧光染色图 ×40 Figure 4 Immunofluorescence images of TRPML1 in HK-2 cells in different treatment groups ×40 |
讨论
溶酶体胞吐是Ca2+依赖的溶酶体与细胞质膜融合、将内容物释放至细胞外的过程,它在多种细胞生理过程如质膜修复、分泌和递质释放中发挥重要作用[7-9]。TRPML1是主要位于溶酶体膜上的溶酶体Ca2+释放通道,属于瞬时受体电位通道蛋白的粘脂亚家族;多项研究表明,TRPML1激活能够介导溶酶体腔内Ca2+释放、诱导Ca2+依赖的溶酶体胞吐,是调控溶酶体胞吐的关键调节因子[10];TFEB既是调控溶酶体生物发生的重要转录因子[11],又能调控TRPML1介导的溶酶体胞吐[7],即TFEB核转位激活能诱导其下游靶基因溶酶体生物发生相关基因如TRPML1和LAMP-1的表达[11],TFEB过表达亦能通过激活TRPML1介导的溶酶体胞吐降低溶酶体贮积症细胞溶酶体内无法降解底物的累积[7],而且TRPML1激活介导的溶酶体Ca2+释放亦能诱导TFEB核转位[12],由此可见,TRPML1和TFEB之间存在一条正反馈环路以促进溶酶体胞吐和溶酶体生物发生。本研究团队前期研究证实TRPML1激动剂ML-SA1通过激活TRPML1-TFEB正反馈环路,诱导溶酶体胞吐/生成,促进人肾近端小管上皮HK-2细胞内蓄积铀的排出及减轻铀诱导的溶酶体膜通透化及细胞死亡,揭示TRPML1是一个有希望的治疗铀肾毒性的新靶点[6],因此,进一步探究新型TRPML1激动剂用作铀促排解毒剂的潜力具有重要的研究价值。
ML-SA5是近年来研发的一种强效的TRPML1通道激动剂,能明显增强杜氏肌肉营养不良症小鼠原代肌管细胞溶酶体Ca2+释放及其介导的质膜修复[13],是否对细胞内蓄积铀具有促排解毒作用尚未见相关报道。溶酶体膜结构蛋白LAMP-1转位至质膜是溶酶体胞吐的标志[7],本研究首先采用免疫荧光法检测定位于质膜的LAMP-1蛋白水平的结果表明,铀染毒细胞24 h后给予ML-SA5处理能使负载铀的HK-2细胞质膜LAMP-1较Ctrl组和U组明显增加,即显著提高了负载铀的HK-2细胞的溶酶体胞吐,而且此作用能被Ca2+依赖性溶酶体胞吐抑制剂Vacuolin-1[14]所阻断,Vacuolin-1有效抑制负载铀的HK-2细胞溶酶体胞吐的作用已被本研究团队前期研究所证实[6]。采用ICP-MS检测细胞内铀含量、采用免疫荧光法检测早期肾损伤分子标志物KIM-1蛋白表达以及采用Calcein-AM/PI染色法检测细胞死亡率的结果表明,TRPML1激动剂ML-SA5能够通过诱导负载铀的HK-2细胞的溶酶体胞吐促进细胞内铀排出,从而减轻铀诱导HK-2细胞的损伤/死亡,但低于TRPML1特异性小分子激动剂ML-SA1的效果[6],可能与最新研究发现ML-SA5为非特异性TRPML1激动剂有关[15]。TFEB是调控溶酶体胞吐和溶酶体生物发生的关键转录因子,它从细胞质转入细胞核是其激活的标志[7, 11],本研究发现ML-SA5延迟处理能够进一步提高负载铀的HK-2细胞TFEB核转位,与文献报道ML-SA5能够诱导正常人皮肤成纤维细胞TFEB核转位相一致[16],可能与ML-SA5激活TRPML1介导的溶酶体Ca2+释放诱导TFEB核转位有关[12-13];ML-SA5促进负载铀的HK-2细胞TFEB激活的作用亦被其下游靶基因溶酶体生物发生相关基因LAMP-1及TRPML1的蛋白表达明显增加及LysoTracker标记的溶酶体数量显著增加所佐证,亦表明ML-SA5能够明显提高负载铀的HK-2细胞的溶酶体生成;再者,ML-SA5激活TFEB进而提高TRPML1蛋白表达的作用又有利于提高TRPML1介导的溶酶体胞吐功效。值得注意的是,单纯铀染毒亦会诱导HK-2细胞溶酶体胞吐、TFEB核转位及溶酶体生物发生增加,这可能是细胞的自我保护反应,但此时单纯铀染毒已导致细胞损伤和死亡明显高于空白对照组,表明细胞的自我保护作用不足以抵抗铀致细胞毒性。
综上所述,本研究证实TRPML1小分子激动剂ML-SA5能够通过促进溶酶体胞吐促进负载铀的HK-2细胞内蓄积铀的排出,从而减轻铀致HK-2细胞损伤/死亡,可能与激活负载铀的HK-2细胞TRPML1-TFEB正反馈环路以促进溶酶体胞吐及溶酶体生成有关,但其在铀暴露动物个体上的促排解毒效果还有待采用动物实验加以验证。本研究从细胞水平进一步表明,从靶向TRPML1的特异性小分子激动剂中探寻铀促排解毒药物是铀中毒治疗新药研发的新方向。
利益冲突 全体作者无任何利益冲突
作者贡献声明 张洪静负责实验设计与操作、数据处理及论文撰写;王睿云、王毅斐、张旭霞协助样品检测及试剂耗材采购;陈红红提出研究思路、指导实验设计和论文修改
| [1] |
Yue YC, Li MH, Wang HB, et al. The toxicological mechanisms and detoxification of depleted uranium exposure[J]. Environ Health Prev Med, 2018, 23(1): 18. DOI:10.1186/s12199-018-0706-3 |
| [2] |
Rathod AM, Verpaele S, Kelvin M, et al. Uranium: an overview of physicochemical properties, exposure assessment methodologies, and health effects of environmental and occupational exposure[J]. Environ Geochem Health, 2023, 45(5): 1183-1200. DOI:10.1007/s10653-022-01293-x |
| [3] |
Homma-Takeda S, Kitahara K, Suzuki K, et al. Cellular localization of uranium in the renal proximal tubules during acute renal uranium toxicity[J]. J Appl Toxicol, 2015, 35(12): 1594-1600. DOI:10.1002/jat.3126 |
| [4] |
Milgram S, Carrière M, Malaval L, et al. Cellular accumulation and distribution of uranium and lead in osteoblastic cells as a function of their speciation[J]. Toxicology, 2008, 252(1-3): 26-32. DOI:10.1016/j.tox.2008.07.054 |
| [5] |
Berry JP. The role of lysosomes in the selective concentration of mineral elements. A microanalytical study[J]. Cell Mol Biol (Noisy-le-grand), 1996, 42(3): 395-411. |
| [6] |
Zhong D, Wang R, Zhang H, et al. Induction of lysosomal exocytosis and biogenesis via TRPML1 activation for the treatment of uranium-induced nephrotoxicity[J]. Nat Commun, 2023, 14(1): 3997. DOI:10.1038/s41467-023-39716-7 |
| [7] |
Medina DL, Fraldi A, Bouche V, et al. Transcriptional activation of lysosomal exocytosis promotes cellular clearance[J]. Dev Cell, 2011, 21(3): 421-430. DOI:10.1016/j.devcel.2011.07.016 |
| [8] |
Xu H, Ren D. Lysosomal physiology[J]. Annu Rev Physiol, 2015, 77: 57-80. DOI:10.1146/annurev-physiol-021014-071649 |
| [9] |
Samie MA, Xu H. Lysosomal exocytosis and lipid storage disorders[J]. J Lipid Res, 2014, 55(6): 995-1009. DOI:10.1194/jlr.R046896 |
| [10] |
Samie M, Wang X, Zhang X, et al. A TRP channel in the lysosome regulates large particle phagocytosis via focal exocytosis[J]. Dev Cell, 2013, 26(5): 511-524. DOI:10.1016/j.devcel.2013.08.003 |
| [11] |
Sardiello M, Palmieri M, di Ronza A, et al. A gene network regulating lysosomal biogenesis and function[J]. Science, 2009, 325(5939): 473-477. DOI:10.1126/science.1174447 |
| [12] |
Medina DL, Di Paola S, Peluso I, et al. Lysosomal calcium signalling regulates autophagy through calcineurin and TFEB[J]. Nat Cell Biol, 2015, 17(3): 288-299. DOI:10.1038/ncb3114 |
| [13] |
Yu L, Zhang X, Yang Y, et al. Small-molecule activation of lysosomal TRP channels ameliorates Duchenne muscular dystrophy in mouse models[J]. Sci Adv, 2020, 6(6): eaaz2736. DOI:10.1126/sciadv.aaz2736 |
| [14] |
Shaik GM, Dráberová L, Heneberg P, et al. Vacuolin-1-modulated exocytosis and cell resealing in mast cells[J]. Cell Signal, 2009, 21(8): 1337-1345. DOI:10.1016/j.cellsig.2009.04.001 |
| [15] |
Peng X, Holler CJ, Alves AF, et al. Discovery and characterization of novel TRPML1 agonists[J]. Bioorg Med Chem Lett, 2024, 98: 129595. DOI:10.1016/j.bmcl.2023.129595 |
| [16] |
Zhang X, Cheng X, Yu L, et al. MCOLN1 is a ROS sensor in lysosomes that regulates autophagy[J]. Nat Commun, 2016, 7: 12109. DOI:10.1038/ncomms12109 |
 2024, Vol. 44
2024, Vol. 44


