放射损伤是放射治疗(放疗)最常见的并发症,如何减少放疗对正常组织的损伤,对提高患者生存质量和延长生命至关重要。放射损伤是多阶段、多细胞参与的过程,涉及多种不同调控网络,具体机制仍不清楚[1]。近年来,研究发现铁死亡是参与放疗诱导细胞死亡的重要机制,调控和干预正常细胞铁死亡,是正常组织抵抗放射损伤的重要机制。本文就铁死亡的调控机制及其与放射损伤关系的研究进展作一综述。
一、铁死亡及其发生机制 1、铁死亡的诱因及特征2012年铁死亡(ferroptosis)由Dixon等[2]首次正式定义,被描述为一种依赖铁离子积累的程序性细胞死亡,其形态学改变和发生机制均不同于凋亡、坏死、自噬等其他形式的细胞坏死,本质是因为细胞膜中含多不饱和脂肪酸的磷脂(polyunsaturated fatty acids-containing phospholipids,PUFA-PLs)在富含铁和活性氧(reactive oxygen species,ROS)的条件下发生过度氧化,细胞内氧化还原失衡,破坏细胞膜的完整性,触发了细胞死亡,主要表现为线粒体体积减小、嵴减少或消失,外膜破裂、固缩等以形态改变为主的超微结构变化[3]。
2、铁死亡的发生机制正常情况下,细胞外Fe3+与转铁蛋白(transferrin,TF)结合,在细胞膜表面形成TF-[Fe3+]2-TFR1转铁蛋白受体1(transferrin receptor 1)复合物,被TFRC1转运入溶酶体中,Fe3+还原为Fe2 +,被二价金属转运蛋白1(divalent metal transporter 1,DMT1)和锌铁蛋白8/14(zinc transporter 8/14,ZIP8/14)储存到不稳定铁池(labile iron pool,LIP)和铁蛋白中,以此维持铁代谢的动态平衡。当细胞内铁超载时,过量的Fe2+与过氧化物发生芬顿(Fenton)反应,产生氧自由基和ROS并激活含铁酶,过量的自由基不能被及时清除使细胞发生氧化应激并产生大量的脂质过氧化物,就会导致细胞发生铁死亡[4-5]。因此,调节细胞铁的含量和活性是调控铁死亡的关键。
铁死亡通常伴随抗氧化与脂质过氧化体系之间的失衡。谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)是抗氧化体系的核心调控酶。GPX4利用还原型谷胱甘肽(glutathione,GSH)将具有细胞毒性的过氧化氢磷脂还原为无毒的脂醇,减少脂质过氧化作用;抑制GPX4活性会导致细胞膜上脂质过氧化物的致命性积累,发生铁死亡[6]。此外,细胞膜转运体胱氨酸/谷氨酸转运蛋白(system xc-,xCT)系统中的轻链亚基溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)能将细胞内谷氨酸(glutamate)转运到细胞外,换取胱氨酸(cystine)。胱氨酸进入细胞后被氧化为半胱氨酸(cysteine),结合甘氨酸生成GSH。抑制xc-系统的活性会抑制胱氨酸的吸收、影响GSH合成、导致GSH耗竭,还会导致GPX4活性降低[7]。
过多的PUFAs会被Fe2+通过芬顿反应氧化成羟自由基,再与膜磷脂中的PUFAs发生连锁反应,产生更多的脂质过氧化物。Fe2+作为脂氧合酶(lipoxygenase,LOX)的辅因子能促进PUFAs过氧化[8]。脂质ROS攻击PUFAs的不饱和双键,引起自由基链式反应。强烈的脂质过氧化导致细胞膜的选择性通透性丧失,脂质双分子层不稳定,导致细胞膜破裂和崩解,细胞发生铁死亡[9](图 1)。
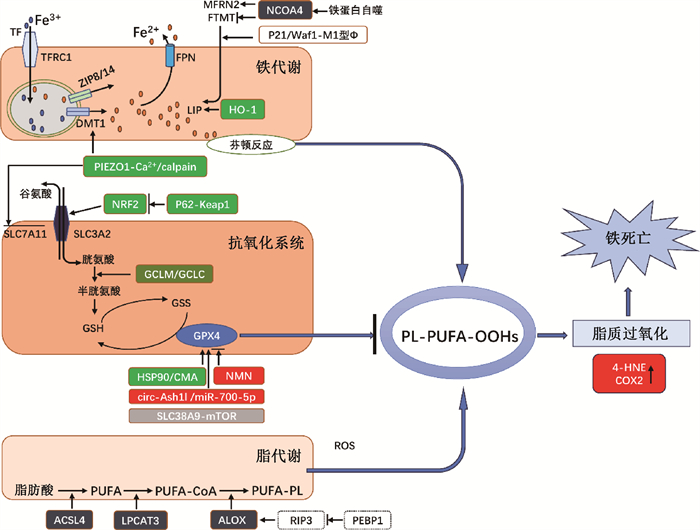
|
图 1 铁死亡机制示意图 Figure 1 Schematic diagram showing the ferroptosis mechanism |
3、铁死亡的检测指标
铁死亡的程度主要通过铁死亡的特征性变化进行评估,如下表 1。
|
|
表 1 铁死亡的检测指标 Table 1 Detection indicators for ferroptosis |
4、放射损伤诱发铁死亡
放疗可通过多个途径诱导脂质过氧化和铁死亡。研究证实放疗能诱导铁死亡标志基因环加氧酶2(prostaglandin-endoperoxide synthase 2,PTGS2)的表达;放疗后的细胞出现了典型的铁死亡形态学特征;用铁死亡抑制剂可以部分恢复放疗后细胞的存活[10]。放疗诱导DNA损伤后,毛细血管扩张性共济失调突变蛋白(Ataxia-telangiectasia mutated proteins,ATM)作为DNA修复系统的核心组成被部分激活,介导SLC7A11下调、与放疗诱导的细胞铁死亡有关。这种SLC7A11抑制可通过减少胱氨酸摄取和GSH合成来触发铁死亡。放疗能上调长链酰基辅酶a合成酶4(achaete-scute family basic helix-loop-helix transcription factor 4,ASCL4),增加脂质合成和随后的氧化损伤,诱发铁死亡。放疗还导致GSH耗竭,削弱GPX4介导的铁死亡防御能力,进一步促进铁死亡[11]。此外,参与铁死亡调控的多种基因也受放疗调控,如p53、RB、
腺苷酸活化蛋白激酶[adenosine 5′-monophosphate(AMP)-activated protein kinase, AMPK]、双微体同源基因(mousedouble minute 2, MDM2)和GTP环水解酶1(GTP-cyclohydrolase 1, GCH1)-四氢生物蝶呤(tetrahydrobiopterin, BH 4)信号轴等[10]。放疗诱导的其他细胞效应也与铁死亡存在重要的关联,比如放疗诱导细胞发生免疫原性死亡后,激活并募集T细胞,CD8+ T细胞分泌的干扰素-γ(interferon-γ,IFN-γ)会进一步促进铁死亡[12]。不同的放疗剂量可能也会对铁死亡的诱导程度产生影响,但是目前并不明确,有关放射诱发铁死亡之后的剂量效应、组织细胞表型和辐射-表型的规律也还有待进一步明确。
二、铁死亡与放射损伤的关系 1、铁死亡与放射性肺损伤研究发现,在放射性急性肺炎和慢性肺纤维化模型中都出现铁死亡的特征性表现,包括线粒体收缩、ROS升高、GPX4减低和细胞内抗氧化反应的核转录因子E2相关因子2[nuclear factor (erythroid-derived 2)-like 2,NRF2]信号通路失活状态。使用Liproxstatin-1处理后,小鼠肺组织的炎症反应明显缓解,GPX4表达明显升高,ROS降低,炎性因子TNF-α、IL-6、IL-10、TGF-β1均明显减少,NRF2和其他参与ROS代谢的多个抗氧化分子的表达水平[包括血红素加氧酶-1(heme oxygenase 1,HO1)、醌氧化还原酶-1(quinone oxidoreductase 1,NQO1)和铁蛋白重链1(ferritin heavy chain 1,FTH1)]均明显升高;证实了铁死亡在放射性肺损伤中的重要作用[13-14]。从机制上,NRF2受P62-KELCH样ECH关联蛋白1(kelch like ECH-associated protein 1,Keap1)通路调控:在肺损伤被修复的同时,P62高表达,诱导NRF2与Keap1结合,胞浆蛋白解离后NRF2转运到细胞核,HO1、NQO1和FTH1表达上调,抑制脂质过氧化,抑制铁死亡[15]。放疗还刺激肺泡上皮表面机械敏感离子成分1(Piezo-type mechanosensitive ion channel component 1,PIEZO1)高表达,PIEZO1使细胞内Ca2+升高,激活Ca2+/钙蛋白酶(calpain)信号通路,calpain靶向下调GPX4和SLC7A11蛋白、上调DMT1。DMT1将细胞外铁摄取入细胞质中,导致细胞内铁超载、诱发铁死亡,促进放射性肺炎的发生。Ca2+/calpain通路激活后还使血管内皮cadherin分子降解,导致ROS水平升高、发生铁死亡[16]。此外,NVP-AUY922(luminespib)是一种间苯二甲酸异恶唑酰胺类药物,被发现能够缓解急性放射性肺组织损伤、减轻炎细胞浸润和炎症因子释放,其机制可能与NVP-AUY922抑制HSP90/CMA(heat shock protein/colonic mucoprotein antigen)通路和GPX4降解、进而抑制铁死亡有关[17]。
2、铁死亡与放射性肠损伤放射性肠炎的发生通常会伴随肠上皮细胞线粒体形态和结构改变、铁含量和MDA浓度改变;铁死亡相关分子网络溶血磷脂酰胆碱酰基转移酶(lysophosphatidylcholine acyltransferase3,LPCAT3)/LOX通路激活、15-脂氧合酶(arachidonate-15-lipoxygenase,ALOX15)分子表达升高。liproxstatin-1处理后肠道免疫失衡被修复,INF-γ和TGF-β分泌减少、IL-17分泌增加,肠道炎症反应被逆转[18]。绿茶提取多酚[(-)-epigallocatechin-3-gallate, EGCG]处理放射性肠炎小鼠后,小鼠存活率明显升高、存活时间延长、肠道黏膜反应和上皮细胞DNA损伤减轻,同时细胞内ROS水平降低,NRF2转录活性被激活,SLC7A11、GPX4和HO1表达上调,进一步抑制肠上皮细胞铁死亡的发生,因此被认为是缓解放射性肠炎的潜在药物手段[19]。通过铁螯合或缺铁饮食来缓解肠上皮细胞中的铁超载、抑制铁死亡,能够减轻小肠黏膜损伤,提高小鼠在接受致死剂量的全腹放疗后的存活率。从机制上讲,是因为放疗后肠上皮细胞中核受体共激活因子(nuclear receptor coactivator 4,NCOA4)表达被激活,NCOA4介导胞浆铁蛋白自噬降解,释放大量游离铁。胞质铁的流入上调线粒体铁转运蛋白2 (mitoferrin2,MFRN2)、下调线粒体铁储存蛋白(mitochondrial ferritin,FTMT)。MFRN2介导游离铁向线粒体内转运,导致线粒体铁超载和过量ROS产生,最终发生脂质过氧化和铁死亡[20]。Ji等[11]比较了小鼠接受放射后肠组织转录组的变化,发现IL-17信号通路、TNF信号通路和趋化因子信号通路均被富集;促进铁死亡的基因表达明显增加、抑制铁死亡的基因明显减少。RSL3会进一步促进肠损伤,而liproxstatin-1会逆转肠损伤。肠道细菌和真菌也可能会加重放疗后肠组织的铁死亡,表现为抗生素处理小鼠和抗真菌药处理小鼠接受放疗后GSH显著降低、GPX4表达增加,肠损伤明显减轻。在这一过程中ASCL4表达明显减少,而如果特异性抑制ACSL4可以进一步抑制肠组织的脂质过氧化并保护肠组织免受损伤。
3、铁死亡与放射性皮肤损伤已有数项研究提示辐射暴露会激活皮肤角质细胞的多种程序性坏死,包括凋亡、焦亡、坏死和铁死亡等,不同通路交互作用,会加重辐射损伤。Vats等[21]在多种不同的模型中证实放疗会诱导角质细胞的ROS积累和脂质过氧化。不同的铁死亡抑制剂均能成功抑制放疗导致的细胞铁死亡。例如在放射性皮炎的小鼠模型中,在损伤的皮肤中能观察到脂质过氧化物4-羟基壬烯醛(4-hyfroxy-2-noneal,4-HNE)、环加氧酶(cyclo-oxygenase,COX2)、8-OHdG和铁含量均明显升高。即使角质形成细胞因为发生铁死亡已经丧失活性,在细胞中仍然能够检测到明显的铁超载和脂质过氧化。β-烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)能够在GPX4的介导下促进GSH生成、减少皮肤脂质过氧化,促进皮肤愈合[22]。大鼠模型中,在放疗损伤的皮肤组织中注射血浆来源外泌体,能够重塑细胞外基质、促进胶原蛋白合成,使成纤维细胞增殖和迁移,修复受损皮肤。在这一过程中,铁死亡相关信号通路被抑制,细胞铁积累和脂质过氧化等现象也都明显减少[23]。此外,缺氧预处理后提取的脂肪干细胞外泌体能通过减少ROS含量和抑制炎性因子分泌来改善放疗后的皮肤反应,其中的机制与circ-Ash1l下调miR-700-5p、上调GPX4,以及抑制细胞铁死亡有关[24]。
4、铁死亡与放射性造血系统损伤低剂量(2.4、4.8、7.2 mGy)照射下,血淋巴细胞中TFRC1、SLC3A2、SLC39A8、FTH1、ACSL4和GPX4的水平均发生明显改变;照射0~4.8 mGy时,上述基因的表达水平随照射剂量升高逐渐下降;照射4.8~28.8 mGy时,上述基因的表达随照射剂量升高逐渐增加[25]。放疗后小鼠骨髓单核细胞中铁超载、脂质过氧化水平升高,ACSL4、ALOX15、GPX4和GSH被清除,导致铁死亡。Ferrostatin-1通过降低GPX4和ACSL4水平,在抑制铁死亡同时会升高外周血中红细胞、白细胞、淋巴细胞和单核细胞的比例[26]。放疗还会引起粒细胞-巨噬细胞造血祖细胞发生铁死亡,引起外周血中白细胞和淋巴细胞数量减少。反之,抵抗铁死亡能够改善造血系统的损伤,提高辐照小鼠的存活率[27]。在使用铁死亡抑制剂基础上联合抗凋亡或抗坏死药物,能更有效地减轻放疗对骨髓的损伤,将全身照射后小鼠30 d生存率由5%提高到75%,同时还能降低血浆和骨髓中炎性因子和应激反应蛋白的含量[28]。胆固醇在SLC38A9-mTOR(mammalian target of rapamycin)轴的介导作用下,能平衡SLC7A11/GPX4表达水平,诱导铁蛋白自噬,直接提高造血细胞对铁死亡的抵抗,使造血干细胞向髓系分化增加、向粒系分化减少。所以mTOR抑制剂和铁死亡诱导剂都能通过调控胆固醇代谢在造血干细胞生存中发挥重要作用[29]。
5、铁死亡与其他放射性损伤miR-132/212调控的尿嘧啶转移酶(terminal uridylyl transferase4,TUT4)被证实与放疗引起的食管黏膜损伤有关,测序结果显示TUT4-/-食管上皮接受放疗后,谷氨酸-半胱氨酸连接酶的调节亚基(glutamate-cysteine ligase modifier subunit,GCLM)和催化亚基(glutamate-cysteine ligase catalytic subunit,GCLC)、SLC7A11、微管相关蛋白轻链(microtubule associated protein 1 light chain 3β,MAP1LC3β)、轻链铁蛋白(ferritin light chain,FTL)和血红素加氧酶1(heme oxygenase 1,HMOX1)均被明显富集,提示铁死亡参与了放射性食管黏膜炎的发生和发展[30]。发生急性放射性脾损伤时,细胞溶血引起血红蛋白变性,红细胞和白细胞死亡,原因与脾中Fe3+含量增加有关,铁超载同时铁结合蛋白、转铁蛋白水平升高,P21/Waf1轴和铁蛋白表达上调,并且促炎性M1型巨噬细胞增加,使脾淋巴细胞发生铁死亡[31]。全身照射后心肌组织脂质过氧化水平持续升高,MDA和黄嘌呤氧化酶、腺苷脱氨酶活性增加,硝酸盐/亚硝酸盐比例和GPX4、过氧化氢酶以及超氧化物歧化酶等抗氧化酶水平降低,提示急性放射性心脏损伤中存在与铁死亡极其类似的现象和机制[32]。此外,铁死亡抑制剂能缓解脑部放疗后受体相互作用蛋白激酶3(receptor interacting protein kinase 3, RIP3)-K51A酶失活的小鼠脑组织中的铁超载、改善脑坏死小鼠的预后。在脑损伤过程中,15LO-PE结合蛋白(phosphatidylethanolamine-binding protein 1,PEBP1)作为细胞从坏死到铁死亡的转换器,抑制RIP3、激活ALOX15,促进脂质过氧化,发生铁死亡[33]。而维生素E能发挥铁死亡抑制剂的作用。维生素E处理后能减轻放疗后海马神经元细胞的氧化应激反应,抑制脂质过氧化并降低细胞内铁离子浓度,有效抑制铁坏死发生,减少放射性神经损伤[34]。
三、铁死亡与放射防护策略随着研究的深入,以铁死亡为靶点设计的调节剂可能会为降低放疗风险提供新的选择,但具体的评估体系和防治方案仍有许多不明确之处,有关用药时机、剂量、给药形式和持续时间等均有待深入的探讨。放疗背景下的铁死亡抑制剂能否被特异性地限制在正常细胞中,而不影响肿瘤细胞的放射敏感性,是必须考虑的问题,也为防护制剂的开发提出了更多的挑战。此外,目前有关铁死亡病理生理学影响和作用机制的研究主要在动物和细胞水平中进行,缺乏对其临床安全性和有效性的评估,尚无制剂进入临床试验或真实世界实践。因此,未来需要更多的实验来验证铁死亡在人体放射性损伤中的防护作用。
四、结语与展望通过深入研究放疗后正常组织和细胞铁死亡的方式和机制,减少放射损伤,提高放射防护,为减轻放射损伤提供了一种潜在的新策略,对改善肿瘤患者的预后和生活质量至关重要。因此基于铁死亡分子调控机制的放射损伤防护应用有着巨大的研究前景和发展潜力。相信不久的未来将会有更多有价值的资料呈现。
利益冲突 无
作者贡献声明 王清鑫、王中秋起草及撰写文章;王伟、王佩国审阅及修改文章
| [1] |
Wang K, Tepper JE. Radiation therapy-associated toxicity: Etiology, management, and prevention[J]. CA Cancer J Clin, 2021, 71(5): 437-454. DOI:10.3322/caac.21689 |
| [2] |
Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [3] |
Chen X, Kang R, Kroemer G, et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18(5): 280-296. DOI:10.1038/s41571-020-00462-0 |
| [4] |
Kawabata H. Transferrin and transferrin receptors update[J]. Free Radic Biol Med, 2019, 133: 46-54. DOI:10.1016/j.freeradbiomed.2018.06.037 |
| [5] |
He YJ, Liu XY, Xing L, et al. Fenton reaction-independent ferroptosis therapy via glutathione and iron redox couple sequentially triggered lipid peroxide generator[J]. Biomaterials, 2020, 241: 119911. DOI:10.1016/j.biomaterials.2020.119911 |
| [6] |
Liu Y, Wan Y, Jiang Y, et al. GPX4: The hub of lipid oxidation, ferroptosis, disease and treatment[J]. Biochim Biophys Acta Rev Cancer, 2023, 1878(3): 188890. DOI:10.1016/j.bbcan.2023.188890 |
| [7] |
Lee N, Carlisle AE, Peppers A, et al. xCT-driven expression of gpx4 determines sensitivity of breast cancer cells to ferroptosis inducers[J]. Antioxidants (Basel), 2021, 10(2): 317. DOI:10.3390/antiox10020317 |
| [8] |
Ma XH, Liu JH, Liu CY, et al. ALOX15-launched PUFA-phospholipids peroxidation increases the susceptibility of ferroptosis in ischemia-induced myocardial damage[J]. Signal Transduct Target Ther, 2022, 7(1): 288. DOI:10.1038/s41392-022-01090-z |
| [9] |
Rochette L, Dogon G, Rigal E, et al. Lipid peroxidation and iron metabolism: Two corner stones in the homeostasis control of ferroptosis[J]. Int J Mol Sci, 2022, 24(1): 449. DOI:10.3390/ijms24010449 |
| [10] |
Lei G, Mao C, Yan Y, et al. Ferroptosis, radiotherapy, and combination therapeutic strategies[J]. Protein Cell, 2021, 12(11): 836-857. DOI:10.1007/s13238-021-00841-y |
| [11] |
Ji Q, Fu S, Zuo H, et al. ACSL4 is essential for radiation-induced intestinal injury by initiating ferroptosis[J]. Cell Death Discov, 2022, 8(1): 332. DOI:10.1038/s41420-022-01127-w |
| [12] |
Liao P, Wang W, Wang W, et al. CD8(+) T cells and fatty acids orchestrate tumor ferroptosis and immunity via ACSL4[J]. Cancer Cell, 2022, 40(4): 365-378. DOI:10.1016/j.ccell.2022.02.003 |
| [13] |
Li X, Zhuang X, Qiao T. Role of ferroptosis in the process of acute radiation-induced lung injury in mice[J]. Biochem Biophys Res Commun, 2019, 519(2): 240-245. DOI:10.1016/j.bbrc.2019.08.165 |
| [14] |
Li X, Duan L, Yuan S, et al. Ferroptosis inhibitor alleviates radiation-induced lung fibrosis (RILF) via down-regulation of TGF-β1[J]. J Inflamm (Lond), 2019, 16: 11. DOI:10.1186/s12950-019-0216-0 |
| [15] |
Li X, Chen J, Yuan S, et al. Activation of the P62-Keap1-NRF2 pathway protects against ferroptosis in radiation-induced lung injury[J]. Oxid Med Cell Longev, 2022, 2022: 8973509. DOI:10.1155/2022/8973509 |
| [16] |
Guo XW, Zhang H, Huang JQ, et al. PIEZO1 ion channel mediates ionizing radiation-induced pulmonary endothelial cell ferroptosis via Ca(2+)/calpain/ve-cadherin signaling[J]. Front Mol Biosci, 2021, 8: 725274. DOI:10.3389/fmolb.2021.725274 |
| [17] |
Li L, Wu D, Deng S, et al. NVP-AUY922 alleviates radiation-induced lung injury via inhibition of autophagy-dependent ferroptosis[J]. Cell Death Discov, 2022, 8(1): 86. DOI:10.1038/s41420-022-00887-9 |
| [18] |
Wang L, Wang A, Fu Q, et al. Ferroptosis plays an important role in promoting ionizing radiation-induced intestinal injuries[J]. Biochem Biophys Res Commun, 2022, 595: 7-13. DOI:10.1016/j.bbrc.2022.01.068 |
| [19] |
Xie LW, Cai S, Zhao TS, et al. Green tea derivative (-)-epigallocatechin-3-gallate (EGCG) confers protection against ionizing radiation-induced intestinal epithelial cell death both in vitro and in vivo[J]. Free Radic Biol Med, 2020, 161: 175-186. DOI:10.1016/j.freeradbiomed.2020.10.012 |
| [20] |
Zhou H, Zhou YL, Mao JA, et al. NCOA4-mediated ferritinophagy is involved in ionizing radiation-induced ferroptosis of intestinal epithelial cells[J]. Redox Biol, 2022, 55: 102413. DOI:10.1016/j.redox.2022.102413 |
| [21] |
Vats K, Kruglov O, Mizes A, et al. Keratinocyte death by ferroptosis initiates skin inflammation after UVB exposure[J]. Redox Biol, 2021, 47: 102143. DOI:10.1016/j.redox.2021.102143 |
| [22] |
Feng Z, Qin Y, Huo F, et al. NMN recruits GSH to enhance GPX4-mediated ferroptosis defense in UV irradiation induced skin injury[J]. Biochim Biophys Acta Mol Basis Dis, 2022, 1868(1): 166287. DOI:10.1016/j.bbadis.2021.166287 |
| [23] |
Gan F, Wang R, Lyu P, et al. Plasma-derived exosomes boost the healing of irradiated wound by regulating cell proliferation and ferroptosis[J]. J Biomed Nanotechnol, 2021, 17(1): 100-114. DOI:10.1166/jbn.2021.3008 |
| [24] |
Zha J, Pan Y, Liu X, et al. Exosomes from hypoxia-pretreated adipose-derived stem cells attenuate ultraviolet light-induced skin injury via delivery of circ-Ash1l[J]. Photodermatol Photoimmunol Photomed, 2023, 39(2): 107-115. DOI:10.1111/phpp.12857 |
| [25] |
Yin J, Hu N, Yi L, et al. Identification of ferroptosis biomarker in ahh-1 lymphocytes associated with low dose radiation[J]. Health Phys, 2021, 120(5): 541-551. DOI:10.1097/HP.0000000000001385 |
| [26] |
Zhang X, Tian M, Li X, et al. Hematopoietic protection and mechanisms of ferrostatin-1 on hematopoietic acute radiation syndrome of mice[J]. Int J Radiat Biol, 2021, 97(4): 464-473. DOI:10.1080/09553002.2021.1876956 |
| [27] |
Zhang X, Xing X, Liu H, et al. Ionizing radiation induces ferroptosis in granulocyte-macrophage hematopoietic progenitor cells of murine bone marrow[J]. Int J Radiat Biol, 2020, 96(5): 584-595. DOI:10.1080/09553002.2020.1708993 |
| [28] |
Thermozier S, Hou W, Zhang X, et al. Anti-ferroptosis drug enhances total-body irradiation mitigation by drugs that block apoptosis and necroptosis[J]. Radiat Res, 2020, 193(5): 435-450. DOI:10.1667/RR15486.1 |
| [29] |
Liu C, Liao W, Chen J, et al. Cholesterol confers ferroptosis resistance onto myeloid-biased hematopoietic stem cells and prevents irradiation-induced myelosuppression[J]. Redox Biol, 2023, 62: 102661. DOI:10.1016/j.redox.2023.102661 |
| [30] |
Sun Z, Zhang J, Zeng F, et al. Differentially expressed mrnas and potential mechanisms of radiation-induced tut4(-/-) esophageal cell injury[J]. Dose Response, 2022, 20(4): 15593258221136810. DOI:10.1177/15593258221136810 |
| [31] |
Rittase WB, Slaven JE, Suzuki YJ, et al. Iron deposition and ferroptosis in the spleen in a murine model of acute radiation syndrome[J]. Int J Mol Sci, 2022, 23(19): 11029. DOI:10.3390/ijms231911029 |
| [32] |
Farzipour S, Jalali F, Alvandi M, et al. Ferroptosis inhibitors as new therapeutic insights into radiation-induced heart disease[J]. Cardiovasc Hematol Agents Med Chem, 2023, 21(1): 2-9. DOI:10.2174/1871525720666220713101736 |
| [33] |
Lamade AM, Wu L, Dar HH, et al. Inactivation of RIP3 kinase sensitizes to 15LOX/PEBP1-mediated ferroptotic death[J]. Redox Biol, 2022, 50: 102232. DOI:10.1016/j.redox.2022.102232 |
| [34] |
任陈, 李旋子, 杜莎莎. 维生素E通过抑制铁坏死减少放射性神经损伤[J]. 南方医科大学学报, 2020, 40(8): 1097-1102. Ren C, Li XZ, Du SS. Vitamin E reduces radiation injury of hippocampal neurons in mice by inhibiting ferroptosis[J]. J South Med Univ, 2020, 40(8): 1097-1102. DOI:10.12122/j.issn.1673-4254.2020.08.05 |
 2024, Vol. 44
2024, Vol. 44


