甲状腺癌(thyroid cancer,TC)是内分泌系统最常见的恶性肿瘤,我国新发甲状腺癌病例数占全球的15.6%,甲状腺癌死亡人数占全球甲状腺癌死亡人数的13.8%,并有逐年上升趋势,严重威胁人们的身心健康[1-2]。其中,分化型甲状腺癌(differentiated thyroid carcinoma, DTC)占95%以上[3]。根据患者发病是否有家族聚集倾向,DTC可以分为家族性DTC(familial DTC,FDTC)和散发性DTC(sporadic DTC,SDTC)。FDTC占所有甲状腺癌的3%~9%,家族一级亲属中有≥2例DTC,且排除其他遗传因素及环境因素的患者,称为FDTC[4-5]。近年来关于FDTC的研究较少,且存在一定争议[6],但已有研究多认为与SDTC相比,FDTC具有较高的侵袭性,且预后更差[7]。“全甲状腺或近全甲状腺切除术+选择性131I治疗(radioiodine therapy,RIT) +促甲状腺激素(TSH)抑制治疗”是公认的成人DTC较完整的标准治疗模式[3]。然而,关于FDTC患者RIT相关的研究较少,且FDTC患者接受RIT后的临床转归以及初次RIT反应是否可以预测其长期预后,仍需进一步研究。本研究回顾性探讨了FDTC与SDTC患者的临床病理特征,分析其首次RIT治疗反应及临床转归,筛选影响患者临床转归的危险因素,为今后FDTC患者131I治疗方案的精准实施提供数据支持。
资料与方法 1、患者资料回顾性筛选2016年1月至2022年1月于天津医科大学总医院核医学科接受RIT的DTC患者2 238例,其中FDTC患者132例,最终入组120例,其中男性34例,女性86例,年龄(43.05±12.99)岁;采用1 ∶4的倾向匹配后的匹配队列进行比较。匹配变量包括年龄、性别、原发肿瘤大小、甲状腺外浸润、淋巴结转移[8]。临床资料完整的SDTC患者480例,其中男性149例,女性331例,年龄(44.34±12.98)岁。所有患者均已行全甲状腺切除±颈部淋巴结清扫术,术后按常规流程评估后行RIT。纳入标准:家族性一级亲属中有≥2例DTC患者;无颈部放射史、高碘地区生活史及高碘饮食史;无家族性癌症综合征(家族性腺瘤样息肉病、家族性多发性结肠息肉-骨瘤-软组织瘤综合征、多发性错构瘤、Carney综合征、Werner综合征)[5, 9];抗甲状腺球蛋白抗体(TgAb) < 20 U/ml;临床资料完整。排除标准:有颈部放射史、高碘地区生活史及高碘饮食史;合并其他恶性肿瘤;TgAb > 20 U/ml;临床资料不完整。本研究经天津医科大学总医院医学伦理委员会批准(审批号:IRB2023-WZ-083)。
2、治疗方案与指标检测本研究患者依据2015年美国甲状腺协会(American Thyroid Association, ATA)指南[10],分别给予131I 3.7~7.4 GBq治疗,RIT后24 h加用左甲状腺素钠替代及抑制治疗,并定期随访血清及影像学相关检查,包括促甲状腺素(thyroid stimulating hormone,TSH)、术后刺激状态甲状腺球蛋白(post-operative stimulated serum thyroglobulin, p-sTg),Tg(采用电化学发光免疫分析法测定,瑞士Roche公司,E170);影像学检查包括颈部超声、CT、MR、131I全身显像、全身骨显像、正电子发射断层成像/计算机体层成像(PET/CT)等。
3、临床病例资料收集收集资料包括年龄、性别、家系中发病代数、术后距RIT时间、病理类型(乳头状癌、滤泡状癌或混合型)、肿瘤最大径、是否多灶、单双侧、周围软组织侵犯、TNM分期、复发危险度分层、首次131I治疗反应、末次随访疾病状态等,采用第7版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)甲状腺癌TNM分期,复发危险度分层采用2015年ATA指南。
4、治疗后疗效评估本研究主要评估指标为Tg、影像学结果、初次RIT治疗反应及末次随访疾病状态。初次RIT治疗反应评估根据初次RIT后3~6个月临床资料,分为无病(no clinical evidence of disease, NED)、生化疾病持续(biochemical persistent disease, BPD)、结构或功能性疾病持续(structural/functional persistent disease, S/FPD)[11]3个亚组,末次随访分为NED及非NED(BPD+S/FPD)组,筛选未能达到NED的危险因素。分析FDTC及SDTC组患者随访1、3、5年NED亚组患者无病生存(DFS,disease-free survival)率;随访BPD及S/FPD亚组无进展生存(PFS,progression-free survival)率。
5、统计学处理采用SPSS 20.0软件进行统计学分析。符合正态分布的定量资料以x±s表示,定性资料以频数(百分比)表示。采用独立样本t检验、χ2检验、二元单因素logistic回归及二元多因素logistic回归分析统计方法进行组间比较分析。P < 0.05为差异有统计学意义。
结果 1、SDTC患者家族性特征根据患病者与家系其他患病亲属关系,50例患者的直系亲属(父母、祖父母或子女)患病(若亲属中直系及旁系均患病则归为直系组),首次RIT治疗反应评估为NED、BPD及S/FPD分别为22、21及7例;70例为旁系亲属(即兄弟姐妹)患病,NED、BPD及S/FPD分别为34、28及8例,两组间差异无统计学意义(P=0.57)。58例为家系中发病的第1代,62例为发病的第2或第3代,第1代及非第1代患者末次随访疾病状态为NED、非NED分别为33、25及36、26例,两组间差异无统计学意义(P=0.75)。
2、两组患者临床资料比较FDTC组多灶性、软组织浸润、TNM分期及复发风险分层高于SDTC组患者(χ2=8.99~47.38,P < 0.05,表 1),而两组在年龄、性别、病理类型、高危亚型、双侧病灶、病灶最大径、p-sTg等因素间差异均无统计学意义(P>0.05,表 1)。
|
|
表 1 FDTC和SDTC两组患者临床病理资料比较 Table 1 Comparison of demographic and pathological data of the FDTC and SDTC groups |
3、两组患者首次治疗RIT反应及末次随访临床转归评估及分析
根据首次RIT后3~6个月血清及影像学资料评估,FDTC及SDTC组达到NED、BPD及S/FPD状态的患者分别为56(46.7%)、50(41.7%)、14(11.6%)及284(59.1%)、160(33.3%)、36(7.5%)例,SDTC组患者NED比例高于FDTC组,BPD及S/FPD比例低于FDTC组(χ2=10.10,P=0.013)。末次随访(中位随访时间为47个月) FDTC及SDTC组,NED、BPD及S/FPD患者分别为71(59.1%)、36(30.1%)、13(10.8%)及337(70.2%)、114(23.7%)、29(6.1%)例(χ2=8.99,P=0.026)。
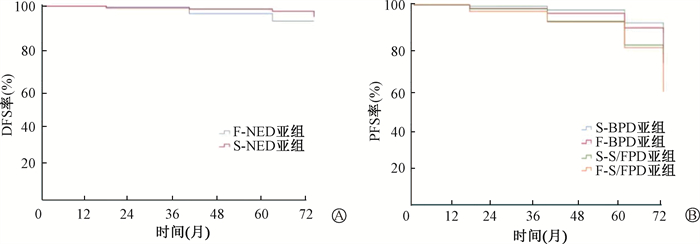
FDTC及SDTC组中,1、3、5年NED亚组患者DFS率分别为100%、96.2%、92.4%及100%、98.5%、97.4%,两组患者均未监测到中位DFS(图 1A);随访1、3、5年,BPD亚组患者PFS率分别为98.1%、95.7%、88.3%及99.3%、97.4%、90.8%(图 1B);随访1、3、5年S/FPD亚组PFS率分别为96.7%、91.4%、78.2%及98.0%、91.6%、79.6%(图 1B)。
|
注:DFS.无病生存;PFS.无进展生存 图 1 NED亚组患者DFS及BPD、S/FPD亚组PFS分析 Figure 1 DFS of the NED subgroup and PFS of the BPD and S/FPD subgroups |
4、末次随访未达到NED状态危险因素分析
采用二元logistic单因素分析显示,肿瘤最大径、T分期、M分期、复发危险度分层、p-sTg与末次随访是否达到NED状态相关(χ2=6.37~13.10,P < 0.05);进一步采用二元logistic多因素回归分析显示,T分期和p-sTg是影响患者是否达到NED状态的独立危险因素。即T分期及p-sTg越高,患者末次随访越难达到NED状态(表 2)。
|
|
表 2 二元多因素logisitic回归分析患者末次随访是否能达到NED的影响因素 Table 2 Multivariate binary logistic regression analysis of factors affecting the achievement of the NED status of patients during the last follow-up |
讨论
甲状腺癌是最常见的内分泌恶性肿瘤,非髓样甲状腺癌(non-medullary thyroid carcinoma,NMTC) 由滤泡细胞起源,占所有病例的90%。3%~9%的NMTC病例是家族性起源的[7]。DTC是NMTC最常见的组织学亚型[2, 12]。随着甲状腺癌发病率升高,FDTC也逐渐被报道及重视,但缺乏对RIT及其相对长期临床转归相关的研究[13-14]。由于FDTC患者的特殊性,如何更精准地制定RIT方案,亟待更多高质量的循证医学证据。本研究系统性回顾分析了接受RIT的FDTC及SDTC患者的临床资料,并对两组患者临床病理差异及临床转归进行探讨。
关于FDTC的侵袭性虽然尚有争议[14],但多个研究发现FDTC较SDTC的侵袭性更高,通常表现为多灶性、淋巴结转移范围广泛、复发风险更高,且患者发病年龄更早[7, 9, 14-15]。据报道,FDTC患者肿物多灶性及双边性比例波动范围较大,多灶性比例为32.0%~71.8%,双边性比例30.2%~ 50.2%[16-17];花文娟等[4]研究显示,FDTC及SDTC患者多灶性和双边性发生率分别为48.5%、45.5%及41.0%、31.2%。本研究FDTC组患者多灶性和双边性发生率为77.5%和62.5%,高于SDTC组患者,其发生率为48.5%及45.0%。本研究中FDTC患者的平均发病年龄略高于花文娟等[4]的研究,与Tavarelli等[18]研究相仿,但3个研究中FDTC组患者平均发病年龄均低于SDTC组患者。本研究还发现,与SDTC组相比,FDTC患者更易出现肿瘤多灶性、软组织侵润,且TNM分期及复发危险度分层更高,但两组患者病理类型及p-sTg无明显差异。虽然FDTC组患者发病年龄早于SDTC组,但差异无统计学意义。有学者分析,具有亲子关系家系特征的FDTC恶性程度更高,尤其是第2代发病患者转移率较第1代患者更高。本研究中,第1代及非第1代患病FDTC患者NED、BPD及S/FPD构成比无明显差异,即未发现患者临床转归与其在家系中发病代数相关。
Marco团队的一项关于82例FDTC患者的研究中,83.2%的患者接受过RIT,在末次随访中,FDTC及SDTC患者的临床治愈率分别为79.3%及84.3%,但差异无统计学意义[13]。Lee等[8]研究发现,中位随访期为142个月(25~273个月)期间,SDTC组64例患者(7.5%)复发,FDTC组29例(10.1%)复发。大多数患者有局部复发(89/93),只有4例患者(均为SNMTC组)发生远处转移,但差异无统计学意义。本研究中,末次随访时FDTC及SDTC组患者NED状态率分别为59.1%及70.2%,差异有统计学意义。本研究中,FDTC患者治愈率低于Marco的相关研究,可能与研究患者复发危险度分层构成比不同相关,因此临床治愈率低于上述研究。与Lee等[8]研究不同,本研究中,FDTC及SDTC组中NED亚组患者均没有观察到中位DFS值,5年DFS率分别为92.4%及97.4%;BPD亚组5年PFS率分别为88.2%、78.2%,S/FPD亚组5年PFS率分别为90.8%、79.6%,即FDTC患者的临床转归差于SDTC患者。因此,对于首次RIT治疗反应评估为BPD及S/FPD的患者的随访应更积极,以期尽早发现患者病情变化。
众所周知,T分期越高,提示局部侵犯相对越重;p-sTg越高存在转移灶风险越高。肿瘤最大径、T分期、软组织侵润、M分期、复发危险度分层、p-sTg与末次随访是否达到NED状态相关;进一步采用二元logistic多因素回归分析显示T分期、p-sTg是影响患者是否达到NED状态的独立危险因素。即T分期及p-sTg越高,患者末次随访越难达到NED状态。因此,对于T分期或p-sTg较高的患者RIT应该更积极,RIT后的随访应更密切。
本研究尚有一些不足之处。首先,本研究是一项回顾性研究,所有数据都来源于患者历史病例资料,FDTC患者群体的相对较小,本研究的小样本量可能导致不可避免的选择偏差;其次,甲状腺癌患者生存期长、死亡率低,本研究随访时间相对较短,且部分患者未进行基因检测,未纳入患者疾病相关死亡率、复发率、基因检测等数据资料;最后,由于在疾病状态评估和血清学疗效评估方面存在争议,甲状腺球蛋白抗体(TgAb)阳性患者未纳入本研究。以上不足之处有待在下一步研究改进,从而更好地了解FDTC。
综上,基于本研究发现,初始RIT的反应有助于指导DTC患者的后续治疗和随访策略,SDTC患者临床转归优于FDTC患者,因此,对FDTC患者应提高前站RIT的警惕性,适当增加患者随访频率;对其一级亲属进行预防性筛查,以便更早地进行诊治。对于p-sTg及T分期较高患者,可酌情增加首次RIT剂量,缩短随访间隔,以期达到更好的治疗效果。
利益冲突 所有作者声明无利益冲突
作者贡献声明 季艳会、王萱、李雪、孙丹阳负责论文撰写、资料收集;肖茜、何雅静负责数据整理、统计分析;孟召伟、贾强、谭建、郑薇负责研究指导、论文修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Megwalu UC, Moon PK. Thyroid cancer incidence and mortality trends in the United States: 2000-2018[J]. Thyroid, 2022, 32(5): 560-570. DOI:10.1089/thy.2021.0662 |
| [3] |
中华医学会与核医学分会. 131I治疗分化型甲状腺癌指南(2021版)[J]. 中华核医学与分子影像杂志, 2021, 41(4): 218-241. Chinese Society of Nuclear Medicine. Guidelines for radioiodine therapy of differentiated thyroid cancer (2021 edition)[J]. Chin J Nucl Med Mol Imaging, 2021, 41(4): 218-241. DOI:10.3760/cma.j.cn321828-20201113-00412 |
| [4] |
花文娟, 张雅婧, 杜成成, 等. 家族性分化型甲状腺癌131I初次治疗后的疗效分析[J]. 中华核医学与分子影像杂志, 2021, 41(4): 201-206. Hua WJ, Zhang YJ, Du CC, et al. Analysis of curative effect after initial 131I treatment of familial differentiated thyroid cancer[J]. Chin J Nucl Med Mol Imaging, 2021, 41(4): 201-206. DOI:10.3760/cma.j.cn321828-20210201-00019 |
| [5] |
Sezer H, Demirkol MO, Yazici D, et al. The clinicopathologic characteristics of familial and sporadic papillary thyroid carcinoma in Turkish patients[J]. Turk J Med Sci, 2020, 50(2): 360-368. DOI:10.3906/sag-1907-94 |
| [6] |
Shafiei S, Sadrolodabaei M, Aghaei A, et al. Longer time to reach excellent response to treatment in familial versus sporadic non-medullary thyroid cancer (NMTC): a matched case-control study[J]. Int J Endocrinol Metab, 2021, 19(2): e108781. DOI:10.5812/ijem.108781 |
| [7] |
Guda BB, Komisarenko Ⅱ, Ostafiichuk MV, et al. Familial non-medullary thyroid carcinoma[J]. Exp Oncol, 2023, 45(1): 70-78. DOI:10.15407/exp-oncology.2023.01.070 |
| [8] |
Lee YM, Jeon MJ, Kim WW, et al. Comparison between familial and sporadic non-medullary thyroid carcinoma: a retrospective individual risk factor-matched cohort study[J]. Ann Surg Oncol, 2021, 28(3): 1722-1730. DOI:10.1245/s10434-020-09025-0 |
| [9] |
Ammar SA, Alobuia WM, Kebebew E. An update on familial nonmedullary thyroid cancer[J]. Endocrine, 2020, 68(3): 502-507. DOI:10.1007/s12020-020-02250-3 |
| [10] |
Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1-133. DOI:10.1089/thy.2015.0020 |
| [11] |
Sung TY, Jeon MJ, Lee YH, et al. Initial and dynamic risk stratification of pediatric patients with differentiated thyroid cancer[J]. J Clin Endocrinol Metab, 2017, 102(3): 793-800. DOI:10.1210/jc.2016-2666 |
| [12] |
Rabold K, Zoodsma M, Grondman I, et al. Reprogramming of myeloid cells and their progenitors in patients with non-medullary thyroid carcinoma[J]. Nat Commun, 2022, 13(1): 6149. DOI:10.1038/s41467-022-33907-4 |
| [13] |
Capezzone M, Fralassi N, Secchi C, et al. Long-term clinical outcome in familial and sporadic papillary thyroid carcinoma[J]. Eur Thyroid J, 2020, 9(4): 213-220. DOI:10.1159/000506955 |
| [14] |
Valerio L, Cantara S, Puxeddu E, et al. Non-syndromic familial non-medullary thyroid carcinoma: clinical and genetic update[J]. Front Endocrinol (Lausanne), 2022, 13: 891903. DOI:10.3389/fendo.2022.891903 |
| [15] |
Spinelli C, Piccolotti I, Bertocchini A, et al. Familial non-medullary thyroid carcinoma in pediatric age: our surgical experience[J]. World J Surg, 2021, 45(8): 2473-2479. DOI:10.1007/s00268-021-06104-5 |
| [16] |
Hillenbrand A, Varhaug JE, Brauckhoff M, et al. Familial nonmedullary thyroid carcinoma-clinical relevance and prognosis. A European multicenter study. ESES Vienna presentation[J]. Langenbecks Arch Surg,, 2010, 395(7): 851-858. DOI:10.1007/s00423-010-0696-0 |
| [17] |
Capezzone M, Robenshtok E, Cantara S, et al. Familial non-medullary thyroid cancer: a critical review[J]. J Endocrinol Invest, 2021, 44(5): 943-950. DOI:10.1007/s40618-020-01435-x |
| [18] |
Tavarelli M, Russo M, Terranova R, et al. Familial non-medullary thyroid cancer represents an independent risk factor for increased cancer aggressiveness: a retrospective analysis of 74 families[J]. Front Endocrinol (Lausanne), 2015, 6: 117. DOI:10.3389/fendo.2015.00117 |
 2024, Vol. 44
2024, Vol. 44


