世界范围内,乳腺癌已经成为女性最常见的恶性肿瘤之一[1]。手术治疗联合放射治疗可降低乳腺癌患者的局部及远处复发率,改善患者预后[2]。在乳腺癌的放射治疗,尤其是左侧乳腺癌中,由于乳腺肿瘤贴近正常组织(心脏和肺等),这些器官会不可避免地受到一定剂量的辐射损伤。研究表明,左侧乳腺癌在自由呼吸状态下进行放射治疗,可能受心脏不良反应的影响而使其疗效降低[3-4]。使用深吸气屏气(deep inspiration breath-hold, DIBH)技术,可显著降低放疗对心脏及其亚结构的照射剂量,改善此类患者的心脏不良反应风险[5-6]。与此同时,在乳腺癌呼吸控制中使用光学体表成像技术引导放射治疗(surface guided radiation therapy,SGRT),可以实时动态监测患者体表位置和呼吸运动,从而实现非电离、高精度的定位,在乳腺癌DIBH门控放疗(DIBH-SGRT)中得到广泛应用[7]。
在乳腺癌的实际治疗过程中,摆位误差、呼吸运动、乳房形状变化等因素可能导致计划剂量与实际剂量之间出现偏差[8]。基于电子射野影像装置的三维在体剂量(electronic portal imaging device-based in-vivo dosimetry,EIVD)验证系统已经被证明能够检测放射治疗实际剂量传输过程中的相关问题[9],并且是提高乳腺癌放射治疗安全性的有用工具[10]。而针对门控放疗的乳腺癌患者,在体剂量的结果如何,是值得关注的问题。
本研究回顾性分析浙江大学医学院附属妇产科医院行DIBH-SGRT的左侧乳腺癌患者数据,比较计划剂量与EIVD测量剂量的差异,探讨影响γ通过率的相关指标和因素,为门控放疗的乳腺癌患者行在体剂量验证提供临床应用参考。
资料与方法 1、患者资料选取2023年3月至11月浙江大学医学院附属妇产科医院放疗科20例左侧乳腺癌保乳术后患者,平均年龄(41.68±7.04)岁(21~51岁),既往身体健康,无其他合并症,顺利完成整个DIBH-SGRT过程。所有患者均知情同意。
2、呼吸训练及CT模拟定位患者平躺、手臂上举抱头、制作个体化塑形垫进行体位固定,采用胸式呼吸训练方法。使用安装在CT定位室的激光表面扫描仪(Sentinel, 瑞典C-RAD AB公司)进行呼吸门控设置:通过Sentinel获取患者自由呼吸的参考图像,并将门控点的位置设置在剑突附近或胸骨中部;患者深吸气屏气,根据呼吸幅度,设定门控窗,窗宽控制在2~3 mm。使用德国西门子公司的SOMATOM Conference大孔径CT模拟定位机获取患者DIBH的CT图像,扫描范围上至乳突,下至膈下,图像层厚为5 mm。
3、勾画及计划设计临床医师在DIBH图像上勾画肿瘤靶区与危及器官,肿瘤靶区包括计划瘤床靶区体积(PTV_TB)、计划靶区体积(PTV),危及器官包括心脏、左侧冠状动脉、左肺、右肺、右侧乳腺。处方剂量给予PTV_TB为5 750 cGy/25次,PTV为5 000 cGy/25次。使用瑞典医科达Infinity直线加速器的6 MV FFF光子线能量在Monaco治疗计划系统(V6.0.)上设计4~6个切线野的动态调强放疗计划(dynamic multi-leaf collimator,DMLC)。经高年资临床医师与高年资物理师审核后,计划分别发送至加速器网络、光学体表系统与EIVD系统(Master V1.0,广州瑞多思公司)。
4、计划实施与在体剂量验证治疗摆位时,采用加速器端的激光表面扫描仪(Catalyst, 瑞典C-Rad AB公司)进行位置验证(线性偏差<3 mm,旋转偏差<2°)。采集患者DIBH过程中的CBCT图像,并修正位置误差。DIBH-SGRT通过医科达Response接口触发,Catalyst系统同时用于监测患者治疗中位置误差,并记录患者实时屏气的6个位置自由度偏移数值,包括3个线性方向左右(Lat)、进出(Long)、升降(Vert)和3个旋转方向左右旋转(Rot)、滚动旋转(Roll)、俯仰旋转(Pitch)。治疗过程同步进行在体剂量验证,EIVD系统会通过数据采集软件DAS自动获取每个射野的出束信息,通过迭代算法,反推通量分布,结合患者计划CT图像,计算体内剂量分布。
5、γ通过率与剂量学指标采用全局分析方法计算DIBH-SGRT的γ通过率。按文献[11-12]推荐,采用3类γ通过率2 mm/2%、3 mm/3%和3 mm/5%,剂量阈值(TH)均为10%。采用DVH指标评估计划剂量与EIVD测量剂量之间的差异。肿瘤靶区的评估采用平均剂量Dmean、2%、98%体积接受的辐射剂量D2、D98;正常组织的评估包括:心脏、左侧冠状动脉、左肺、右肺、右侧乳腺的Dmean,心脏的V500、V1 000、V2 000,左肺的V500、V2 000、V3 000。
6、统计学处理采用SPSS 19.0软件对数据进行统计处理。数据满足正态分布,结果用x±s表示。对肿瘤靶区、危及器官数据结果进行配对样本t检验。采用Pearson相关性分析,计算3类γ通过率与剂量学差异、DIBH位移偏差间的相关性。P < 0.05为差异有统计学意义。
结果 1、分次内DIBH位移偏差统计CBCT扫描后的分次内监测数据。在6个位置自由度中,线性方向Lat、Long、Vert的平均偏移量分别为(1.11±0.78)、(1.50±0.46)和(1.04±0.26)mm,旋转方向Rot、Roll、Pitch的平均偏移量分别为(0.51±0.15)°、(0.67±0.29)°和(0.72±0.18)°
2、γ通过率DIBH-SGRT的2 mm/2%、3 mm/3%、3 mm/5%的γ通过率分别为(73.43±4.29)%、(86.00±2.97)%和(92.96±1.73)%。
3、测量剂量与计划剂量的差异肿瘤靶区与计划设计时数据相比(表 1),在PTV_TB和PTV Dmean的平均剂量偏差为0.23%和0.59%,在D2的平均剂量偏差为3.04%和1.87%,在D98的平均剂量偏差为3.19%和2.88%。危及器官与计划设计时数据相比(表 2),心脏、左侧冠状动脉、右侧乳腺、右肺的Dmean均显示剂量学差异(t=-20.72、-17.68、-16.16、-16.79,P<0.001),心脏与左肺的体积剂量的剂量学差异无统计学意义(P>0.05)。在3类γ通过率下患者经EIVD验证的剂量差异示于图 1。
|
|
表 1 测量剂量与计划剂量在肿瘤靶区的剂量学参数比较(cGy,x±s) Table 1 Comparison of dosimetric parameters between measured dose and planned dose in planning target volumes (cGy, x±s) |
|
|
表 2 测量剂量与计划剂量在危及器官的剂量学参数比较(x±s) Table 2 Comparison of dosimetric parameters between measured dose and planned dose in organs at risk (x±s) |
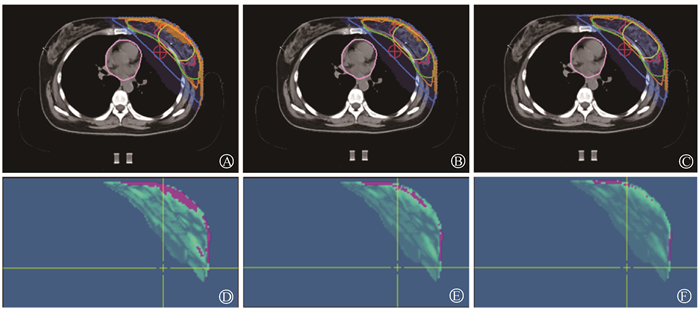
|
注:A、B、C中黄色线为PTV_TB,绿色线为PTV,粉色线为心脏;红色线为处方剂量5 750 cGy剂量线,橘黄色线为处方剂量5 000 cGy剂量线,蓝色线为2 000 cGy剂量线;橙黄色区域为测量剂量与计划剂量的偏差;D、E、F中红色区域为γ计算不通过区域 图 1 基于EIVD验证的剂量分布差异A、D.γ通过率在2 mm/2%的剂量分布差异;B、E.γ通过率在3 mm/3%的剂量分布差异;C、F.γ通过率在3 mm/5%的剂量分布差异 Figure 1 Differences in dose distribution derived from EIVD verification A, D. Differences in dose distribution under the γ pass rate with a criterion of 2 mm/2%; B, E. Differences in dose distribution under the γ-pass rate with a criterion of 3 mm/3%; C, F. Differences in dose distribution under the γ-pass rate with a criterion of 3 mm/5% |
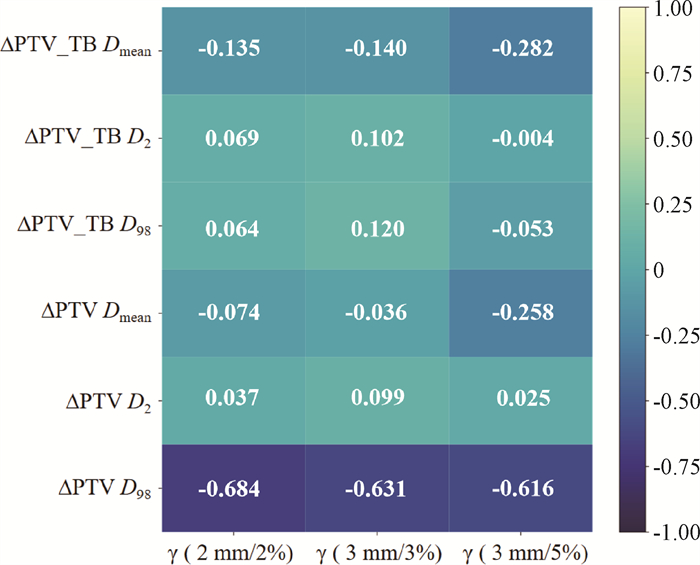
4、肿瘤靶区剂量学差异与γ通过率间的相关性
2 mm/2%、3 mm/3%、3 mm/5%的γ通过率除了在PTV D98呈现中等强度的相关(R=-0.684、-0.631、-0.616,P < 0.05)外,在其余肿瘤靶区剂量差异间均呈现出弱相关或无相关。相关性分析热图示于图 2。
|
图 2 肿瘤靶区剂量学差异与γ通过率间的相关性分析热图 Figure 2 Heat map showing the correlation between dosimetric differences in planning target volumes and γ pass rates |
5、分次内DIBH位移偏差与γ通过率间的相关性
2 mm/2%的γ通过率在Lat与Vert方向呈现出强相关(R=-0.809、-0.762,P < 0.05),3 mm/3%同样在这2个线性方向呈现强相关(R=-0.718、-0.757,P < 0.05)。所有γ通过率在3个旋转方向均呈现出弱相关或无相关(图 3)。

|
注:Lat. 左右方向;Long. 进出方向;Vert. 升降方向;Rot. 左右旋转方向; Roll. 滚动旋转方向;Pitch. 俯仰旋转方向 图 3 分次内位移偏差与γ通过率间的相关性分析热图 Figure 3 Heat map showing the correlation between displacement deviations and γ pass rates |
讨论
在体剂量验证技术可以为精准调强放疗提供有效的端到端质量保证,并且能够检测实际照射剂量与计划剂量之间的差异[13]。Olaciregui-Ruiz等[14]发现,使用反投影技术对电子射野影像装置(EPID)数据进行分析时,可以检测到患者的位移。Steers等[15]证明在体EPID图像是监测患者治疗过程中变化的有用技术,特别是对于体重减轻和肿瘤缩小的情况。有研究利用EIVD验证技术实时监测治疗期间的辐射剂量分布,并根据测量剂量的变化信息来触发自适应放射治疗[16]。然而,先前的研究大都集中于患者自由呼吸状态,将EIVD验证技术应用于门控放疗的相关研究,目前鲜有报道。
在乳腺癌的门控放疗中,SGRT技术已经被证明能够提高摆位的精准性和DIBH位置的重复性[17-18],并通过设置6个位置自由度的阈值,与加速器进行联动,保证治疗的安全性。本研究所有患者完成CBCT扫描及摆位误差修正后,在6个位置自由度中,Lat、Long、Vert的平均偏移量均在2 mm以内,Rot、Roll、Pitch的平均偏移量均在1°以内。结合EIVD验证的全局γ通过率分析,发现2 mm/2%和3 mm/3%对于DIBH-SGRT分次内Lat与Vert方向相关性较强,说明EIVD验证系统能够潜在发现患者屏气过程中的位移偏差,同时也提示在SGRT中应该设定更严格的左右方向和上下方向门控阈值,以保证更好的DIBH重复性。
在EIVD测量剂量与计划剂量的比较中,对于靶区而言,PTV_TB和PTV Dmean的平均剂量偏差为0.23%和0.59%,D2的平均剂量偏差为3.04%和1.87%,D98的平均剂量偏差为3.19%和2.88%。根据ICRU 83号报告[19]的建议,本研究中肿瘤靶区的各个剂量学参数指标均符合±3.5%的剂量差异设定。另外,肿瘤靶区的剂量偏差更多出现在靠近皮肤组织区域,即分次内出现屏气位移偏差时,射野入射方向将会出现明显的剂量扰动。这也进一步证明,EIVD验证能够有效保证左侧乳腺癌DIBH-SGRT过程中肿瘤靶区剂量传递的精准性。
在正常组织的比较中,心脏、左侧冠状动脉、右侧乳腺、右肺的Dmean则显示出较大的剂量学差异(P<0.001),而心脏与左肺的体积剂量均未表现出明显的差异(P>0.05),这与先前在胸部肿瘤中应用EIVD验证的结果相似[20]。由于乳腺癌患者行DIBH,这些正常组织本身距离肿瘤靶区较远,在计划系统中计算所得的辐射剂量亦较小,也就是在正常组织的低剂量区域评估中,使用EIVD验证可能会出现一定的剂量不准确性,需要提升低剂量区域在体剂量验证的性能。
对于QA结果的评估中,采用γ通过率标准还是DVH标准一直是争论的焦点[21-22]。γ通过率通常衡量错误的数量,而DVH似乎与临床相关性直接相关。有研究尝试将二者相关性联系起来,结果表明,γ通过率和剂量差异之间的相关性高度依赖于治疗部位和技术[23-24]。本研究通过Pearson相关性分析计算3类γ通过率与肿瘤靶区剂量学差异间的相关性,研究结果显示γ通过率与肿瘤靶区的剂量学差异相关性较弱(R<0.7)。这就表明采用EIVD系统进行DIBH-SGRT计划剂量验证时,计划是否符合临床执行要求不能单一通过γ通过率进行判断,而需要结合更多临床相关的指标,如DVH、锥形束CT(CBCT)、光学体表监测等。
本研究也存在一些局限性:首先,未纳入其他更多的具体偏差对测量结果的影响,例如多叶光栅(MLC)或机器跳数(MU)的偏差,肿瘤靶区缩放以及患者体重改变的影响等,而是将测量剂量与计划剂量进行比较。其次,使用计划CT代替CBCT来计算γ通过率和DVH,其主要原因是图像质量可能会对计算产生影响。最后,本研究未纳入不同剂量阈值(如TH=20%)的γ通过率,而是使用更通用的指标来验证EIVD的性能。
综上所述,本研究证明EIVD系统能够有效保证左侧乳腺癌DIBH-SGRT过程中肿瘤靶区剂量传递的精准性,但是对于正常组织低剂量区域的验证性能有待提高。同时,在EIVD系统中采用γ通过率分析能够潜在发现患者屏气过程中的位移偏差,指导SGRT合适的门控阈值设定。对于验证结果的评估,需要联合γ通过率、DVH分析、CBCT分析、光学体表监测分析等,为开展剂量引导下的自适应DIBH-SGRT提供更充分的临床证据。
利益冲突 无
作者贡献声明 王佳浩负责设计研究方案, 研究实施、论文撰写; 谢洪玲负责研究实施及数据分析; 赵亚东、周鹏飞、李卉负责数据收集和统计分析; 唐秋负责论文修改和技术指导
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
Buchholz TA. Increasing the value of radiotherapy in breast cancer[J]. Lancet Oncol, 2021, 22(5): 572-573. DOI:10.1016/S1470-2045(21)00120-0 |
| [3] |
Zagar TM, Cardinale DM, Marks LB. Breast cancer therapy-associated cardiovascular disease[J]. Nat Rev Clin Oncol, 2016, 13(3): 172-184. DOI:10.1038/nrclinonc.2015.171 |
| [4] |
Boekel NB, Schaapveld M, Gietema JA, et al. Cardiovascular disease risk in a large, population-based cohort of breast cancer survivors[J]. Int J Radiat Oncol Biol Phys, 2016, 94(5): 1061-1072. DOI:10.1016/j.ijrobp.2015.11.040 |
| [5] |
Simonetto C, Eidemüller M, Gaasch A, et al. Does deep inspiration breath-hold prolong life? Individual risk estimates of ischaemic heart disease after breast cancer radiotherapy[J]. Radiother Oncol, 2019, 131: 202-207. DOI:10.1016/j.radonc.2018.07.024 |
| [6] |
Hayden AJ, Rains M, Tiver K. Deep inspiration breath hold technique reduces heart dose from radiotherapy for leftsided breast cancer[J]. J Med Imaging Radiat Oncol, 2012, 56: 464-472. DOI:10.1111/j.1754-9485.2012.02405.x |
| [7] |
Laaksomaa M, Sarudis S, Rossi M, et al. AlignRT(®) and Catalyst? in whole-breast radiotherapy with DIBH: Is IGRT still needed?[J]. J Appl Clin Med Phys, 2019, 20(3): 97-104. DOI:10.1002/acm2.12553 |
| [8] |
Mourik AV, Kranen SV, Hollander SD, et al. Effects of setup errors and shape changes on breast radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2011, 79(5): 1557-1564. DOI:10.1016/j.ijrobp.2010.07.032 |
| [9] |
Mijnheer B, Beddar S, Izewska J, et al. In vivo dosimetry in external beam radiotherapy[J]. Med Phys, 2013, 40(7): 070903. DOI:10.1118/1.4811216 |
| [10] |
Sánchez-Artuñedo D, Reyes López V, Granado Carrasco R, et al. Gamma passing rates of daily EPID transit images correlate to PTV coverage for breast cancer IMRT treatment plans[J]. J Appl Clin Med Phys, 2023, 24(5): e13913. DOI:10.1002/acm2.13913 |
| [11] |
McKenzie EM, Balter PA, Stingo FC, et al. Toward optimizing patient-specific IMRT QA techniques in the accurate detection of dosimetrically acceptable and unacceptable patient plans[J]. Med Phys, 2014, 41(12): 121702. DOI:10.1118/1.4899177 |
| [12] |
Ezzell GA, Burmeister JW, Dogan N, et al. IMRT commissioning: multiple institution planning and dosimetry comparisons, a report from AAPM Task Group 119[J]. Med Phys, 2009, 36(11): 5359-5373. DOI:10.1118/1.3238104 |
| [13] |
Mijnheer B, Beddar S, Izewska J, et al. In vivo dosimetry in external beam radiotherapy[J]. Med Phys, 2013, 40(7): 070903. DOI:10.1118/1.4811216 |
| [14] |
Olaciregui-Ruiz I, Rozendaal R, van Oers R, et al. Virtual patient 3D dose reconstruction using in air EPID measurements and a back-projection algorithm for IMRT and VMAT treatments[J]. Phys Med, 2017, 37: 49-57. DOI:10.1016/j.ejmp.2017.04.016 |
| [15] |
Steers JM, Zavala Bojorquez J, Moore K, et al. Using in vivo EPID images to detect and quantify patient anatomy changes with gradient dose segmented analysis[J]. Med Phys, 2020, 47(11): 5419-5427. DOI:10.1002/mp.14476 |
| [16] |
Fiagan Y, Bossuyt E, Nevens D, et al. The use of in-vivo dosimetry to identify head and neck cancer patients needing adaptive radiotherapy[J]. Radiother Oncol, 2023, 184: 109676. DOI:10.1016/j.radonc.2023.109676 |
| [17] |
Alderliesten T, Sonke JJ, Betgen A, et al. Accuracy evaluation of a 3-dimensional surface imaging system for guidance in deep-inspiration breath-hold radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2013, 85(2): 536-542. DOI:10.1016/j.ijrobp.2012.04.004 |
| [18] |
Cravo Sá A, Fermento A, Neves D, et al. Radiotherapy setup displacements in breast cancer patients: 3D surface imaging experience[J]. Rep Pract Oncol Radiother, 2018, 23(1): 61-67. DOI:10.1016/j.rpor.2017.12.007 |
| [19] |
International Commission on Radiation Units and Measurements. Report 83. Prescribing, recording, and reporting photon-beam intensity-modulated radiation therapy (IMRT)[R]. J ICRU, 2010, 10(1): 1-106.
|
| [20] |
李玉成, 程品晶, 蒋璐, 等. 基于EPID三维剂量重建在肿瘤患者中应用[J]. 中华放射肿瘤学杂志, 2018, 27(11): 984-988. Li YC, Cheng PJ, Jiang L, et al. Application of EPID-based 3D dose reconstruction in cancer patients[J]. Chin J Radiat Oncol, 2018, 27(11): 984-988. DOI:10.3760/cma.j.issn.1004-4221.2018.11.007 |
| [21] |
van der Bijl E, van Oers R, Olaciregui-Ruiz I, et al. Comparison of gamma and DVH-based in vivo dosimetric plan evaluation for pelvic VMAT treatments[J]. Radiother Oncol, 2017, 125(3): 405-410. DOI:10.1016/j.radonc.2017.09.014 |
| [22] |
Baran M, Tabor Z, Tulik M, et al. Are gamma passing rate and dose-volume histogram QA metrics correlated?[J]. Med Phys, 2021, 48(9): 4743-4753. DOI:10.1002/mp.15142 |
| [23] |
Rozendaal RA, Mijnheer BJ, van Herk M, et al. In vivo portal dosimetry for head-and-neck VMAT and lung IMRT: linking γ-analysis with differences in dose-volume histograms of the PTV[J]. Radiother Oncol, 2014, 112(3): 396-401. DOI:10.1016/j.radonc.2014.03.021 |
| [24] |
Bojechko C, Ford EC. Quantifying the performance of in vivo portal dosimetry in detecting four types of treatment parameter variations[J]. Med Phys, 2015, 42(12): 6912-6918. DOI:10.1118/1.4935093 |
 2024, Vol. 44
2024, Vol. 44


