宫颈癌是女性生殖系统最常见的恶性肿瘤[1]。同步放化疗(CCRT)是治疗宫颈癌的重要手段[1]。国内宫颈癌每年死亡例数约3.7万,探讨影响患者生存率的可干预因素,对于进一步降低死亡率有重要意义[1]。肌少症是一种以进行性、广泛性的骨骼肌含量减少和功能减退为主要特点的综合征[2]。肿瘤患者因分解代谢增加和合成代谢降低而具有较高的肌少症患病率[3]。国外有研究表明,临床Ⅲ期宫颈癌患者的生物电阻抗矢量显著短于Ⅱ期和Ⅰ期,提示Ⅲ期宫颈癌患者肌肉减少[4]。放疗会进一步增加宫颈癌肌肉丢失、促进肌少症的发生[5]。已有研究证实,肌少症是消化道肿瘤的独立预后因素,但是这些研究多为外科术后患者,肌少症是否对接受CCRT的宫颈癌患者也存在影响尚不明确[6-7]。因此,本研究以行CCRT的宫颈癌患者为研究对象,探讨肌少症对患者近期效果和远期预后的影响,为明确宫颈癌患者肌少症的临床意义、进一步改善预后提供一定的研究依据。
资料与方法 1、研究对象前瞻性选取2017年1月至2021年12月间在河南省人民医院诊治并符合条件的宫颈癌患者410例为研究对象,平均年龄(55.7±9.8)岁,其中,Ⅰ期21例(5.1%),Ⅱ期170例(41.5%),Ⅲ期197例(48.0%),Ⅳ期22例(5.4%);鳞癌324例(79.0%),腺癌62例(15.1%),腺鳞癌24例(5.9%)。纳入标准:国际妇产科联盟(FIGO)临床分期为ⅠB3、ⅡA2、ⅡB~ⅣA期的宫颈癌,初始治疗方式为CCRT;病理类型为鳞癌、腺癌、腺鳞癌;卡氏功能状态评分>70,年龄>40岁。排除标准:术后放疗或既往有盆腔放疗史者,或同时行靶向治疗、免疫治疗的患者;合并其他癌症、严重心肺功能不全、肝肾功能不全者;存在心理精神疾病而影响交流者;拒绝参与研究者。研究经院伦理委员会批准[审批号:(2016)伦审(126)号],患者均已签署知情同意。
2、CCRT方法联合体外放疗和腔内放疗完成治疗。体外放疗采用调强放疗,盆腔放射治疗剂量为45~50 Gy。如腹主动脉旁淋巴引流区需加量,在影像引导下予以45~50 Gy照射,盆腔和/或腹主动脉旁转移淋巴结同步加量至55~60 Gy。体外放疗后程,在CT图像引导下进行腔内后装放疗,后装机为荷兰核通公司高剂量率192Ir,1~2次/周,6.0 Gy/次,共5次。同步化疗以铂类为基础,共4~6个周期。
3、一般资料纳入研究对象后,收集患者的临床病理资料,包括年龄、体质量指数(BMI)、肿瘤直径、病理学类型、淋巴结转移状态、FIGO临床分期、血清鳞状细胞癌抗原(SCCA)等。
4、肌少症诊断和分组肌少症评估均在CCRT前。骨骼肌含量测定:应用生物电阻抗方法(BIA)测量体内肌肉含量,计算四肢骨骼肌质量指数(SMI)。握力测量:患者取坐位,屈肘90°,使用液压式握力器(LJST801-2,北京)测量优势手握力,连续测量2次,取较大值。步速测量:患者在病房走廊内以自然速度行走6 m,记录所用时间。连续测量2次,计算步行速度,取较大值[8]。由于肌少症的诊断标准在研究期间有所改变[2],因此,本研究中2020年之前的病例又根据新的共识做出了调整,其诊断标准为SMI<5.7 kg/m2,握力<18 kg或6 m步行速度<1.0 m/s,并据此将研究对象分为肌少症组和非肌少症组[2]。
5、CCRT近期疗效和急性不良反应按照实体瘤疗效评价标准评估近期疗效[7],分为完全缓解(CR)、部分缓解(PR)、病情稳定(SD)和疾病进展(PD),以CR和PR计算有效率,计算方法为(CR+PR)/总例数×100%。按美国放射治疗协作组分级标准[9]评价急性不良反应,包括血液系统急性不良反应、下消化道急性不良反应和泌尿系统急性不良反应,均分为0~4级。3级以上暂停CCRT,对症支持治疗后缓解者去除化疗进行单独放疗,对症治疗后不能缓解者终止放疗。记录因各种急性不良反应而致CCRT终止或治疗时间延长情况,CCRT总时间超过8周定义为治疗时间延长[1]。
6、随访及远期预后本研究进行以微信随访为主的前瞻性随访,辅以电话随访、门诊随访和住院随访等。观察终点为总体生存期(OS)、无复发生存期(PFS)。OS定义为研究对象从诊断到因任何原因死亡时间。PFS仅针对CR患者,定义为CR患者从CCRT结束到宫颈癌复发、转移的时间。随访间歇为3个月,随访截止日期为2022年12月31日。失访患者的数据为删失数据。
7、统计学处理应用SPSS 22.0做统计分析。应用logistic回归模型计算倾向评分,采用最邻匹配法,将非肌少症组和肌少症组根据年龄、BMI、肿瘤直径、病理学类型、淋巴结转移状态、FIGO临床分期、血SCCA按照1 ∶1进行倾向性评分匹配,匹配容差为0.02。连续变量呈正态分布者用x ± s表示,两独立样本之间的比较采用独立样本t检验,分类变量用绝对数和百分比[n(%)]表示,两独立样本之间的比较采用χ2检验。生存时间用中位数(四分位间距)表示。生存率估算应用Kaplan-Meier法,生存曲线之间的比较采用log-rank检验。应用单因素Cox比例风险回归分析PFS的影响因素,将P<0.1的变量纳入多因素Cox比例风险回归分析。所有的检验均为双侧检验,P<0.05为差异有统计学意义。
结果 1、宫颈癌肌少症患病情况410例研究对象中,152例(37.1%)患者患有肌少症。
2、倾向评分匹配后肌少症组和非肌少症组的近期疗效和急性不良反应比较将肌少症组和非肌少症组进行1 ∶1匹配,共有114对匹配成功。两组之间的年龄、BMI、肿瘤直径、病理学类型、淋巴结转移状态、FIGO临床分期和血SCCA无显著差异。与非肌少症组相比,肌少症组的2级以上下消化道和血液系统急性不良反应、CCRT终止或治疗时间延长的比例均高于非肌少症组,有效率和2级以上泌尿系统急性不良反应在两组之间差异无统计学意义(P>0.05,表 1)。
|
|
表 1 肌少症组和非肌少症组的近期疗效和急性毒性反应比较 Table 1 Comparison of short-term outcomes and acute adverse reactions between the sarcopenia and non-sarcopenia groups |
3、肌少症组和非肌少症组的生存情况比较
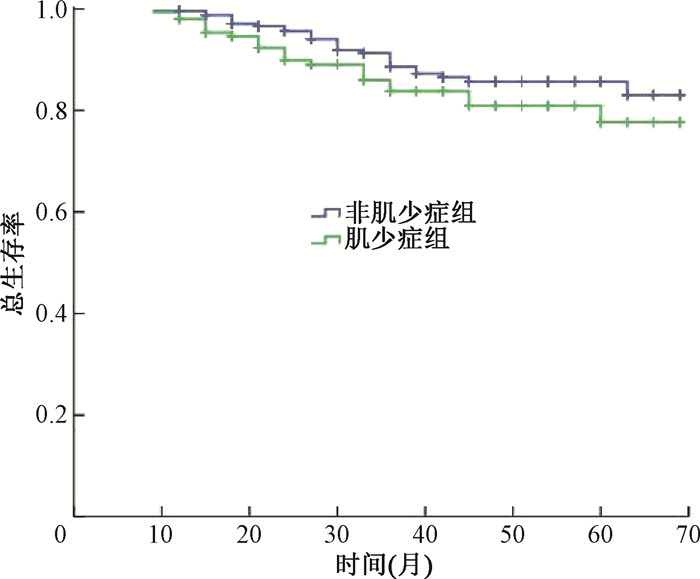
随访时间为36(9~69)个月。随访期间有6例失访。非肌少症组有27例死亡,其OS为30(18~36)个月,3年生存率为88.7%,5年生存率为85.6%;肌少症组有23例死亡,其OS为24(15~33)个月,3年生存率为83.8%,5年生存率为77.7%。2组之间生存曲线差异无统计学意义(P>0.05,图 1)。
|
图 1 肌少症组和非肌少症组的总体生存曲线比较 Figure 1 Comparison of overall survival curves between the sarcopenia and non-sarcopenia groups |
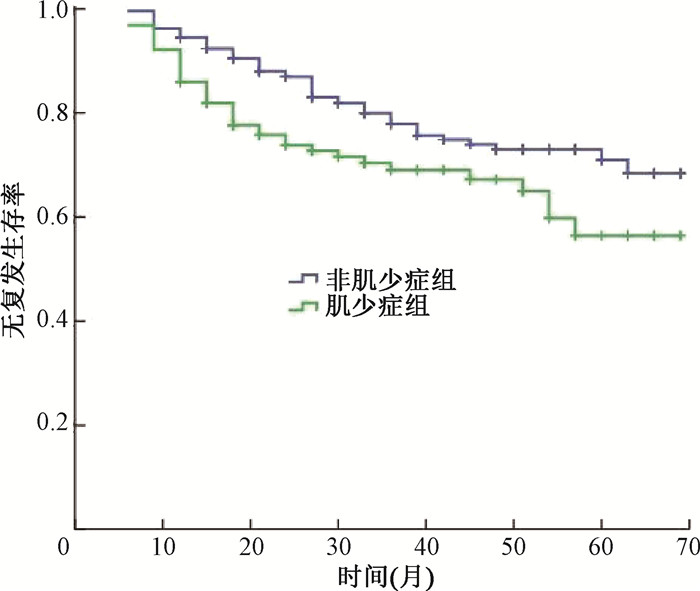
CR患者中,非肌少症组有239例,肌少症组有128例。非肌少症组有52例复发,其PFS为21(12~33)个月,3年无复发生存率为77.9%,5年无复发生存率为71.0%;肌少症组有41例复发,其PFS为15(10.5~24)个月,3年无复发生存率为69.0%,5年无复发生存率为56.5%。2组之间无复发生存曲线差异有统计学意义(χ2=5.89,P=0.015,图 2)。
|
图 2 肌少症组和非肌少症组的无复发生存曲线比较 Figure 2 Comparison of progression-free survival curves between the sarcopenia and non-sarcopenia groups |
4、肌少症对宫颈癌复发的影响
单因素Cox回归分析表明,BMI(χ2=4.41,P=0.036)、病理类型(χ2=3.95,P=0.047)、淋巴结转移(χ2=4.12,P=0.042)、FIGO分期(χ2=5.58,P=0.018)和血SCCA水平(χ2=3.92,P=0.048)是影响PFS的因素,见表 2;将上述因素和肌少症纳入多因素Cox回归分析,肌少症(χ2=4.33,P=0.037)是PFS的独立危险因素,见表 3。
|
|
表 2 CCRT宫颈癌患者远期复发的单因素分析结果 Table 2 Univariate Cox analysis results of long-term recurrence in cervical cancer patients undergoing CCRT |
|
|
表 3 CCRT宫颈癌患者远期复发的多因素Cox分析结果 Table 3 Multivariate Cox analysis results of long-term recurrence in cervical cancer patients undergoing CCRT |
讨论
肌少症已经成为一种独立的疾病越来越受到重视。在治疗前的肿瘤患者中,肌少症患病率为38.6%[10]。国内目前尚未见宫颈癌肌少症患病率的报道。本研究宫颈癌肌少症患病率为37.1%。由于不同研究采用的肌少症的诊断方法和标准不完全一样,并且研究对象的纳入标准和人种等也存在差异,因此,不同研究的肌少症患病率存在一定差异。宫颈癌患者肌肉减少的原因有多种,是饮食摄入减少、肿瘤相关的慢性炎症和代谢紊乱等综合作用的结果[3]。
本研究中,两组患者的近期疗效相似,但是两组之间的急性不良反应存在差异,表现为肌少症组的下消化道和血液系统的急性不良反应发生率均显著高于非肌少症组。叶倩等[7]以老年食管癌患者为研究对象,发现肌少症患者的放疗不良反应总发生率高于非肌少症患者,本研究结果与之一致。Erul等[11]在头颈部肿瘤中的研究发现,与非肌少症患者相比,肌少症患者经历了更多的放疗相关不良反应。关于肛门周围癌的研究发现,放化疗后肌少症与≥3级白细胞减少症和≥3级血小板减少症显著相关[12],也支持本研究结果。同时,本研究还发现,肌少症组患者更易出现CCRT终止或时间延长,其主要原因与肌少症组更多的急性不良反应有关。CCRT终止或时间延长有可能影响远期治疗效果。
几种潜在的机制可以解释肌少症与CCRT不良反应之间的关系。首先,放疗可引起肠道损伤,并且较高的肠道剂量与肌肉减少显著相关[5],同时放疗对泌尿系统和血液系统也可能存在类似影响;其次,低SMI患者放疗不良反应增加也可能是促炎状态所致[13];再者,肌少症患者的药代动力学会发生改变,从而增加了放化疗的血液系统不良反应[12]。因此,肌少症可作为一个识别CCRT急性不良反应高危患者的指标。
本研究发现,肌少症组的无复发生存曲线显著低于非肌少症组,并且多因素分析进一步证实,肌少症是影响PFS的独立因素。国内研究表明,放疗前肌少症是食管癌患者PFS的独立预后因素[7]。在胰腺癌的研究中发现,肌少症是PFS的一个重要影响因素[14]。上述研究与本研究结果一致。导致肌少症患者远期预后较差的可能原因有:CCRT终止或时间延长是影响远期治疗效果的原因之一,而本研究已经证实,肌少症组CCRT终止或时间延长的比例显著高于非肌少症组;肌少症与机体功能状态密切相关,而功能状态是影响癌症患者预后的公认因素[15];肌肉质量下降减少了肌细胞因子的分泌(如IL-6、IL-8、IL-15),而这些细胞因子可阻碍肿瘤进展[16]。传统指标BMI在多因素分析中未进入方程,这可能是由于BMI不能区分肌肉和脂肪,无法准确地反映肌肉减少对预后的影响。
本研究未发现肌少症对OS存在影响。近期一篇关于接受放疗的老年癌症患者的荟萃分析表明,肌少症与总体生存率无关[17]。在胰腺癌的研究中也发现,肌少症不是影响总体生存率的显著因素[14]。但是关于食管癌的研究表明,肌少症是食管癌总体生存率的独立影响因素[7]。本研究结果异于食管癌的可能原因有:样本数量相对较少,随访时间相对较短,且患者具有相对长的预后,因而死亡人数相对较少,其差异未能显现出来;研究对象不同,前面调查的研究对象是老年人[7],而本研究主要是中年人,肌少症对老年人的死亡影响可能更大;肌少症的测量方法和定义也不同。前面研究采用CT测量第3腰椎水平骨骼肌面积并据此定义肌少症[7],本研究采用生物电阻抗方法。需要继续增加样本和随访时间观察肌少症对OS的影响。
早期识别和干预是正确管理肌少症的关键。本研究也提示,在CCRT之前评估肌少症的重要性,有助于更好地判断预后,加强随访,以期更早地发现肿瘤复发并及时干预。在治疗方面,如何通过防治肌少症来减轻宫颈癌CCRT治疗过程中的不良反应、改善远期预后成为一个有重要意义的课题。抗阻运动对肿瘤相关性肌肉减少症最为有效[3]。一项随机、三盲临床试验表明,补充ω-3脂肪酸可有效维持宫颈癌患者的营养状态和骨骼肌质量,并减少放化疗不良反应[18]。对患有肌少症的宫颈癌患者进行营养治疗和抗阻运动锻炼,可能会降低放疗不良反应、改善预后,这需要随机对照试验进一步证实。
本研究是国内首个探讨肌少症对行CCRT治疗宫颈癌患者近期疗效和远期预后影响的研究,具有一定的临床实用和指导意义,但是一项单中心研究,并且随访时间相对较短。此外,本研究有严格的纳入、排除标准,这虽然减少了患者的异质性,但是有可能缩小了适用范围,研究结果的推广要慎重。本研究是一个观察性研究,肌少症的状态可能随着年龄的增加、人为的干预有所改变,这也可能会增加或削弱肌少症和远期预后之间的关联。因此,针对肌少症的干预性研究是必要的,这也是本课题组下一步的研究目标。
总之,本研究表明,肌少症增加了行CCRT治疗的宫颈癌患者的急性不良反应和远期复发风险。针对肌少症的干预有可能进一步提升宫颈癌的治疗效果。
利益冲突 无
作者贡献声明 刘明博负责研究的总体实施、论文的撰写和修改;董青青、周博负责研究对象的纳入、住院期间研究资料的收集;刘东斌负责研究对象的随访;王跃伟负责研究数据的统计、分析;吴广银负责研究的设计和规划
| [1] |
中国抗癌协会妇科肿瘤专业委员会. 子宫颈癌诊断与治疗指南(2021年版)[J]. 中国癌症杂志, 2021, 31(6): 474-489. The Chinese Gynecologic Cancer Society (CGCS) of China Anti-Cancer Association. Guidelines for the diagnosis and treatment of cervical cancer (2021 Edition)[J]. Chin Oncol, 2021, 31(6): 474-489. DOI:10.19401/j.cnki.1007-3639.2021.06.06 |
| [2] |
姜珊, 康琳, 刘晓红. 2019亚洲肌少症诊断及治疗共识解读[J]. 中华老年医学杂志, 2020, 39(4): 373-376. Jiang S, Kang L, liu XH. Interpretation of Asian Working Group for Sarcopenia: 2019 consensus update on sarcopenia diagnosis and treatment[J]. Chin J Geriatr, 2020, 39(4): 373-376. DOI:10.3760/cma.j.issn.0254-9026.2020.04.002 |
| [3] |
中国抗癌协会肿瘤营养专业委员会. 肿瘤相关性肌肉减少症临床诊断与治疗指南[J]. 肿瘤代谢与营养电子杂志, 2022, 9(1): 24-34. Chinese Society of Nutritional Oncology. Guidelines for clinical diagnosis and treatment of cancer-related sarcopenia[J]. Electron J Metab Nutr Cancer, 2022, 9(1): 24-34. |
| [4] |
Flores-Cisneros L, Cetina-Pérez L, Castillo-Martínez L, et al. Body composition and nutritional status according to clinical stage in patients with locally advanced cervical cancer[J]. Eur J Clin Nutr, 2021, 75(5): 852-855. DOI:10.1038/s41430-020-00797-y |
| [5] |
Lee J, Lin JB, Wu MH, et al. Association of bowel radiation dose-volume with skeletal muscle loss during pelvic intensity-modulated radiotherapy in cervical cancer[J]. Support Care Cancer, 2021, 29(9): 5497-5505. DOI:10.1007/s00520-021-06131-x |
| [6] |
Yang YR, Shi CS, Chang SW, et al. The impact of sarcopenia on overall survival in patients with pan-RAS wild-type colorectal liver metastasis receiving hepatectomy[J]. Sci Rep, 2023, 13(1): 6911. DOI:10.1038/s41598-023-33439-x |
| [7] |
叶倩, 凌志, 刘申香, 等. 肌肉减少症对老年食管癌患者根治性放疗临床疗效及预后的影响[J]. 国际肿瘤学杂志, 2022, 49(4): 199-205. Ye Q, Ling Z, Liu SX, et al. Effects of sarcopenia on the clinical efficacy and prognosis of radical radiotherapy in elderly patients with esophageal cancer[J]. J Int Oncol, 2022, 49(4): 199-205. DOI:10.3760/cma.j.cn371439-20210526-00035 |
| [8] |
肖潇, 胡松, 季晓云, 等. 80岁及以上住院患者肌肉减少症与营养状况的相关性分析[J]. 中华老年医学杂志, 2019, 38(6): 654-657. Xiao X, Hu S, Ji XY, et al. Association between sarcopenia and nutritional status in hospitalized patients aged 80 years and over[J]. Chin J Geriatr, 2019, 38(6): 654-657. DOI:10.3760/cma.j.issn.0254-9026.2019.06.014 |
| [9] |
郭旗, 许碧纯, 刘叶红, 等. 宫颈癌术后调强放射治疗的早期不良反应及影响因素[J]. 中华放射医学与防护杂志, 2020, 40(5): 365-371. Guo Q, Xu BC, Liu YH, et al. Early side effects and influencing factors of postoperative intensity-modulated radiation therapy for cervical cancer[J]. Chin J Radiol Med Prot, 2020, 40(5): 365-371. DOI:10.3760/cma.j.issn.0254-5098.2020.05.007 |
| [10] |
Pamoukdjian F, Bouillet T, Lévy V, et al. Prevalence and predictive value of pre-therapeutic sarcopenia in cancer patients: A systematic review[J]. Clin Nutr, 2018, 37(4): 1101-1113. DOI:10.1016/j.clnu.2017.07.010 |
| [11] |
Erul E, Guven DC, Ozbay Y, et al. Evaluation of sarcopenia as a prognostic biomarker in locally advanced head and neck squamous cell carcinoma[J]. Biomark Med, 2023, 17(2): 87-99. DOI:10.2217/bmm-2022-0748 |
| [12] |
Martin D, von der Grün J, Rödel C, et al. Sarcopenia is associated with hematologic toxicity during chemoradiotherapy in patients with anal carcinoma[J]. Front Oncol, 2020, 10: 1576. DOI:10.3389/fonc.2020.01576 |
| [13] |
Zwart AT, Pörtzgen W, van Rijn-Dekker I, et al. Sex-specific cut-off values for low skeletal muscle mass to identify patients at risk for treatment-related adverse events in head and neck cancer[J]. J Clin Med, 2022, 11(16): 4650. DOI:10.3390/jcm11164650 |
| [14] |
Cho WK, Yu JI, Park HC, et al. Impact of sarcopenia on survival of pancreatic cancer patients treated with concurrent chemoradiotherapy[J]. Tumori, 2021, 107(3): 247-253. DOI:10.1177/0300891620937795 |
| [15] |
Kong S, Shin S, Lee JK, et al. Association between sarcopenia and physical function among preoperative lung cancer patients[J]. J Pers Med, 2020, 10(4): 166. DOI:10.3390/jpm10040166 |
| [16] |
Medici F, Rizzo S, Buwenge M, et al. Everything you always wanted to know about sarcopenia but were afraid to ask: a quick guide for radiation oncologists (Impact of sarcopenia in radiotherapy: The AFRAID Project)[J]. Curr Oncol, 2022, 29(11): 8513-8528. DOI:10.3390/curroncol29110671 |
| [17] |
Catikkas NM, Bahat Z, Oren MM, et al. Older cancer patients receiving radiotherapy: a systematic review for the role of sarcopenia in treatment outcomes[J]. Aging Clin Exp Res, 2022, 34(8): 1747-1759. DOI:10.1007/s40520-022-02085-0 |
| [18] |
Aredes MA, da Camara AO, de Paula NS, et al. Efficacy of ω-3 supplementation on nutritional status, skeletal muscle, and chemoradiotherapy toxicity in cervical cancer patients: A randomized, triple-blind, clinical trial conducted in a middle-income country[J]. Nutrition, 2019, 67-68: 110528. DOI:10.1016/j.nut.2019.06.009 |
 2024, Vol. 44
2024, Vol. 44


