2020年全球癌症数据显示,在全部恶性肿瘤中,食管癌的发病率第7位,死亡率第6位[1]。我国以食管鳞癌(esophageal squamous cell carcinoma,ESCC)患者为主,占90%[2]。手术治疗是食管癌的主要治疗手段,对于局部晚期的食管癌患者,术前新辅助治疗可以提高生存[3-4],但最佳策略仍不清楚。传统的新辅助放化疗(NCRT)和新辅助化疗(NCT)是共识性选择,随着程序性细胞死亡1 (programmed cell death 1,PD-1) 抑制剂在食管癌治疗中的兴起,其作为围手术期治疗的方法,已初显成果,但仍处于起步阶段,其疗效尚需进一步的研究和探讨。本研究主要目的回顾性分析NCRT,NCT和新辅助免疫+化疗(NICT)联合食管切除术治疗在局部晚期食管鳞状细胞癌(ESCC) 的疗效及安全性。
资料与方法 1、研究对象回顾性分析2015年1月至2022年5月安阳市肿瘤医院行新辅助治疗局部晚期食管癌患者,纳入标准:①病理证实食管鳞癌。②行为状态评分(Karnofsky performance status,KPS)≥80分。③接受NCRT、NCT或NICT后联合食管癌根治手术。④临床资料完整。⑤化疗周期数:3周方案,化疗周期≥2个周期,或单周方案,化疗周期≥5周,方案无更换。⑥淋巴结清扫≥15枚。排除标准:①单纯放疗。②未完成治疗。③患第二肿瘤或双源癌。④严重心肺功能障碍。⑤化疗方案更改,或合并其他治疗如靶向治疗等。因放疗加免疫开展较少,未纳入。治疗前行颈胸上下腹部增强CT、内镜或超声内镜、磁共振成像(MRI)、正电子发射断层成像/计算机体层成像(PET/CT)及食管造影检查并进行临床分期。临床分期采用美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版食管癌TNM分期。所有患者均签署知情同意书,本研究经安阳市肿瘤医院伦理委员会批准(审批号:2023WZ03K01)。
本研究共纳入542例患者,其中NCRT组137例,NCT组241例,NICT组164例;女性198例,男性344例;≤65岁289例,>65岁253例。见表 1。
|
|
表 1 新辅助患者的一般基线特征 Table 1 Baseline characteristics of patients treated with neoadjuvant therapy |
2、治疗方式
(1) 放化疗组(NCRT):共137例患者,平均年龄63岁;化疗方案TP方案(紫杉类联合铂类(紫杉醇/多西紫杉醇/白蛋白结合型紫杉醇联合顺铂/卡铂/奈达铂)(86例(62.8%),PF方案(顺铂联合氟尿嘧啶类(顺铂联合氟尿嘧啶/卡培他滨/替吉奥)24例(17.5%),单药铂类(顺铂)或氟尿嘧啶类(卡培他滨/替吉奥)27例(19.7%);化疗2个周期107例(78.1%),3~4个周期30例(21.9%);术后119例(86.9%)未行辅助化疗,18例(13.1%)予以1~4个周期辅助化疗。放疗靶区勾画参照《食管癌放射治疗靶区画》[5]和《中国食管癌放射治疗指南(2022年版)》[6],采用6 MV直线加速器,1.8~2.0 Gy/次,1次/d,5次/周,放疗剂量40.0~50.4 Gy,靶区包括食管病变及转移淋巴结,累及野照射。
(2) 化疗组(NCT):共241例,平均年龄65岁,化疗方案TP方案231例(95.9%),PF方案10例(4.1%);化疗2周期227例(94.2%),3~4个周期14例(5.8%);术后123例(51.0%)未行辅助化疗,118例(49.0%)予以1~6个周期辅助化疗。
(3) 免疫+化疗组(NICT):共164例,平均年龄67岁,NCT方案均为TP方案;PD-1抑制剂为:信迪利单抗注射液。术后未行辅助治疗108例(65.9%),术后辅助治疗共56例(34.1%),其中免疫加化疗23例(14.0%),单纯辅助化疗16例(9.8%),单纯辅助免疫17例(10.3%)。
新辅助治疗后手术时机一般在放化疗结束后4~8周,免疫或化疗结束后3~6周。
3、观察指标主要研究终点为显著病理学缓解(major pathologic response,MPR)和病理学完全缓解(complete pathologic response,pCR)。次要研究终点为无进展生存期(progression-free survival, PFS)、总生存期(overall survival, OS)和术后并发症。新辅助治疗术后病理学评估采用:食管癌的疗效分级系统采用美国病理学家协会/美国国立综合癌症网络(CAP/NCCN)指南的标准。MPR定义:术后病理检测残留的肿瘤细胞<10%,包括TRG 0级、1级和pCR。pCR定义:原发肿瘤或清扫淋巴结中无残留存活肿瘤细胞。PFS定义:为从确诊日期到肿瘤进展或任何原因死亡时间。OS定义: 从确诊日期到任何原因死亡时间或最后随访时间。新辅助治疗不良反应根据美国癌症常见不良事件通用术语标准(CTCAE)5.0版进行分级。
末次治疗结束后4~8周开始随访复查,后1~3个月定期检查,2~5年后每3~6个月,5年以上每6~12个月复查。通过门诊或住院系统、外院资料、定期随访了解患者生存及具体病情。随访截至2023年8月20日,随访率97%。
4、统计学处理采用SPSS 27.0软件进行统计分析。使用Kaplan-Meier法计算生存分析,单因素分析采用Log-rank检验进行,多因素分析采用Cox比例风险回归模型进行,组间比较用χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。
结果 1、临床特征分析新辅助治疗的患者中,年龄≤65岁者占53.3%,男性占63.5%,病变位于胸中段占67.2%,Ⅲ期占67.5%,3组患者的基线情况,除了年龄(χ2=13.23,P=0.001)外,其余临床特征差异均无统计学意义(P>0.05,表 1)。
2、治疗完成情况及不良反应及并发症全部完成治疗。NCRT组2例放化疗结束后手术前出现食管气管瘘,11例因3级放射性食管炎出现治疗时间延长,手术延迟,有2例为R1切除;NCT组均R0切除,有1例死于手术;NICT组有1例R1切除,3例术后出现Ⅲ级免疫相关性肺炎,给予治疗后好转。NCRT、NCT和NICT的吻合口瘘为12例(8.8%)、10例(4.1%)和8例(4.9%),差异无统计学意义(P>0.05);术中>100 ml血量5例(3.6%)、3例(1.2%)和5例(3.0%),差异无统计学意义(P>0.05)。新辅助治疗期间不良反应恶心和呕吐均为1/2级,NCRT、NCT和NICT的3/4级骨髓抑制分别为8例(5.8%)、15例(6.2%)和6例(3.7%),3/4级转氨酶异常分别为3例(2.2%)、6例(2.5%)和4例(2.5%),差异均无统计学意义(P>0.05)。
3、3组生存及复发情况比较结果示于图 1。由图 1可见,NCRT组和NCT组3、5年的样本量分别为86和54、148和97例。NCRT组1、2、3、5年的OS率分别为89.8%、82.3%、72.3%、62.7%,中位OS时间为89个月(95%CI 68~110个月);NCT组1、2、3、5年的OS率分别为85.9%、71.4%、61.4%、44.8%,中位OS时间49个月(95%CI 39~59个月);NICT组1、2、3年的OS率分别为91.9%、81.5%、77.8%,中位OS时间未达到;3组对比,差异有统计学意义(χ2=1.67,P < 0.001)。NCRT组1、2、3、5年的PFS率分别为81.5%、67.9%、66.6%、54.7%,中位PFS时间89个月(95%CI 45~133个月);NCT组1、2、3、5年的PFS率分别为75.9%、61.0%、53.5%、41.0%,中位PFS时间42个月(95%CI 35~51个月);NICT组1、2、3年的PFS率分别为80.1%、65.5%、65.3%,中位PFS时间未达到,差异有统计学意义(χ2=4.62,P=0.048)。从局部复发和转移的部位来看,NCRT组、NCT组和NICT组的局部复发率分别为:35.8%(49/137)、47.7%(115/241)、23.8%(39/164),NCRT组远处转移率为8.8%(12/137,肺转移3例、肝转移3例、骨转移2例、吻合口复发2例,其他2例)、NCT组远处转移率为12.9%(31/241,肺转移13例、肝转移8例、骨转移1例、吻合口复发3例,其他6例)、NICT组远处转移率7.9%(13/164,肺转移5例、肝转移1例、骨转移1例、吻合口复发3例,其他4例)差异有统计学意义(χ2=38.85,P < 0.001)。
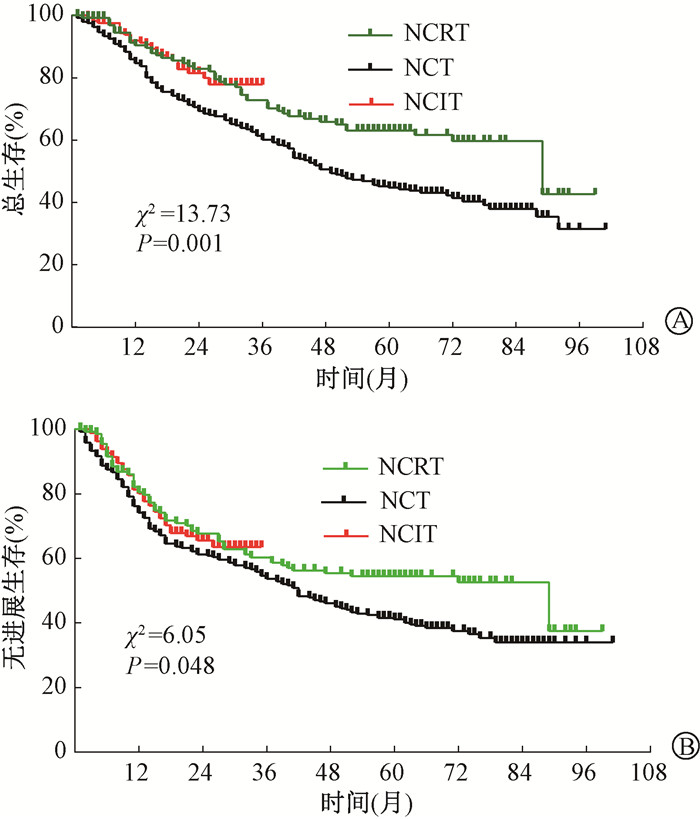
|
注:NCRT.放化疗组;NCT.化疗组;NICT.免疫+化疗组 图 1 3组不同模式新辅助食管鳞癌患者的生存曲线 A. 总生存(OS);B. 无进展生存(PFS) Figure 1 Survival curves of ESCC patients treated with three different types of neoadjuvant therapy A. Overall survival (OS); B. Progression-free survival (PFS) |
从生存和复发转移上看NCRT和NICT一致,均优于NCT。因此把NCRT与NICT两组单独比较,发现两组的OS和PFS相似,差异均无统计学意义(P>0.05)。
单因素分析结果列于表 2。由表 2可知,NCT、性别、T4、N2和N3是影响OS的因素(χ2=9.51、14.60、19.88、6.50,P<0.05);多因素分析显示,NCT、性别、T4和N2是影响OS的因素(χ2=9.51、9.51、14.60、19.88,P<0.05)。单因素分析显示,NCT、T4、N2和N3是影响PFS的因素(χ2=5.21、8.25、23.21、4.11,P<0.05);多因素分析显示,T4和N2是影响PFS的因素(P<0.05)。
|
|
表 2 542患者OS和PFS的单因素及多因素分析 Table 2 Univariate and multivariate analysis of the OS and PFS of 542 patients |
4、3组术后病理资料比较
新辅助治疗前3组的临床T分期和N分期基本均衡,差异无统计学意义(P>0.05,表 1)。新辅助治疗术后,NCRT、NCT组和NICT组yT2组、yT3组比例,NCT组均高于NCRT和NICT组,差异有统计学意义(χ2=113.45,P < 0.001);N+组的比例也高于NCRT和NICT组,差异均有统计学意义(χ2=27.97,P < 0.001)。3组中NCRT和NICT组的MPR率和pCR率相近,均明显高于NCT组,差异有统计学意义(χ2=46.96、57.19,P < 0.001)。NCT组有更高神经侵犯和脉管侵犯,且均高于NCRT和NICT,差异均有统计学意义(χ2=13.67、13.39,P=0.001,表 3)。3组对比NCRT和新辅助免疫治疗的近期疗效相似,而NCT的淋巴结阳性率更高,且伴有更多的神经侵犯及脉管癌栓。
|
|
表 3 3组术后病理资料分布与比较 Table 3 Comparison of postoperative pathological data among the three groups |
讨论
对于cT1bN+或T3-4任何N的胸段食管癌,2023 CSCO食管癌诊疗指南推荐:NCRT或NCT,这两种治疗手段都是Ⅰ级推荐,也是目前临床中广泛采用的治疗手段,新辅助免疫联合化疗正在大量涌现, 然仍处于初始阶段。大部分研究示NCRT对比术前化疗可提高局部区域控制率和根治性手术切除率,长期生存二者差异无统计学意义,真实世界中行NCRT的比例不高,新辅助免疫可获得较好的pCR和MPR,然能否转化为生存获益尚未可知。三者对比的研究较少,本研究回顾性分析真实世界中3组不同新辅助治疗的模式,发现NICT、NCRT的pCR、MPR(31.1%、35.8%和63.4%、66.4%)相近,均明显高于NCT(6.6%、35.3%),3年OS率和PFS率(77.8%、72.3%和65.3%、66.6%)相近,均明显高于NCT组(61.4%、53.5%),免疫治疗或可成为术前治疗的另一种有效的手段。
CROSS研究开创了局晚期食管新辅助治疗的里程碑,它是一个多中心的研究,共纳入了368例患者,术前采用TP方案化疗,放疗剂量41.4 Gy,其中放化疗手术组中鳞癌患者共41例,其术后的pCR达49%。结果显示,放化疗手术组与单纯手术相比,放化疗手术组中鳞癌的中位总生存期为81.6(95%CI 47.2~116.0)个月,单独手术组21.1(95%CI 15.4~26.7)个月,差异有统计学意义(P=0.008);10年整体OS获益达到13%(38%和25%,P=0.004),其中鳞癌组获益明显(46%和23%,P=0.007)[7-8]。中国的NEOCRTEC5010研究纳入了451例局部晚期食管鳞癌, 采用长春瑞滨联合顺铂(NP)化疗方案, 放疗剂量40 Gy,对比单纯手术, 其中位OS(100.1和66.5个月,P= 0.025)、PFS (100.1和41.7个月,P=0.001)都有显著提升,CRT组pCR率为43.2%[9]。基于此两项研究[7-8],新辅助同步放化疗联合手术成为局部晚期食管癌治疗的Ⅰ类证据。本研究中,同步放化疗联合手术组的pCR率35.8%,低于上述两个研究,中位OS时间为89个月与CROSS研究相近,低于NEOCRTEC5010研究[9],可能与本研究时间跨度较长,化疗药物的更新(较早期的患者多采用紫杉醇或多西紫杉醇,近期患者多采用白蛋白紫杉醇),手术方式的选择(较早期患者多采用开胸手术,随着腔镜的成熟与发展,现食管根治术多采用腔镜手术),及治疗中有19例出现手术延迟有关。
日本的JCOG1109研究对CF(顺铂+氟尿嘧啶)、DCF(多西他赛+顺铂+氟尿嘧啶)和CF+RT在食管癌新辅助治疗手段进行了比较,3年OS分别为62.6%、72.1%和68.4%,DCF高于CF(P=0.006),三药化疗明显优于二药[3]。Tang等[11]研究表明,在cT3-4aN0-1M0 ESCC的患者中,行NCRT与NCT后微创食管切除术(MIE) 治疗,3年OS率分别为64.1%和54.9%。病理学完全分别为27.7%(31/112)和2.9%(3/104),差异有统计学意义(P < 0.001),NCRT组显著高于NCT组,NCRT组复发风险较低的(P = 0.063),两组的复发模式相似(P = 0.802)[3]。NCT也是食管癌新辅助治疗的传统手段,其是较早应用于食管癌的新辅助治疗,与NCRT对比,其循证医学证据级别稍低[7, 10-11];然而,在实际中,NCT开展较多。
为了改善预后,国内尝试把免疫治疗添加到术前。然而NCT联合免疫治疗尚处于起步阶段,虽然较单纯NCT有更好的肿瘤缓解,但总体pCR和MPR未达到NCRT的效果。JCOG1804E研究是一项评估顺铂+氟尿嘧啶或多西紫杉醇+顺铂+氟尿嘧啶联合纳武利尤单抗疗效和安全性的Ⅰ期试验,纳武利尤单抗加5-氟尿嘧啶+顺铂(二药联合纳武利尤单抗的疗效)的pCR率达到33.3%。后加入多西他赛后三药联合纳武利尤单抗的pCR达33.3%(4/12)。初步结果示化疗联合免疫治疗耐受性好[12-14]。Chen等[15]发现,特瑞普利单抗联合CP方案在18例食管癌新辅助治疗中, 术后pCR率达33%。NICE研究是一项针对可切除胸段食管鳞癌的单臂、Ⅱ期临床研究,采用卡瑞利珠单抗联合白蛋白紫杉醇+卡铂治疗方案,共入组60例患者,pCR率(ypT0N0)达到了39.2%(20/51),MPR率(ypT0N0 /N+)达49.01%(25/51)[16]。同样的NIC-ESCC2019研究,采用卡瑞利珠单抗联合白蛋白紫杉醇+顺铂作为新辅助治疗方案,共入组56例患者,原发灶pCR率为35.3%(18/51),原发灶和淋巴结pCR率为31.4% (16/51),不包含pCR的单独主要病理缓解(major pathologic response,MPR)率为23.5%(12/51)[17]。一项食管癌新辅助免疫联合化疗的荟萃分析,其共纳入Ⅱ期或Ⅲ期临床试验27个,815例患者,结果显示,食管鳞状细胞癌的pCR率为32.4%(95%CI 28.2%~36.8%),MPR率为49.4%(95%CI 42.1% ~ 56.7%)[18]。从以上研究结果可以看出,新辅助免疫联合化疗近期疗效的pCR率为21.7%~50.0%,MPR率为23.5%~72.4%,较术前化疗有了明显的提升。本研究中新辅助免疫组pCR和MPR分别为31.1%和63.4%,与既往研究相似。
Xu等[19]研究发现,NICT对比NCRT后的病理反应pCR率(29.8%和34.0%,P=0.167)与本研究(31.1%和35.8%)相当,MPR率(53.6%和64.7%,P=0.001)与本研究(63.4%和66.4%)相似。Wang等[20]发表了一项Mate分析,为了比较新辅助治疗的不同模式,该研究分析了16个双臂研究,结果显示,新辅助免疫联合放化疗和NCRT之间的pCR和MPR率差异无统计学意义,且均优于新辅助免疫治疗,且NCT的结果最差;1年OS和DFS率新辅助免疫联合化疗组最优。后该研究又将新辅助免疫联合放化疗和新辅助免疫联合化疗病例的数据纳入新辅助免疫治疗组,将NCRT和NCT病例纳入传统的新辅助治疗组。共纳入头对头16项试验进行两两荟萃分析,结果显示新辅助免疫治疗组患者的1年OS和DFS率显著高于传统新辅助治疗组。本研究中未纳入新辅助免疫联合放化疗患者,与传统的新辅助治疗相比NICT组在pCR和MPR率及3年OS和PFS也显示出明显的优势。
NCRT对比NCT,循证医学证据较充分[21],然而NICT目前尚无长期生存的随机对照研究,本研究结果显示,免疫组与放化疗组近期疗效、3年生存、局部复发率和远处转移率相似,亚组分析中示:OS在年龄、性别、胸中段、T3、N1更能从NICT中获益;化疗组对比免疫组中,OS除了T2和N0患者,均能从NICT中获益。因此,3组对比,NICT与NCRT的生存获益相似,3组的不良反应相似,但是亚组显示,NICT获益更明显,本研究建议NICT为术前新辅助治疗手段之一,但仍需大型的随机对照研究进一步证实。
本研究存在一些不足之处,包括3组治疗时间跨度较长、化疗方案、术后辅助治疗差异、年龄因素不平衡等,但是本研究为真实世界研究,这也反映了真实世界情况下的治疗模式和结果,从而提高了研究结果的外部有效性,尚需进一步长期随访及大型的随机对照研究进一步证实。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 张耀文、程欣宇负责研究设计和实施及论文撰写;汪晨宇、郭莹指导论文修改;任润川、金琳芝、王韶花负责收集数据、文献查找及数据分析
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Kato K, Ito Y, Daiko H, et al. A randomized controlled phase Ⅲ trial comparing two chemotherapy regimen and chemoradiotherapy regimen as neoadjuvant treatment for locally advanced esophageal cancer, JCOG1109 NExT studyr[J]. J Clin Oncol, 2022, 40(4_suppl): 238-238. DOI:10.1200/JCO.2022.40.4_suppl.238 |
| [4] |
Allum WH, Stenning SP, Bancewicz J, et al. Long-term results of a randomized trial of surgery with or without preoperative chemotherapy in esophageal cancer[J]. J Clin Oncol, 2009, 27(30): 5062-5067. DOI:10.1200/JCO.2009.22.2083 |
| [5] |
肖泽芬, 周宗玫, 李晔雄. 食管癌放射治疗靶区勾画[M]. 北京: 人民卫生出版社, 2017. Xiao ZF, Zhou ZM, Li YX. Target delineation for radiotherapy of esophageal cancer[M]. Beijing: People's Health Publishing House, 2017. |
| [6] |
中国医师协会放射肿瘤治疗医师分会, 中华医学会放射肿瘤治疗学分会, 中国抗癌协会肿瘤放射治疗专业委员会. 中国食管癌放射治疗指南(2021年版)[J]. 国际肿瘤学杂志, 2022, 49(1): 14. Chinese Association for Therapeutic Radiation Oncologists, China Society for Radiology Oncology, Chinese Anticancer Association on Obcology Radiotherapy Committee. Chinese guidelines for radiotherapy of esophageal cancer (2021 Edition)[J]. Int J Oncol, 2022, 49(1): 14. DOI:10.3760/cma.j.cn371439-20211021-00002 |
| [7] |
Eyck BM, van Lanschot J, Hulshof M, et al. Ten-year outcome of neoadjuvant chemoradiotherapy plus surgery for esophageal cancer: The randomized controlled CROSS trial[J]. J Clin Oncol, 2021, 39(18): 1995-2004. DOI:10.1200/JCO.20.03614 |
| [8] |
Shapiro J, van Lanschot J, Hulshof M, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial[J]. Lancet Oncol, 2015, 16(9): 1090-1098. DOI:10.1016/S1470-2045(15)00040-6 |
| [9] |
Yang H, Liu H, Chen Y, et al. Neoadjuvant chemoradiotherapy followed by surgery versus surgery alone for locally advanced squamous cell carcinoma of the esophagus (NEOCRTEC5010): A phase Ⅲ multicenter, randomized, open-label clinical trial[J]. J Clin Oncol, 2018, 36(27): 2796-2803. DOI:10.1200/JCO.2018.79.1483 |
| [10] |
Ando N, Kato H, Igaki H, et al. A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907)[J]. Ann Surg Oncol, 2012, 19(1): 68-74. DOI:10.1245/s10434-011-2049-9 |
| [11] |
Tang H, Wang H, Fang Y, et al. Neoadjuvant chemoradiotherapy versus neoadjuvant chemotherapy followed by minimally invasive esophagectomy for locally advanced esophageal squamous cell carcinoma: a prospective multicenter randomized clinical trial[J]. Ann Oncol, 2023, 34(2): 163-172. DOI:10.1016/j.annonc.2022.10.508 |
| [12] |
Yamamoto S, Kato K, Daiko H, et al. Feasibility study of nivolumab as neoadjuvant chemotherapy for locally esophageal carcinoma: FRONTiER (JCOG1804E)[J]. Future Oncol, 2020, 16(19): 1351-1357. DOI:10.2217/fon-2020-0189 |
| [13] |
Matsuda S, Yamamoto S, Kato K, et al. FRONTiER: A feasibility trial of nivolumab with neoadjuvant CF or DCF, FLOT therapy for locally advanced esophageal carcinoma (JCOG1804E)—Short-term results for cohorts C and D[J]. J Clin Oncol, 2022, 40(4_suppl): 286-286. DOI:10.1200/JCO.2021.39.3_suppl.202 |
| [14] |
Yamamoto S, Kato K, Daiko H, et al. FRONTiER: A feasibility trial of nivolumab with neoadjuvant CF or DCF therapy for locally advanced esophageal carcinoma (JCOG1804E)—The short-term results of cohort A and B[J]. J Clin Oncol, 2021, 39(3_suppl): 202-202. DOI:10.1200/JCO.2021.39.3_suppl.202 |
| [15] |
Chen R, Liu Q, Li Q, et al. A phase Ⅱ clinical trial of toripalimab combined with neoadjuvant chemoradiotherapy in locally advanced esophageal squamous cell carcinoma (NEOCRTEC1901)[J]. EClinicalMedicine, 2023, 62: 102118. DOI:10.1016/j.eclinm.2023.102118 |
| [16] |
Liu J, Yang Y, Liu Z, et al. Multicenter, single-arm, phase Ⅱ trial of camrelizumab and chemotherapy as neoadjuvant treatment for locally advanced esophageal squamous cell carcinoma[J]. J Immunother Cancer, 2022, 10(6): e004291corrl. DOI:10.1136/jitc-2021-004291corrl |
| [17] |
Liu J, Li J, Lin W, et al. Neoadjuvant camrelizumab plus chemotherapy for resectable, locally advanced esophageal squamous cell carcinoma (NIC-ESCC2019): A multicenter, phase 2 study[J]. Int J Cancer, 2022, 151(1): 128-137. DOI:10.1002/ijc.33976 |
| [18] |
Ge F, Huo Z, Cai X, et al. Evaluation of clinical and safety outcomes of neoadjuvant immunotherapy combined with chemotherapy for patients with resectable esophageal cancer: A systematic review and meta-analysis[J]. JAMA Netw Open, 2022, 5(11): e2239778. DOI:10.1001/jamanetworkopen.2022.39778 |
| [19] |
Xu L, Wei XF, Li CJ, et al. Pathologic responses and surgical outcomes after neoadjuvant immunochemotherapy versus neoadjuvant chemoradiotherapy in patients with locally advanced esophageal squamous cell carcinoma[J]. Front Immunol, 2022, 13: 1052542. DOI:10.3389/fimmu.2022.1052542 |
| [20] |
Wang H, Song C, Zhao X, et al. Evaluation of neoadjuvant immunotherapy and traditional neoadjuvant therapy for resectable esophageal cancer: a systematic review and single-arm and network meta-analysis[J]. Front Immunol, 2023, 14: 1170569. DOI:10.3389/fimmu.2023.1170569 |
| [21] |
Yuan M, Bao Y, Ma Z, et al. The optimal treatment for resectable esophageal cancer: A network meta-analysis of 6168 patients[J]. Front Oncol, 2021, 11: 628706. DOI:10.3389/fonc.2021.628706 |
 2024, Vol. 44
2024, Vol. 44


