2. 大连医科大学研究生院,大连 116044
2. Graduate School of Dalian Medical University, Dalian 116044, China
立体定向放射治疗(SBRT)的概念起源于立体定向放射外科(stereotaxic radiosurgery, SRS),将低分次、单次大剂量、小野集束照射的方式与立体定向固定方法和图像引导技术相结合,可实现较为集中的剂量分布和较高的等效生物剂量,且SBRT相较于传统放疗疗程缩短可极大减轻患者负担[1]。SBRT已被广泛用于早期肺癌和肺转移癌的治疗,并获得良好的疗效,且较少出现严重不良反应[2-5]。目前常用于开展SBRT的设备有直线加速器、伽马刀、Tomotherapy和Cyberknife等[1]。伽马刀利用放射性核素60Co作为放射源,释放平均能量为1.25 MeV的伽马射线,具有输出稳定性高、剂量衰减快的特点。伽马刀应用于肝脏、胰腺等体部肿瘤已取得很好的疗效[6-7]。此外,伽马刀用于早期非小细胞肺癌以及肺转移癌的治疗也实现了很好的疗效和安全性[8-13]。有文献报道了伽马刀与加速器应用于颅内、肝脏、胰腺肿瘤的剂量对比研究[14-19],但伽马刀应用于肺部肿瘤的剂量学研究较少。本研究目的在于比较分析伽马刀与加速器用于肺部肿瘤SBRT的剂量学差异,为临床治疗策略的选择提供理论依据。
资料与方法 1、病例资料选取2022年1月至2023年5月在大连大学附属中山医院肿瘤中心进行肺部SBRT治疗的患者7例,其中男性6例,女性1例,中位年龄74(37~76)岁;原发性肺癌4例,肺转移癌3例,共有病灶13个。计划靶区(PTV)的中位体积为9.96(2.34 ~ 56.20)cm3,直径为2.81(1.74 ~ 5.75)mm。针对上述病灶分别设计γ_SBRT与X_SBRT计划,同一患者位置邻近的病灶设计在同一计划中,得到γ_SBRT与X_SBRT计划各10个,PTV的处方剂量为30 ~ 50 Gy/5 ~ 10次。计划与靶区的具体情况详见表 1。本研究经过大连大学附属中山医院医学伦理委员会审批通过(审批号:KY2024-001-1)。且所有对象均签署知情同意书。
|
|
表 1 计划与靶区基本情况 Table 1 Summary of plans and target volumes |
2、体位固定与模拟定位
采用热塑膜或负压真空袋结合热塑膜进行体位固定。患者仰卧,双手上举抱肘。通过日本东芝Asteion 4排螺旋CT进行增强扫描,扫描时头先进,在自由呼吸状态下采集影像。扫描参数为:管电压120 kV,管电流150 mA,影像层厚2.5 mm。将图像以DICOM格式传输到瑞典医科达放疗计划系统Monaco(V6.00.11)进行靶区和危及器官(organs at risk,OARs)定义。
3、靶区定义由放疗医生在计划CT肺窗上勾画大体肿瘤体积(GTV),在GTV的基础上外扩0.5~1.0 cm形成PTV。靶区定义标准参考国际辐射单位与测量委员会(ICRU) 83号报告[20]。OARs包括患侧肺、健侧肺、食管、心脏和脊髓。
4、计划设计将患者的计划CT、靶区和OARs传输到伽马刀放疗计划系统RT Pro TPS(V1.2.3,大医集团,中国),在Monaco以及RT Pro TPS上分别设计X_SBRT与γ_SBRT计划。X_SBRT治疗应用Synergy直线加速器(医科达,瑞典),配置Agility 80对多叶准直器(MLC),MLC叶片宽度为5 mm。X_SBRT计划采用6 MV X射线,使用1~2个共面弧进行旋转容积调强放疗(VMAT)计划设计,最大剂量率为600 MU/min。计划目标:≥ 98%PTV体积接受100%处方剂量,PTV的Dmax不超过150%处方剂量,在满足上述目标的前提下尽可能减少OARs受量。γ_SBRT计划治疗应用CybeRay立体定向放疗系统(大医集团,中国),配置13枚密封60Co放射源以及7组准直器,直径分别为:0.6、0.9、1.2、1.6、2.0、2.5、3.5 cm,源焦距为60.8 cm。γ_SBRT计划采用共面旋转照射,机架角度选择需规避碰撞风险。计划目标:≥ 98%PTV体积接受100%处方剂量,100%PTV体积接受≥ 90%处方剂量,在此基础上尽量提高PTV的适形性并缩短治疗时间。两种计划计算网格设置为2 mm。OARs评价均参考Timmerman提出的剂量限制标准[21]。
5、计划评价PTV通过靶区覆盖率、CI、GI、Dmax、Dmean、Dmin进行评价,靶区覆盖率、CI、GI的计算方法见式(1)~(3):
| $ \text { 靶区覆盖率 }=\left(V_{100 \%} \cap V_{\mathrm{PTV}}\right) / V_{\mathrm{PTV}} $ | (1) |
| $ \mathrm{CI}=\left(V_{100 \%} \cap V_{P T V}\right)^2 /\left(V_{\mathrm{PTV}} \times V_{100 \%}\right) $ | (2) |
| $ \mathrm{GI}=V_{50 \%} / V_{\mathrm{PTV}} $ | (3) |
式中,V100%为100%处方剂量线包绕的体积;VPTV为PTV体积;V50%为50%处方剂量线包绕的体积。剂量分布通过V20、V10、V5、V100%、V50%进行评价。OARs评价指标有:患侧肺Dmean、Lung_V20、Lung_V5,健侧肺Dmean、Lung_V5,食管、脊髓和心脏的Dmax。治疗时间是指剂量输出时间,在X_SBRT计划中为加速器出束时间,γ_SBRT计划中为开源时间,不包括摆位和图像引导时间。
6、统计学处理采用软件SPSS 19.0进行统计分析。通过统计描述及Wilcoxon符号秩检验分析γ_SBRT与X_SBRT计划的剂量差异。P < 0.05为差异有统计学意义。
结果10组计划均满足临床治疗要求,剂量参数通过剂量体积直方图(DVH)进行评估。对于PTV,γ_SBRT计划的GI低于X_SBRT计划(z=-2.80,P < 0.05),γ_SBRT计划的Dmax和Dmean高于X_SBRT计划(z=-2.80、-2.80,P < 0.05);靶区覆盖率、CI以及Dmin在二者间差异无统计学意义(P > 0.05)。在剂量分布上,图 1举例展示两患者γ_SBRT和X_SBRT计划PTV最大直径横断面的剂量分布情况对比。γ_SBRT计划的V20、V10、V5、V50%均小于X_SBRT计划(z=-2.80、-2.80、-2.80、-2.80,P < 0.05)。V100%在二者间差异无统计学意义(P>0.05)。对于OARs,γ_SBRT计划患侧肺Dmean、Lung_V20、Lung_V5,健侧肺Dmean、Lung_V5,以及食管、心脏的Dmax均低于X_SBRT计划(z=-2.80、-2.81、-2.70、-2.80、-2.37、-2.80、-1.99,P < 0.05);脊髓Dmax在二者间差异无统计学意义(P>0.05)。γ_SBRT计划的治疗时间长于X_SBRT计划(z=-2.70,P < 0.05,表 2)。
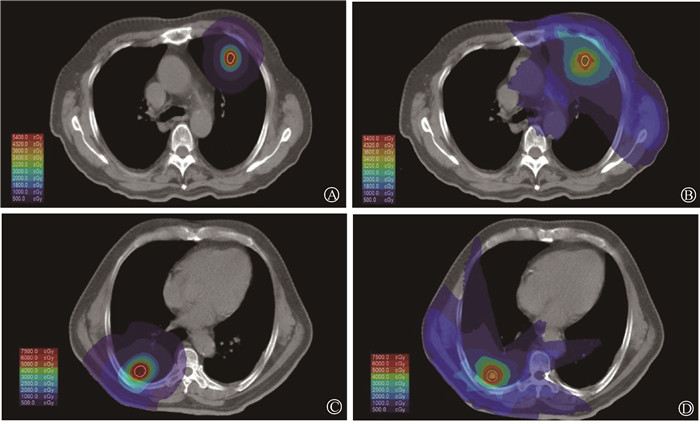
|
图 1 两患者γ_SBRT和X_SBRT计划PTV最大直径横断面剂量分布情况对比 A. 患者1的γ_SBRT计划(处方剂量36 Gy);B. 患者2的γ_SBRT计划(处方剂量50 Gy);C. 患者1的X_SBRT计划(处方剂量36 Gy);D. 患者2的X_SBRT计划(处方剂量50 Gy) Figure 1 Comparison of dose distribution in the maximum-diameter section of PTVs between γ_SBRT and X_SBRT plans of two patients A. γ-SBRT plan for patient 1 (prescription dose: 36 Gy); B. γ-SBRT plan for patient 2 (prescription dose: 50 Gy); C. X_SBRT plan for patient 1 (prescription dose: 36 Gy); D. X_SBRT plan for patient 2 (prescription dose: 50 Gy) |
|
|
表 2 γ_SBRT与X_SBRT计划PTV剂量参数、剂量分布、OARs剂量以及治疗时间对比 Table 2 Comparison of PTV dosimetric parameters, dose distribution, dose to OARs, and delivery time between γ_SBRT and X_SBRT plans |
讨论
60Co产生的伽马射线平均能量低,剂量衰减快。本研究显示,伽马刀用于肺部肿瘤SBRT可以减少靶区周围低剂量区以及正常肺组织受量。有研究表明,在头部SRS中,伽马刀计划相较于加速器GI更低,可减少靶区周围低剂量区,从而减少正常脑组织的受照体积[22-23]。Cao等[17]比较了多种技术应用于脑部肿瘤立体定向放疗,结果表明伽马刀GI最优,且在小体积肿瘤(< 20 cm3),中正常脑组织V5最低。在对伽马刀与螺旋断层治疗(Tomotherapy,简称Tomo)的剂量研究中,吴伟章等[18]研究表明在胰腺肿瘤中,Tomo与伽马刀相比低剂量区范围更大;朱夫海等[19]研究表明在肝脏肿瘤中,Tomo可以减少肝脏V25~V40,但增加V5~V10;曹洋森等[16]的研究表明,伽马刀的GI以及10%处方剂量线包绕的体积均低于Tomo和加速器。上述结果表明伽马刀在减少靶区周围以及重叠器官低剂量区方面有优势。
对于与靶区没有重叠的OARs,本研究中γ_SBRT计划食管、心脏Dmax低于X_SBRT计划,脊髓Dmax差异无统计学意义。Balik等[24]的研究表明:在垂体腺瘤和前庭神经鞘瘤SRS中,加速器计划的视神经Dmax低于伽马刀计划,而脑干Dmax和耳蜗Dmean差异无统计学意义。Kim等[25]的研究表明,在前庭神经鞘瘤SRS中,耳蜗和脑干剂量在伽马刀和加速器计划中差异无统计学意义。此外,吴伟章等[18]的研究表明,在胰腺肿瘤中Tomo可以降低十二指肠和胃的Dmax。朱夫海等[19]研究表明,在肝脏肿瘤中Tomo可减少脊髓Dmax以及胃、左肾Dmean;曹洋森等[16]的研究中,伽马刀计划与加速器以及Tomo相比,左肾和右肾Dmean最低,但空回肠Dmax最高。上述结果可能由于加速器和Tomo采用“逆向优化”的方式,具有可针对OARs设置限制条件的优势,而伽马刀具有剂量快速跌落的优势,两种计划的优势在OARs剂量上的表现随位置关系变化互相抵消。
对于靶区剂量,伽马刀计划的PTV和GTV都可达到较高Dmax和Dmean,与曹洋森等[16]的研究结果一致。一般认为在不增加正常组织受照的情况下提高靶区剂量对治疗有益。上述结果可能由于在伽马刀放疗计划系统RT Pro TPS中,处方剂量定义为50%等剂量线,即Dmax为200%处方剂量;而加速器计划不限制Dmax和处方剂量的相对关系。另外,一般认为加速器等的“逆向计划”方式可以实现较好的适形度。吴伟章等[18]、朱夫海等[19]以及曹洋森等[16]的研究均表明,Tomo的靶区适形度优于伽马刀;曹洋森等[16]还发现加速器的靶区适形度优于伽马刀。本研究中CI在两种计划中未见明显差异。可能由于纳入的病灶形状较规则,容易实现很好的适形性;其次,伽马刀应用多个直径较小的准直器可提高适形性,但会大幅增加治疗时间。
本研究存在以下不足之处:在肺部肿瘤SBRT中,呼吸运动的影响不可忽略。定位CT扫描的随机性会造成肿瘤位置偏差,从而导致漏照或更多正常组织受照[26],故推荐采用呼吸运动管理措施[1]。本研究未能深入探索呼吸运动对治疗精度和剂量分布的影响,仅通过GTV直接外扩的方式来减少呼吸运动引起的靶区漏照。另外,两计划系统算法有差异。Monaco应用X射线体素蒙特卡罗(XVMC)算法,在肺部肿瘤SBRT计算中被认为是最理想算法[1];而RT Pro TPS应用Collapsed Cone卷积叠加(CCCS)算法。虽然都进行了组织非均匀性修正,但Monaco中会由于PTV中的空腔而出现剂量极低的冷点,而RT Pro TPS不存在这种情况。两计划系统对于肺部剂量计算的准确性存在偏差。最后,剂量分布受计划设计者主观因素和优化参数设置的影响,在对两种技术的比较中,结果可能存在偏移。
伽马刀用于肺部肿瘤SBRT仍存在挑战:伽马刀治疗时间长,会带来患者依从性下降以及分次内误差不可控的问题,固定方式需要满足精度、舒适性和可重复性的要求;其次,伽马刀呼吸运动管理受限。常用呼吸运动管理措施有主动呼吸控制(active breathing control,ABC)、门控、追踪、腹压、4DCT等[26]。伽马刀治疗时间长,不适合开展ABC;且设备暂不具备应用门控、追踪的条件;此外,伽马刀设备孔径小、治疗时间长,不利于腹压设备的应用,故推荐应用4DCT准确勾画肿瘤在不同呼吸时相的位置。
综上,伽马刀与加速器开展肺部SBRT治疗均能满足临床需求。伽马刀SBRT计划在靶区外剂量跌落方面优于加速器,在肺部肿瘤治疗中有望减少靶区周围低剂量区以及正常肺组织受照剂量,但治疗时间显著增加。且实施过程中需要进一步加强精度管理。
利益冲突 无
作者贡献声明 段文越负责设计研究方案,研究实施及论文撰写; 吴华健、赵耿昊、张传豪、范治军负责研究实施,数据收集整理分析;王喆负责项目设计与指导,论文审校;王若雨提供研究思路,对项目进行监督
| [1] |
Benedict SH, Yenice KM, Followill D, et al. Stereotactic body radiation therapy: the report of AAPM Task Group 101[J]. Med Phys, 2010, 37(8): 4078-4101. DOI:10.1118/1.3438081 |
| [2] |
Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage Ⅰ non-small-cell lung cancer: a pooled analysis of two randomised trials[J]. Lancet Oncol, 2015, 16(6): 630-637. DOI:10.1016/S1470-2045(15)70168-3 |
| [3] |
Lindberg K, Nyman J, Riesenfeld Källskog V, et al. Long-term results of a prospective phase Ⅱ trial of medically inoperable stage Ⅰ NSCLC treated with SBRT - the Nordic experience[J]. Acta Oncol, 2015, 54(8): 1096-1104. DOI:10.3109/0284186X.2015.1020966 |
| [4] |
Westover KD, Iyengar P, Sharma AN, et al. SABR for aggressive local therapy of metastatic cancer: A new paradigm for metastatic non-small cell lung cancer[J]. Lung Cancer, 2015, 89(2): 87-93. DOI:10.1016/j.lungcan.2015.04.009 |
| [5] |
Soyfer V, Corn BW, Shtraus N, et al. Single-institution experience of SBRT for lung metastases in sarcoma patients[J]. Am J Clin Oncol, 2017, 40(1): 83-85. DOI:10.1097/COC.0000000000000103 |
| [6] |
夏廷毅, 孙庆选, 于涌, 等. 体部γ-刀治疗52例胰腺癌的疗效分析[J]. 中华肝胆外科杂志, 2006, 12(2): 86-88. Xia TY, Sun QX, Yu Y, et al. Analysis of clinical outcomes of body gamma knife therapy for 52 patients with advanced pancreatic carcinoma[J]. Chin J Hepatobiliary Surg, 2006, 12(2): 86-88. DOI:10.3760/cma.j.issn.1007-8118.2006.02.006 |
| [7] |
龙志雄, 王建国, 李卫东, 等. 体部γ刀治疗原发性小肝癌的疗效观察[J]. 中华放射肿瘤学杂志, 2008, 17(5): 348-349. Long ZX, Wang JG, Li WD, et al. Observation of therapeutic effects of body gamma knife on primary small hepatocellular carcinoma[J]. Chin J Radiat Oncol, 2008, 17(5): 348-349. DOI:10.3321/j.issn.1004-4221.2008.05.017 |
| [8] |
胡小龙, 李宏奇, 徐向升, 等. 43例寡转移NSCLC立体定向放疗结果分析[J]. 中华放射肿瘤学杂志, 2017, 26(10): 1141-1146. Hu XL, Li HQ, Xu XS, et al. Result of stereotactic radiotherapy of oligometastasis non-small cell lung cancer[J]. Chin J Radiat Oncol, 2017, 26(10): 1141-1146. DOI:10.3760/cma.j.issn.1004-4221.2017.10.007 |
| [9] |
李宏奇, 吴伟章, 王颖杰, 等. 采用体部伽马刀治疗肺转移瘤的安全性研究[J]. 中国医学装备, 2013, 10(7): 80-83. Li HQ, Wu WZ, Wang YJ, et al. Evaluation on clinical safety of metastatic tumor of lung treated by body gamma knife[J]. China Med Equip, 2013, 10(7): 80-83. DOI:10.3969/j.issn.1672-8270.2013.07.030 |
| [10] |
唐新宇, 颜婧. 伽马刀分次立体定向放疗治疗早期非小细胞肺癌的临床分析[J]. 中华肺部疾病杂志(电子版), 2021, 14(2): 237-239. Tang XY, Yan J. Clinical analysis of gamma knife fractionated stereotactic radiotherapy for early stage non-small cell lung cancer[J]. Chin J Pulm Dis(Electron Ed), 2021, 14(2): 237-239. DOI:10.3877/cma.j.issn.1674-6902.2021.02.025 |
| [11] |
李宏奇, 王颖杰, 李平, 等. 体部伽马刀治疗早期非小细胞肺癌临床观察[J]. 中华放射肿瘤学杂志, 2012, 21(4): 321-324. Li HQ, Wang YJ, Li P, et al. Clinical study of stereotactic gamma-ray body radiation therapy for patients with stage Ⅰ/Ⅱ nonsmall cell lung cancer[J]. Chin J Radiat Oncol, 2012, 21(4): 321-324. DOI:10.3760/cma.j.issn.1004-4221.2012.04.009 |
| [12] |
夏廷毅, 孙庆选, 李平, 等. 体部γ-刀高分次剂量治疗Ⅰ~Ⅱ期非小细胞肺癌的临床研究[J]. 临床肿瘤学杂志, 2005, 10(1): 20-24. Xia TY, Sun QX, Li P, et al. Clinical study of body gamma knife in the treatment of non-small cell lung cancer: preliminary results of a pilot study[J]. J Clin Oncol, 2005, 10(1): 20-24. DOI:10.3969/j.issn.1009-0460.2005.01.007 |
| [13] |
Wu D, Zhu H, Tang H, et al. Clinical analysis of stereotactic body radiation therapy using extracranial gamma knife for patients with mainly bulky inoperable early stage non-small cell lung carcinoma[J]. Radiat Oncol, 2011, 6: 84. DOI:10.1186/1748-717X-6-84 |
| [14] |
Veselsky T, Syruckova T, Kindlova A, et al. Pituitary adenoma treatment plan quality comparison between linear accelerator volumetric modulated arc therapy and Leksell Gamma Knife® radiosurgery[J]. Med Dosim, 2021, 46(4): 440-448. DOI:10.1016/j.meddos.2021.06.003 |
| [15] |
Schelin ME, Liu HS, Ali A, et al. Dosimetric comparison of Gamma Knife® Icon (TM) and linear accelerator-based fractionated stereotactic radiotherapy (FSRT) plans for the re-irradiation of large (>14 cm3) recurrent glioblastomas[J]. J Radiosurg SBRT, 2021, 7(3): 233-243. |
| [16] |
曹洋森, 张建英, 李婷婷, 等. 五种光子放疗设备在胰腺癌立体定向放疗中剂量学比较[J]. 中华放射肿瘤学杂志, 2021, 30(2): 156-163. Cao YS, Zhang JY, Li TT, et al. Comparison of dose distributions among five radiotherapy apparatuses in stereotactic body radiation therapy for pancreatic cancer[J]. Chin J Radiat Oncol, 2021, 30(2): 156-163. DOI:10.3760/cma.j.cn113030-20190606-00214 |
| [17] |
Cao H, Xiao Z, Zhang Y, et al. Dosimetric comparisons of different hypofractionated stereotactic radiotherapy techniques in treating intracranial tumors > 3 cm in longest diameter[J]. J Neurosurg, 2019, 132(4): 1024-1032. DOI:10.3171/2018.12.JNS181578 |
| [18] |
吴伟章, 朱夫海, 常冬姝, 等. 胰腺癌伽马刀和螺旋断层放疗治疗计划剂量学比较[J]. 中国医疗器械杂志, 2013, 37(3): 232-234. Wu WZ, Zhu FH, Chang DS, et al. Dosimetric comparison of treatment plans of pancreatic carcinoma treated with body gamma knife and tomotherapy[J]. Chin J Med Devices, 2013, 37(3): 232-234. DOI:10.3969/j.issn.1671-7104.2013.03.022 |
| [19] |
朱夫海, 吴伟章, 任刚, 等. 肝癌体部γ刀与HT的剂量特点分析[J]. 中华放射肿瘤学杂志, 2015, 24(2): 189-192. Zhu FH, Wu WZ, Ren G, et al. Analysis on the dose characteristics of body γ knife and tomotherapy treatment for hepatocellular carcinoma[J]. Chin J Radiat Oncol, 2015, 24(2): 189-192. DOI:10.3760/cma.j.issn.1004-4221.2015.02.020 |
| [20] |
Hodapp N. The ICRU Report 83: prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlenther Onkol, 2012, 188(1): 97-99. DOI:10.1007/s00066-011-0015-x |
| [21] |
Timmerman R. A story of hypofractionation and the table on the wall[J]. Int J Radiat Oncol Biol Phys, 2022, 112(1): 4-21. DOI:10.1016/j.ijrobp.2021.09.027 |
| [22] |
Liu HS, Andrews DW, Evans JJ, et al. Plan quality and treatment efficiency for radiosurgery to multiple brain metastases: non-coplanar RapidArc vs. gamma knife[J]. Front Oncol, 2016, 6: 26. DOI:10.3389/fonc.2016.00026 |
| [23] |
Chea M, Fezzani K, Jacob J, et al. Dosimetric study between a single isocenter dynamic conformal arc therapy technique and gamma knife radiosurgery for multiple brain metastases treatment: impact of target volume geometrical characteristics[J]. Radiat Oncol, 2021, 16(1): 45. DOI:10.1186/s13014-021-01766-w |
| [24] |
Balik S, Chao S, Neyman G. Gamma knife and volumetric modulated arc therapy stereotactic radiosurgery plan quality and OAR sparing comparison for pituitary adenomas and vestibular schwannomas[J]. J Radiosurg SBRT, 2018, 5(3): 237-247. |
| [25] |
Kim H, Potrebko P, Rivera A, et al. Tumor volume threshold for achieving improved conformity in VMAT and gamma knife stereotactic radiosurgery for vestibular schwannoma[J]. Radiother Oncol, 2015, 115(2): 229-234. DOI:10.1016/j.radonc.2015.03.031 |
| [26] |
Keall PJ, Mageras GS, Balter JM, et al. The management of respiratory motion in radiation oncology report of AAPM Task Group 76[J]. Med Phys, 2006, 33(10): 3874-3900. DOI:10.1118/1.2349696 |
 2024, Vol. 44
2024, Vol. 44


